文档内容
化学参考答案
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项
是符合题目要求的。
题号 1 2 3 4 5 6 7
答案 C C A D B A B
题号 8 9 10 11 12 13 14
答案 B C D C B A C
【解析】
1.A 项,烯烃发生加聚反应制备聚乙烯塑料。B 项,手机芯片的基础材料是利用半导体硅单
质。D项,赤铁矿的主要成分是Fe O 。
2 3
2.A项,为HCl分子中共价键电子云轮廓图。B项,氯原子的半径大于碳原子。D项,该物
质的名称为3−甲基丁酸。
3.B项,新制氯水可以氧化SO2。C项,溶液可能呈酸性,可能呈碱性,其中Fe2+在碱性条
3
件下不共存,酸性条件下Fe2+与NO不共存。D项,溶液中存在Fe3+,Fe3+与CO2发生完
3 3
全双水解,与CN−可以形成配合物而不共存。
4.B项,向NaAlO 溶液通入过量的CO 时可以生成Al(OH) 白色沉淀,向饱和Na CO 溶液
2 2 3 2 3
中通入过量的CO 时,由于NaHCO 溶解度更小,故会析出NaHCO 白色沉淀。C项,新
2 3 3
制氯水中的次氯酸和硝酸光照时均可分解生成O 。D项,根据得失电子数守恒原则,Al~
2
3
3e−~ H ,Si~4e−~2H ,故生成的H 的物质的量之比为3∶4。
2 2 2
2
5.缺少溶液体积,无法计算氢氧根离子数目,A错误。标准状况下,2.24L CH Cl为0.1mol,
3
含 C—H 键数为 0.3N ,B 正确。常温下,Fe 与浓硫酸发生钝化,无法求出具体的气体分
A
子数,C 错误。1L 0.1mol/L K Cr O 溶液中含有 K Cr O 、K CrO ,含铬的离子总数为
2 2 7 2 2 7 2 4
0.1~0.2N ,D错误。
A
6.用硝酸银溶液检验苯与Br 发生取代反应后的产物HBr之前,需用CCl 除去混在其中挥发
2 4
出的Br 蒸气,避免干扰,A正确。酒精灯的加热温度在400~500℃,达不到题干的900℃,
2
B错误。浓硫酸与CaF 反应可得HF,(高沸点酸制低沸点酸),但HF与玻璃中的SiO 反
2 2
应,因此该反应不能在玻璃容器中进行,C错误。配制溶液时,向250mL容量瓶中转移溶
液时需要玻璃棒引流,D错误。
化学参考答案·第1页(共7页)7.B 项,Z 中两个环共用的碳为 sp3杂化,导致两个环的碳无法全部共平面。C 项,1∶1 反
应生成2−溴−2丁烯;1∶2反应生成2,2−二溴丁烷和2,3−二溴丁烷,共三种。D项,Z
中含有4个碳碳双键和1个碳氧双键,均可和H 加成,1mol Z最多消耗5mol。
2
8.由信息推出:X、Y、Z、W分别为C、O、S、Cl。C的核外电子排布式为1s22s22p2,A正
确。SOCl 中心原子为硫,σ键数3,孤对电子数为1,价层电子对数4,sp3杂化,三角锥
2
形,B错误。COCl 中心原子为碳,σ键数3,孤对电子数为0,价层电子对数3,sp2杂化,
2
C正确。COCl 和SOCl 均可水解,前者生成CO 和HCl,后者生成SO 和HCl,D正确。
2 2 2 2
9.A项,根据制备流程可知Pt电极区应生成氯气,故Pt电极为阳极,与电源正极相连。
B项,电解结束后Pt电极区生成了CH ClCH OH,Ni电极区生成了KOH,将二者混合时
2 2
发 生 取 代 反 应 生 成 。 C 项 , Pt 电 极 区 总 反 应 为
Cl−−2e−+H O+CH CH →CH ClCH OH+H+,Ni电极区总反应为2H O+2e−=H ↑
2 2 2 2 2 2 2
+2OH−,电解液混合后发生的反应为 CH ClCH OH+OH−→ +Cl−+H O,
2 2 2
电解
H++OH−=H O,故合成过程的总反应为CH CH +H O===== +H ↑。D项,
2 2 2 2 2
当Ni电极上产生H 0.2mol时,根据上述合成过程的总反应生成的 的物质的量
2
也为0.2mol,即8.8g。
10.根据1个WM含有82个电子,可以算出平均每个W、M原子含有16.2个电子,故M为
4
Cl,W为Al;又由于X和Y的最高正价与最低负价的代数和均为0,推出X为H,Y为
C;最后根据1mol化合物Z(YX ) WM 含有124mol质子,推出Z为N。A项,由于原子
3 4 4
半径Al>Si>C,所以原子半径:Al>C。B 项,N、Cl 可分别与H形成 NH 和HCl,二者
3
可进一步化合生成盐 NH Cl。C 项,C 和 N 的最高价氧化物对应的水化物分别为 H CO
4 2 3
和HNO ,酸性:HNO >H CO D项,由于AlCl 为共价化合物,熔融状态下不导电,故
3 3 2 3。 3
不能电解AlCl 制备单质Al。
3
11.均摊法计算可知晶胞含2个H、2个Co、4个O,化学式为HCoO ,A正确。右图清晰可
2
知氧存在 O2−和 OH−两种形态,B 正确。结合两幅图可知 Co 的配位数应为 6,C 错误。
晶胞密度计算正确,D正确。
12.常温下,向饱和Na CO 溶液中加少量BaSO 粉末,因c(Ba2+)·c(CO2)>K (BaCO ),而
2 3 4 3 sp 3
产生BaCO 沉淀,加入盐酸产生气泡,不能说明K (BaCO )、K (BaSO )的关系,A错误。
3 sp 3 sp 4
化学参考答案·第2页(共7页)卤代烃与NaOH水溶液共热,充分反应后,向溶液中先加入HNO ,中和前面加入的NaOH
3
避免产生干扰,再加入 AgNO ,产生白色沉淀,则该卤代烃含氯元素,B 正确。向等浓
3
度等体积的 H O 中加入 KMnO 溶液,KMnO 将 H O 氧化为 O ,而不是作催化剂,C
2 2 4 4 2 2 2
错误。应先加入淀粉溶液,最后加入硫酸,否则可能会先发生反应,观察不到蓝色变化,
试剂顺序不合理,D错误。
13.A项,由于整个过程中H CO 不发生分解,根据物料守恒:c(Na+)=c(H CO )+c(HCO)
2 3 2 3 3
+c(CO2)。a点溶液中存在电荷守恒:c(Na+)+2c(Ca2+)+c(H+)=c(HCO)+2c(CO2)+c(Cl−)
3 3 3
+c(OH−)。联立后得到:c(H CO )+2c(Ca2+)+c(H+)=c(CO 2−)+c(Cl−)+c(OH−)。由于a点溶液
2 3 3
呈碱性,则 c(H+)c(CO 2−)+c(Cl−)。B 项,a→b 的过程
2 3 3
中产生CaCO 沉淀的同时生成HCO,且HCO 的量逐渐增加,对于水的电离抑制程度逐渐
3 2 3 2 3
c(H+)c(CO2) c(H+)c(CO2)c(Ca2+) 107.203.36109
增加。D项,K (H CO ) 3 = 3
a2 2 3 c(HCO) c(HCO)c(Ca2+) c(HCO)c(Ca2+)
3 3 3
4.71011所以:c(HCO)·c(Ca2+) ≈ 7.15×10−6.2。
3
14.由于反应Ⅰ和反应Ⅱ均为气体分子总数增大的反应,温度不变,增加压强,平衡逆向移动,
乙烷的转化率减小,所以p <p ,A正确。压强为p ,温度为210℃时,乙烷的转化率为
1 2 1
50%,则一共消耗乙烷1mol。其中乙烯的选择性为80%,则反应Ⅱ中有0.2mol的乙烷参
加反应,生成H 0.6mol,B正确。压强为p ,温度为210℃时,反应Ⅰ有0.8mol乙烷参
2 1
与反应,生成0.8mol CO和0.8mol C H 。反应Ⅱ中有0.2mol的乙烷参加反应,生成0.8mol CO,
2 4
所以共生成1.6mol CO和0.8mol C H ,C错误。当压强为p ,温度为210℃时,反应Ⅰ
2 4 1
0.81.60.8 64
的平衡常数K mol/L。已知反应Ⅰ的 ΔH >0,当升高温度至 300℃,
1
12.8 175
64
平衡正向移动,K增大,所以K mol/L。D正确。
175
二、非选择题:本题共4小题,共58分。
15.(除特殊标注外,每空2分,共14分)
(1)水浴加热(1分) 过滤(1分)
(2)Ca(C H O ) +H SO =2C H O +CaSO ↓ 葡萄糖酸中有羟基和羧基两种官能
6 11 7 2 2 4 6 l2 7 4
团,它们能与水分子形成分子间氢键,所以葡萄糖酸易溶于水
(3)将未转化的葡萄糖酸钙完全转化为葡萄糖酸
(4)b(1分)
26(cV cV )
(5)①蓝(1分) 酒红(1分) ② 1 1 2 2 ③偏高(1分)
a
化学参考答案·第3页(共7页)【解析】(1)由于控制温度是90℃,所以该反应可采取的加热方式是水浴加热;操作1后
得到的是滤液和CaSO 沉淀,所以操作名称为过滤。
4
(2)步骤Ⅰ中,葡萄糖酸钙与稀硫酸发生复分解反应,则反应的化学方程式是
Ca(C H O ) +H SO =2C H O +CaSO ↓。
6 11 7 2 2 4 6 l2 7 4
(3)将滤液 1 通过 H+型阳离子交换树脂,氢离子和阳离子钙离子交换,因此目的是将未
转化的葡萄糖酸钙完全转化为葡萄糖酸。
(4)由于向滤液2中加入10mL 95%的乙醇目的是利于析出葡萄糖酸锌晶体。
(5)①整个滴定过程中 EDTA 与锌离子反应,锌离子来源为两部分:一部分来自产品配
成的溶液,另一部分为锌离子标准溶液。开始滴定时溶液中成分为 Zn−EDTA(无色)、
EDTA、EBT,故溶液颜色为蓝色;用锌离子标准溶液滴定时,到达滴定终点会生成
Zn−EBT(酒红色),即到终点颜色变化为蓝色变为酒红色;
②Zn2++EDTA=Zn−EDTA,可找到关系式:
465103(cV cV )
Zn2+~ EDTA,则锌元素的质量分数为 1 1 2 2 100%。
a
③若滴定前滴定管的尖嘴部分无气泡,滴定后有气泡,会导致消耗锌标准溶液 V mL 偏
2
小,则导致此次测定结果偏高。
16.(除特殊标注外,每空2分,共14分)
(1)3d8(1分)
(2)SO
2
(3)2Fe2++2H++H O =2Fe3++2H O 2Fe3++3Ni(OH) 2Fe(OH) +3Ni2+
2 2 2 2 3
(4)1.2×10−2或0.012
(5)H SO(1分) 54.5 pH太小,锌的萃取率低,pH太大,镍可能以Ni(OH) 的形
2 4 2
式沉出,不利于硫酸镍晶体的生成(1点1分)
【解析】向硫酸镍通入硫化氢气体将三价铁还原为二价铁,将铜离子转化为硫化铜沉淀,
过滤后滤渣硫化铜灼烧生成氧化铜,再溶于硫酸得到硫酸铜;滤液中加过氧化氢将亚铁离
子氧化成三价铁离子,再加氢氧化镍调节pH值使三价铁离子转化为氢氧化铁沉淀,过滤
后在滤液中加氟化镍将钙离子沉淀,过滤后滤液中加萃取剂将锌转移至有机相中,滤液为
硫酸镍溶液,经蒸发浓缩、冷却结晶、过滤、洗涤等操作得到硫酸镍晶体,据此分析解答。
(3)加入H O 的目的是将Fe2+氧化为Fe3+;加入Ni(OH) 的目的是调节pH,使Fe3+水解
2 2 2
反应2Fe3++3Ni(OH) 2Fe(OH) +3Ni2+正向进行,促进Fe3+的沉淀。
2 3
(4)根据K (CaF )=c(Ca2+)×c2(F−),得出c2(F−)≥4×10−6mol/L,设NiF 溶液的体积为V L,
sp 2 2
化学参考答案·第4页(共7页)即溶液中n(F−)=2V×2×10−3=4V×10−3(mol),沉淀时消耗的F−的物质的量为V×2×10−3mol,
则总共需要n(F−)=2.4V×10−3mol,所加的NiF 溶液的浓度至少为1.2×10−2mol/L。
2
(5)欲使有机相中的锌转化成硫酸锌,需使萃取平衡逆向移动,为不引入新杂质应加入硫
酸使反应逆行移动;由题干信息可知,若溶液 4 的 pH=3,则 c(H+)=0.001mol • L−1,
c(Zn2+)=0.011mol • L−1,多次萃取后水相中c(H+)为0.013mol • L−1,则溶液中多的c(H+)为
0.012mol • L−1,根据“Zn2++2HR ZnR +2H+”得除去c(Zn2+)= 1 ×0.012mol • L−1
2
2
0.006
=0.006mol • L−1;则锌的萃取率为 ×100%≈54.5%;由图示信息可知pH太小,锌的萃
0.011
取率低;pH太大,镍可能以Ni(OH) 的形式沉出,不利于硫酸镍晶体的生成。
2
17.(除特殊标注外,每空2分,共15分)
(1)①<(1分) ②加快反应速率;提高平衡时C H SH的选择性(答到一点得1分)
6 5
4(m8n2)
(2)①BC ② ③在590℃时主反应已达平衡,副反应未达平衡;由于主
(12mn)2
反应 ΔH<0,升高温度平衡逆向移动,C H SH 的产率逐渐降低;副反应随温度升高速率
6 5
加快,C H 的产率逐渐升高(共三点,少一点扣1分)
6 6
2 3 b
(3)①Na−e−=Na+ ②cd ③
2 a
【解析】(1)①主反应:C H Cl(g)+H S(g) C H SH(g)+HCl(g) ΔH=−16.8kJ·mol−1
6 5 2 6 5
副反应:C H Cl(g)+H S(g) C H (g)+HCl(g)+ 1 S (g) ΔH=−45.8kJ·mol−1
6 5 2 6 6 8
8
反应C H SH(g) C H (g)+ 1 S (g) ΔH=−45.8−(−16.8)=−29kJ·mol−1为放热反应,故
6 5 6 6 8
8
逆反应的活化能大于正反应的活化能;
②反应在高压容器中进行时,反应物的浓度更高,反应的速率更快;达平衡时,副反应压
强增大平衡逆向移动,促使主反应平衡正向移动可提高C H SH的选择性。
6 5
(2)①A项,主反应ΔH、ΔS均<0,根据自发反应吉布斯自由能判据ΔG=ΔH−TΔS<0,反
应在低温条件下可以自发进行。B 项,由于生成的 n(HCl)=n(C H SH)+n(C H ),
6 5 6 6
n(C H )=8n(S ),所以n(C H SH)=m−8n,转化的n(C H Cl)等于生成的n(C H SH)+n(C H ),
6 6 8 6 5 6 5 6 5 6 6
m8n
所以C H SH的选择性为 100%。C项,平衡时v (C H Cl)v (C H )
6 5 m 正 6 5 正 6 6
v (C H SH),v (H S)v (C H )v (C H SH),所以v (C H Cl)v (H S)2[v
正 6 5 正 2 正 6 6 正 6 5 正 6 5 正 2 正
化学参考答案·第5页(共7页)K
(C H )v (C H SH)]。D 项, p(主反应) 为主反应减去副反应后对应反应的平衡常数,由
6 6 正 6 5 K
p(副反应)
于对应反应的 ΔH=−16.8−(−45.8)=+29kJ·mol−1,为吸热反应,升高温度平衡正向移动,
平衡常数K 增大。
p
(3)②a项,离子液体中阴阳离子间为离子键,作用力强于一般有机溶剂中的分子间作用
力,故离子液体不易挥发、不易燃。b项,Ⅰ、Ⅱ、Ⅲ的阳离子,其中心原子均为sp3杂化。
c项,由于阴离子半径BFAlCl。
4 4 4 4
d 项,Ⅳ的阳离子中环上三个 C 各提供一条单电子 P 轨道,带正电荷的 N 提供一条单电
子P轨道,另一N提供一条对电子P轨道,故一共5条P轨道6个电子,大Π键6。
5
3 312
③Na S 的晶胞参数可以表示为 ,由于 Na+处于晶胞内八个小立方体的体心内,所
2
aN
A
1 3 312 3 312
以d(Na Na) ;CaF 的晶胞参数可以表示为 ,由于Ca2+处于晶胞的顶
2
2 bN bN
A A
2 3 312
点 和 面 心 , 所 以 距 离 最 近 的 d(Ca2 Ca2) , 所 以 d(Na Na) ∶
2 bN
A
1 3 312 2 3 312 2 3 b
d(Ca2 Ca2) ∶ 。
2 aN 2 bN 2 a
A A
18.(除特殊标注外,每空2分,共15分)
(1)丙三醇(1分)
(2)
(3)保护丙三醇1,2号位的两个羟基不被氧化
(4)
(5)
加聚反应
(6)
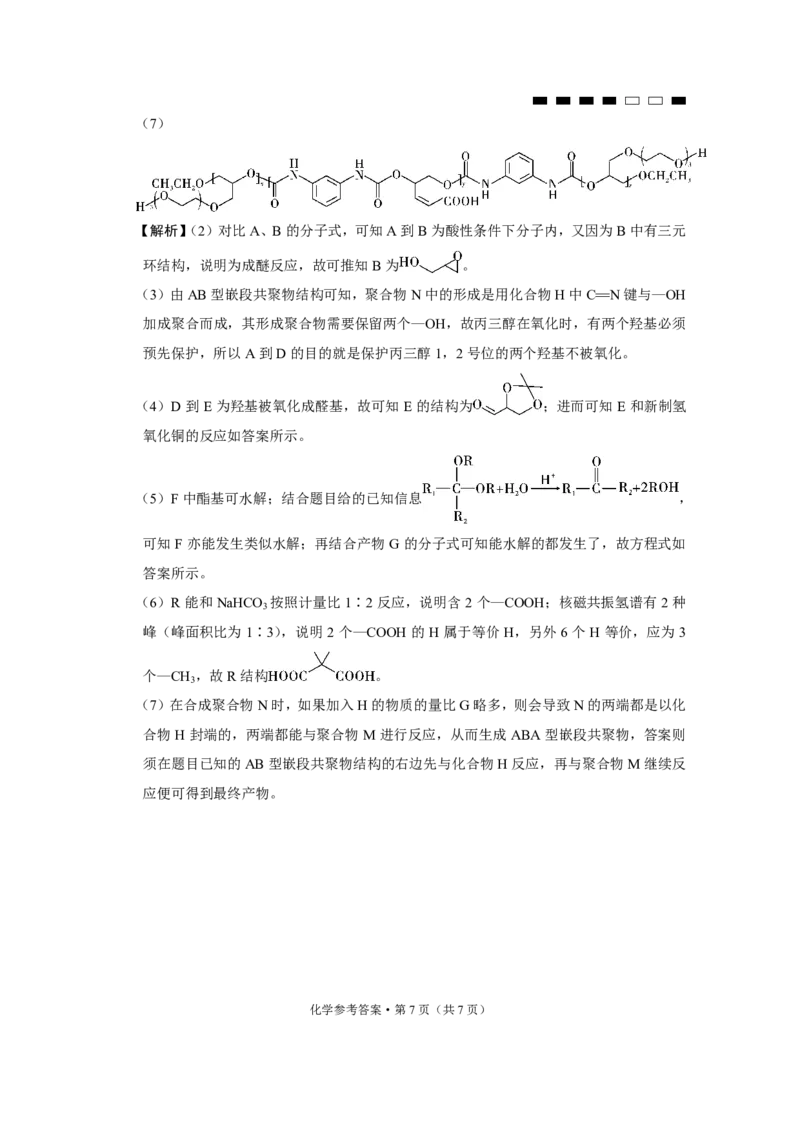
化学参考答案·第6页(共7页)(7)
【解析】(2)对比A、B的分子式,可知A到B为酸性条件下分子内,又因为B中有三元
环结构,说明为成醚反应,故可推知B为 。
(3)由AB型嵌段共聚物结构可知,聚合物N中的形成是用化合物H中C N键与—OH
加成聚合而成,其形成聚合物需要保留两个—OH,故丙三醇在氧化时,有两个羟基必须
预先保护,所以A到D的目的就是保护丙三醇1,2号位的两个羟基不被氧化。
(4)D到E为羟基被氧化成醛基,故可知E的结构为 ;进而可知E和新制氢
氧化铜的反应如答案所示。
(5)F中酯基可水解;结合题目给的已知信息 ,
可知 F 亦能发生类似水解;再结合产物 G 的分子式可知能水解的都发生了,故方程式如
答案所示。
(6)R 能和NaHCO 按照计量比1∶2反应,说明含2 个—COOH;核磁共振氢谱有2种
3
峰(峰面积比为 1∶3),说明 2 个—COOH 的 H 属于等价 H,另外 6 个 H 等价,应为 3
个—CH ,故R结构 。
3
(7)在合成聚合物N时,如果加入H的物质的量比G略多,则会导致N的两端都是以化
合物 H 封端的,两端都能与聚合物 M 进行反应,从而生成 ABA 型嵌段共聚物,答案则
须在题目已知的AB型嵌段共聚物结构的右边先与化合物H反应,再与聚合物M继续反
应便可得到最终产物。
化学参考答案·第7页(共7页)