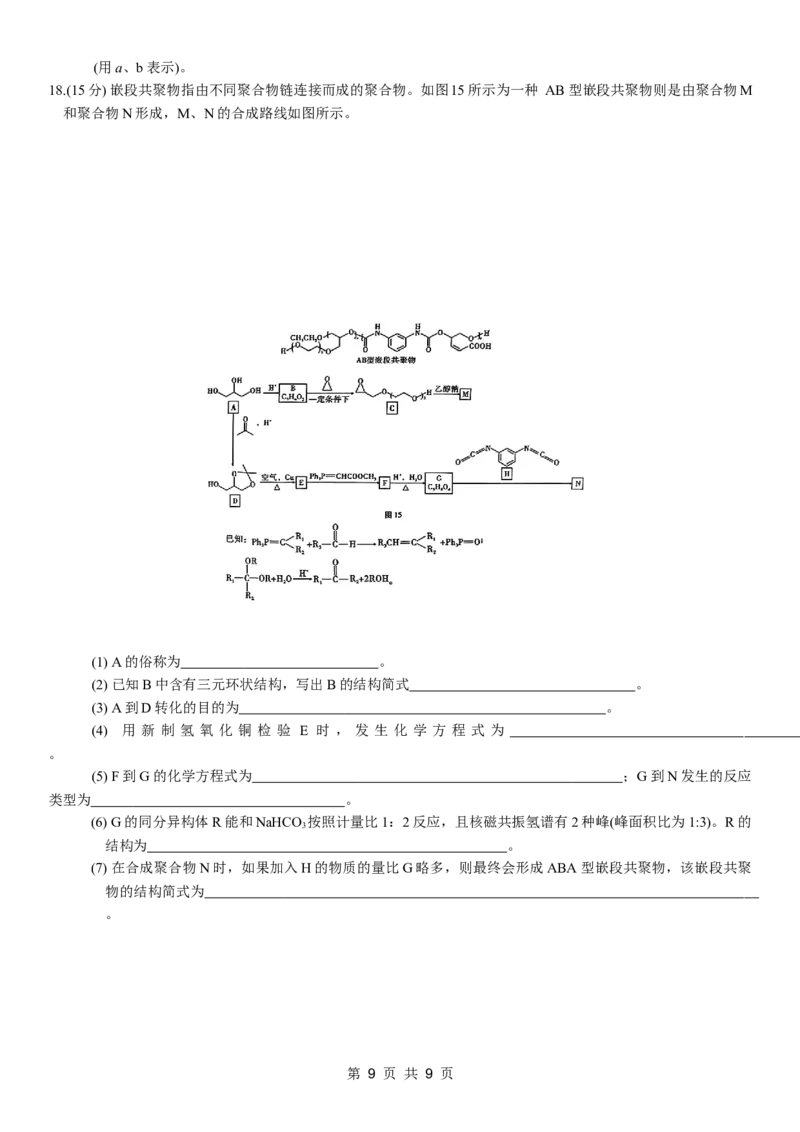
文档内容
重庆市第八中学 2024 届高考适应性月考卷(六)
化 学 试 卷
注意事项:
1. 答题前,考生务必用黑色碳素笔将自己的姓名、准考证号、考场号、座位号在答题卡上填写清楚。
2. 每小题选出答案后,用2B 铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选
涂其他答案标号。在试题卷上作答无效。
3. 考试结束后,请将本试卷和答题卡一并交回。满分 100分,考试用时75分钟。
可能用到的相对原子质量: H—1 C—12 O—16 F—19 Na—23 S—32 Ca—40 Fe—56 Co—59 Zn—65
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 化学和生活、科技、社会发展息息相关,下列说法正确的是
A. 利用烯烃发生缩聚反应制备聚乙烯塑料
B. 华为新上市的 mate60pro手机引发关注,其芯片的基础材料是SiO₂
C. 三星堆黄金面具出土时光亮且薄如纸,说明金不活泼和有很好的延展性
D. 火星全球影像彩图显示了火星表土颜色,表土中赤铁矿主要成分为 Fe₃O₄
2. 下列化学用语表达正确的是
A. Cl₂分子中共价键电子云轮廓图:
B. CCl₄分子的空间填充模型为
C. 次氯酸钠的电子式:
D.CH₃CH(CH₃)CH₂COOH的名称:2-甲基丁酸
3. 常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 在澄清透明溶液中:Cu²⁺、NH₄、Cl⁻、NO₃
B. 在新制氯水中:NH:、Na⁺、SO²⁻、SO²⁻
C. 在加入铝粉能产生 H₂的溶液中: Fe²⁺、Na⁺、SO²⁻、NO₃
D. 加入KSCN 溶液显红色的溶液中: K⁺、CO²⁻、CN⁻、AlO₂
4. 下述说法不正确的是
A. Cl₂和I₂分别与Fe反应生成FeCl₃和FeI₂
B. 分别向 NaAlO₂溶液和饱和 Na₂CO₃溶液中通入过量的CO₂时均可析出白色沉淀
C. 新制氯水和浓硝酸在光照下可产生同种气体
D. 将等物质的量的Al和Si分别加入足量NaOH 溶液中,生成气体的物质的量之比为4:3
5. 设N 为阿伏加德罗常数的值。下列说法正确的是
A
A. 25℃时, pH=12 的 Na₂CO₃溶液中含有OH⁻的数目为0.01N
A
B. 标准状况下, 2.24L CH₃Cl含有的 C—H 键数为0.3N
A
C. 常温下,56g Fe 与足量浓硫酸充分反应生成气体的分子数为N
A
D.1L0.1mol/LK₂Cr₂O₁,溶液中含铬的离子总数为0.2N
A
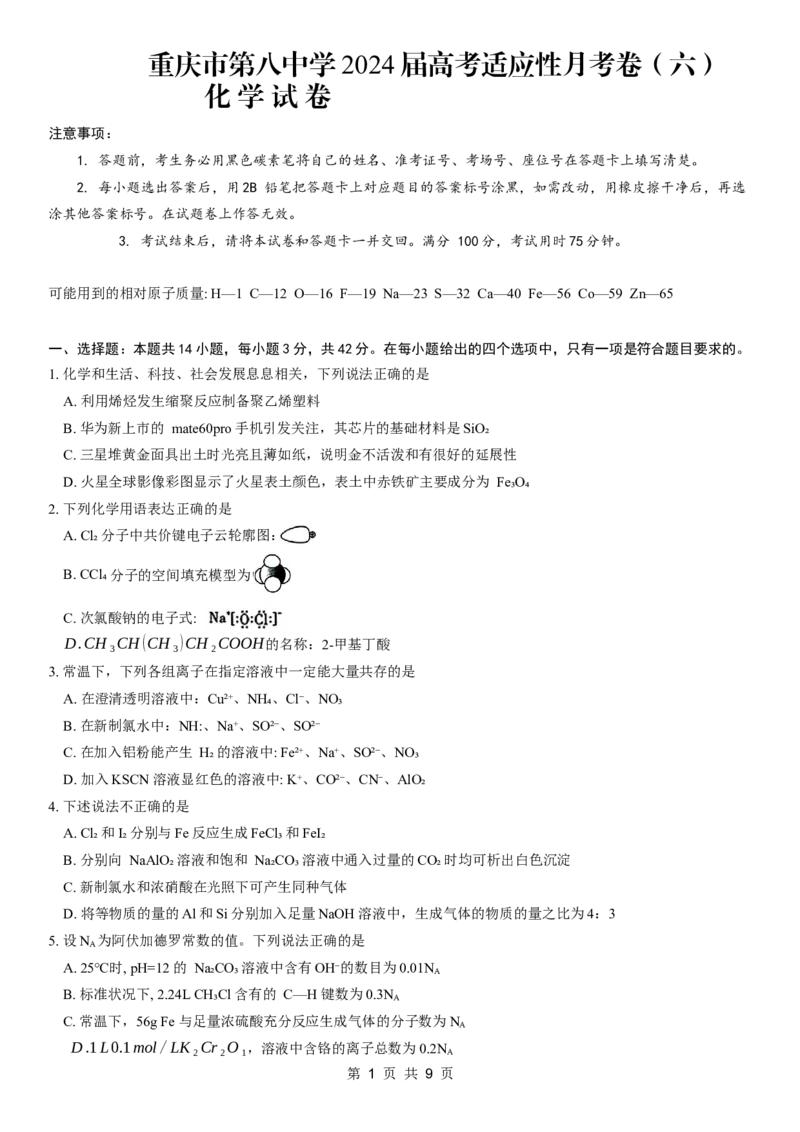
第 1 页 共 9 页6. 下列装置和操作(如图1) 能达到实验目的的是
A. 图甲制备溴苯并验证其反应类型
B. 图乙煅烧贝壳至 900℃,得到生石灰
C. 图丙浓硫酸与萤石 (主要成分为 CaF₂) 加热制备 HF
D. 图丁配制溶液时,向250mL 容量瓶中转移溶液
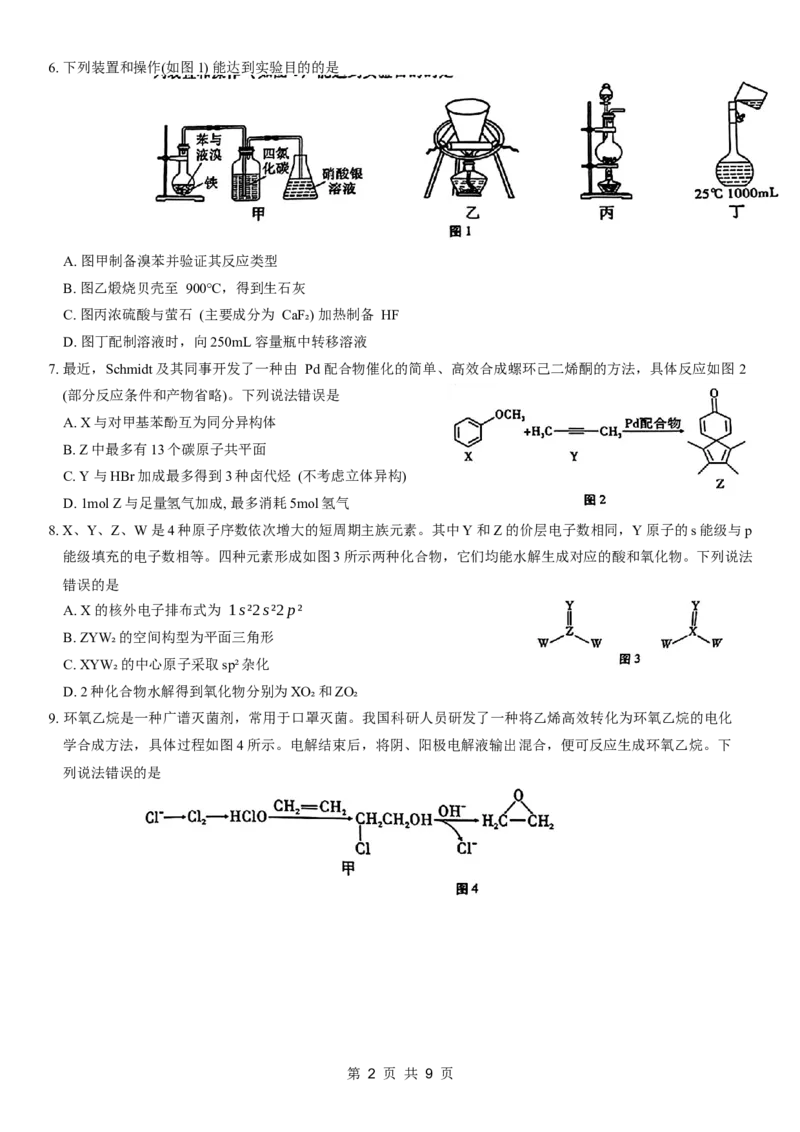
7. 最近,Schmidt及其同事开发了一种由 Pd 配合物催化的简单、高效合成螺环己二烯酮的方法,具体反应如图 2
(部分反应条件和产物省略)。下列说法错误是
A. X与对甲基苯酚互为同分异构体
B. Z中最多有13个碳原子共平面
C. Y 与HBr加成最多得到3种卤代烃 (不考虑立体异构)
D. 1mol Z与足量氢气加成, 最多消耗5mol氢气
8. X、Y、Z、W 是4种原子序数依次增大的短周期主族元素。其中Y 和Z 的价层电子数相同,Y 原子的s能级与p
能级填充的电子数相等。四种元素形成如图3 所示两种化合物,它们均能水解生成对应的酸和氧化物。下列说法
错误的是
A. X 的核外电子排布式为 1s²2s²2p²
B. ZYW₂的空间构型为平面三角形
C. XYW₂的中心原子采取sp²杂化
D. 2种化合物水解得到氧化物分别为XO₂和ZO₂
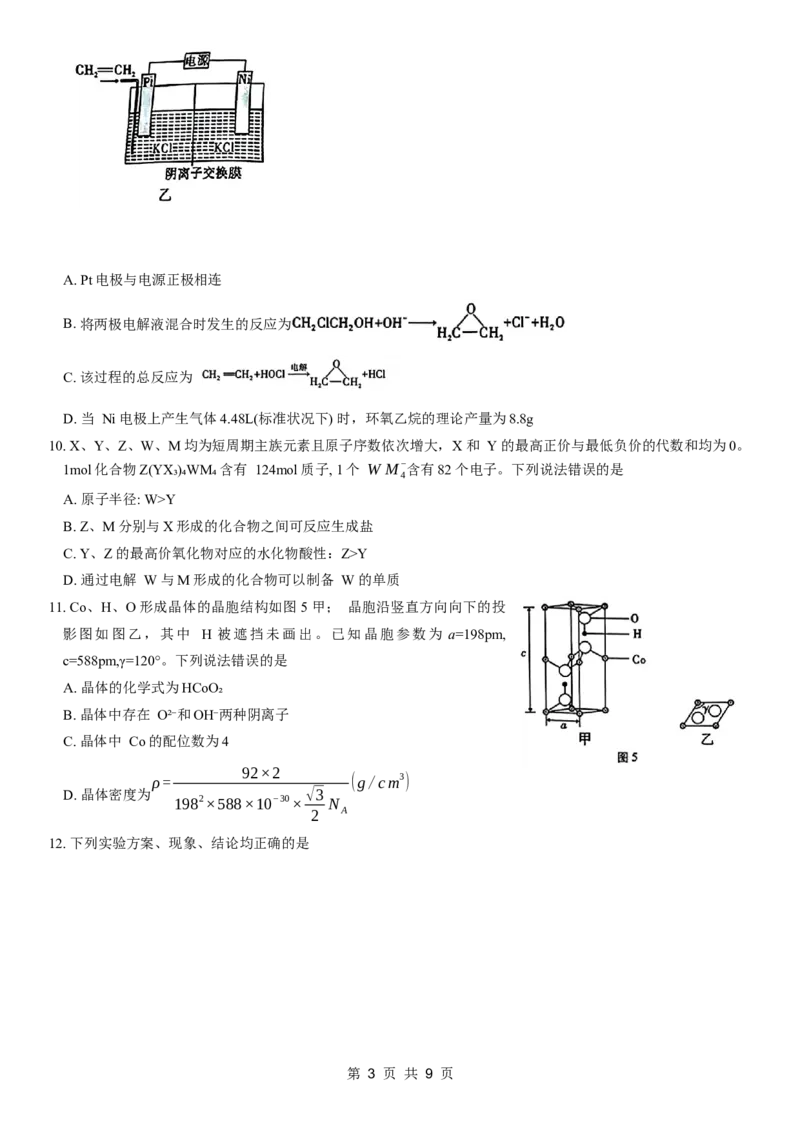
9. 环氧乙烷是一种广谱灭菌剂,常用于口罩灭菌。我国科研人员研发了一种将乙烯高效转化为环氧乙烷的电化
学合成方法,具体过程如图4所示。电解结束后,将阴、阳极电解液输出混合,便可反应生成环氧乙烷。下
列说法错误的是
第 2 页 共 9 页A. Pt电极与电源正极相连
B. 将两极电解液混合时发生的反应为
C. 该过程的总反应为
D. 当 Ni电极上产生气体4.48L(标准状况下) 时,环氧乙烷的理论产量为8.8g
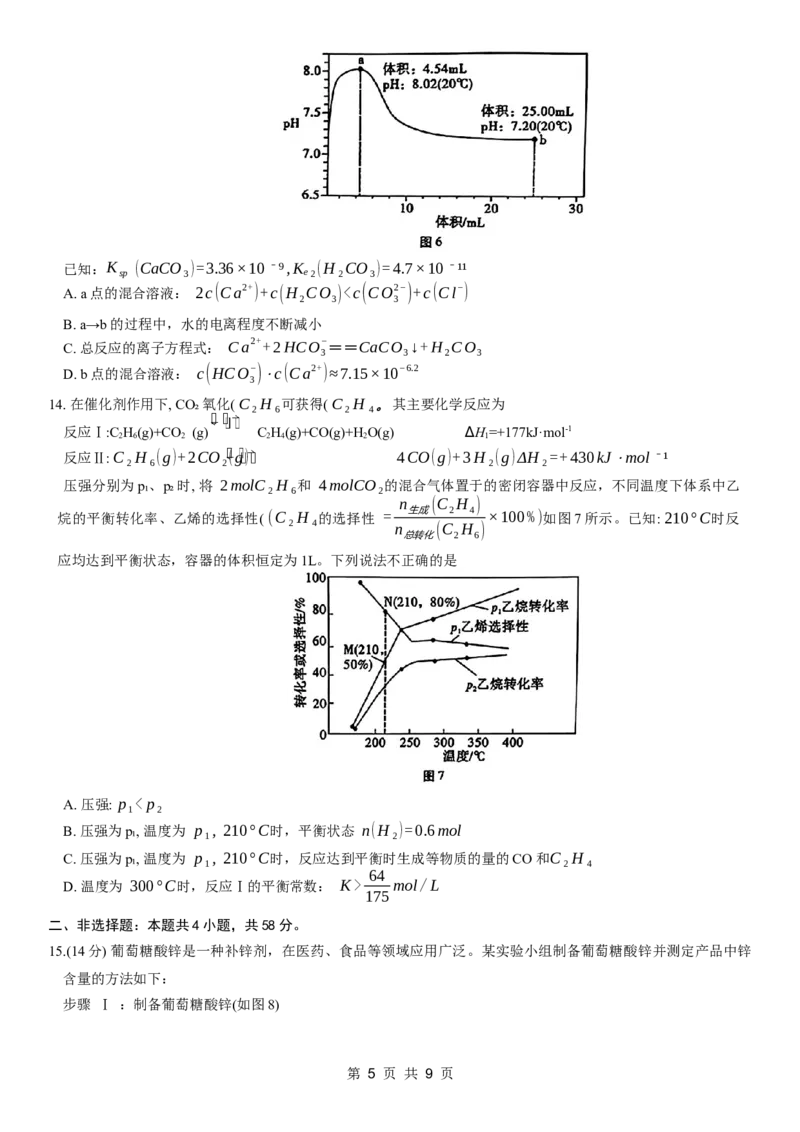
10. X、Y、Z、W、M均为短周期主族元素且原子序数依次增大,X 和 Y 的最高正价与最低负价的代数和均为0。
1mol化合物Z(YX₃)₄WM₄含有 124mol质子, 1个 W M−含有82个电子。下列说法错误的是
4
A. 原子半径: W>Y
B. Z、M分别与X形成的化合物之间可反应生成盐
C. Y、Z的最高价氧化物对应的水化物酸性:Z>Y
D. 通过电解 W 与M形成的化合物可以制备 W 的单质
11. Co、H、O形成晶体的晶胞结构如图5 甲; 晶胞沿竖直方向向下的投
影图如图乙,其中 H 被遮挡未画出。已知晶胞参数为 a=198pm,
c=588pm,γ=120°。下列说法错误的是
A. 晶体的化学式为HCoO₂
B. 晶体中存在 O²⁻和OH⁻两种阴离子
C. 晶体中 Co的配位数为4
92×2
ρ= (g/cm3)
D. 晶体密度为 √3
1982×588×10−30× N
2 A
12. 下列实验方案、现象、结论均正确的是
第 3 页 共 9 页选项 操作 现象 结论
向饱和 Na₂CO₃溶液中加入少量 BaSO₄ 粉末, 过产生气泡, 固体
A K (BaCO₃) mol/L
175
二、非选择题:本题共4小题,共58分。
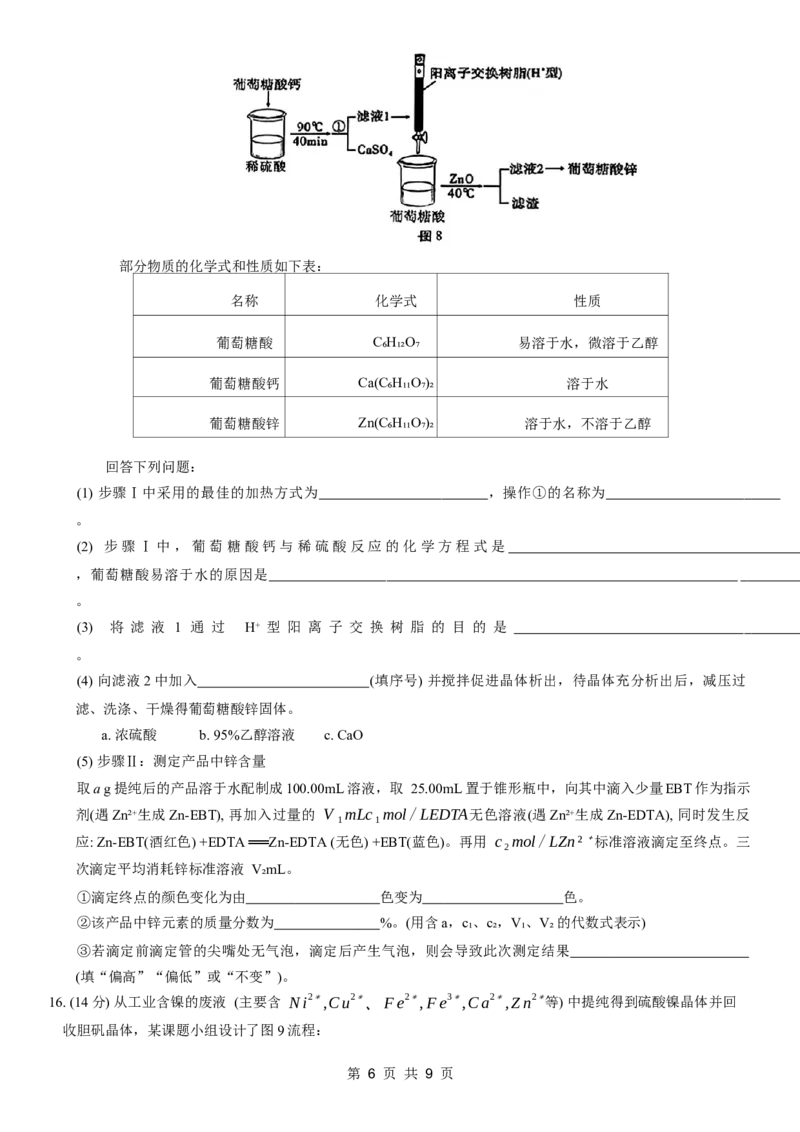
15.(14分) 葡萄糖酸锌是一种补锌剂,在医药、食品等领域应用广泛。某实验小组制备葡萄糖酸锌并测定产品中锌
含量的方法如下:
步骤 Ⅰ :制备葡萄糖酸锌(如图8)
第 5 页 共 9 页部分物质的化学式和性质如下表:
名称 化学式 性质
葡萄糖酸 C₆H₁₂O₇ 易溶于水,微溶于乙醇
葡萄糖酸钙 Ca(C₆H₁₁O₇)₂ 溶于水
葡萄糖酸锌 Zn(C₆H₁₁O₇)₂ 溶于水,不溶于乙醇
回答下列问题:
(1) 步骤Ⅰ中采用的最佳的加热方式为 ,操作①的名称为
。
(2) 步骤Ⅰ中,葡萄糖酸钙与稀硫酸反应的化学方程式是
,葡萄糖酸易溶于水的原因是
。
(3) 将 滤 液 1 通 过 H⁺ 型 阳 离 子 交 换 树 脂 的 目 的 是
。
(4) 向滤液2中加入 (填序号) 并搅拌促进晶体析出,待晶体充分析出后,减压过
滤、洗涤、干燥得葡萄糖酸锌固体。
a. 浓硫酸 b. 95%乙醇溶液 c. CaO
(5) 步骤Ⅱ:测定产品中锌含量
取a g提纯后的产品溶于水配制成100.00mL 溶液,取 25.00mL 置于锥形瓶中,向其中滴入少量EBT作为指示
剂(遇Zn²⁺生成Zn-EBT), 再加入过量的 V ₁mLc₁mol/LEDTA无色溶液(遇Zn²⁺生成Zn-EDTA), 同时发生反
应: Zn-EBT(酒红色) +EDTA ══Zn-EDTA (无色) +EBT(蓝色)。再用 c₂mol/LZn²⁺标准溶液滴定至终点。三
次滴定平均消耗锌标准溶液 V₂mL。
①滴定终点的颜色变化为由 色变为 色。
②该产品中锌元素的质量分数为 %。(用含a,c₁、c₂,V₁、V₂的代数式表示)
③若滴定前滴定管的尖嘴处无气泡,滴定后产生气泡,则会导致此次测定结果
(填“偏高”“偏低”或“不变”)。
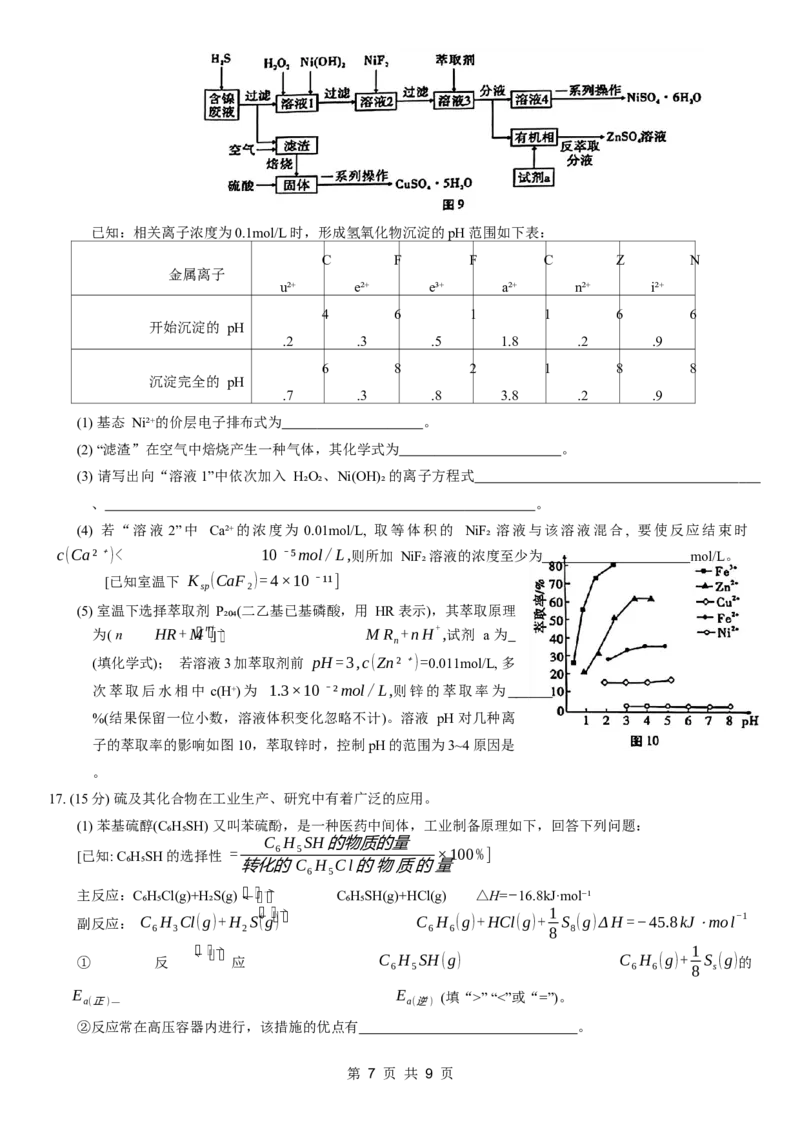
16. (14分) 从工业含镍的废液 (主要含 Ni2∗,Cu2∗、Fe2∗,Fe3∗,Ca2∗,Zn2∗等) 中提纯得到硫酸镍晶体并回
收胆矾晶体,某课题小组设计了图9流程:
第 6 页 共 9 页已知:相关离子浓度为0.1mol/L时,形成氢氧化物沉淀的pH 范围如下表:
C F F C Z N
金属离子
u²⁺ e²⁺ e³⁺ a²⁺ n²⁺ i²⁺
4 6 1 1 6 6
开始沉淀的 pH
.2 .3 .5 1.8 .2 .9
6 8 2 1 8 8
沉淀完全的 pH
.7 .3 .8 3.8 .2 .9
(1) 基态 Ni²⁺的价层电子排布式为 。
(2) “滤渣”在空气中焙烧产生一种气体,其化学式为 。
(3) 请写出向“溶液1”中依次加入 H₂O₂、Ni(OH)₂的离子方程式
、 。
(4) 若“溶液 2”中 Ca²⁺的浓度为 0.01mol/L, 取等体积的 NiF₂ 溶液与该溶液混合, 要使反应结束时
c(Ca²⁺)< 10⁻⁵mol/L,则所加 NiF₂溶液的浓度至少为 mol/L。
[已知室温下 K (CaF₂)=4×10⁻¹¹]
sp
(5) 室温下选择萃取剂 P₂₀₄(二乙基已基磷酸,用 HR 表示),其萃取原理
为( n HR+Mn+ M R +nH+,试剂 a 为
n
(填化学式); 若溶液3加萃取剂前 pH=3,c(Zn²⁺)=0.011mol/L, 多
次萃取后水相中 c(H⁺)为 1.3×10⁻²mol/L,则锌的萃取率为
%(结果保留一位小数,溶液体积变化忽略不计)。溶液 pH 对几种离
子的萃取率的影响如图10,萃取锌时,控制pH的范围为3~4原因是
。
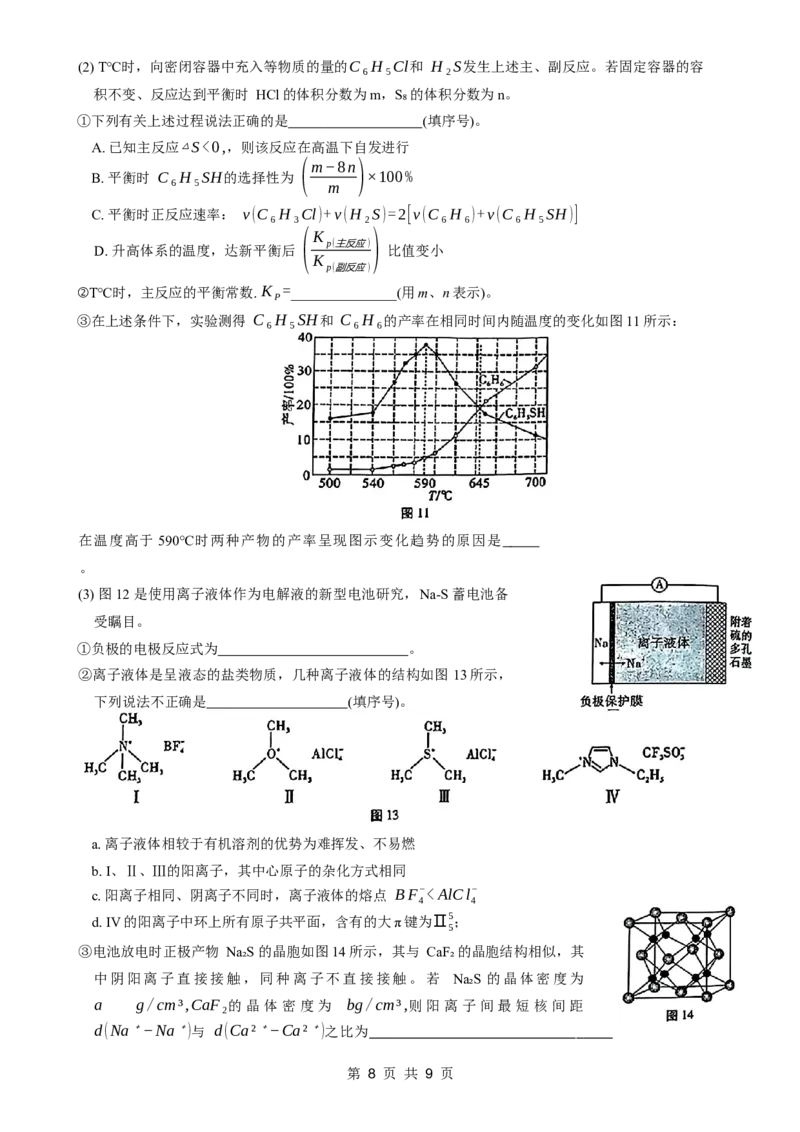
17. (15分) 硫及其化合物在工业生产、研究中有着广泛的应用。
(1) 苯基硫醇(C₆H₅SH) 又叫苯硫酚,是一种医药中间体,工业制备原理如下,回答下列问题:
C H SH的物质的量
[已知: C₆H₅SH的选择性 = 6 5 ×100%]
转化的C H Cl的物质的量
6 5
主反应:C₆H₅Cl(g)+H₂S(g) C₆H₅SH(g)+HCl(g) △H=−16.8kJ·mol⁻¹
1
副反应: C H Cl(g)+H S(g) C H (g)+HCl(g)+ S (g)ΔH=−45.8kJ⋅mol−1
6 3 2 6 6 8 8
1
① 反 应 C H SH(g) C H (g)+ S (g)的
6 5 6 6 8 s
E _ E (填“>” “<”或“=”)。
a(正) a(逆)
②反应常在高压容器内进行,该措施的优点有 。
第 7 页 共 9 页(2) T℃时,向密闭容器中充入等物质的量的C₆H₅Cl和 H₂S发生上述主、副反应。若固定容器的容
积不变、反应达到平衡时 HCl的体积分数为m,S₈的体积分数为n。
①下列有关上述过程说法正确的是 (填序号)。
A. 已知主反应△S<0,,则该反应在高温下自发进行
(m−8n)
B. 平衡时 C₆H₅SH的选择性为 ×100%
m
C. 平衡时正反应速率: v(C₆H₃Cl)+v(H₂S)=2[v(C₆H₆)+v(C₆H₅SH)]
K
( )
p(主反应)
D. 升高体系的温度,达新平衡后 比值变小
K
p(副反应)
②T℃时,主反应的平衡常数. K =_______________(用m、n表示)。
P
③在上述条件下,实验测得 C₆H₅SH和 C₆H₆的产率在相同时间内随温度的变化如图11 所示:
在温度高于 590℃时两种产物的产率呈现图示变化趋势的原因是
。
(3) 图12 是使用离子液体作为电解液的新型电池研究,Na-S蓄电池备
受瞩目。
①负极的电极反应式为 。
②离子液体是呈液态的盐类物质,几种离子液体的结构如图 13所示,
下列说法不正确是 (填序号)。
a. 离子液体相较于有机溶剂的优势为难挥发、不易燃
b. Ⅰ、Ⅱ、Ⅲ的阳离子,其中心原子的杂化方式相同
c. 阳离子相同、阴离子不同时,离子液体的熔点 BF−