文档内容
2025 届高三年级摸底考试
化学
本试卷共8页,20小题,满分100分,考试用时75分钟。
注意事项:
1.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名和考生号、试室号、座位号填
写在答题卡上。用2B铅笔将试卷类型和考生号填涂在答题卡相应位置上。
2.选择题每小题选出答案后,用2B铅笔把答题卡上对应的题目选项的答案信息点涂黑;如需
改动,用橡皮擦干净后,再填涂其他答案。答案不能答在试卷上。
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相
应位置上:如需改动,先划掉原来的答案,然后再写上新的答案,不准使用铅笔和涂改液。
不按以上要求作答的答案无效。
4.作答选做题时,请先用2B铅笔填涂选做题的题组号的信息点,再作答。漏涂、错涂、多涂
的,答案无效。
5.考生必须保持答题卡的整洁。
可能用到的相对原子质量:H1 C12 O16 Al27 Ca40 Ti48 Zn65
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题
4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 书法之美尽在“笔墨纸砚”之间。下列说法错误的是
A. 制作笔头的“狼毫”主要成分是蛋白质
B. 墨汁的主要成分是碳,常温下性质稳定
C. 宣纸的主要成分是合成高分子材料
D. 澄泥砚属于陶制砚台,陶瓷的主要成分是硅酸盐
2. 下列化学用语或图示表达正确的是
A. 的空间结构模型:
第1页/共15页
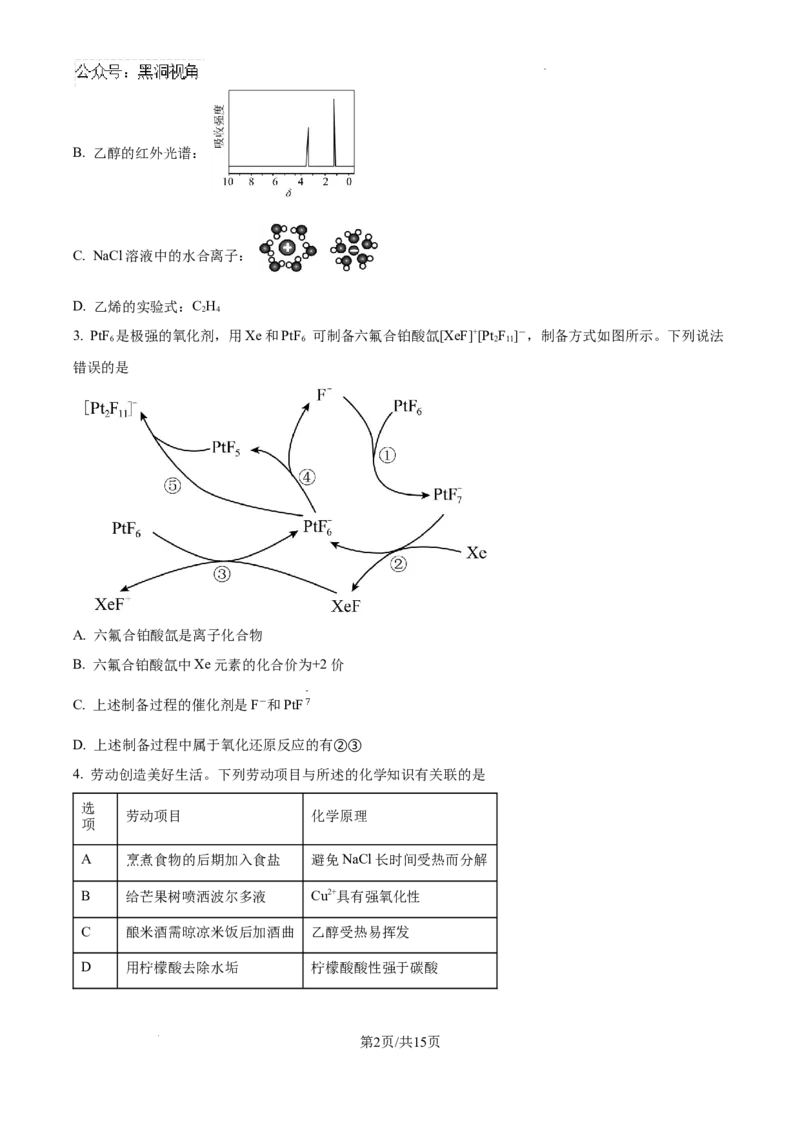
学科网(北京)股份有限公司B. 乙醇的红外光谱:
C. NaCl溶液中的水合离子:
D. 乙烯的实验式:C H
2 4
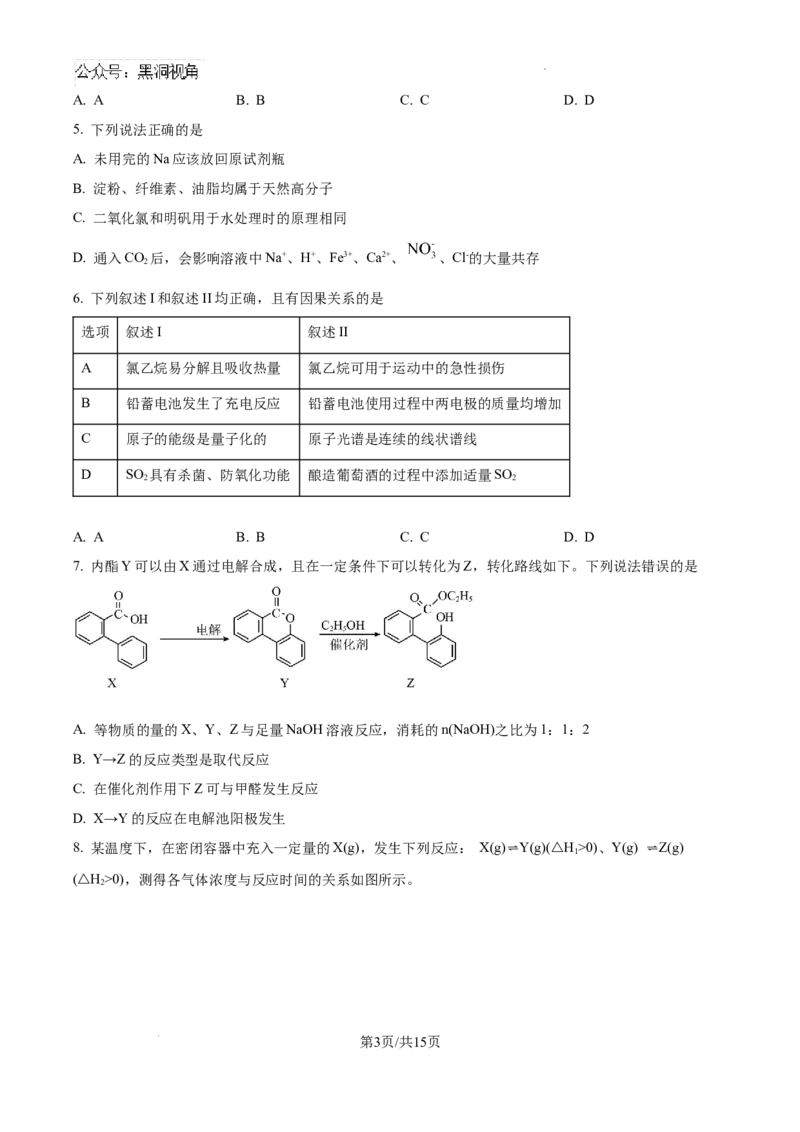
3. PtF 是极强的氧化剂,用Xe和PtF 可制备六氟合铂酸氙[XeF]+[Pt F ]-,制备方式如图所示。下列说法
6 6 2 11
错误的是
A. 六氟合铂酸氙是离子化合物
B. 六氟合铂酸氙中Xe元素的化合价为+2价
C. 上述制备过程的催化剂是F-和PtF
D. 上述制备过程中属于氧化还原反应的有②③
4. 劳动创造美好生活。下列劳动项目与所述的化学知识有关联的是
选
劳动项目 化学原理
项
A 烹煮食物的后期加入食盐 避免NaCl长时间受热而分解
B 给芒果树喷洒波尔多液 Cu2+具有强氧化性
C 酿米酒需晾凉米饭后加酒曲 乙醇受热易挥发
D 用柠檬酸去除水垢 柠檬酸酸性强于碳酸
第2页/共15页
学科网(北京)股份有限公司A. A B. B C. C D. D
5. 下列说法正确的是
A. 未用完的Na应该放回原试剂瓶
B. 淀粉、纤维素、油脂均属于天然高分子
C. 二氧化氯和明矾用于水处理时的原理相同
D. 通入CO 后,会影响溶液中Na+、H+、Fe3+、Ca2+、 、Cl-的大量共存
2
6. 下列叙述I和叙述II均正确,且有因果关系的是
选项 叙述I 叙述II
A 氯乙烷易分解且吸收热量 氯乙烷可用于运动中的急性损伤
B 铅蓄电池发生了充电反应 铅蓄电池使用过程中两电极的质量均增加
C 原子的能级是量子化的 原子光谱是连续的线状谱线
D SO 具有杀菌、防氧化功能 酿造葡萄酒的过程中添加适量SO
2 2
A. A B. B C. C D. D
7. 内酯Y可以由X通过电解合成,且在一定条件下可以转化为Z,转化路线如下。下列说法错误的是
A. 等物质的量的X、Y、Z与足量NaOH溶液反应,消耗的n(NaOH)之比为1:1:2
B. Y→Z的反应类型是取代反应
C. 在催化剂作用下Z可与甲醛发生反应
D. X→Y的反应在电解池阳极发生
8. 某温度下,在密闭容器中充入一定量的X(g),发生下列反应: X(g)⇌Y(g)(△H
1
>0)、Y(g) ⇌Z(g)
(△H>0),测得各气体浓度与反应时间的关系如图所示。
2
第3页/共15页
学科网(北京)股份有限公司下列反应进程示意图符合题意的是
A. B. C.
D.
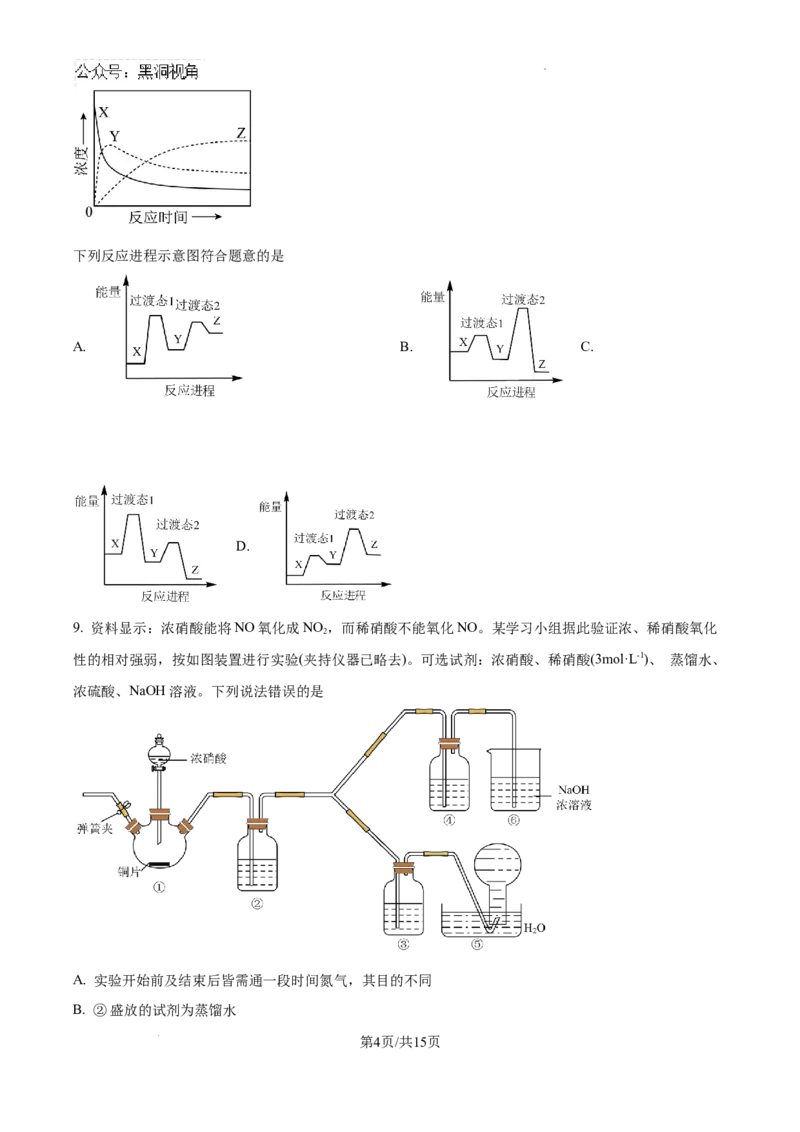
9. 资料显示:浓硝酸能将NO氧化成NO ,而稀硝酸不能氧化NO。某学习小组据此验证浓、稀硝酸氧化
2
性的相对强弱,按如图装置进行实验(夹持仪器已略去)。可选试剂:浓硝酸、稀硝酸(3mol·L-1)、 蒸馏水、
浓硫酸、NaOH溶液。下列说法错误的是
A. 实验开始前及结束后皆需通一段时间氮气,其目的不同
B. ②盛放的试剂为蒸馏水
第4页/共15页
学科网(北京)股份有限公司C. 做实验时应避免将有害气体排放到空气中,故装置③④盛放的试剂依次是浓硝酸、稀硝酸
D. 能证明氧化性的相对强弱的实验现象是:③中气体仍为无色而④中气体变为红棕色
10. 下列叙述对应的方程式书写错误的是
A. 向次氯酸钙溶液通入足量二氧化碳: ClO-+ CO + H O = HClO +
2 2
B. 向饱和NaOH溶液通入过量CO 析出白色晶体: OH-+ CO=
2 2
C. 加热蓝色的CuCl 溶液,溶液变黄绿色:[Cu(H O) ]2+ (aq)[蓝色] + 4Cl-(aq) [CuCl ]2-(aq)[黄色] +
2 2 4 4
4HO(l) △H>0
2
D. 向FeSO 溶液中加入HO 出现红褐色沉淀: 2Fe2+ + H O + 4H O = 2Fe(OH) ↓+ 4H+
4 2 2 2 2 2 3
11. 一种Zn/CuSe混合离子软包二次电池装置示意图如图所示(其中一极产物为Cu Se固体),其中离子交换
2
膜为阳离子交换膜或阴离子交换膜,下列说法错误的是
A. Cu Se固体为放电时正极产物
2
B. 无论放电或充电,电路中每转移2mol电子就有2mol离子通过离子交换膜
C. 充电时,阴极电极反应式为: Zn2++ 2e = Zn
D. 由该装置可推测出还原性:Zn>Cu Se
2
12. N 是阿伏加德罗常数,下列说法正确的是
A
A. 28g由乙烯与丙烯组成的混合物中含碳碳双键的数目为N
A
B. 90g 葡萄糖分子中,手性碳原子个数为2.5N
A
C. 标准状况下5.6 LC H 中含有的s-sp3 σ键数为2.5N
4 10 A
D. 0.1mol·L-1 Na SO 溶液中, 数目小于0.1N
2 3 A
13. 某锂盐的结构如图所示,其阴离子是由原子序数依次增大的短周期主族元素X、Y、Z、W形成,X、
Y与Z同一周期,Y与W同族。下列说法正确的是
第5页/共15页
学科网(北京)股份有限公司A. 第一电离能: Z>Y>X
B. 高温或放电条件下,X单质与Y单质直接化合反应生成XY
C. 氢化物的沸点: Y>Z>X
D. 加热条件下,Cu单质与W单质直接化合反应生成CuW
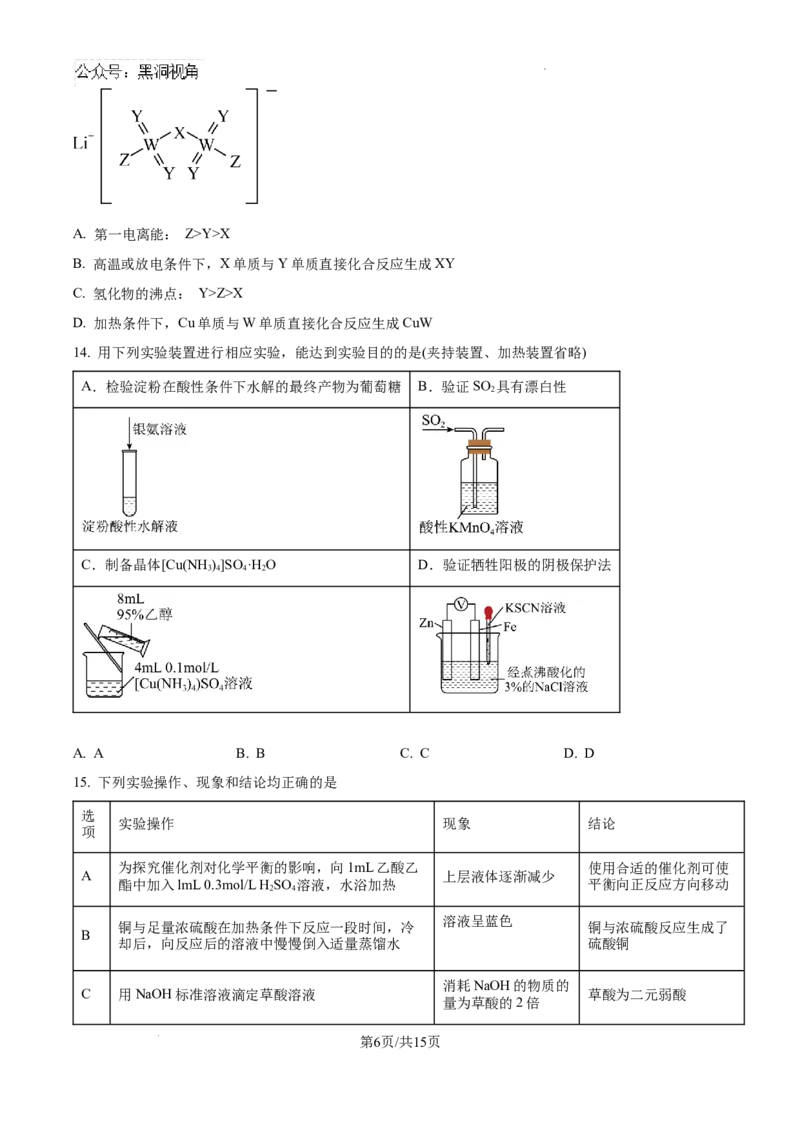
14. 用下列实验装置进行相应实验,能达到实验目的的是(夹持装置、加热装置省略)
A.检验淀粉在酸性条件下水解的最终产物为葡萄糖 B.验证SO 具有漂白性
2
C.制备晶体[Cu(NH )]SO ·H O D.验证牺牲阳极的阴极保护法
3 4 4 2
A. A B. B C. C D. D
15. 下列实验操作、现象和结论均正确的是
选
实验操作 现象 结论
项
为探究催化剂对化学平衡的影响,向1mL乙酸乙 使用合适的催化剂可使
A 上层液体逐渐减少
酯中加入lmL 0.3mol/L H SO 溶液,水浴加热 平衡向正反应方向移动
2 4
溶液呈蓝色
铜与足量浓硫酸在加热条件下反应一段时间,冷 铜与浓硫酸反应生成了
B
却后,向反应后的溶液中慢慢倒入适量蒸馏水 硫酸铜
消耗NaOH的物质的
C 用NaOH标准溶液滴定草酸溶液 草酸为二元弱酸
量为草酸的2倍
第6页/共15页
学科网(北京)股份有限公司向FeBr 和KSCN混合溶液中滴入少量新制氯水, 下层呈无色,上层呈
D 2 Fe2+的还原性强于Br-
再加入CCl 混合振荡、静置 红色
4
A. A B. B C. C D. D
16. {Ti O }团簇是比较罕见的一个穴醚无机类似物,我国科学家通过将{Rb@Ti O }和Cs+反应,测定笼
12 18 12 18
内Cs+的浓度,计算Cs+取代Rb+反应的平衡常数(K ),反应示意图和所测数据如图。有关说法不正确的是
eq
图中 表示平衡时铯离子浓度和铷离子浓度之比,其它类似
A. 离子半径:r(Cs+)>r(Rb+)
B. 研究发现:Cs+的直径显著大于{Ti O }团簇表面的孔径且{Ti O }的骨架结构在Cs+交换过程中没有被
12 18 12 18
破坏。据此推断:{Ti O }团簇表面的孔是柔性的
12 18
C. K ≈0.1
eq
D. {Ti O }团簇对于Cs+具有比Rb+大的亲和力
12 18
二、非选择题:本题共4小题,共56分。
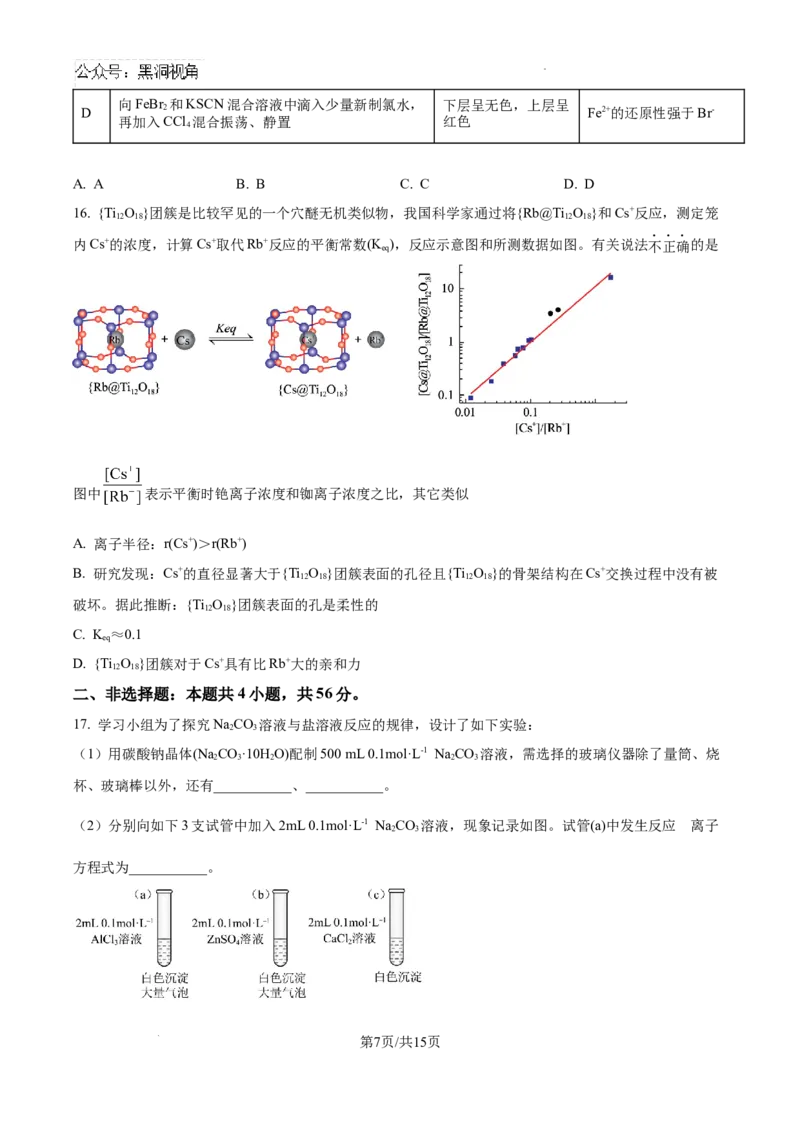
17. 学习小组为了探究NaCO 溶液与盐溶液反应的规律,设计了如下实验:
2 3
(1)用碳酸钠晶体(Na CO·10H O)配制500 mL 0.1mol·L-1 Na CO 溶液,需选择的玻璃仪器除了量筒、烧
2 3 2 2 3
杯、玻璃棒以外,还有___________、___________。
的
(2)分别向如下3支试管中加入2mL 0.1mol·L-1 Na CO 溶液,现象记录如图。试管(a)中发生反应 离子
2 3
方程式为___________。
第7页/共15页
学科网(北京)股份有限公司(3)设计热分解实验,探究白色沉淀的成分:
将(2)中所得三种沉淀,分别置于B中。实验结束后,数据记录如下:
样 加热前样品质 加热后样品质 C质量增 D质量增
品 量/g 量/g 重/g 重/g
a 5.2 3.4 1.8 0
.
b 11.2 81 0.9 2.2
c 5.0 5.0 0 0
已知:查表,得到几种物质的溶解度(20℃)数据如下。
溶解 溶解 溶解 溶解 溶解
物质 物质 物质 物质 物质
度/g 度/g 度/g 度/g 度/g
Al(OH) 1.5×1 Zn(O 1.4×1 Ca(O Cd(O 1.9×1 Mn(O 3.2×1
0.160
0-8 H) 0-5 H) H) 0-4 H) 0-4
3 2 2 2 2
Al (CO 易水 4.7×1 Ca 5.3×1 Cd 4.3×1 Mn 4.9×1
2 ZnCO
) 解 3 0-5 CO 0-4 CO 0-5 CO 0-5
3 3 3 3 3
①装置E的作用是___________。
②计算可得(b)中沉淀的化学式为___________。
的
③(c)中样品最终确定为CaCO ,试分析CaCO 未分解 原因___________。
3 3
④(c)中沉淀是碳酸盐而不是碱的原因是___________。
⑤根据探究的结论预测,物质的量浓度均为0.1mol·L-1的CdSO4溶液和NaCO 溶液等体积混合,得到的沉
2 3
淀的化学式较可能为___________。
⑥制备MnCO 常用MnSO 溶液和NH HCO 溶液,不选择NaCO 溶液可能的原因是_________。
3 4 4 3 2 3
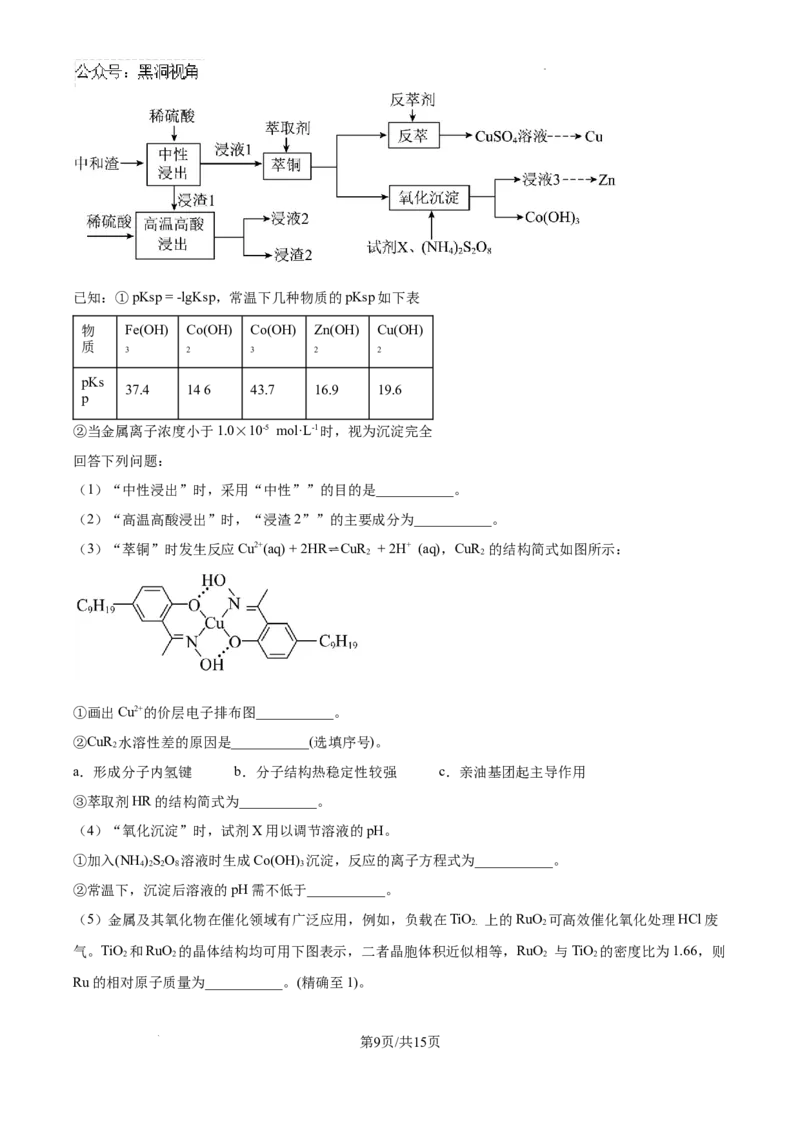
18. 中和渣是有色金属冶炼过程中产生的危险废渣。从中和渣(主要含有CaSO 和少量Zn2+、Cu2+、Co2+、
4
Fe3+ 的氢氧化物)中回收铜、锌等金属的工艺流程如下图:
第8页/共15页
学科网(北京)股份有限公司已知:①pKsp = -lgKsp,常温下几种物质的pKsp如下表
物 Fe(OH) Co(OH) Co(OH) Zn(OH) Cu(OH)
质
3 2 3 2 2
.
pKs
37.4 146 43.7 16.9 19.6
p
②当金属离子浓度小于1.0×10-5 mol·L-1时,视为沉淀完全
回答下列问题:
(1)“中性浸出”时,采用“中性””的目的是___________。
(2)“高温高酸浸出”时,“浸渣2””的主要成分为___________。
(3)“萃铜”时发生反应Cu2+(aq) + 2HR⇌CuR
2
+ 2H+ (aq),CuR
2
的结构简式如图所示:
①画出Cu2+的价层电子排布图___________。
②CuR 水溶性差的原因是___________(选填序号)。
2
a.形成分子内氢键 b.分子结构热稳定性较强 c.亲油基团起主导作用
③萃取剂HR的结构简式为___________。
(4)“氧化沉淀”时,试剂X用以调节溶液的pH。
①加入(NH )SO 溶液时生成Co(OH) 沉淀,反应的离子方程式为___________。
4 2 2 8 3
②常温下,沉淀后溶液的pH需不低于___________。
(5)金属及其氧化物在催化领域有广泛应用,例如,负载在TiO 上的RuO 可高效催化氧化处理HCl废
2. 2
气。TiO 和RuO 的晶体结构均可用下图表示,二者晶胞体积近似相等,RuO 与TiO 的密度比为1.66,则
2 2 2 2
Ru的相对原子质量为___________。(精确至1)。
第9页/共15页
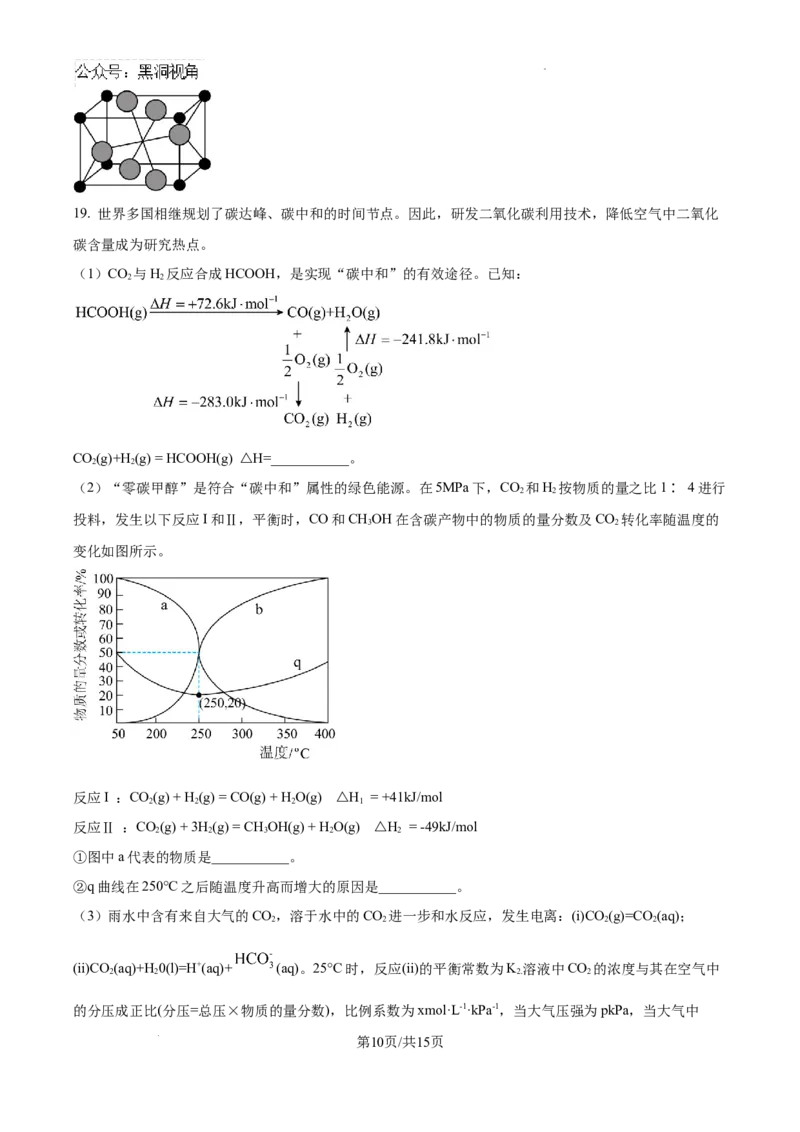
学科网(北京)股份有限公司19. 世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化
碳含量成为研究热点。
(1)CO 与H 反应合成HCOOH,是实现“碳中和”的有效途径。已知:
2 2
CO(g)+H(g) = HCOOH(g) △H=___________。
2 2
(2)“零碳甲醇”是符合“碳中和”属性的绿色能源。在5MPa下,CO 和H 按物质的量之比1∶ 4进行
2 2
投料,发生以下反应I和Ⅱ,平衡时,CO和CHOH在含碳产物中的物质的量分数及CO 转化率随温度的
3 2
变化如图所示。
反应I :CO(g) + H(g) = CO(g) + H O(g) △H = +41kJ/mol
2 2 2 1
反应Ⅱ :CO(g) + 3H(g) = CH OH(g) + H O(g) △H = -49kJ/mol
2 2 3 2 2
①图中a代表的物质是___________。
②q曲线在250°C之后随温度升高而增大的原因是___________。
(3)雨水中含有来自大气的CO,溶于水中的CO 进一步和水反应,发生电离:(i)CO(g)=CO (aq);
2 2 2 2
(ii)CO (aq)+H 0(l)=H+(aq)+ (aq)。25°C时,反应(ii)的平衡常数为K 溶液中CO 的浓度与其在空气中
2 2 2. 2
的分压成正比(分压=总压×物质的量分数),比例系数为xmol·L-1·kPa-1,当大气压强为pkPa,当大气中
第10页/共15页
学科网(北京)股份有限公司CO(g)的物质的量分数为y时(考虑水的电离,水的离子积常数为Kw;忽略 的电离):
2
①溶液中CO 的浓度c(CO)aq为___________mol/L(写出表达式,以下符号可选用:K、x、p、y、Kw)
2 2 2
②溶液中H+浓度c(H+)、OH-浓度c(OH-)和 浓度c( )之间满足等量关系:___________。
③溶液中H+浓度c(H+)为___________mol/L(写出表达式,以下符号可选用:K、x、p、y、Kw)
2
(4)两种酸式碳酸盐的分解反应如下。某温度下平衡时总压强分别为p 和p。
1 2
反应1: NH HCO (s) = NH (g)+HO(g)+CO(g) p =3×104Pa 。
4 3 3 2 2 1
反应2: 2NaHCO (s) = Na CO(s)+HO(g)+CO(g) p = 4×103Pa
3 2 3 2 2 2
该温度下,刚性密闭容器中放入NH HCO 和NaCO 固体,平衡后以上3种固体均大量存在:
4 3 2 3
①算该温度下平衡后刚性密闭容器总压强P =___________,写出计算过程,结果保留三位有效数字(已知:
总
Kp为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
②通入NH ,再次平衡后,总压强___________(填“增大”、“减小”或“不变”)。
3
③缩小体积,再次平衡后,总压强___________(填“增大”、“减小”或“不变”)。
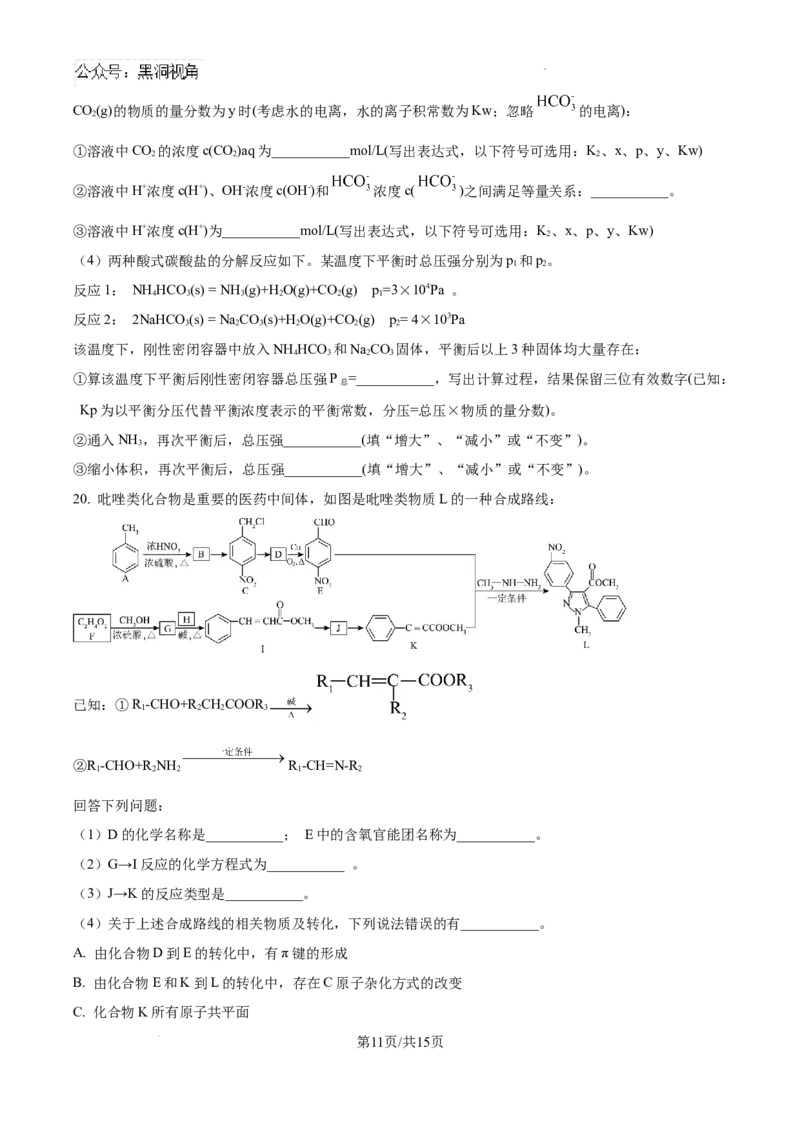
20. 吡唑类化合物是重要的医药中间体,如图是吡唑类物质L的一种合成路线:
已知:①R -CHO+R CHCOOR
1 2 2 3
②R -CHO+R NH R -CH=N-R
1 2 2 1 2
回答下列问题:
(1)D的化学名称是___________; E中的含氧官能团名称为___________。
(2)G→I反应的化学方程式为___________ 。
(3)J→K的反应类型是___________。
(4)关于上述合成路线的相关物质及转化,下列说法错误的有___________。
A. 由化合物D到E的转化中,有π键的形成
B. 由化合物E和K到L的转化中,存在C原子杂化方式的改变
C. 化合物K所有原子共平面
第11页/共15页
学科网(北京)股份有限公司D. lmol化合物CH-NH-NH 最多能与1mol质子(H+)形成配位键
3 2
(5)对于化合物I,分析预测其可能的化学性质,完成下表。
反应形成的新有机物
序 反应类
反应试剂、条件
号 (写出完整的有机物) 型
取代反
① (a)___________ (b)___________
应
加成反
② H、催化剂、加热 (c)___________
2 应
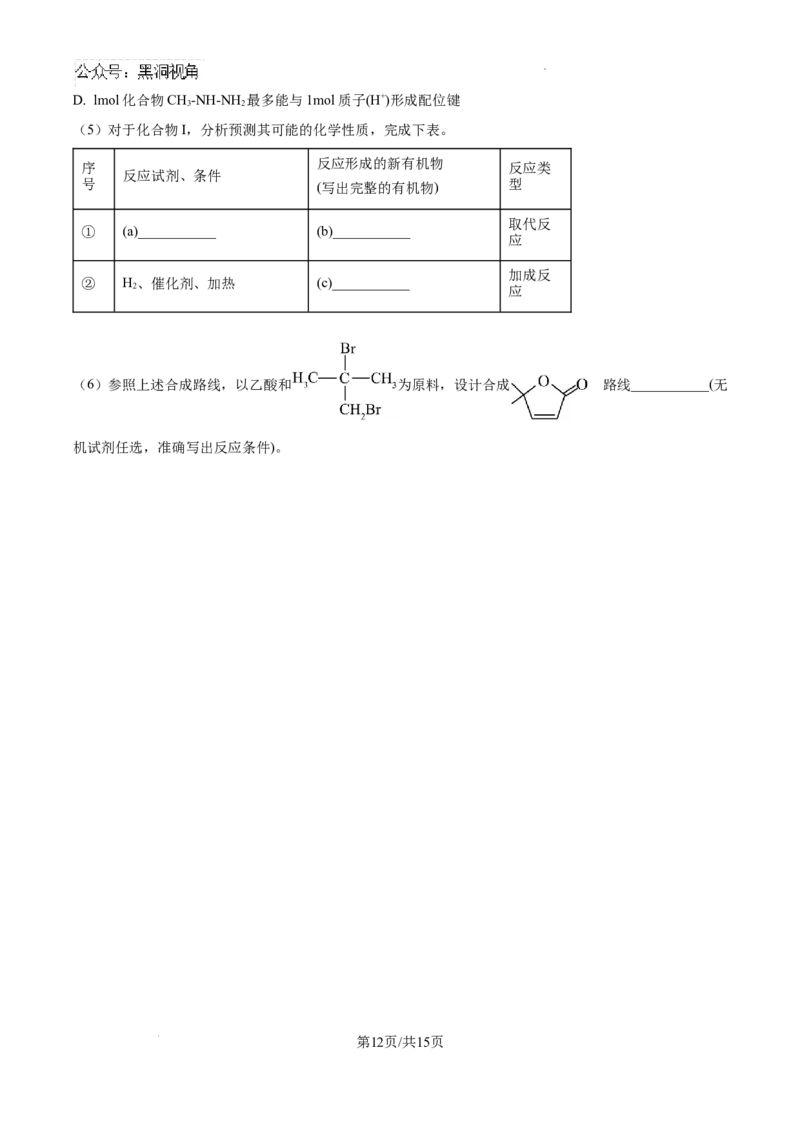
(6)参照上述合成路线,以乙酸和 为原料,设计合成 路线___________(无
的
机试剂任选,准确写出反应条件)。
第12页/共15页
学科网(北京)股份有限公司2025 届高三年级摸底考试
化学
本试卷共8页,20小题,满分100分,考试用时75分钟。
注意事项:
1.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名和考生号、试室号、座位号填
写在答题卡上。用2B铅笔将试卷类型和考生号填涂在答题卡相应位置上。
2.选择题每小题选出答案后,用2B铅笔把答题卡上对应的题目选项的答案信息点涂黑;如需
改动,用橡皮擦干净后,再填涂其他答案。答案不能答在试卷上。
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相
应位置上:如需改动,先划掉原来的答案,然后再写上新的答案,不准使用铅笔和涂改液。
不按以上要求作答的答案无效。
4.作答选做题时,请先用2B铅笔填涂选做题的题组号的信息点,再作答。漏涂、错涂、多涂
的,答案无效。
5.考生必须保持答题卡的整洁。
可能用到的相对原子质量:H1 C12 O16 Al27 Ca40 Ti48 Zn65
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题
4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
【1题答案】
【答案】C
【2题答案】
【答案】A
【3题答案】
【答案】C
【4题答案】
【答案】D
【5题答案】
【答案】A
【6题答案】
【答案】D
第13页/共15页
学科网(北京)股份有限公司【7题答案】
【答案】A
【8题答案】
【答案】D
【9题答案】
【答案】C
【10题答案】
【答案】B
【11题答案】
【答案】B
【12题答案】
【答案】C
【13题答案】
【答案】B
【14题答案】
【答案】C
【15题答案】
【答案】D
【16题答案】
【答案】C
二、非选择题:本题共4小题,共56分。
【17题答案】
【答案】(1) ①. 500mL容量瓶 ②. 胶头滴管
(2)2A13++ 3 + 3H O = 2Al(OH) ↓+3CO ↑
2 3 2
(3) ①. 防止空气中水蒸气、CO 倒吸进入D装置 ②. Zn(OH) ·ZnCO [或Zn(OH) CO] ③.
2 2 3 2 2 3
酒精灯火焰的温度低于碳酸钙的分解温度 ④. 溶解度越小越易生成,碳酸钙的溶解度远小于氢氧化钙
⑤. xCdCO·yCd(OH) [x和y可取大于0的其他数值:或Cd (OH) CO] ⑥. Mn(OH) 和MnCO 溶解度
3 2 2 2 3 2 3
较接近,NaCO 溶液中显碱性,而NH HCO 显酸性,加碳酸钠会有Mn(OH) 生成,使产物MnCO 纯度下
2 3 4 3 2 3
降
【18题答案】
【答案】(1)便于Fe(OH) 的沉淀和分离
3
第14页/共15页
学科网(北京)股份有限公司(2)CaSO (3) ①. ②. ac ③.
4
(4) ①. + 2Co2+ + 6H O = 2 + 2Co(OH) ↓+ 6H+ ②. 1.1
2 3
(5)101
【19题答案】
【答案】(1)-31.4kJ·mol-1
(2) ①. 甲醇(或CHOH) ②. 升温反应I使CO 的平衡转化率增大,反应Ⅱ使之减少,在250℃后
3 2
反应I起决定作用,正反应为吸热反应,升高温度,平衡正向移动,CO 的转化率增大
2
(3) ①. pxy ②. c(H+)= c(OH-)+ c( ) ③.
(4) ①. 2.54×105Pa ②. 不变 ③. 不变
【20题答案】
【答案】(1) ①. 对硝基苯甲醇 ②. 硝基和醛基
(2)CHCOOCH + +H O
3 3 2
(3)消去反应 (4)CD
( 5 ) ① . 稀 硫 酸 、 加 热 ② . 和 CHOH ③.
3
(6)
第15页/共15页
学科网(北京)股份有限公司