文档内容
2024 年重庆市普通高中学业水平选择性考试
高考模拟调研卷化学(一)
化学测试卷共4页,满分100分。考试时间75分钟。
可能用到的相对原子质量:H-1C-12N-14P-11Cl-35.5Cr-52In-115
一、选择题:本题共14个小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。
1. 化学与生产、生活、科技密切相关,下列说法正确的是
A.工业上用作塑料填充剂的纳米碳酸钙是胶体
B.补铁剂(含FeSO₄)与胃舒平配合使用效果更好
C.中国天眼FAST用到的高性能碳化硅是一种新型无机非金属材料
D.“墨子号”卫星的成功发射实现了光纤量子通信,光纤的主要成分是晶体硅
2. 下列离子方程式书写正确的是
A.AlCl₃溶液显酸性的原因:
B.向Na₂S O₂溶液中加入稀硫3酸+: +
2
Al +3H₂O= Al OH ₃+3H
C.向NaOH溶液中通入少量 2− +
S2O3 +2H =SO2 ↑+S ↓+H2O
D.向FeI 液中滴入少量H₂O₂溶液: − −
2 CO2:CO2+OH =HCO3
3.下列叙述错误的是
2Fe²⁺+H₂O₂+2H⁺=2Fe³⁺+2H₂O
A. 工业上用H₂还原MgO来冶炼金属Mg B.石灰石是制造玻璃的主要原料之一
C.浓硫酸具有吸水性,可用于干燥SO₂ D.饱和Na₂CO₃溶液可将水垢中的CaSO₄转化为CaCO₃
4.肼(N₂H₄)是一种应用广泛的化工原料,可用作火箭和燃料电池的燃料。实验室制取肼的化学方程式为:
。已知N 为阿伏加德罗常数的值,下列说法正确的是
A
2NH₃+
A.6.4gN₂H₄分子中含有的电子数为3.6N 溶液中含有的氯原子数为0.5N
A A
NaClO=N₂H₄+NaCl+H₂O
C.每消耗44.8LNH₃,理论上转移电子数为2N D.标准状况下,33.6LH₂O含有水分子数为1.5N
A A
B.0.5mol⋅L⁻¹NaCl
5. 下列实验装置或操作能够达到实验目的的是
A. 验证铁粉发生析氢腐B. 验证浓硫酸的强氧化C.检查装置气密性D.乙醇萃取碘水中的
蚀 性 碘
6. 氨硼烷(NH₃BH₃)是一种新型储氢材料,分子中与N 原子相连的F原子呈正电性,与B原子相连的H 原子呈负
电性。氨硼烷与水发生如下反应: 。下列说法正确的是
A.中子数为8的N原子: N B.基态原子第一电离+能由大3到−小:O>N>B
3NH3BH3+6H2O 3NH4 +B3O6 +9H2 ↑
C.反应前后B原子均采用8 sp²杂化 D.氨硼烷中两种氢原子之间存在相互吸引作用
7
7.某种抗结核候选药物的重要中间体(G)可通过如下过程制得。下列有关说法正确的是
A.M中含有两个手性碳原子
B.1molG最多可消耗3molNaOH
C.N与 互为同系物
D.可消耗反应生成的酸,提高反应转化率
8. W、X、Y、Z是原子序数依次增大且不相邻的短周期主族元素,由这四种元素组成的化合物的结构如图所示
下列有关说法正确的是
A.Z的原子结构示意图为
B.X、Y、Z的简单氢化物中沸点最高的是Y
C.X的基态原子有6种空间运动状态的电子
D.该化合物在酸性条件下水解生成的气体为极性分子
9. 下列实验操作、现象和所得结论均正确的是
选项 实验操作 现象 结论
向盛有2mL 0.1mol·L⁻¹AgNO₃溶液的
先生成白色沉淀,后沉淀由
A 试管中滴加 4 滴 0.1mol·L⁻¹NaCl 溶 K (AgCl)>K (AgI)
白色变为黄色 sp sp
液; 振荡试管, 然后再向其中滴加
第1页共4页4滴0.1mol·L⁻¹KI溶液
B 在稀硫酸中加入少量Cu₂O(s) 溶液由无色变为蓝色,并有 反应中 Cu 2 O作氧化剂
红色固体生成 又作还原剂
在灼热木炭中加入浓硫酸, 将生
C 成的气体依次通过品红溶液、饱和
品红溶液褪色,澄清石灰水 浓硫酸和木炭反应产生
NaHCO₃溶液、澄清石灰水
变浑浊 SO₂和CO₂气体
D 向CuSO₄溶液中滴加浓氨水至过量 先生成蓝色沉淀,后逐渐溶 Cu(OH)₂是两性氢氧化物
解
10.一种新型电池装置如下图所示。金刚石压砧把H₂压入储氢材料,在压力梯度的驱动下生成质子,电子先后通
过下层Pt电极和外接线路转移到Pd电极参与反应,形成闭合回路。下列说法正确的是
A.Pd电极发生的反应是氧化反应
B.电流方向是Pt→负载→Pd→交换膜→Pt
C.电池负极反应为
D.由于压力梯度Pt电极的电势会高于Pd电极的电势
PdH −e⁻=PdH −1+H⁺
11.在MoO₃作用下,HOCH₂CH₂OH发生反应的历程如图所示,下列说法正确的是
A.MoO₃能提高 的平衡转化率
B.该反应历程中C-C、C-H键均发生断裂
HOCH₂CH₂OH
滴入过量酸性高锰酸钾溶液中生成CO₂
D.若将原料换为 ,则生成物为乙醛和丙烯
C.HOCH₂CH₂OH
12.常温下,向20mL浓度为 溶液中滴加等物质的量浓度的 H溶液,所得混合溶液的
HOCH CH₃ CH OH CH₃
导电能力与加入CH₃COOH溶液体积(V)的关系如图所示,电离平衡常数 下列说
0.1mol⋅L⁻¹NH₃⋅H₂O CH₃COO
法不正确的是
Ka CH3COOH =Kb NH3⋅H2O ,
A.N点溶液pH=7
B.N点溶液中:
C.Q点溶液中: − +
c NH3⋅H2O +c OH =c CH3COOH +c H
D.M、N、Q三点中,+ N点溶+液中水的电离程−度最大 −
c NH4 +c H =c CH3COO >c OH
13.InP晶体属于立方晶系,其晶胞结构如图1所示,晶胞参数为anm,若沿y轴方向观察该晶胞,可得投影图如
图2所示。已知N 为阿伏加德罗常数的值,下列说法不正确的是
A
A.晶体中In的配位数为4
B.晶胞中,1、2原子间间距与2、4相等
C.晶体密度为
D.P原子与In原 58 子 4 3 之间2的1最近距−3离为
NAa ×10 g⋅cm
14. 工业上用 CO₂和 H₂合成甲醇涉及以下反应
4
。在催化剂作用下,将 和 混合充入一恒容密容器中进行反
①CO2 g +3H2 g CH3OH g +H2O g ∆H1; ②CO₂ g +
应,达到平衡时,CO₂的转化率和容器中混合气体的平均相对分子质量随温度变化如图。下列说法不正确的
H₂ g CO g +H₂O g ∆H₂ 1molCO₂ 2molH₂
是
A.反应①为放热反应
B.250℃以后反应①的选择性减小
C.T℃,达平衡时反应②的选择性为40%
D.T℃,达平衡时H₂O的分压是CO的5倍
二、非选择题:本题共4小题,共58分。
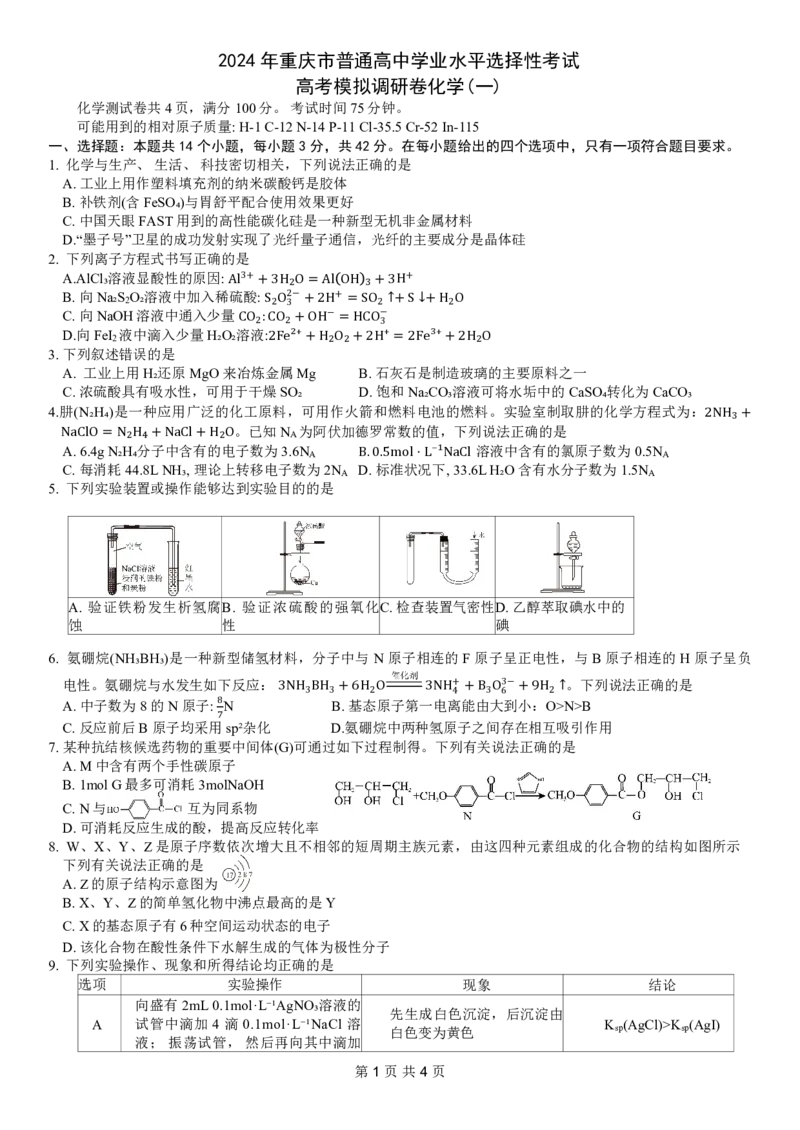
15.(14分)微颗粒的氧化锌作为一种纳米材料开始在相关领域发挥作用,利用锌焙砂(主要成分为ZnO,含 及
铅、铜、镉的氧化物)生产高纯氧化锌的工业流程如图所示。回答下列问题:
As2O3
第2页共4页已知: 微溶于水而生成亚砷酸 和 难溶于水。
(1)基态Zn原子核外价层电子轨道表达式为 ,(NF₄)₂S₂O 中S的化合价为 。
8
As₂O₃ H₃AsO₃ ,FeAsO₄ ZnCO₃
(2)“浸出”过程中 足量,则生成的主要配离子的化学式为 ;增大浸出率可采取的措
施是 (写出两条)。
H₃⋅H₂O
(3)“除砷”过程中, 作氧化剂(溶液呈酸性),发生反应的离子方程式为 。
(4)“除重金属”过程中加入Na S后 在溶液中的残留浓度为 此时 。
2
NH₄ ₂S₂O₈
[已知 。 2+
Cu²⁺ 10⁻¹⁰mol⋅L⁻¹, c(Pb )=
(5)“沉锌”前锌元素以 存在,写出“沉锌”的化学方程式 。
Kₛₚ CuS =6.4×10⁻³⁶,Kₛₚ PbS =8.0×10⁻²⁸]
(6)流程中可循环利用的物质有(NH₄)₂SO₄、 、 (填化学式)。
Zn NH₃ ₂SO₄
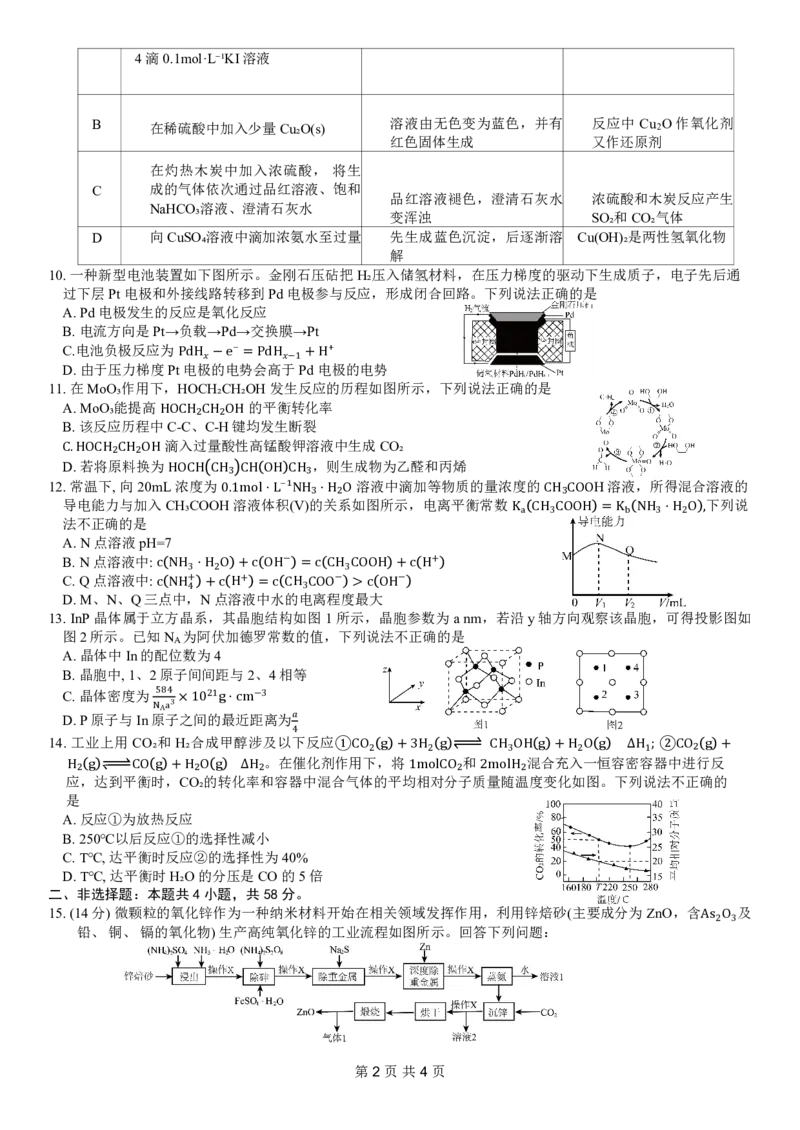
16.(15分)三氯化铬是有机金属化学中的重要原料,为紫色晶体,熔点为 ,易潮解,高温下易被氧气氧化。
实验室用Cr₂O₃和CCl₄加热到750℃时可制取 ,同时还生成 ,其装置图如下(加热及夹持装置略去)。
1152°C
请回答下列问题:
CrCl₃ COCl₂
已知:CC14沸点76.8℃;COCl₂有毒,沸点8 ,遇水剧烈水解生成刺激性气味的气体。
Ⅰ.制备CrCl₃:
8.2°C,
(1)仪器B的名称是 。
(2)装置D、E的作用分别是 、 。
(3)实验前先通入一段时间N₂的目的是 。
(4)制备CrCl₃的化学方程式为 。
(5)判断反应结束的依据是 。
Ⅱ.测定CrCl₃纯度:
称取5.0g CrCl₃产品,在强碱性条件下,加入过量 %H O 溶液,并小火加热,使 Cr元素完全转化为
2 2
;继续加热一段时间,冷却后配制成500mL溶液;取出20mL,滴加适量硫酸酸化后,用新配制的0.1
30
2mo2l−· 标准液滴定至终点,消耗标准液25mL(已知 被 还原为 。
CrO4
(6)CrC−l₃1被H₂O₂氧化成 的离子方程式为 2−。
L NH₄ ₂Fe SO₄ ₂ Cr2O7 Fe²⁺ Cr³⁺)
(7)产品中CrCl₃的纯度为 2− (杂质不参与反应)。
CrO4
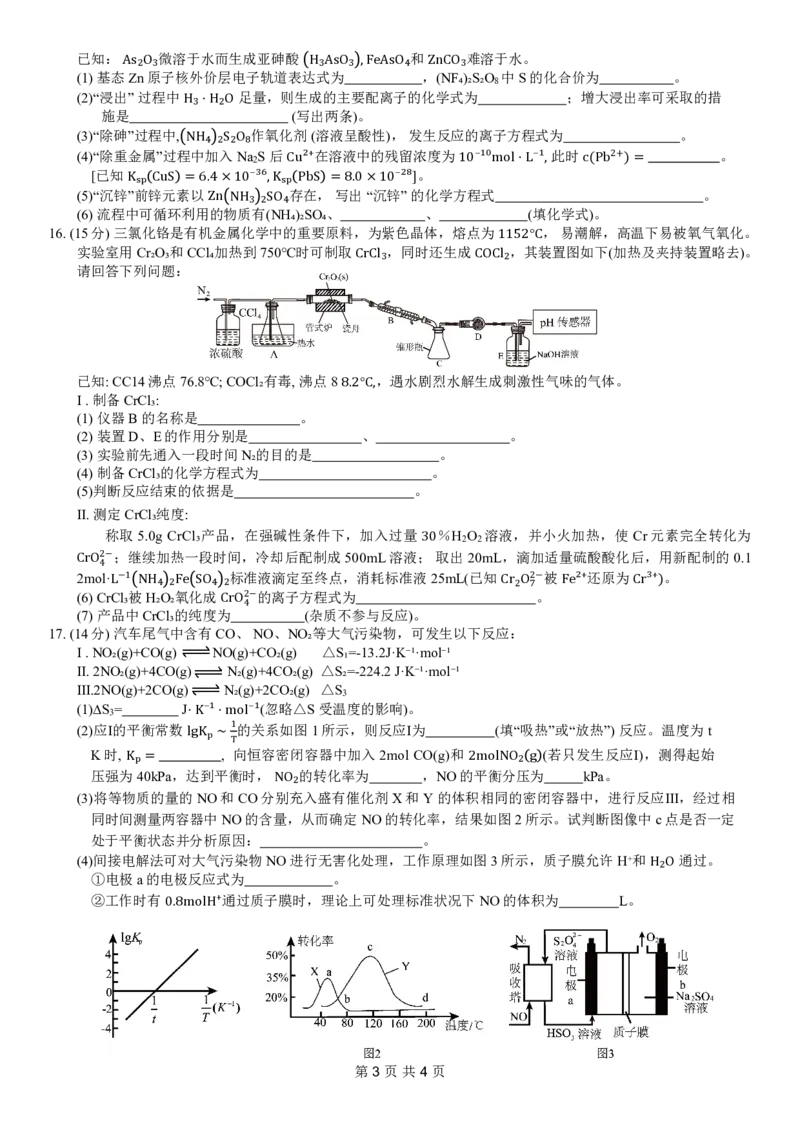
17.(14分)汽车尾气中含有CO、NO、NO₂等大气污染物,可发生以下反应:
Ⅰ.NO₂(g)+CO(g) NO(g)+CO₂(g) △S₁=-13.2J·K⁻¹·mol⁻¹
Ⅱ.2NO₂(g)+4CO(g) N₂(g)+4CO₂(g) △S₂=-224.2J·K⁻¹·mol⁻¹
Ⅲ.2NO(g)+2CO(g) N₂(g)+2CO₂(g) △S
3
(1)∆S = J (忽略△S受温度的影响)。
3
(2)应Ⅰ的平衡常数 的关系如图1所示,则反应Ⅰ为 (填“吸热”或“放热”)反应。温度为t
⋅K⁻¹⋅mol⁻¹
1
K时, lgKp ∼ , T 向恒容密闭容器中加入2mol CO(g)和 (若只发生反应Ⅰ),测得起始
压强为40kPa,达到平衡时, 的转化率为 ,NO的平衡分压为 kPa。
Kₚ= 2molNO₂ g
(3)将等物质的量的NO和CO分别充入盛有催化剂X和Y的体积相同的密闭容器中,进行反应Ⅲ,经过相
NO₂
同时间测量两容器中NO的含量,从而确定NO的转化率,结果如图2所示。试判断图像中c点是否一定
处于平衡状态并分析原因: 。
(4)间接电解法可对大气污染物NO进行无害化处理,工作原理如图3所示,质子膜允许H⁺和 通过。
①电极a的电极反应式为 。
H₂O
②工作时有 通过质子膜时,理论上可处理标准状况下NO的体积为 L。
0.8molH⁺
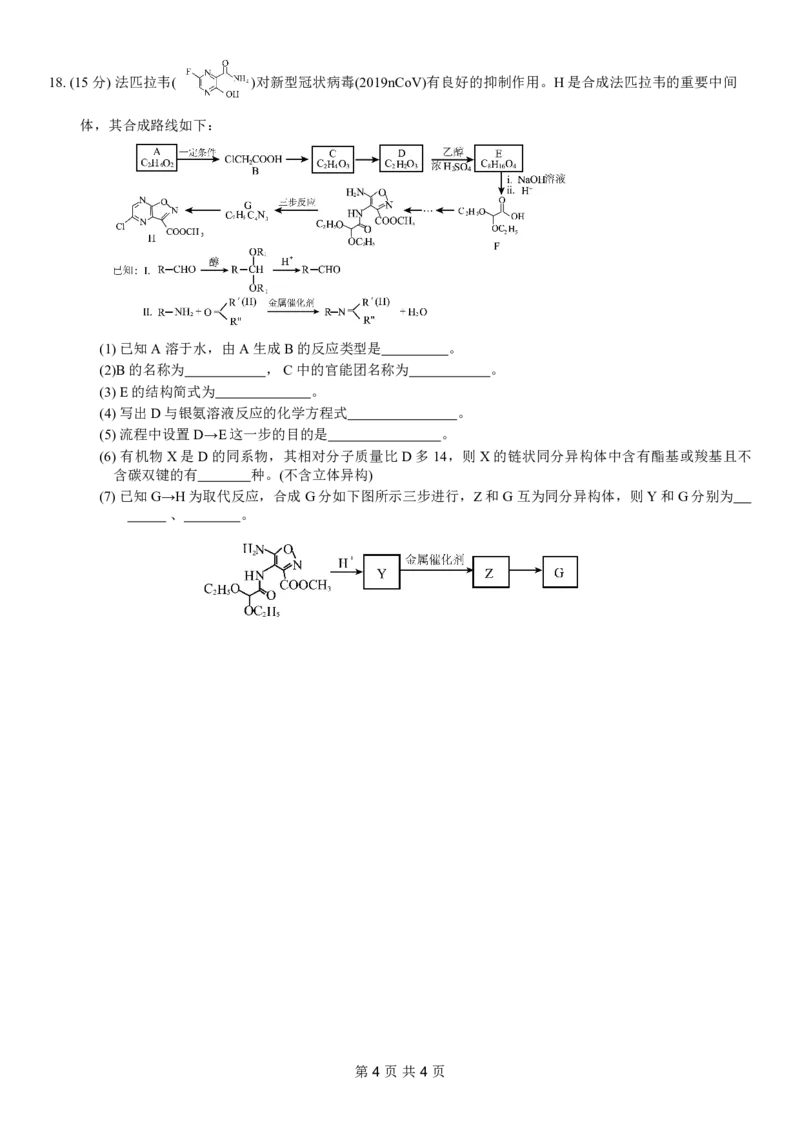
第3页共4页18.(15分)法匹拉韦( )对新型冠状病毒(2019nCoV)有良好的抑制作用。H是合成法匹拉韦的重要中间
体,其合成路线如下:
(1)已知A溶于水,由A生成B的反应类型是 。
(2)B的名称为 ,C中的官能团名称为 。
(3)E的结构简式为 。
(4)写出D与银氨溶液反应的化学方程式 。
(5)流程中设置D→E这一步的目的是 。
(6) 有机物X是D的同系物,其相对分子质量比D多14,则X的链状同分异构体中含有酯基或羧基且不
含碳双键的有 种。(不含立体异构)
(7)已知G→H为取代反应,合成G分如下图所示三步进行,Z和G互为同分异构体,则Y和G分别为
、 。
第4页共4页