文档内容
深圳市高级中学2025届高三第一次诊断测试
化学试题
考生注意:
1.满分100分,考试时间75分钟。
2.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用 2B铅笔把答题卡上对应题目的答案标号
涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无
效,在试题卷、草稿纸上作答无效。
可能用到的相对原子质量:H 1,C 12,N 14,O 16,Na 23,Al 27,S 32,Cl 35.5,K 39,Mn 55,Fe 56,Cu
64
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分,第11~16小题,每小题4分。在每小题给出
的四个选项中,只有一个选项是符合题目要求的。
1.书法是中华文化之瑰宝,“无色而具画图的灿烂,无声而有音乐的和谐”,书法之美尽在纸砚笔墨之间。下列
关于传统文房四宝的相关说法错误的是
A.宣纸的主要成分是合成高分子材料
B.澄泥砚属于陶制砚台,陶瓷的主要成分是硅酸盐
C.制作笔头的“狼毫”主要成分是蛋白质
D.墨汁的主要成分是碳,常温下性质稳定
2.2023年5月10日,最强太空“快递小哥”天舟六号货运飞船由长征七号运载火箭发射升空,体现了我国强大科
技力量。下列说法正确的是( )
A. “长征七号”使用碳纤维材料减轻火箭质量,碳纤维属于金属材料
B.“天舟六号”配有半刚性太阳电池阵“翅膀”,电池板主要成分是
C.“长征七号”采用液氧、煤油等作为推进剂,液氧、煤油是纯净物
D. “天舟六号”为空间站送去电推进氙气瓶, 与 互为同位素
3.化学与生产生活密切相关。下列过程中不涉及化学变化的是
A.用铝热反应焊接铁轨
B.在钢铁部件表面进行钝化处理
C.制作博古梁架时,在木材上雕刻花纹
D.《诗经·周颂·良耜》中描述农民生产的情形:“荼蓼(杂草)朽(腐烂)止,黍稷茂止”
4.下列化学用语或图示表达正确的是
A.碳的基态原子轨道表示式: B.S2−的结构示意图:
C.NaH的电子式: Na:H D.次氯酸的结构式:H-O-Cl
5.测定食物中铜含量前需对食物样品进行预处理:称取1.000g样品与浓硝酸充分反应后,小火蒸干炭化,再高温
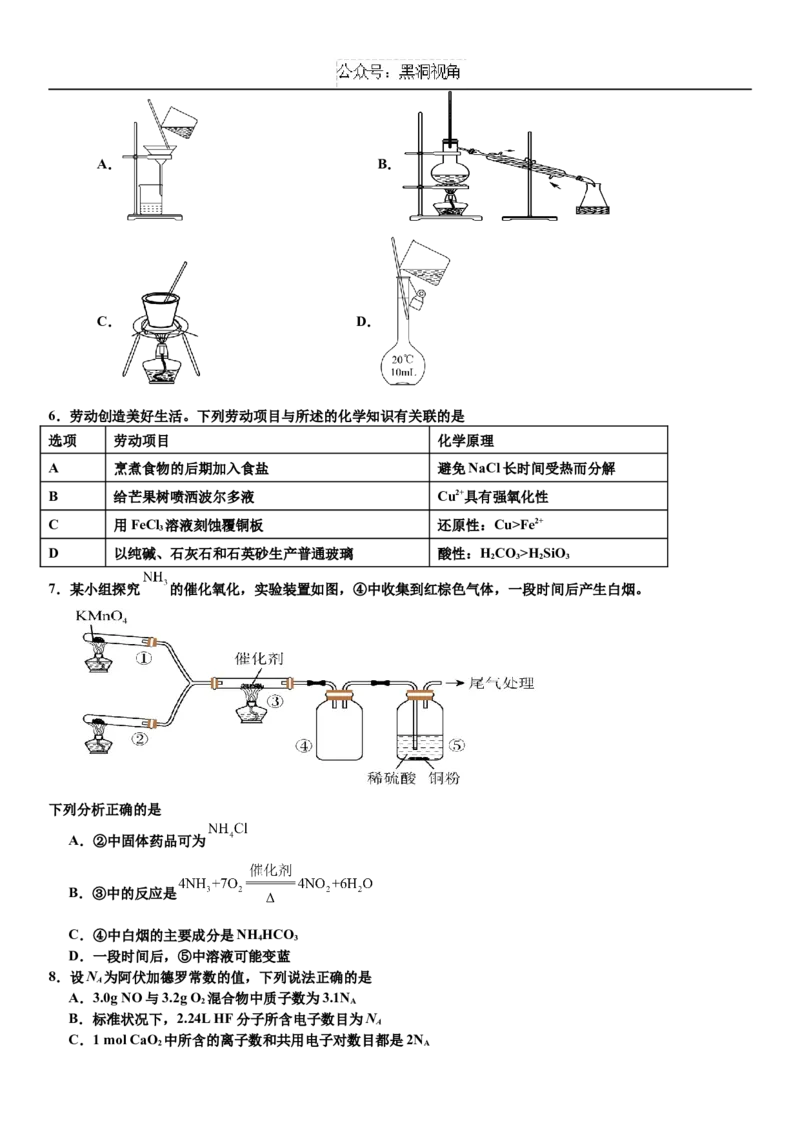
灰化,冷却后加入1mL稀硝酸,取滤液配制成10.00mL溶液。上述处理过程中不涉及的操作是A. B.
C. D.
6.劳动创造美好生活。下列劳动项目与所述的化学知识有关联的是
选项 劳动项目 化学原理
A 烹煮食物的后期加入食盐 避免NaCl长时间受热而分解
B 给芒果树喷洒波尔多液 Cu2+具有强氧化性
C 用FeCl 溶液刻蚀覆铜板 还原性:Cu>Fe2+
3
D 以纯碱、石灰石和石英砂生产普通玻璃 酸性:HCO >H SiO
2 3 2 3
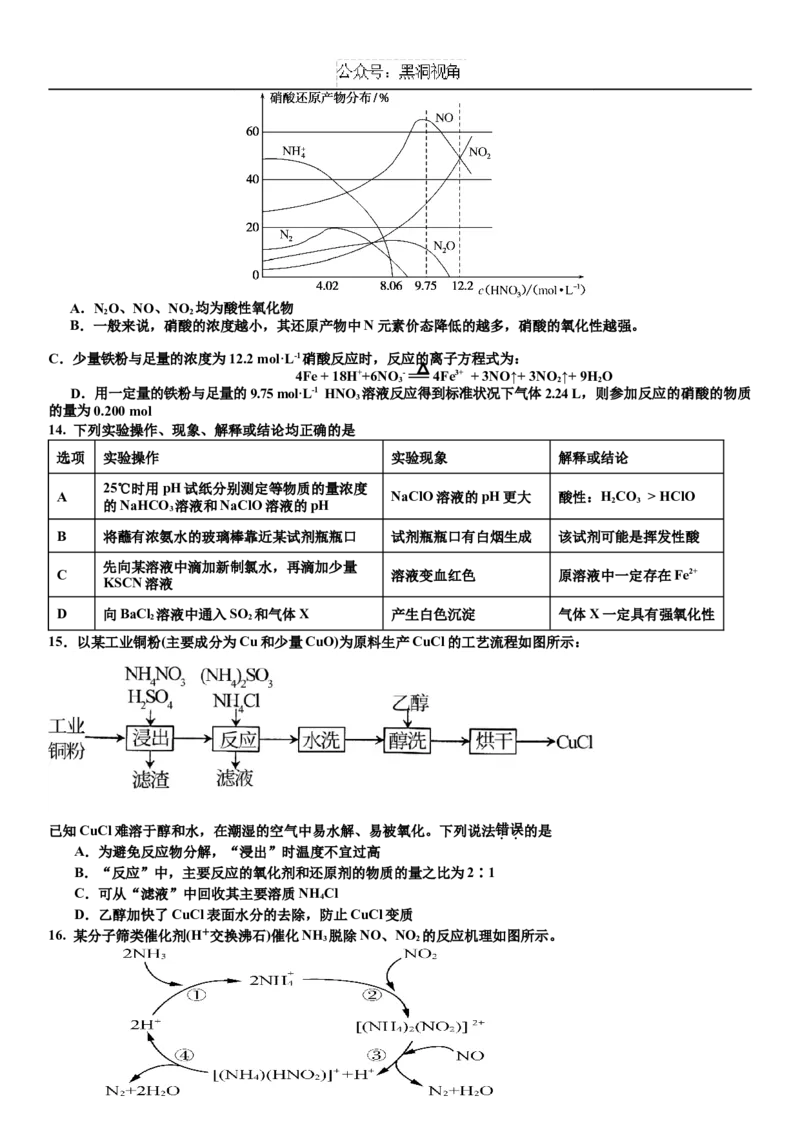
7.某小组探究 的催化氧化,实验装置如图,④中收集到红棕色气体,一段时间后产生白烟。
下列分析正确的是
A.②中固体药品可为
B.③中的反应是
C.④中白烟的主要成分是NH HCO
4 3
D.一段时间后,⑤中溶液可能变蓝
8.设N 为阿伏加德罗常数的值,下列说法正确的是
A
A.3.0g NO与3.2g O 混合物中质子数为3.1N
2 A
B.标准状况下,2.24L HF分子所含电子数目为N
A
C.1 mol CaO 中所含的离子数和共用电子对数目都是2N
2 AD.向 的 溶液中通入 至中性,溶液中 数目为
9.下列物质的制备与工业生产实际相符合的是( )
A. 制漂白粉:
B. 制高纯硅:
C. 海水提镁:
D. 制纯碱:
10.如图所示是某短周期元素的“价类二维图",该元素最高正价和最低负价之代数和为4,f、h均为正盐,且焰
色试验的火焰颜色都是黄色。下列说法正确的是
A.d能使 品红溶液褪色
B.a和c反应可以生成b
C.e的浓溶液与非金属单质碳反应,e显示了强氧化性和酸性
D.f、h的水溶液都呈碱性
11.下列过程涉及的离子方程式正确的是
A. NaHSO 溶液与 Ba(OH) 溶液反应至中性:2H++ SO 2-+Ba2++2OH-=BaSO ↓+2H O
4 2 4 4 2
B. 向Ca(ClO) 溶液中通入过量的 SO :ClO-+SO+H O=HClO+
2 2 2 2
C. 用稀硝酸鉴别铜合金制成的假金币:Cu+4H++NO =Cu2++NO↑+2H O
2 2
D. 向氢氧化铁中滴加氢碘酸溶液:3H++Fe(OH) =2Fe3++3H O
3 2
12.已知反应: ,下列关于该反应说法错误的是
A.产物 和 都可以用于自来水消毒杀菌
B.氧化性:
C.氧化产物和还原产物的物质的量之比为1∶2
D.当反应中有 转移时,被氧化的 为
13.下图表示铁与不同浓度硝酸反应时(可加热),硝酸还原产物分布与硝酸浓度的关系,下列说法正确的是( )A.NO、NO、NO 均为酸性氧化物
2 2
B.一般来说,硝酸的浓度越小,其还原产物中N元素价态降低的越多,硝酸的氧化性越强。
C.少量铁粉与足量的浓度为12.2 mol·L-1硝酸反应时,反应的离子方程式为:
4Fe + 18H++6NO-=4Fe3+ + 3NO↑+ 3NO ↑+ 9H O
3 2 2
D.用一定量的铁粉与足量的9.75 mol·L-1 HNO 溶液反应得到标准状况下气体2.24 L,则参加反应的硝酸的物质
3
的量为0.200 mol
14. 下列实验操作、现象、解释或结论均正确的是
选项 实验操作 实验现象 解释或结论
25℃时用pH试纸分别测定等物质的量浓度
A NaClO溶液的pH更大 酸性:HCO > HClO
的NaHCO 溶液和NaClO溶液的pH 2 3
3
B 将蘸有浓氨水的玻璃棒靠近某试剂瓶瓶口 试剂瓶瓶口有白烟生成 该试剂可能是挥发性酸
先向某溶液中滴加新制氯水,再滴加少量
C 溶液变血红色 原溶液中一定存在Fe2+
KSCN溶液
D 向BaCl 溶液中通入SO 和气体X 产生白色沉淀 气体X一定具有强氧化性
2 2
15.以某工业铜粉(主要成分为Cu和少量CuO)为原料生产CuCl的工艺流程如图所示:
已知CuCl难溶于醇和水,在潮湿的空气中易水解、易被氧化。下列说法错误的是
A.为避免反应物分解,“浸出”时温度不宜过高
B.“反应”中,主要反应的氧化剂和还原剂的物质的量之比为2∶1
C.可从“滤液”中回收其主要溶质NH Cl
4
D.乙醇加快了CuCl表面水分的去除,防止CuCl变质
16. 某分子筛类催化剂(H+交换沸石)催化NH 脱除NO、NO 的反应机理如图所示。
3 2下列有关该历程的说法错误的是:
A.NH +是中间产物
4
B.若1mol NO参与反应,则反应③转移电子数为2N
A
C.反应④属于分解反应
D.总反应化学方程式为2NH +NO+NO 2N+3H O
3 2 2 2
二、非选择题(本大题共4题,共56分)
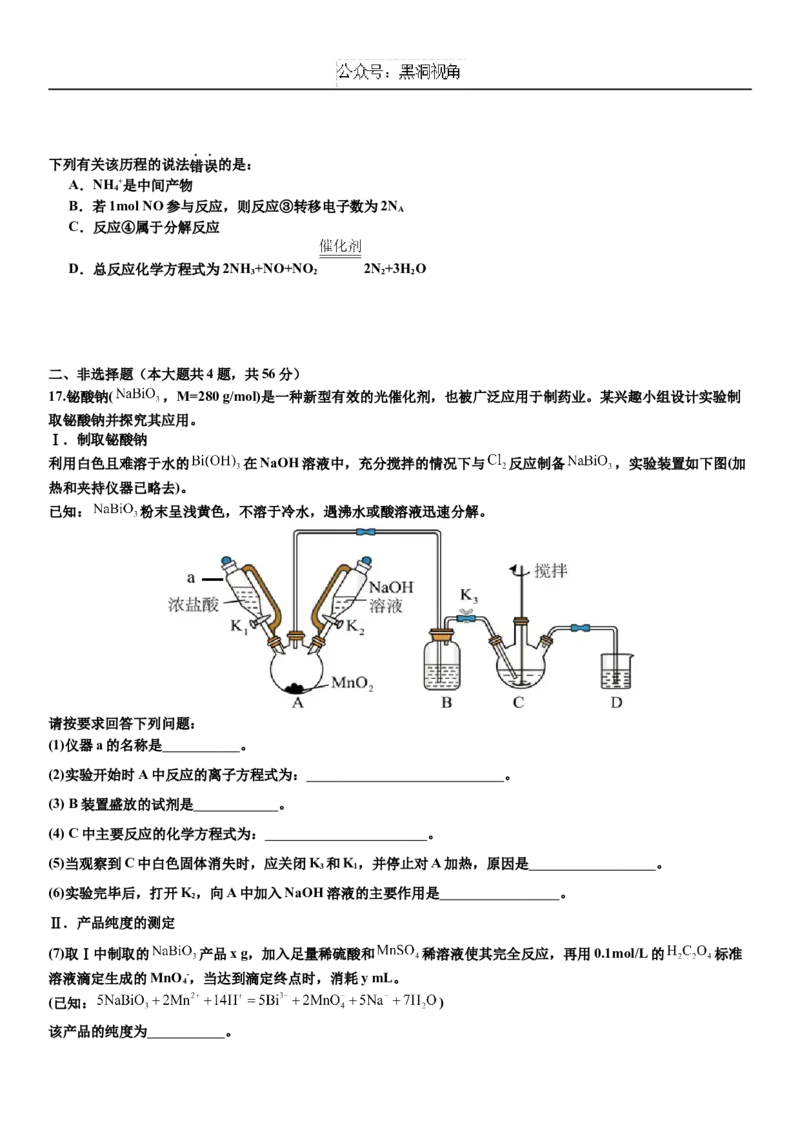
17.铋酸钠( ,M=280 g/mol)是一种新型有效的光催化剂,也被广泛应用于制药业。某兴趣小组设计实验制
取铋酸钠并探究其应用。
Ⅰ.制取铋酸钠
利用白色且难溶于水的 在NaOH溶液中,充分搅拌的情况下与 反应制备 ,实验装置如下图(加
热和夹持仪器已略去)。
已知: 粉末呈浅黄色,不溶于冷水,遇沸水或酸溶液迅速分解。
请按要求回答下列问题:
(1)仪器a的名称是 。
(2)实验开始时A中反应的离子方程式为: 。
(3) B装置盛放的试剂是 。
(4) C中主要反应的化学方程式为: 。
(5)当观察到C中白色固体消失时,应关闭K 和K,并停止对A加热,原因是 。
3 1
(6)实验完毕后,打开K,向A中加入NaOH溶液的主要作用是 。
2
Ⅱ.产品纯度的测定
(7)取Ⅰ中制取的 产品x g,加入足量稀硫酸和 稀溶液使其完全反应,再用0.1mol/L的 标准
溶液滴定生成的MnO -,当达到滴定终点时,消耗y mL。
4
(已知: )
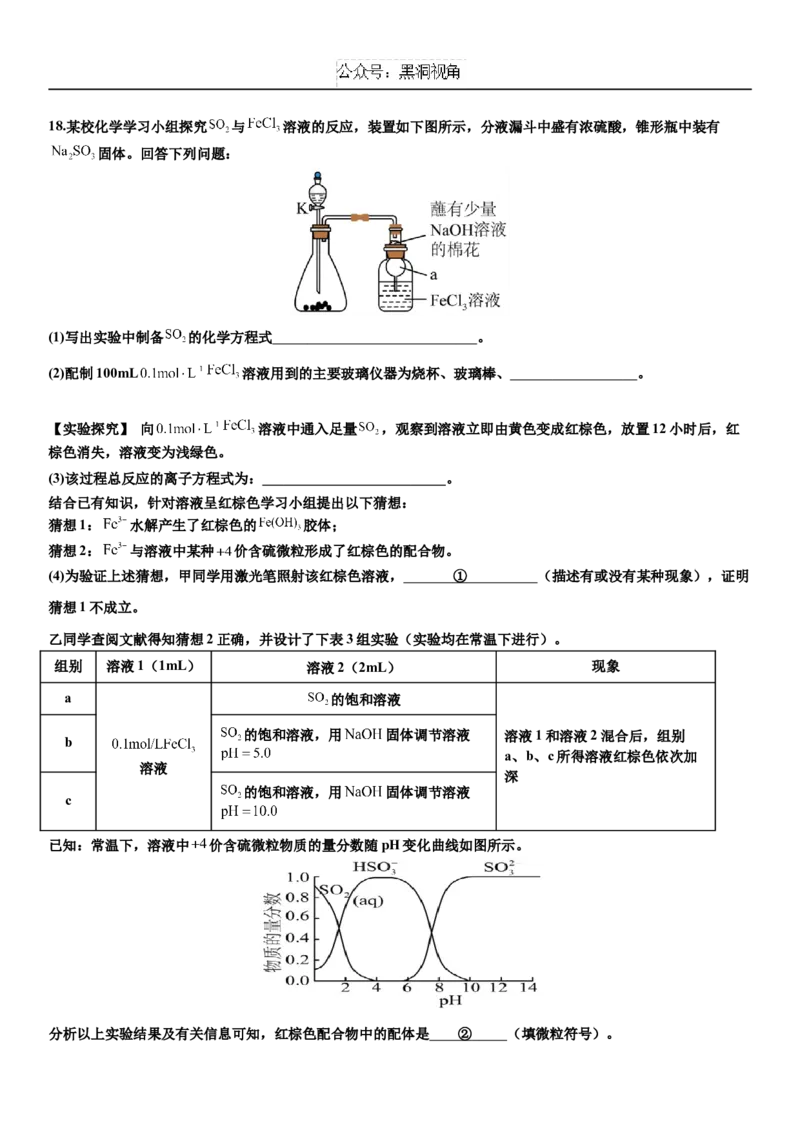
该产品的纯度为 。18.某校化学学习小组探究 与 溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有
固体。回答下列问题:
(1)写出实验中制备 的化学方程式 。
(2)配制100mL 溶液用到的主要玻璃仪器为烧杯、玻璃棒、 。
【实验探究】 向 溶液中通入足量 ,观察到溶液立即由黄色变成红棕色,放置12小时后,红
棕色消失,溶液变为浅绿色。
(3)该过程总反应的离子方程式为: 。
结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:
猜想1: 水解产生了红棕色的 胶体;
猜想2: 与溶液中某种 价含硫微粒形成了红棕色的配合物。
(4)为验证上述猜想,甲同学用激光笔照射该红棕色溶液, ① (描述有或没有某种现象),证明
猜想1不成立。
乙同学查阅文献得知猜想2正确,并设计了下表3组实验(实验均在常温下进行)。
组别 溶液1(1mL) 溶液2(2mL) 现象
a 的饱和溶液
的饱和溶液,用 固体调节溶液 溶液1和溶液2混合后,组别
b
a、b、c所得溶液红棕色依次加
溶液
深
的饱和溶液,用 固体调节溶液
c
已知:常温下,溶液中 价含硫微粒物质的量分数随pH变化曲线如图所示。
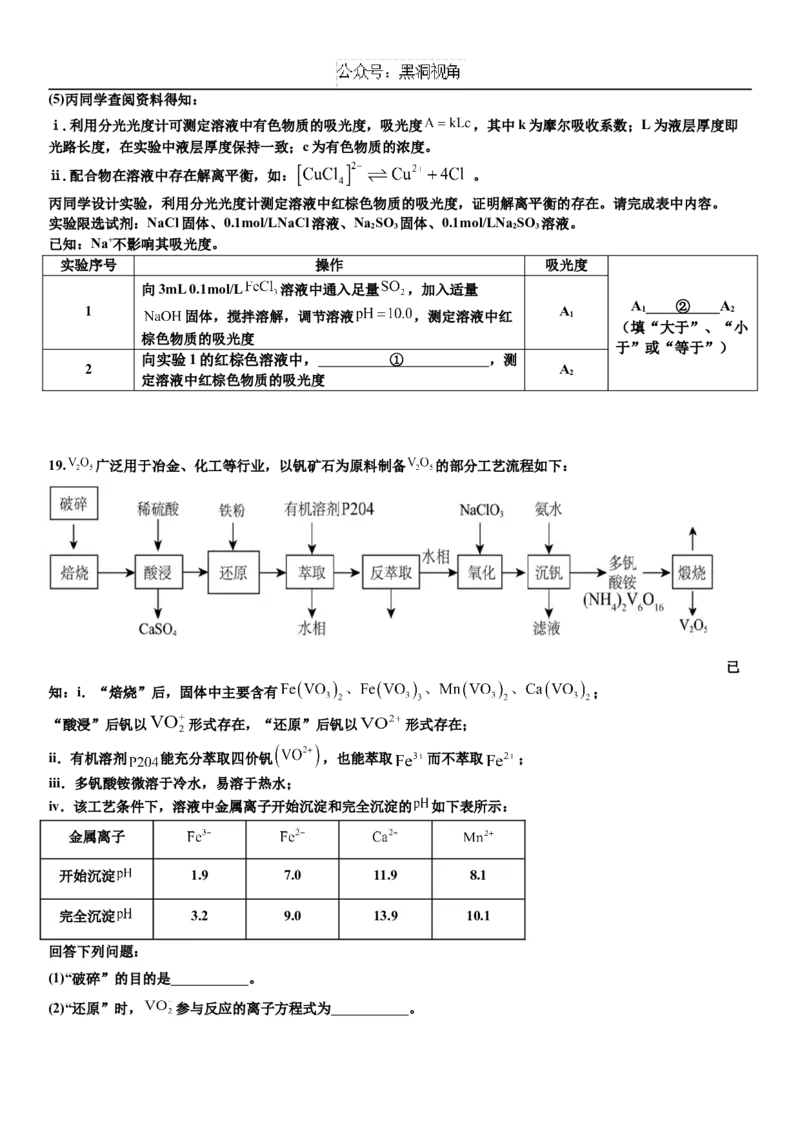
分析以上实验结果及有关信息可知,红棕色配合物中的配体是 ② (填微粒符号)。(5)丙同学查阅资料得知:
ⅰ.利用分光光度计可测定溶液中有色物质的吸光度,吸光度 ,其中k为摩尔吸收系数;L为液层厚度即
光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。
ⅱ.配合物在溶液中存在解离平衡,如: 。
丙同学设计实验,利用分光光度计测定溶液中红棕色物质的吸光度,证明解离平衡的存在。请完成表中内容。
实验限选试剂:NaCl固体、0.1mol/LNaCl溶液、Na SO 固体、0.1mol/LNa SO 溶液。
2 3 2 3
已知:Na+不影响其吸光度。
实验序号 操作 吸光度
向3mL 0.1mol/L 溶液中通入足量 ,加入适量
A ② A
1 A 1 2
固体,搅拌溶解,调节溶液 ,测定溶液中红 1
(填“大于”、“小
棕色物质的吸光度
于”或“等于”)
向实验1的红棕色溶液中, ① ,测
2 A
2
定溶液中红棕色物质的吸光度
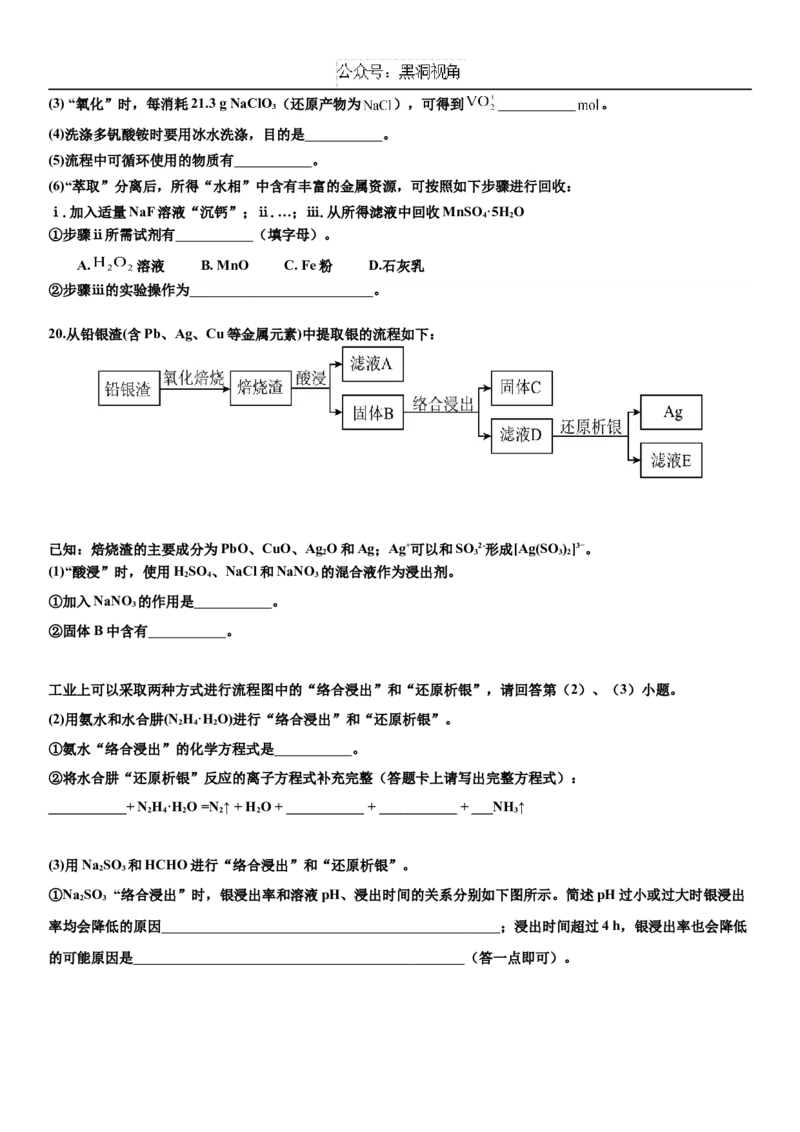
19. 广泛用于冶金、化工等行业,以钒矿石为原料制备 的部分工艺流程如下:
已
知:i.“焙烧”后,固体中主要含有 ;
“酸浸”后钒以 形式存在,“还原”后钒以 形式存在;
ii.有机溶剂 能充分萃取四价钒 ,也能萃取 而不萃取 ;
iii.多钒酸铵微溶于冷水,易溶于热水;
iv.该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的 如下表所示:
金属离子
开始沉淀 1.9 7.0 11.9 8.1
完全沉淀 3.2 9.0 13.9 10.1
回答下列问题:
(1)“破碎”的目的是 。
(2)“还原”时, 参与反应的离子方程式为 。(3) “氧化”时,每消耗21.3 g NaClO (还原产物为 ),可得到 。
3
(4)洗涤多钒酸铵时要用冰水洗涤,目的是 。
(5)流程中可循环使用的物质有 。
(6)“萃取”分离后,所得“水相”中含有丰富的金属资源,可按照如下步骤进行回收:
ⅰ.加入适量NaF溶液“沉钙”;ⅱ.…;ⅲ.从所得滤液中回收MnSO ·5HO
4 2
①步骤ⅱ所需试剂有 (填字母)。
A. 溶液 B. MnO C. Fe粉 D.石灰乳
②步骤ⅲ的实验操作为 。
20.从铅银渣(含Pb、Ag、Cu等金属元素)中提取银的流程如下:
已知:焙烧渣的主要成分为PbO、CuO、Ag O和Ag;Ag+可以和SO 2-形成[Ag(SO )]3−。
2 3 3 2
(1)“酸浸”时,使用HSO 、NaCl和NaNO 的混合液作为浸出剂。
2 4 3
①加入NaNO 的作用是 。
3
②固体B中含有 。
工业上可以采取两种方式进行流程图中的“络合浸出”和“还原析银”,请回答第(2)、(3)小题。
(2)用氨水和水合肼(N H·HO)进行“络合浸出”和“还原析银”。
2 4 2
①氨水“络合浸出”的化学方程式是 。
②将水合肼“还原析银”反应的离子方程式补充完整(答题卡上请写出完整方程式):
___________+ NH·HO =N ↑ + H O + ___________ + ___________ + ___NH ↑
2 4 2 2 2 3
(3)用Na SO 和HCHO进行“络合浸出”和“还原析银”。
2 3
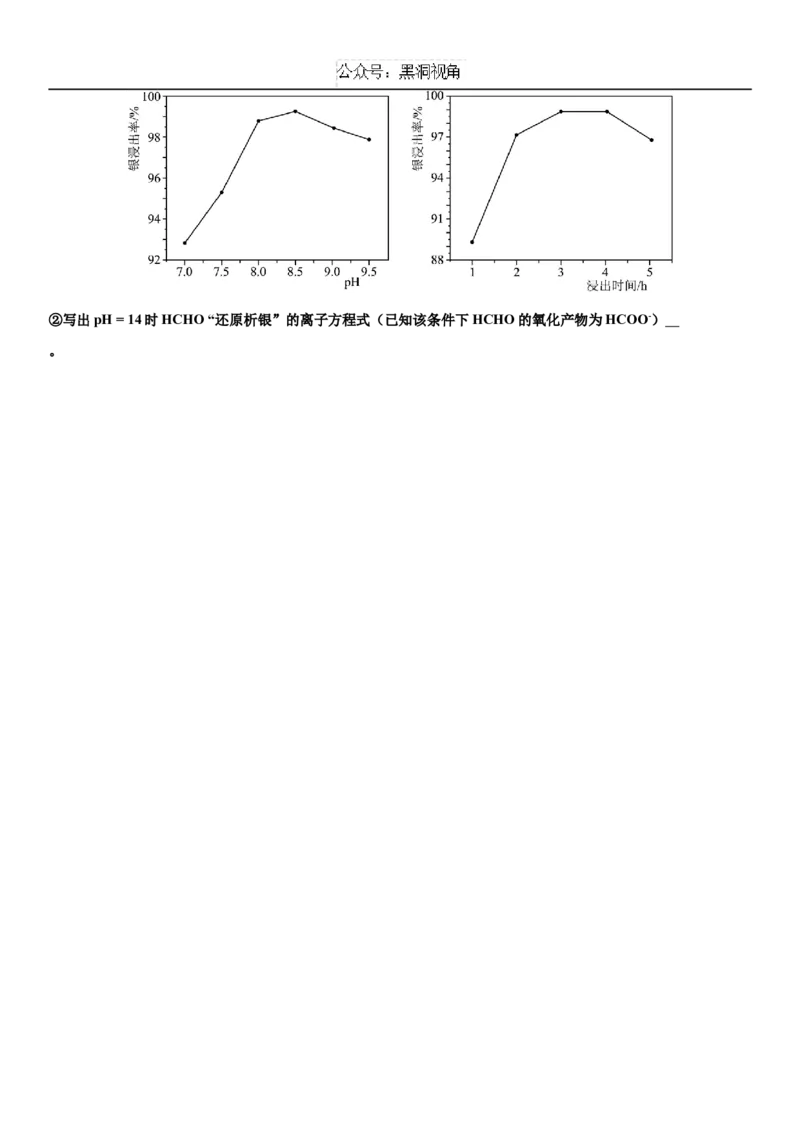
①Na SO “络合浸出”时,银浸出率和溶液pH、浸出时间的关系分别如下图所示。简述pH过小或过大时银浸出
2 3
率均会降低的原因 ;浸出时间超过4 h,银浸出率也会降低
的可能原因是 (答一点即可)。②写出pH = 14时HCHO “还原析银”的离子方程式(已知该条件下HCHO的氧化产物为HCOO-)
。深圳市高级中学2025届高三第一次诊断测试
化学试题 参考答案
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分,第11~16小题,每小题4分。在每小题给出
的四个选项中,只有一个选项是符合题目要求的。
题号 1 2 3 4 5 6 7 8 9 10
答案 A D C D B C D A D B
题号 11 12 13 14 15 16
答案 A D C B C B
二、非选择题(共56分)
17.(每空2分,共14分)
(1) 恒压滴液漏斗(或恒压分液漏斗)
(2) MnO+4H++2Cl- Mn2++Cl↑+2HO
2 2 2
(3) 饱和食盐水
(4)
(5) 防止 过量使溶液呈酸性,导致 分解
(6) 除去A中残留
(7)
18.(每空2分,共14分)
(1)
(2) 胶头滴管、100mL容量瓶
(3) 2Fe3++SO+2HO = 2Fe2++SO2-+4H+
2 2 4
(4) ① 溶液中无明显光路(或溶液中无丁达尔效应) ② SO2-
3
(5) ① 加入少量 固体,搅拌溶解 ② 小于
19.(每空2分,共14分)
(1) 增大固体接触面积,提高焙烧速率
(2)
(3) 1.2
(4) 降低多钒酸铵的溶解度,减少损失
(5) (或氨水)、有机溶剂
(6) ①AB ②蒸发浓缩、冷却结晶、过滤(洗涤、干燥)
20.(每空2分,共14分)
(1) ① 利用硝酸根在酸性条件下的氧化性,将Ag单质氧化 ② AgCl和PbSO
4
(2) ① AgCl + 2NH·HO = [Ag(NH)]Cl + 2HO(或AgCl + 2NH = [Ag(NH)]Cl)
3 2 3 2 2 3 3 2
② 4[Ag(NH)]+ + NH·HO = N↑ + HO + 4Ag↓+ 4NH + 4NH↑
3 2 2 4 2 2 2 3
(3) ① pH过小,配体SO2-转化为HSO-(或HSO);pH过大,Ag+转化为AgOH(或AgO)沉淀。
3 3 2 3 2
配体SO2-被空气中O 氧化而消耗(或SO2-将Ag+还原为Ag)
3 2 3
② 2[Ag(SO)]3− + HCHO + 3OH- = 2Ag↓+ 4SO2- + HCOO− + 2HO
3 2 3 2