文档内容
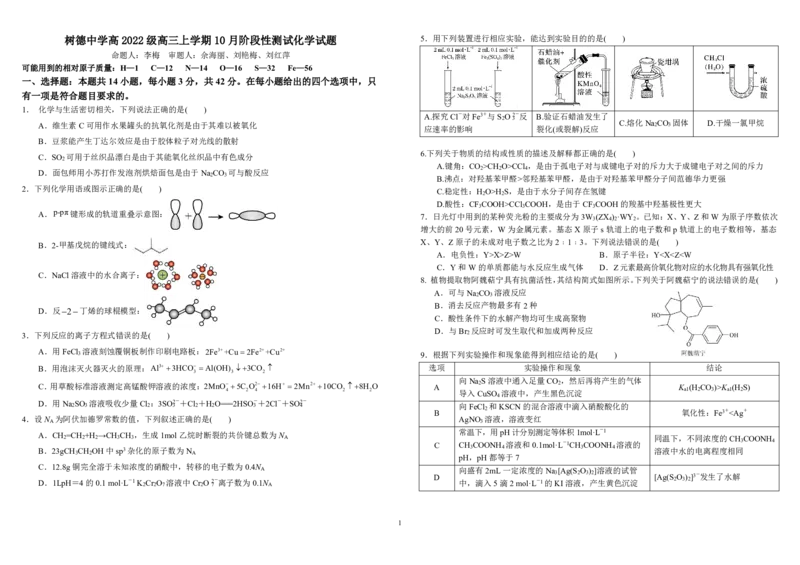
树德中学高 2022 级高三上学期 10 月阶段性测试化学试题 5.用下列装置进行相应实验,能达到实验目的的是( )
命题人:李梅 审题人:佘海丽、刘艳梅、刘红萍
可能用到的相对原子质量:H—1 C—12 N—14 O—16 S—32 Fe—56
一、选择题:本题共 14小题,每小题 3分,共42分。在每小题给出的四个选项中,只
有一项是符合题目要求的。
1. 化学与生活密切相关,下列说法正确的是( )
A.探究Cl-对Fe3+与S O2-反 B.验证石蜡油发生了
2 3
A.维生素C可用作水果罐头的抗氧化剂是由于其难以被氧化 C.熔化Na 2 CO 3 固体 D.干燥一氯甲烷
应速率的影响 裂化(或裂解)反应
B.豆浆能产生丁达尔效应是由于胶体粒子对光线的散射
C.SO 可用于丝织品漂白是由于其能氧化丝织品中有色成分 6.下列关于物质的结构或性质的描述及解释都正确的是( )
2
A.键角:CO >CH O>CCl ,是由于孤电子对与成键电子对的斥力大于成键电子对之间的斥力
2 2 4
D.面包师用小苏打作发泡剂烘焙面包是由于Na CO 可与酸反应
2 3 B.沸点:对羟基苯甲醛>邻羟基苯甲醛,是由于对羟基苯甲醛分子间范德华力更强
2.下列化学用语或图示正确的是( ) C.稳定性:H O>H S,是由于水分子间存在氢键
2 2
D.酸性:CF COOH>CCl COOH,是由于CF COOH的羧基中羟基极性更大
3 3 3
A.p-pπ键形成的轨道重叠示意图:
7.日光灯中用到的某种荧光粉的主要成分为3W (ZX ) ·WY 。已知:X、Y、Z和W为原子序数依次
3 4 2 2
增大的前20号元素,W为金属元素。基态X原子s轨道上的电子数和p轨道上的电子数相等,基态
B.2-甲基戊烷的键线式: X、Y、Z原子的未成对电子数之比为2﹕1﹕3。下列说法错误的是( )
A.电负性:Y>X>Z>W B.原子半径:YK (H S)
4 2 4 2 2 导入CuSO 溶液中,产生黑色沉淀 a1 2 3 a1 2
4
D.用Na 2 SO 3 溶液吸收少量Cl 2 :3SO2 3 -+Cl 2 +H 2 O===2HSO- 3 +2Cl-+SO2 4 - 向FeCl 和KSCN的混合溶液中滴入硝酸酸化的
B 2 氧化性:Fe3+0
II.C H (g)+2CO (g)4CO(g)+3H (g) ΔH >0
11 2 6 2 2 2
D.若Li
2
S的晶胞参数为anm,则E、F间的距离为 anm
向容积为10L的密闭容器中投入2molC H 和3molCO ,不同温度下,测得5min时(反应均未平衡)的相
4 2 6 2
关数据见下表,下列说法错误的是( )
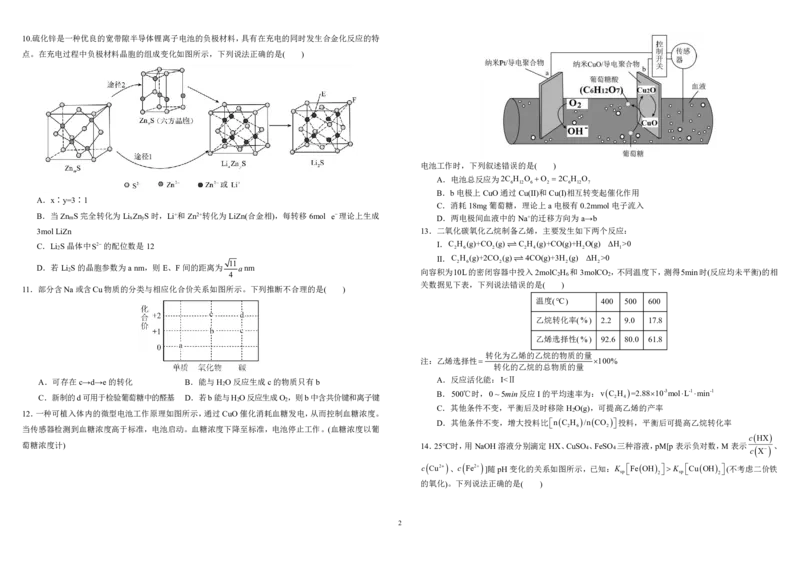
11.部分含Na或含Cu物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
温度(C) 400 500 600
乙烷转化率(%) 2.2 9.0 17.8
乙烯选择性(%) 92.6 80.0 61.8
转化为乙烯的乙烷的物质的量
注:乙烯选择性 100%
转化的乙烷的总物质的量
A.可存在c→d→e的转化 B.能与H O反应生成c的物质只有b A.反应活化能:I<Ⅱ
2
B.500℃时,0~5min反应I的平均速率为:vC H =2.8810-3molL-1min-1
C.新制的d可用于检验葡萄糖中的醛基 D.若b能与HO反应生成O,则b中含共价键和离子键 2 4
2 2
C.其他条件不变,平衡后及时移除H O(g),可提高乙烯的产率
12.一种可植入体内的微型电池工作原理如图所示,通过CuO催化消耗血糖发电,从而控制血糖浓度。 2
D.其他条件不变,增大投料比 nC H /nCO 投料,平衡后可提高乙烷转化率
当传感器检测到血糖浓度高于标准,电池启动。血糖浓度下降至标准,电池停止工作。(血糖浓度以葡 2 6 2
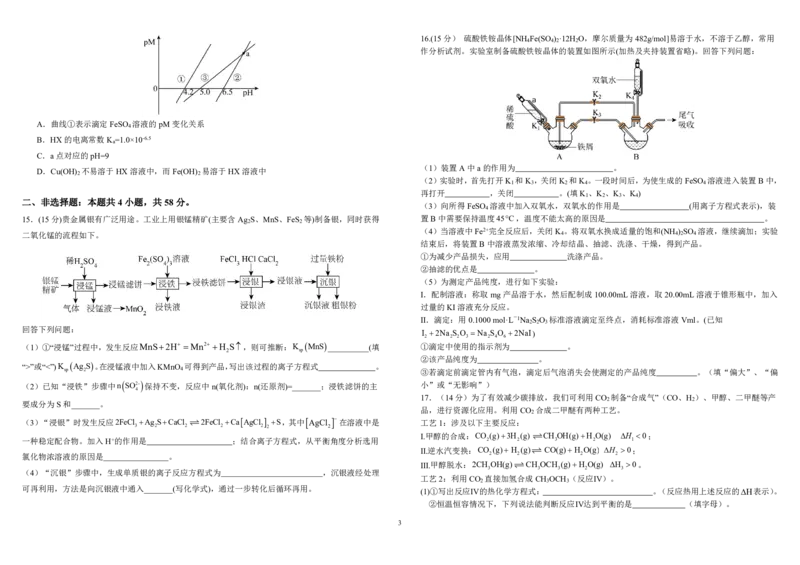
cHX
萄糖浓度计) 14.25℃时,用NaOH溶液分别滴定HX、CuSO
4
、FeSO
4
三种溶液,pM[p表示负对数,M表示
c X
、
c Cu2 、c Fe2 ]随pH变化的关系如图所示,已知:K
sp
FeOH
2
K
sp
CuOH
2
(不考虑二价铁
的氧化)。下列说法正确的是( )
216.(15分) 硫酸铁铵晶体[NH Fe(SO ) ·12H O,摩尔质量为482g/mol]易溶于水,不溶于乙醇,常用
4 4 2 2
作分析试剂。实验室制备硫酸铁铵晶体的装置如图所示(加热及夹持装置省略)。回答下列问题:
A.曲线①表示滴定FeSO 溶液的pM变化关系
4
B.HX的电离常数K =1.0×10-6.5
a
C.a点对应的pH=9
D.Cu(OH) 不易溶于HX溶液中,而Fe(OH) 易溶于HX溶液中
(1)装置A中a的作用为 。
2 2
(2)实验时,首先打开K 和K ,关闭K 和K 。一段时间后,为使生成的FeSO 溶液进入装置B中,
1 3 2 4 4
再打开 ,关闭 。(填K 、K 、K 、K )
1 2 3 4
二、非选择题:本题共 4小题,共 58分。
(3)向所得FeSO 溶液中加入双氧水,双氧水的作用是 (用离子方程式表示),装
4
15.(15分)贵金属银有广泛用途。工业上用银锰精矿(主要含Ag S、MnS、FeS 等)制备银,同时获得 置B中需要保持温度45°C,温度不能太高的原因是 。
2 2
(4)当溶液中Fe2+完全反应后,关闭K 。将双氧水换成适量的饱和(NH ) SO 溶液,继续滴加;实验
二氧化锰的流程如下。 4 4 2 4
结束后,将装置B中溶液蒸发浓缩、冷却结晶、抽滤、洗涤、干燥,得到产品。
①为减少产品损失,应用 洗涤产品。
②抽滤的优点是 。
(5)为测定产品纯度,进行如下实验:
Ⅰ.配制溶液:称取mg产品溶于水,然后配制成100.00mL溶液,取20.00mL溶液于锥形瓶中,加入
过量的KI溶液充分反应。
Ⅱ.滴定:用0.1000mol·L-1Na S O 标准溶液滴定至终点,消耗标准溶液Vml。(已知
2 2 3
回答下列问题:
I 2Na S O Na S O 2NaI)
2 2 2 3 2 4 6
(1)①“浸锰”过程中,发生反应MnS2H Mn2 H S,则可推断:K MnS __________(填 ①滴定中使用的指示剂为 。
2 sp
②该产品纯度为 。
“>”或“<”)K Ag S。在浸锰液中加入KMnO 可得到产品,写出该过程的离子方程式 。
sp 2 4 ③若滴定前滴定管内有气泡,滴定后气泡消失会使测定的产品纯度 。(填“偏大”、“偏
(2)已知“浸铁”步骤中n SO2- 保持不变,反应中n(氧化剂):n(还原剂)=_______;浸铁滤饼的主 小”或“无影响”)
4
17.(14分)为了有效减少碳排放,我们可利用CO 制备“合成气”(CO、H )、甲醇、二甲醚等产
2 2
要成分为S和_______。
品,进行资源化应用。利用CO 合成二甲醚有两种工艺。
2
(3)“浸银”时发生反应2FeCl Ag SCaCl 2FeCl CaAgCl S,其中 AgCl 在溶液中是 工艺1:涉及以下主要反应:
3 2 2 2 2 2 2
Ⅰ.甲醇的合成:CO (g)3H (g) CH OH(g)H O(g) H 0;
一种稳定配合物。加入H+的作用是 ;结合离子方程式,从平衡角度分析选用 2 2 3 2 1
Ⅱ.逆水汽变换:CO (g) H (g) CO(g) H O(g) H 0;
氯化物浓溶液的原因是 。 2 2 2 2
Ⅲ.甲醇脱水:2CH OH(g)CH OCH (g)H O(g) H 0。
3 3 3 2 3
(4)“沉银”步骤中,生成单质银的离子反应方程式为 ,沉银液经处理
工艺2:利用CO 直接加氢合成CH OCH (反应Ⅳ)。
2 3 3
可再利用,方法是向沉银液中通入_______(写化学式),通过一步转化后循环再用。
(1)①写出反应Ⅳ的热化学方程式: 。(反应热用上述反应的H表示)。
②恒温恒容情况下,下列说法能判断反应Ⅳ达到平衡的是 (填字母)。
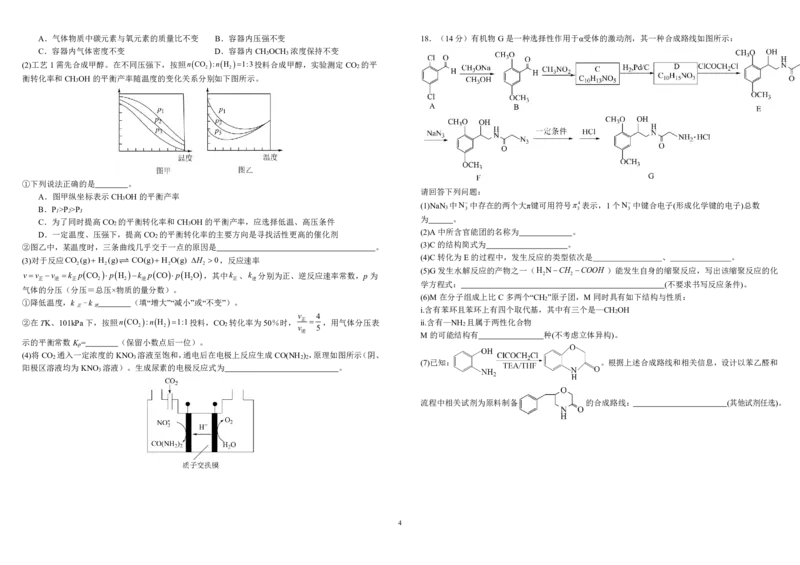
3A.气体物质中碳元素与氧元素的质量比不变 B.容器内压强不变 18.(14分)有机物G是一种选择性作用于α受体的激动剂,其一种合成路线如图所示:
C.容器内气体密度不变 D.容器内CH OCH 浓度保持不变
3 3
(2)工艺1需先合成甲醇。在不同压强下,按照nCO :nH 1:3投料合成甲醇,实验测定CO 的平
2 2 2
衡转化率和CH OH的平衡产率随温度的变化关系分别如下图所示。
3
①下列说法正确的是 。
请回答下列问题:
A.图甲纵坐标表示CH OH的平衡产率
3
B.P 1 >P 2 >P 3 (1)NaN 3 中N 3 中存在的两个大π键可用符号 3 4表示,1个N 3 中键合电子(形成化学键的电子)总数
为 。
C.为了同时提高CO 的平衡转化率和CH OH的平衡产率,应选择低温、高压条件
2 3
D.一定温度、压强下,提高CO 的平衡转化率的主要方向是寻找活性更高的催化剂
(2)A中所含官能团的名称为 。
2
②图乙中,某温度时,三条曲线几乎交于一点的原因是 。
(3)C的结构简式为 。
(3)对于反应CO (g) H (g) CO(g) H O(g) H 0,反应速率
(4)C转化为E的过程中,发生反应的类型依次是 、 。
2 2 2 2
vv v k pCO pH k pCOpH O,其中k 、k 分别为正、逆反应速率常数,p为
(5)G发生水解反应的产物之一(H
2
NCH
2
COOH )能发生自身的缩聚反应,写出该缩聚反应的化
正 逆 正 2 2 逆 2 正 逆
学方程式: (不要求书写反应条件)。
气体的分压(分压=总压×物质的量分数)。
(6)M在分子组成上比C多两个“CH ”原子团,M同时具有如下结构与性质:
①降低温度,k -k (填“增大”“减小”或“不变”)。 2
正 逆 ⅰ.含有苯环且苯环上有四个取代基,其中有三个是—CH OH
2
v 4
②在TK、101kPa下,按照nCO
2
:nH
2
1:1投料,CO
2
转化率为50%时,
v
正
5
,用气体分压表 ⅱ.含有—NH
2
且属于两性化合物
逆 M的可能结构有 种(不考虑立体异构)。
示的平衡常数K = (保留小数点后一位)。
p
(4)将CO 通入一定浓度的KNO 溶液至饱和,通电后在电极上反应生成CO(NH ) ,原理如图所示(阴、
2 3 2 2
(7)已知: 。根据上述合成路线和相关信息,设计以苯乙醛和
阳极区溶液均为KNO 溶液)。生成尿素的电极反应式为 。
3
流程中相关试剂为原料制备 的合成路线: (其他试剂任选)。
4