文档内容
大连金州高中期中考试试卷
高三化学
(考试时间:75分钟 满分100分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Cl-35.5 Ti-48 Fe-56 Br-80 I-127
第Ⅰ卷 (45分)
一、选择题部分(本部分包括15小题,每小题3分,总共45分)
1.碳量子点(CDs)是一种尺寸小于10纳米,含有N、O等杂原子的新型碳基纳米材
料,在紫外光照射下,产生荧光。居家利用香蕉皮等果蔬厨余物制备碳量子点的流程如
下:
下列叙述不正确的是( )
A.碳量子点是碳的一种新型单质
B.产生荧光与电子跃迁有关
C.果蔬厨余物含C、H、O等元素
D.所得滤液可产生丁达尔效应
2.20 K时,以N (凝固状态)为基体用红外光谱研究HO与F 之间的反应,首次得
2 2 2
到HOF存在的证据。下列相关叙述不正确的是( )
A.红外光谱图可见O-F键振动吸收峰
B.HOF与HO的空间结构均为V形
2
C.HOF与HClO中O均显(-2)价
D.HO与F 可发生反应:HO + F == HF + HOF
2 2 2 2
3.已知Al(OH) 可溶解于强碱溶液中,反应为:Al(OH) + OH-== [Al(OH) ]-,从结构
3 3 4
角度分析,下列物质溶解原因与该反应相同的是( )
A.Cu(OH) 溶解于稀硫酸中 B.AgCl溶解于氨水中
2
C.CaCO 溶解于盐酸中 D.CuS溶解于浓硝酸中
3
4.下列物质的性质与用途具有对应关系的是( )
A.Cl 能溶于水,可用于工业制盐酸
2
B.NO 易溶于水,可用于工业制硝酸
2
C.HClO溶液显酸性,可用作漂白剂
D.晶体Si熔点高,可用作计算机芯片
5.在实验室,下列图示装置不能达到实验目的的是( )
高三化学 第1页 共8页
学科网(北京)股份有限公司A.钠的燃烧 B.制备少量NH C.收集NO气体 D.制取少量SO
3 2
6.下列推理正确的是( )
依据 推断
A
沸点:I > Br > Cl 沸点:O > N > H
2 2 2 2 2 2
B
酸性:HClO >HIO 酸性:HCl >HI
4 4
C
半径:Na > Cl 半径:Na+ > Cl-
D
键能:Cl-Cl > Br-Br 键能:F-F > Cl-Cl
7.NaO 常用于潜水艇和消防员的呼吸面具中,可发生如下反应:
2 2
2NaO + 2CO == 2NaCO +O,2NaO +2HO == 4NaOH +O
2 2 2 2 3 2 2 2 2 2
设N 为阿伏加德罗常数的值。下列叙述正确的是( )
A
A.11.2 L CO 含σ键数目为N
2 A
B.0.1mol NaO 晶体中含离子数目为0.4 N
2 2 A
C.每生成3.2 g O 转移电子数目为0.2 N
2 A
D.0.1 mol·L-1 NaCO 溶液中含CO2数目为0.1 N
2 3 - A
8.某化学项目学习小组在实验室中采用下图装置模拟侯氏制碱法制备少量 NaHCO 晶
3
体。
下列相关叙述不正确的是( )
A.m口通入CO 气体,n口接尾气处理装置
2
B.将氨盐水雾化,可提高CO 的吸收效率
2
C.若用冷水浴,有利于NaHCO 晶体析出
3
D.生成晶体的离子方程式为:NaCl + NH ·H O + CO == NaHCO ↓+ NH++ Cl-
3 2 2 3
9.探究铁及其化合物的性质,下列方案设计、现象和结论都正确的是( )
高三化学 第2页 共8页
学科网(北京)股份有限公司实验方案 现象 结论
A 往FeCl 溶液中加入Cu片 溶液逐渐变蓝 Fe2+的氧化能力比Cu2+强
2
往 FeCl 溶液中滴加 KSCN 溶液先变成红色, KCl稀释了溶液,红色变
B 3
溶液,再加入少量KCl固体 后红色变浅 浅
用盐酸浸泡带有铁锈的铁
C 有特征蓝色沉淀 铁锈的主要成分为FeO
钉,滴加K[Fe(CN) ]溶液
3 6
Fe3+先水解得 Fe(OH) 胶
向沸水中逐滴加5~6滴饱和 液体先变成红褐色, 3
D 体,再聚集成 Fe(OH) 沉
FeCl 溶液,持续煮沸 然后析出红褐色沉淀 3
3 淀
10.X、Y、Z、Q、W五种元素原子序数依次增大,分布在前四周期,Y、Z、Q是构成
地壳的主要元素,Z、Q同周期并相邻,基态W原子的核外电子恰好填满10个原子轨道,
由这五种元素构成的某天然结晶水合物的化学式为W[ZQY ]·3XY。下列叙述正确的
2 3 10 2
是( )
A.第一电离能:Y>Q>Z>W B.X与Y形成的粒子中一定不含配位键
C.Q、W单质的晶体类型相同 D.Z的最高价氧化物对应的水化物是强
酸
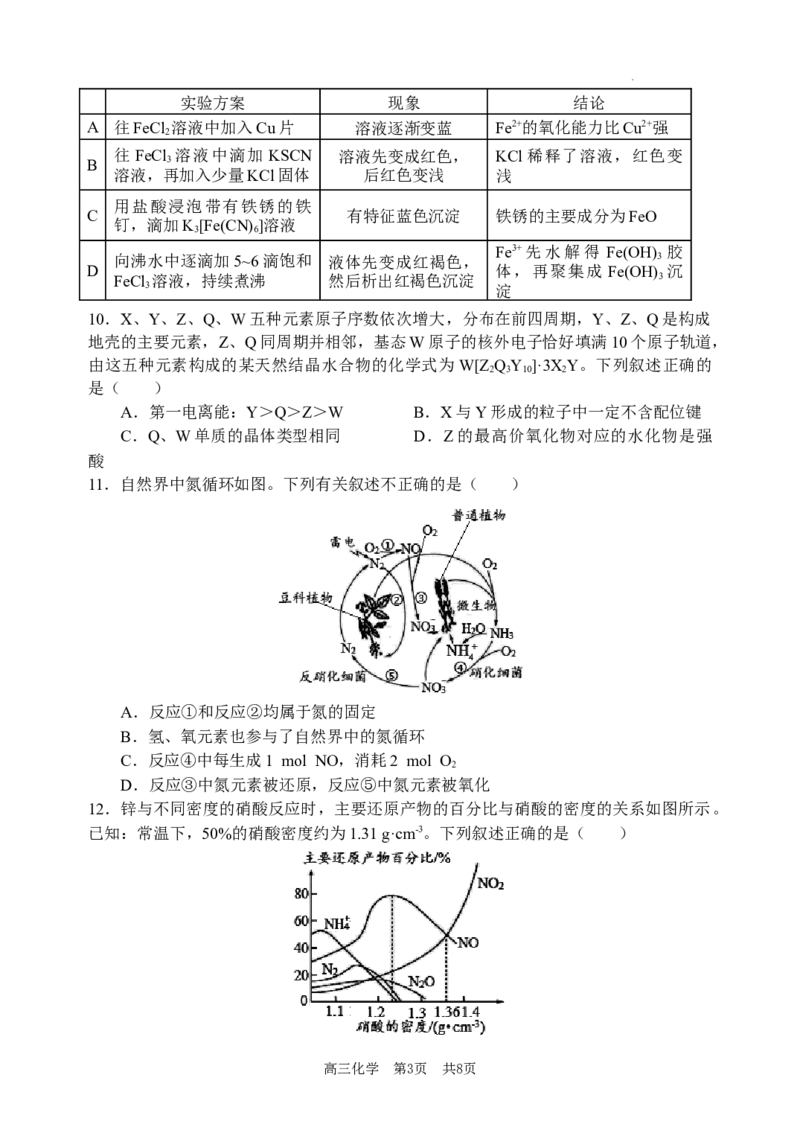
11.自然界中氮循环如图。下列有关叙述不正确的是( )
A.反应①和反应②均属于氮的固定
B.氢、氧元素也参与了自然界中的氮循环
C.反应④中每生成1 mol NO,消耗2 mol O
2
D.反应③中氮元素被还原,反应⑤中氮元素被氧化
12.锌与不同密度的硝酸反应时,主要还原产物的百分比与硝酸的密度的关系如图所示。
已知:常温下,50%的硝酸密度约为1.31 g·cm-3。下列叙述正确的是( )
高三化学 第3页 共8页
学科网(北京)股份有限公司A.氮与氧只能形成三种氧化物
B.锌与密度为1.36 g·cm-3的硝酸反应时,n(消耗Zn)∶n(消耗HNO)=1∶2
3
C.常温下,50%的硝酸的物质的量浓度约为5.2 mol·L-1
D.还原产物中NO 的百分比随硝酸密度增大而升高
2
13.焦亚硫酸钠(NaSO)为白色或黄色结晶,有强烈的刺激性气味,溶于水,水溶液
2 2 5
呈酸性,与强酸接触放出SO 并生成相应的盐类;久置空气中,易氧化变质。NaSO 可
2 2 2 5
由NaHSO 过饱和溶液经结晶脱水制得。利用SO 生产NaSO 的流程如下:
3 2 2 2 5
下列相关叙述不正确的是( )
A.1 mol Na SO 晶体中过氧键数目为 N
2 2 5 A
B.NaSO 久置空气中可发生反应为:NaSO + O +H O== 2NaHSO
2 2 5 2 2 5 2 2 4
C.反应Ⅱ为:NaCO +2NaHSO == 2NaSO +CO ↑+ H O
2 3 3 2 3 2 2
D.反应Ⅲ中充入SO 是为得到NaHSO 过饱和溶液
2 3
14.已知一氯乙烯(C HCl)分子中,C的一个sp2杂化轨道与Cl的3p 轨道形成C-Cl
2 3 x
σ键,并且Cl的3p 轨道与C的2p 轨道形成3中心4电子的大π键(π4)。下列粒子中,
z z
含有π4 键的是( )
A.CO2 B.NO C.O D.SO2
- 3 -
15.TiO 通过氮掺杂生成TiO N 的反应如图。已知原子1、2的分数坐标为(0,0, )
2 (2-a) b
和(1,0,0),设阿伏加德罗常数的值为N 。
A
下列叙述不正确的是( )
A.原子3的分数坐标为(1,1, ) B.TiO 的密度为\s\do6(NAx2y) g·cm-3
2
C.TiO N 晶体中a= D.TiO N 晶体中b=
(2-a) b (2-a) b
第Ⅱ卷 (55分)
高三化学 第4页 共8页
学科网(北京)股份有限公司二、非选择题部分(本部分包括4小题,总共55分)
16.(14分)
氯元素可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如
图装置(部分装置省略)制备KClO 和NaClO,并比较其氧化性。
3
回答下列问题:
(1)甲中盛放浓盐酸的仪器名称是_______,乙装置的作用是_______。
(2)丙中采用的加热方式是_______。
(3)丁中化学反应的离子方程式是_______。
(4)戊的作用是尾气吸收,可选用试剂_______(填序号)。
A.HSO B.NaOH C.NaCl D.HNO
2 4 3
(5)反应结束后,取出丙中试管,经冷却结晶、_____、洗涤、干燥,得到KClO 晶体。
3
(6)取少量KClO 和NaClO溶液分别置于1号和2号试管中,滴加KI溶液。1号试管
3
溶液颜色不变。2号试管溶液变为棕色,加入CCl 振荡,静置后CCl 层显紫色。可知该
4 4
条件下KClO 的氧化能力_______NaClO(填“大于”或“小于”)。
3
17.(14分)
高品质MnO 可用于生产锂离子电池正极材料锰酸锂。以软锰矿与黄铁矿为主要原
2
料采用“两矿一步浸出法”制备高品质MnO 的某工艺流程如图:
2
已知:①软锰矿与黄铁矿的主要成分分别为MnO 、FeS,还均含少量Fe、Ca、Mg、
2 2
Al、Si等元素的氧化物;
②该工艺条件下,相关金属离子完全形成氢氧化物沉淀的pH如下:
回 金属离子 Fe²+ Fe³+ Mn²+ Mg²+ Al³+ 答
下 列
开始沉淀pH 6.9 1.9 6.6 9.1 3.4
问 题:
沉淀完全(c=1.0×10-⁵ mol·L-1)的pH 8.3 3.2 10.1 10.9 4.7
( 1
)基态Fe2+的价层电子排布图为________。
(2)“配矿”过程中,将软锰矿与黄铁矿粉碎混匀的目的是________。
(3)“酸浸”操作中需先后分批加入HSO 、HO。加入HSO 后酸浸过程中主要反应
2 4 2 2 2 4
高三化学 第5页 共8页
学科网(北京)股份有限公司的离子方程式为:2FeS + 3MnO + 12H+== 2Fe3+ + 3Mn2+ + 4S↓ + 6HO
2 2 2
2Fe2+ + MnO + 4H+== 2Fe3+ + Mn2+ + 2HO
2 2
①已知滤渣1的主要成分为S、SiO、CaSO 等,其附着在矿粉颗粒表面使上述反应
2 4
受阻,此时加入HO,利用其迅速分解产生的大量气泡可破除该不利影响。分析导致
2 2
HO 迅速分解的因素是________。
2 2
②矿粉颗粒表面附着物被破除后,HO 还可以继续与MnO 反应,从而提高锰元素
2 2 2
的浸出率,该反应的离子方程式是________。
(4)“调pH”操作中需调节溶液pH范围为4.7~6.0,此时“滤渣2”的主要成分为_____、
_____(填化学式)。
(5)“沉锰”步骤发生主要反应的离子方程式为________。
(6)利用惰性电极电解HSO -MnSO -HO体系获得MnO 的机理(部分)如图甲所示,
2 4 4 2 2
硫酸浓度与电流效率的关系如图乙所示。硫酸浓度超过3.0 mol·L-1时,电流效率降低的
原因是________。
18.(13分)
铈(Ce)是一种应用非常广泛的稀土元素。现以氟碳铈矿(含CeFCO、BaO、SiO
3 2
等)为原料制备含Ce3+溶液,其工艺流程如图所示:
已知:①Ce4+能与F-结合成[CeF](4-x)+,也能与 结合成[CeSO]2+;
x 4
②Ce3+和NaSO 形成复盐沉淀,Ce3+在空气中易被氧化为Ce4+;
2 4
③硫脲(SCN H)具有还原性,酸性条件下易被氧化为(SCN H)。
2 4 2 3 2
回答下列问题:
(1)焙烧,CeFCO 与 O 反应,生成 CeO 、CeF 和 CO ,写出焙烧的化学方程式
3 2 2 4 2
______。
(2)滤渣A的主要成分是______、______。
(3)步骤①加入稀硫酸浸出,Ce的浸出率与c(H+)、温度的关系如图所示,应选择的适
高三化学 第6页 共8页
学科网(北京)股份有限公司宜的条件为_______(填序号)。
A.65℃ 2.0mo1·L-1 B.75℃ 2.0mol·L-1
C.85℃ 2.5mol·L-1 D.100℃ 2.5mol·L-1
(4)写出步骤②中加入硫脲还原[CeSO]2+的离子方程式为____,其中硫脲的结构式___。
4
(5)步骤③加入盐酸后,通常还需加入______(填“氧化剂”或“还原剂”),其主
要目的为______。
19.(14分)
化学实验小组借助KI,探究影响物质的氧化性、还原性因素。实验如下:
Ⅰ.FeCl 、CuCl 、AgNO 溶液分别与KI反应,实验操作及现象如下:
3 2 3
实验操作 实验及现象
①X为AgNO 溶液,产生黄色沉淀,溶液不变蓝
3
将5 mL 0.1 mol·L-1 X溶液滴
②X为CuCl 溶液,过滤,得到蓝色溶液和白色沉淀
2
入10 mL 0.1 mol·L-1 KI-淀粉
溶液中 ③X为FeCl 溶液,溶液变蓝,没有沉淀产生;再滴
3
加K[Fe(CN) ]溶液,产生沉淀,过滤,沉淀为蓝色
3 6
已知:CuI为难溶于水的白色固体。常温下,Ksp(AgI)=8.5×10-17 ,Ksp(CuI)=1.2×10-12。
(1)实验②中的氧化产物为______(填化学式)。
(2)实验③中氧化剂与还原剂的物质的量之比为______。
(3)已知:Ag+的氧化性比Fe3+的强,但氧化剂的氧化性强弱除受本身性质影响外,还
与温度、浓度、溶液的酸碱度等外界条件有关。分析实验①③,试解释实验①中溶液没
有变蓝的主要原因可能是______。
Ⅱ.氯气与KI反应。
高三化学 第7页 共8页
学科网(北京)股份有限公司已知:I
2
和I-在溶液中会发生反应I
2
+I- I,部分离子颜色如表所示。
离子 I ICl ICl IO
颜色 棕黄色,遇淀粉变蓝 红色 黄色 无色
(4)A装置中发生反应的化学方程式为______。
(5)反应一段时间后,B中溶液颜色变为浅棕色,为了探究B溶液中的含碘物质,设
计如下实验:
实验操作 实验现象
I.取反应后B中的溶液10mL,分成两等份,第一 第一份溶液变蓝色;
份滴入1滴碘水;第二份滴入1滴淀粉溶液 第二份溶液颜色没有变化
II.将 I 溶于 KI 溶液中配制得碘总浓度为 加淀粉后溶液变蓝,
2
0.1mol·L-1的溶液,取该溶液2mL,向其中滴加1 通氯气后蓝色褪去,
滴淀粉溶液,再通入少量氯气 溶液显浅棕色
III.向II反应后的溶液中继续通入氯气 溶液几乎变为无色
①实验操作I的目的是排除______(填离子符号)的干扰。
②写出ICl在水溶液中与Cl 反应生成IO的离子方程式:______。
2
③由以上实验可推断B中溶液颜色变成浅棕色的原因可能是生成了______、______
(填离子符号),这两种离子混合后溶液呈浅棕色。
高三化学 第8页 共8页
学科网(北京)股份有限公司