文档内容
2024-2025 学年上期高二年级期中联考试题
化学学科
考试时间: 75分钟 分值: 100分
注意事项:本试卷分试题卷和答题卡两部分。考生应首先阅读试题卷上的文字信息,然后在
答题卡上作答(答题注意事项见答题卡) 。在试题卷上作答无效。
可能用到的相对原子质量:H:1 B:11 C:12 O:16 S:32 Pb:207
第Ⅰ卷
一、选择题(共16小题,每小题3分,共48分。每小题只有一个选项符合题意。)
1. 近年来,我国新能源产业得到了蓬勃发展,下列说法错误的是
A. 规模化使用氢能有助于实现碳达峰
B. 太阳能电池是一种将化学能转化为电能的装置
C. 锂离子电池放电时锂离子从负极脱嵌,充电时锂离子从正极脱嵌
D. 理想的新能源应具有资源丰富、可再生、对环境无污染等特点
【答案】B
【解析】
【详解】A.规模化使用氢能可以减少CO 的排放,有助于实现碳达峰,故A正确;
2
B.太阳能电池是一种将太阳能转化为电能的装置,故B错误;
C.锂离子电池放电时负极材料产生锂离子,锂离子从负极脱嵌,充电时锂离子从正极脱嵌,故C正确;
D.新能源的优点就是具有资源丰富、可再生、无污染或少污染,开发利用的有太阳能、风能等等,故D
正确;
2. 2024年5月8日,我国第三艘航空母舰福建舰顺利完成首次海试。舰体表面需要采取有效的防锈措施,
下列防锈措施不属于在金属表面覆盖保护层的是
A. 船底四周镶嵌锌块 B. 钢铁表面发蓝处理
C. 钢铁表面喷涂油漆 D. 铝制品的阳极氧化
【答案】A
【解析】
【详解】A.船底四周镶嵌锌块,是利用原电池原理,将比铁更活泼的金属与铁相连,构成原电池,阻止
铁失电子,从而保护铁不受腐蚀,属于牺牲阳极的阴极保护,A符合题意;
B.钢铁表面发蓝处理,是在钢铁表面形成Fe O 保护膜,阻止铁与水膜、氧气接触,从而防止钢铁腐蚀,
3 4
B不符合题意;C.钢铁表面喷涂油漆, 是利用油漆阻止钢铁与外界水膜、空气等接触,从而保护钢铁,C不符合题意;
D.铝制品的阳极氧化,是将铝制品表面形成氧化铝保护膜,阻止铁制品表面与空气中的氧气等接触,从
而保护铝制品不受腐蚀,D不符合题意;
故选A。
3. 下列说法正确的是
A. 氢氧化钠固体溶于水放出大量的热,故该过程是放热反应
B. 放热反应不需要加热就能进行,吸热反应不加热就不能进行
C. 可逆反应的ΔH表示完全反应时的热量变化,与反应是否可逆无关
D. 同温同压下,反应 在光照和点燃条件下的ΔH不同
【答案】C
【解析】
【详解】A.氢氧化钠固体溶于水放出大量的热,但该过程是物理变化,不是化学反应,即不是放热反应,
故A错误;
B.放热反应可能需要加热才能进行,如焦炭燃烧,吸热反应不加热可能就能进行,如Ba(OH) •8HO和
2 2
NH Cl的反应常温下就可以进行,故B错误;
4
C.无论化学反应是否可逆,热化学方程式中的反应热ΔH都表示反应进行到底(完全转化)时的能量变化,
即与加入反应物的多少无关,与反应是否可逆无关,故C正确;
D.反应热ΔH只与反应的始态和终态有关,与反应途径无关,所以同温同压下,反应
在光照和点燃条件下的ΔH相同,故D错误;
故答案为:C。
4. 下列事实不能用平衡移动原理解释的是
A. 晒自来水养小金鱼
B. 合成氨时采用700K的温度
C. 开启啤酒瓶后,瓶中马上泛起大量泡沫
D. 实验室制取乙酸乙酯时,将乙酸乙酯不断蒸出
【答案】B
【解析】
【详解】A.自来水用氯气消毒过,发生反应:Cl+H O HCl+HClO,次氯酸见光分解反应为:
2 2
2HClO=2HCl+O ↑,HClO浓度减小,促进化学平衡正向移动,减少了氯气的含量,使其更适宜金鱼生存,
2可以用平衡移动原理解释, 故A不选;
B.合成氨反应是一个放热反应,升高温度会使平衡向吸热方向移动,即逆向移动,不利于氨的合成,合
成氨的反应温度通常控制在700K左右,这是因为在这个温度下,催化剂的活性最大,可以加快反应速率,
不能用平衡移动原理解释,故B选;
C.因溶液中存在二氧化碳的溶解平衡,打开啤酒瓶后,压强减小,二氧化碳逸出,能用平衡移动原理解
释,故C不选;
D.实验室制取乙酸乙酯时采用加热的方式将生成的乙酸乙酯不断蒸出,从而使平衡向生成乙酸乙酯的方
向移动,能用平衡移动原理解释,故D不选;
答案选B。
5. 恒温恒容下反应 达到平衡状态时,再通入一定量的 N。下列说法正
2
确的是(K 为平衡常数,Q 为浓度商)
A. Q 不变,K 变大,H 转化率增大
2
B. Q 增大,K 变大,N 转化率减小
2
C. Q 变小,K 不变,N 转化率减小
2
D. Q 增大,K 不变,H 转化率增大
2
【答案】C
【解析】
【详解】平衡常数只与温度有关,温度不变常数K不变。向容器中加入一定量的N,根据浓度商的公式
2
知Q减小,平衡正向移动,氢气的转化率增大,氮气的转化率减小;
答案选C。
6. 对于可逆反应A(g)+2B(g) 2C (g) ΔH<0,达到平衡时,要使正反应速率增大,且使A的转化率
增大,以下采取的措施可行的是
A. 升高温度 B. 增大A的浓度 C. 减少C的浓度 D. 增大压强
【答案】D
【解析】
【详解】A. 升高温度平衡左移,A的转化率减小,故A不符合题意;B. 增大A的浓度,A的转化率减小,
故B不符合题意;C. 减少C的浓度,正反应速率不变,故C不符合题意;D. 增大压强,正、逆反应速率
增大,平衡右移,A的转化率增大,故D符合题意。故选D。7. 下列说法正确的是
A. 化学平衡正向移动,反应物的转化率一定增大
B. 平衡常数发生变化,化学平衡不一定发生移动
C. 对于任何化学反应来说,反应速率越大,反应现象越明显
D. AgCl(s) Ag+(aq)+Cl-(aq)的平衡常数表达式为K=c (Ag+)∙c (Cl-)
平 平
【答案】D
【解析】
【详解】A.若可逆反应中有两种反应物,增大一种反应物的浓度,化学平衡正向移动,但该反应物的转
化率减小,A不正确;
B.一个可逆反应,要么放出热量,要么吸收热量,平衡常数发生变化,表明温度发生改变,则化学平衡
一定发生移动,B不正确;
C.有些化学反应(如酸碱中和反应),通常观察不到明显的现象,即便有现象发生,当反应速率很快时,反
应现象可能一闪即逝,所以并不是反应速率越快反应现象越明显,C不正确;
D.对于沉淀溶解平衡AgCl(s) Ag+(aq)+Cl-(aq),其平衡常数表达式为K=c (Ag+)∙c (Cl-),D正确;
平 平
故选D。
8. 下列有关铅蓄电池 的说法错误的是
A. 放电时,两个电极的质量均增加 B. 放电时, 溶液中 H⁺向 PbO 极移动
2
C. 充电时,电解质溶液密度增大 D. 用铅蓄电池电解 MgCl 溶液可制备 Mg
2
【答案】D
【解析】
【分析】铅蓄电池放电时,Pb发生失电子的氧化反应,Pb为负极,PbO 发生得电子的还原反应,PbO 为
2 2
正极。
【详解】A.放电时,负极Pb的电极反应式为Pb-2e-+ =PbSO,负极质量增加,正极PbO 的电极反应
4 2
式为PbO +2e-+4H++ =PbSO+2H O,正极质量增加,A项正确;
2 4 2
B.放电时,溶液中阳离子H+向正极PbO 极移动,B项正确;
2
C.充电时总反应为2PbSO +2H O=Pb+PbO+2H SO ,电解质溶液硫酸的浓度增大,电解质溶液密度增大,
4 2 2 2 4
C项正确;D.电解MgCl 溶液生成Mg(OH) 、H 和Cl,不能制备Mg,电解熔融MgCl 制备Mg,D项错误;
2 2 2 2 2
答案选D。
9. 羰基硫(COS)是一种粮食熏蒸剂,能防止某些害虫和真菌的危害。在容积不变的密闭容器中,使 CO和
HS发生下列反应并达到平衡:CO(g)+HS(g) COS(g)+H (g)。若反应前CO的物质的量为10mol,达到
2 2 2
平衡时CO的物质的量为8mol,且化学平衡常数为0.1,下列说法不正确的是
A. 升高温度,HS的浓度增大,表明该反应是放热反应
2
B. 通入 CO后,正反应速率逐渐增大
C. 反应前 HS的物质的量为7mol
2
D. 达到平衡时CO 的转化率为20%
【答案】B
【解析】
【分析】在容积不变的密闭容器中,使CO和HS发生下列反应并达到平衡:CO(g)+HS(g) COS(g)
2 2
+H (g)。若反应前CO的物质的量为10mol,达到平衡时CO的物质的量为8mol,且化学平衡常数为0.1,
2
设HS的起始投入量为x,容器的体积为V,则可建立如下三段式:
2
=0.1,x=7。
【详解】A.升高温度,HS的浓度增大,则平衡逆向移动,表明该反应是放热反应,A正确;
2
B.通入 CO后,瞬间正反应速率增大,但随后反应物浓度逐渐减小,正反应速率逐渐减小,B不正确;
C.由分析可知,反应前 HS的物质的量为7mol,C正确;
2
D.达到平衡时CO 的转化率为 =20%,D正确;
故选B。
10. 在一定温度下的密闭容器中发生反应:xA(g)+yB(g) zC(g),平衡时测得B的浓度为0.60mol∙L−1。保
持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得 B的浓度为0.36mol∙L−1。下列有关判断正确的是
A. x+yz,
A错误;
B.由分析可知,减小压强,该反应平衡逆向移动,B错误;
C.由分析可知,减小压强,该反应平衡逆向移动,A的转化率降低,C正确;
D.由分析可知,减小压强,该反应平衡逆向移动,C的体积分数减小,D错误;
故选C。
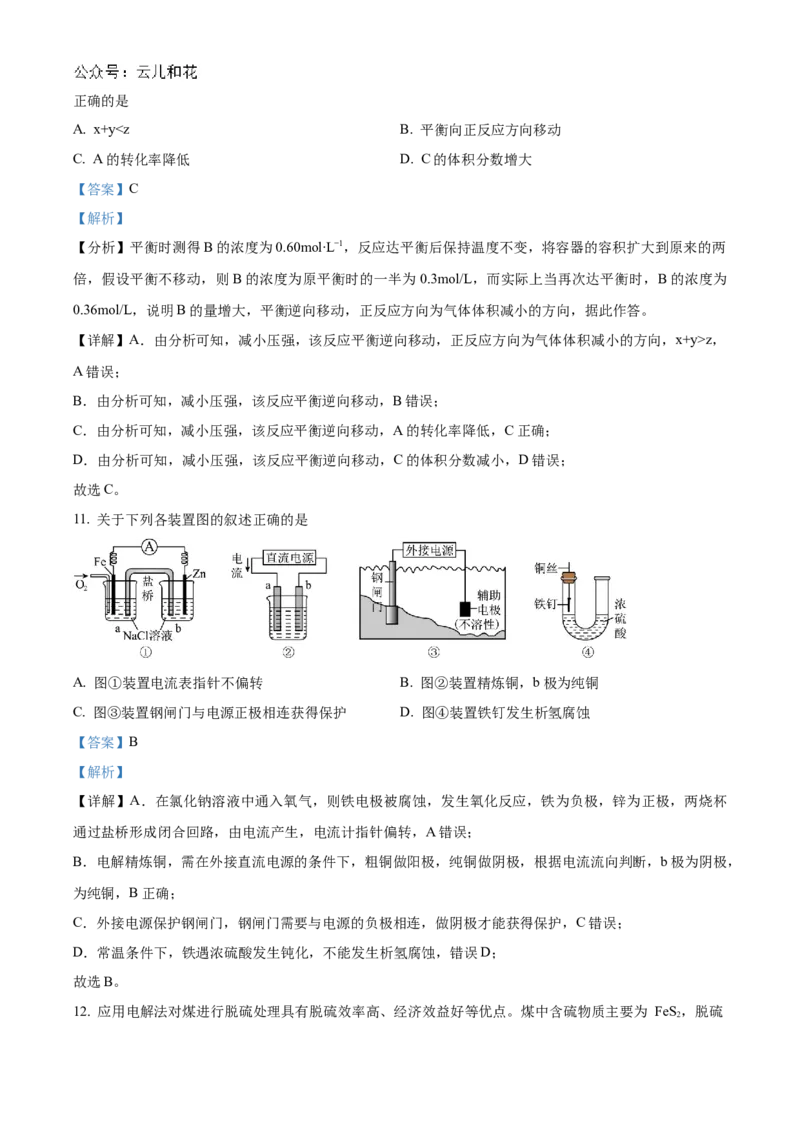
11. 关于下列各装置图的叙述正确的是
A. 图①装置电流表指针不偏转 B. 图②装置精炼铜,b极为纯铜
C. 图③装置钢闸门与电源正极相连获得保护 D. 图④装置铁钉发生析氢腐蚀
【答案】B
【解析】
【详解】A.在氯化钠溶液中通入氧气,则铁电极被腐蚀,发生氧化反应,铁为负极,锌为正极,两烧杯
通过盐桥形成闭合回路,由电流产生,电流计指针偏转,A错误;
B.电解精炼铜,需在外接直流电源的条件下,粗铜做阳极,纯铜做阴极,根据电流流向判断,b极为阴极,
为纯铜,B正确;
C.外接电源保护钢闸门,钢闸门需要与电源的负极相连,做阴极才能获得保护,C错误;
D.常温条件下,铁遇浓硫酸发生钝化,不能发生析氢腐蚀,错误D;
故选B。
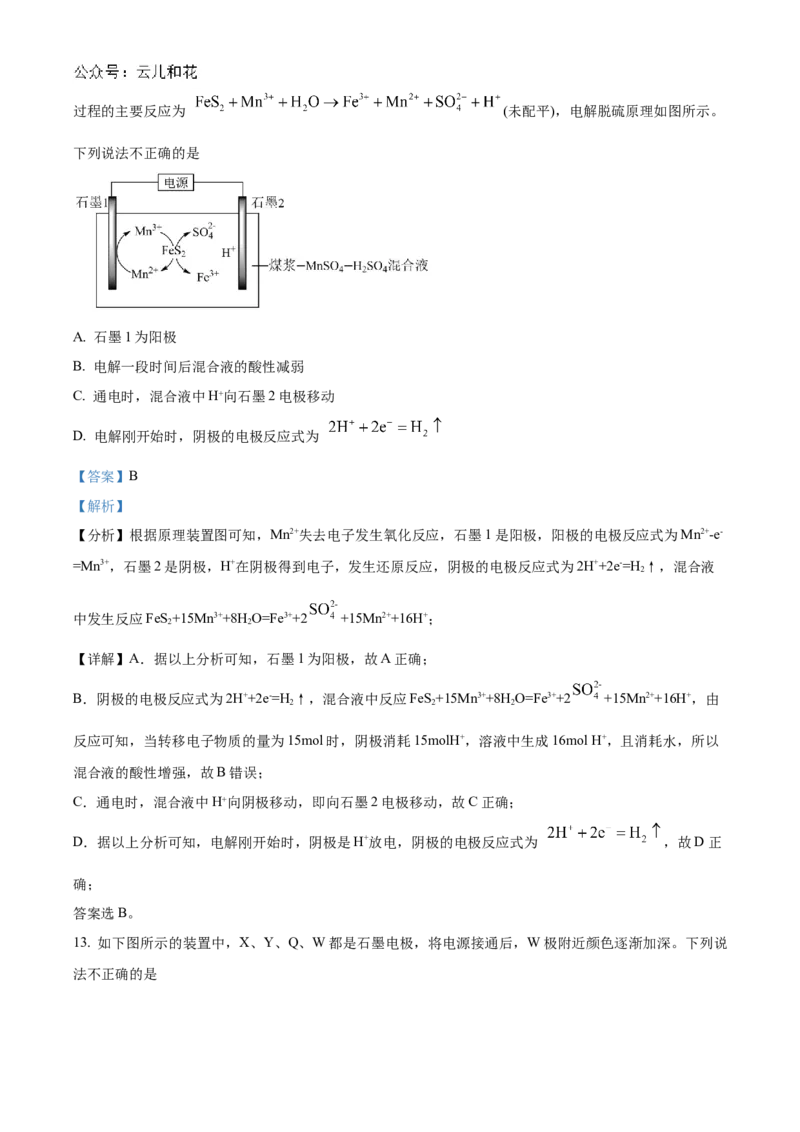
12. 应用电解法对煤进行脱硫处理具有脱硫效率高、经济效益好等优点。煤中含硫物质主要为 FeS,脱硫
2过程的主要反应为 (未配平),电解脱硫原理如图所示。
下列说法不正确的是
A. 石墨1为阳极
B. 电解一段时间后混合液的酸性减弱
C. 通电时,混合液中H⁺向石墨2电极移动
D. 电解刚开始时,阴极的电极反应式为
【答案】B
【解析】
【分析】根据原理装置图可知,Mn2+失去电子发生氧化反应,石墨1是阳极,阳极的电极反应式为Mn2+-e-
=Mn3+,石墨2是阴极,H+在阴极得到电子,发生还原反应,阴极的电极反应式为2H++2e-=H ↑,混合液
2
中发生反应FeS+15Mn3++8H O=Fe3++2 +15Mn2++16H+;
2 2
【详解】A.据以上分析可知,石墨1为阳极,故A正确;
B.阴极的电极反应式为2H++2e-=H ↑,混合液中反应FeS+15Mn3++8H O=Fe3++2 +15Mn2++16H+,由
2 2 2
反应可知,当转移电子物质的量为15mol时,阴极消耗15molH+,溶液中生成16mol H+,且消耗水,所以
混合液的酸性增强,故B错误;
C.通电时,混合液中H⁺向阴极移动,即向石墨2电极移动,故C正确;
D.据以上分析可知,电解刚开始时,阴极是H+放电,阴极的电极反应式为 ,故D正
确;
答案选B。
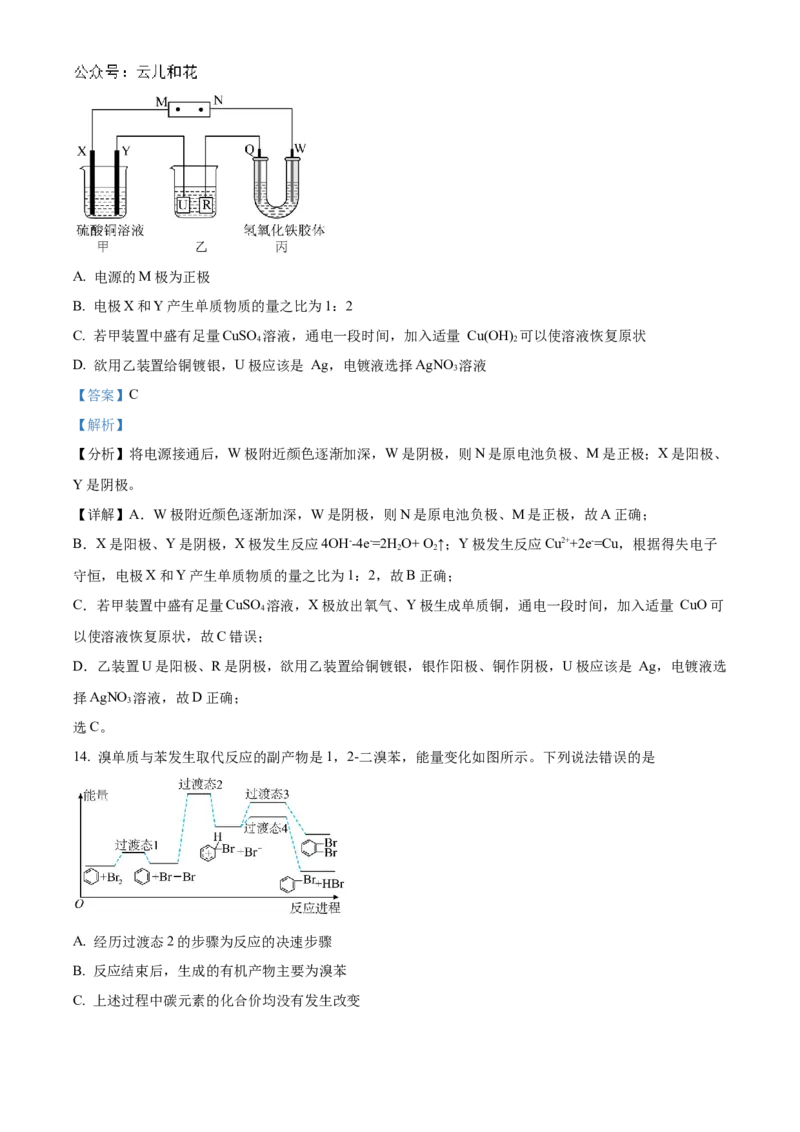
13. 如下图所示的装置中,X、Y、Q、W都是石墨电极,将电源接通后,W极附近颜色逐渐加深。下列说
法不正确的是A. 电源的M极为正极
B. 电极X和Y产生单质物质的量之比为1:2
C. 若甲装置中盛有足量CuSO 溶液,通电一段时间,加入适量 Cu(OH) 可以使溶液恢复原状
4 2
D. 欲用乙装置给铜镀银,U极应该是 Ag,电镀液选择AgNO 溶液
3
【答案】C
【解析】
【分析】将电源接通后,W极附近颜色逐渐加深,W是阴极,则N是原电池负极、M是正极;X是阳极、
Y是阴极。
【详解】A.W极附近颜色逐渐加深,W是阴极,则N是原电池负极、M是正极,故A正确;
B.X是阳极、Y是阴极,X极发生反应4OH--4e-=2H O+ O ↑;Y极发生反应Cu2++2e-=Cu,根据得失电子
2 2
守恒,电极X和Y产生单质物质的量之比为1:2,故B正确;
C.若甲装置中盛有足量CuSO 溶液,X极放出氧气、Y极生成单质铜,通电一段时间,加入适量 CuO可
4
以使溶液恢复原状,故C错误;
D.乙装置U是阳极、R是阴极,欲用乙装置给铜镀银,银作阳极、铜作阴极,U极应该是 Ag,电镀液选
择AgNO 溶液,故D正确;
3
选C。
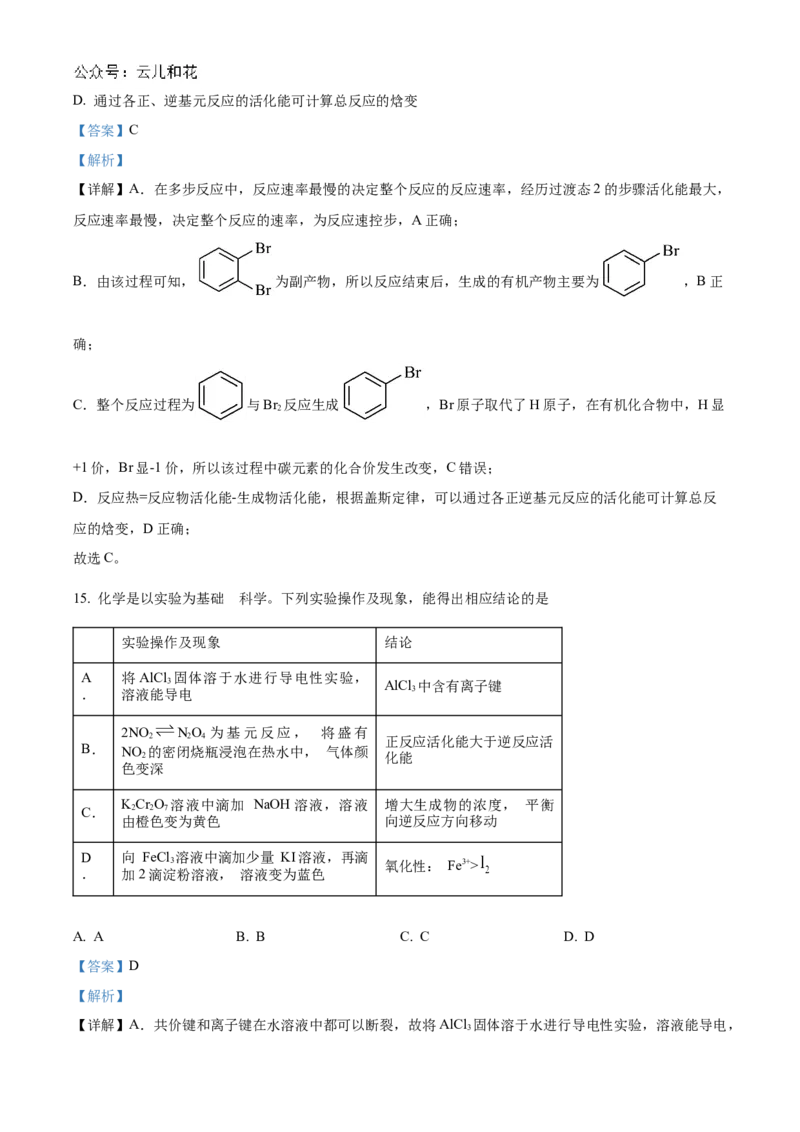
14. 溴单质与苯发生取代反应的副产物是1,2-二溴苯,能量变化如图所示。下列说法错误的是
A. 经历过渡态2的步骤为反应的决速步骤
B. 反应结束后,生成的有机产物主要为溴苯
C. 上述过程中碳元素的化合价均没有发生改变D. 通过各正、逆基元反应的活化能可计算总反应的焓变
【答案】C
【解析】
【详解】A.在多步反应中,反应速率最慢的决定整个反应的反应速率,经历过渡态2的步骤活化能最大,
反应速率最慢,决定整个反应的速率,为反应速控步,A正确;
B.由该过程可知, 为副产物,所以反应结束后,生成的有机产物主要为 ,B正
确;
C.整个反应过程为 与Br 反应生成 ,Br原子取代了H原子,在有机化合物中,H显
2
+1价,Br显-1价,所以该过程中碳元素的化合价发生改变,C错误;
D.反应热=反应物活化能-生成物活化能,根据盖斯定律,可以通过各正逆基元反应的活化能可计算总反
应的焓变,D正确;
故选C。
的
15. 化学是以实验为基础 科学。下列实验操作及现象,能得出相应结论的是
实验操作及现象 结论
A 将AlCl 固体溶于水进行导电性实验,
3 AlCl 中含有离子键
. 溶液能导电 3
2NO NO 为基元反应, 将盛有
2 2 4 正反应活化能大于逆反应活
B. NO 的密闭烧瓶浸泡在热水中, 气体颜
2 化能
色变深
KCr O 溶液中滴加 NaOH溶液,溶液 增大生成物的浓度, 平衡
C. 2 2 7
由橙色变为黄色 向逆反应方向移动
D 向 FeCl 溶液中滴加少量 KI溶液,再滴
3 氧化性: Fe3+>
. 加2滴淀粉溶液, 溶液变为蓝色
A. A B. B C. C D. D
【答案】D
【解析】
【详解】A.共价键和离子键在水溶液中都可以断裂,故将AlCl 固体溶于水进行导电性实验,溶液能导电,
3不能说明AlCl 中含有离子键,A错误;
3
B.2NO NO 为基元反应,将盛有NO 的密闭烧瓶浸泡在热水中,气体颜色变深,平衡逆向进行,反
2 2 4 2
应为放热反应,正反应活化能小于逆反应活化能,B错误;
C.KCr O 溶液中存在: ,滴加 NaOH溶液,消耗氢离子,降低生成物浓
2 2 7
度,平衡正向进行,C错误;
D.向 FeCl 溶液中滴加少量 KI溶液,再滴加2滴淀粉溶液, 溶液变为蓝色,说明有单质碘生成,即发生
3
反应 ,故氧化性Fe3+> ,D正确;
故选D。
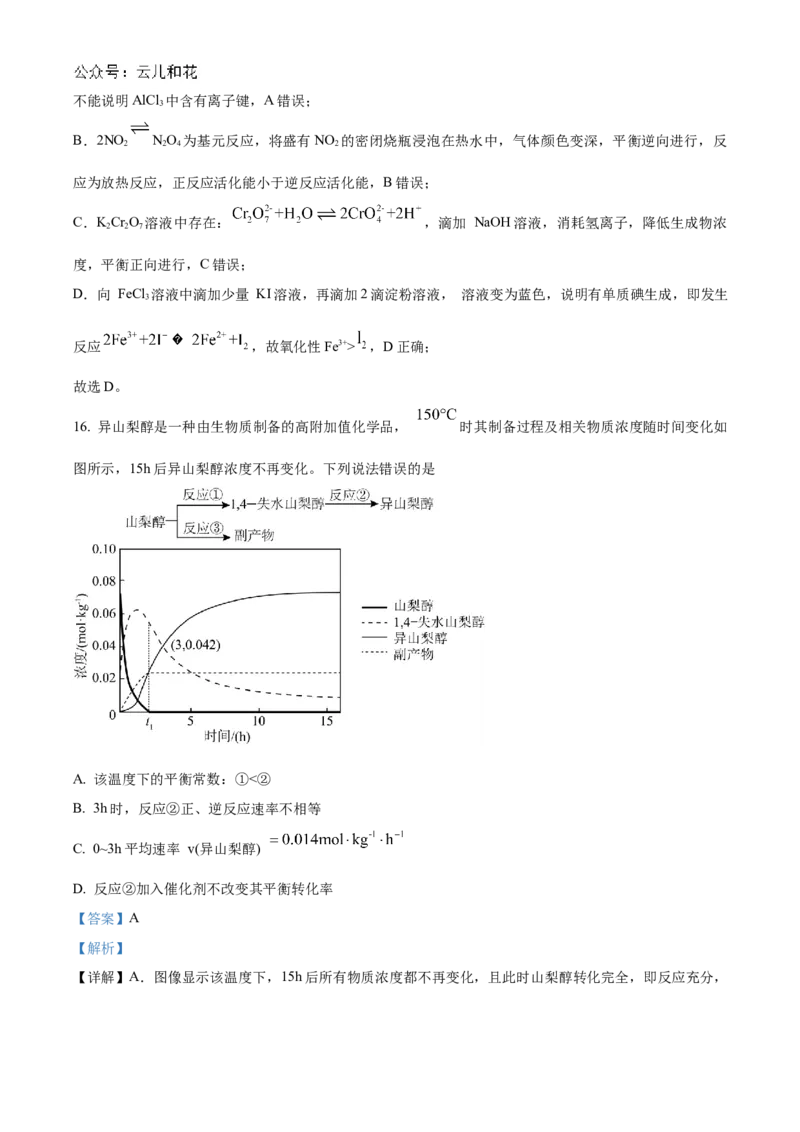
16. 异山梨醇是一种由生物质制备的高附加值化学品, 时其制备过程及相关物质浓度随时间变化如
图所示,15h后异山梨醇浓度不再变化。下列说法错误的是
A. 该温度下的平衡常数:①<②
B. 3h时,反应②正、逆反应速率不相等
C. 0~3h平均速率 v(异山梨醇)
D. 反应②加入催化剂不改变其平衡转化率
【答案】A
【解析】
【详解】A.图像显示该温度下,15h后所有物质浓度都不再变化,且此时山梨醇转化完全,即反应充分,的
而1,4-失水山梨醇仍有剩余,即反应②正向进行程度小于反应①、反应限度小于反应①,所以该温度下
平衡常数:①>②,故A错误;
B.由图可知,3小时后异山梨醇浓度继续增大,15h后异山梨醇的浓度才不再变化,所以3h时,反应②
未达到平衡状态,即正、逆反应速率不相等,故B正确;
C.由图可知,在3h内异山梨醇的浓度变化量为0.042mol/kg,所以平均速率v(异山梨醇)=
,故C正确;
D.催化剂只能改变化学反应速率,不能改变物质平衡转化率,所以反应②加入催化剂不改变其平衡转化
率,故D正确;
故答案为:A。
第Ⅱ卷
二、非选择题(本题包括4小题,共52分)
17. 用相关化学反应原理解释下列问题。
(1)三元催化器可以将高温汽车尾气中的CO和NO转化为无毒气体,写出该反应的化学方程式
___________。
(2)5.6g B H 气体在氧气中燃烧, 生成固态B O 和液态水, 放出433kJ热量, 写出该反应的热化学方
2 6 2 3
程式___________。
(3)酸性较弱时,钢铁发生电化学腐蚀的正极反应式为___________。
(4)CO与血红蛋白( Hb)结合的能力比O 更强,该过程可表示为
2
如果一旦发现有人CO中毒,应该立刻采取的措施 是___________。
(5)二甲醚(CHOCH )被称为“21世纪的清洁燃料”,二甲醚可用作燃料电池,若电解质溶液为KOH溶液,
3 3
则负极的电极反应式为___________。
【答案】(1)
(2) ΔH = kJ∙mol−1
(3)
(4)切断CO来源,将病人移至空气流通处,必要时放入高压氧仓(5)
【解析】
【小问1详解】
三元催化器可以将高温汽车尾气中的CO和NO转化为无毒气体CO 和N,该反应的化学方程式为
2 2
。
【小问2详解】
5.6g B H 气体(物质的量为 =0.2mol)在氧气中燃烧,生成固态B O 和液态水,放出433kJ热量,
2 6 2 3
则1molB H(g)发生该反应,放热 =2165kJ,则热化学方程式为
2 6
ΔH = kJ∙mol−1。
【小问3详解】
酸性较弱时,钢铁发生吸氧腐蚀,正极O 得电子产物与电解质反应生成OH-,则该电化学腐蚀的正极反应
2
式为 。
【小问4详解】
CO与血红蛋白( Hb)结合的能力比O 更强,该过程可表示为 如果一
2
旦发现有人CO中毒,应该切断一氧化碳的来源,将人移至氧气充足的地方,则立刻采取的措施是:切断
CO来源,将病人移至空气流通处,必要时放入高压氧仓。
【小问5详解】
二甲醚(CHOCH )可用作燃料电池,若电解质溶液为KOH溶液,则负极二甲醚(CHOCH )失电子产物与电
3 3 3 3
解质反应,生成KCO 等,电极反应式为 。
2 3
18. 化学反应的过程不仅包括物质变化,还包括能量变化。研究化学能与其他形式能量之间的相互转化具
有重要的意义。I.化学能与热能
用 的盐酸与 的氢氧化钠溶液在如图所示的装置中进行中和反应,通
过测定反应过程中所放出的热量可计算中和热。
(1)仪器A的名称是___________。
(2)已知:近似认为溶液密度是1g·cm⁻³,溶液的比热容c= 忽略溶液体积变化。实验数据
如下,请计算中和热ΔH=___________。
起始温度t/℃
1
实验次 终 止 温 度
数 氢氧化钠溶 t 2 /℃
盐酸 平均值
液
1 26.4 26.2 26.3 29.4
. .
2 27.0 274 27.2 317
3 25.9 25.9 25.9 28.8
(3)上述实验测得的中和热与理论值 存在较大偏差,产生偏差的原因可能是
___________(填字母)。
A.量取盐酸时仰视读数
B.实验装置保温隔热效果差
C.为了使反应充分,向酸溶液中分次加入碱溶液
Ⅱ. 化学能与电能
在如图所示装置中, A、B、E、F为多孔的石墨惰性电极; C、D为两个铂夹,夹在被 Na₂SO₄溶液浸湿
的滤纸条上,滤纸中部滴有 KMnO 溶液; 电源有a、b两极。试管中充满KOH 溶液后倒立于 KOH溶液
4
的水槽中,烧杯中为 500mL0.04mol·L⁻¹的 AgNO 溶液。断开 K, 闭合K、K, 通直流电, 实验现象
3 1 2 3
如图所示。(4)a为电源的___________极,在NaSO 溶液浸湿的滤纸条中部的 溶液处观察到的现象是
2 4
___________。
(5)开始时,烧杯中发生的离子反应方程式___________。一段时间后,在标准状况下A、B处共收集到
气体672mL,忽略溶液体积变化,则此时烧杯中 c(H⁺)=___________,烧杯中产生的气体体积为
___________。
(6)若电解一段时间后,A、B均有气体包围电极。此时切断K、K,闭合K,观察到检流计的指针移
2 3 1
动,其理由___________。
【答案】(1)(玻璃)搅拌器
(2)
(3)BC (4) ①. 负极 ②. 紫色向D处移动
(5) ①. ②. 0.04mol∙L−1 ③. 448mL
(6)此装置构成氢氧燃料电池,所以检流计指针移动
【解析】
【小问1详解】
仪器A的名称是(玻璃)搅拌器。
【小问2详解】
第1次测定温度差为:(29.4-26.3)℃=3.1℃,第2次测定的温度差为:(31.7-27.2)℃=4.5℃,第3次测定的
温度差为:(28.8-25.9)℃=2.9℃,实验2的误差太大要舍去,2次温度差的平均值为 =3.0℃,
的盐酸与 的氢氧化钠溶液,生成水的物质的量
为(0.05L×0.50mol/L=0.025mol,溶液的质量为:100mL×1g/cm3=100g,温度变化的值为△T=3.0°C,则生成
0.025mol水放出的热量为:Q=m⋅c⋅△T=100g×4.2J/(g⋅°C)×3.0°C=1260J,即1.26kJ,所以实验测得的中和热 。
【小问3详解】
上述实验测得的中和热与理论值 存在较大偏差,说明测定放出的热量偏小,
A.量取盐酸时仰视读数,会导致量取盐酸的体积偏大,放出的热量偏多,A不选;
B.实验装置保温隔热效果差,会导致测定放出的热量偏小,B选;
C.为了使反应充分,向酸溶液中分次加入碱溶液,会导致热量散失较多,导致测定放出的热量偏小,C
选;
故选BC。
【小问4详解】
切断K,合闭K、K 通直流电,电极A、B及氢氧化钾溶液构成电解池,根据离子的放电顺序,溶液中氢
1 2 3
离子、氢氧根离子放电,分别生成氢气和氧气,氢气和氧气的体积比为2:1,通过图像知,B极上气体体
积是A极上气体体积的2倍,所以B极上得H,A极上得到O,所以B极是阴极,A极是阳极,则a是负
2 2
极,b是正极;浸有硫酸钠的滤纸和电极C、D与电源也构成了电解池,因为a是负极,b是正极,所以C
是阴极,D是阳极,电解质溶液中的阳离子K+向阴极C电极区域移动,阴离子 向阳极D区域移动,
所以D极附近的溶液呈紫色。
【小问5详解】
开始时,烧杯中发生电解硝酸盐溶液的反应,Ag+在阴极得到电子生成Ag,HO在阳极失去电子生成O,
2 2
根据得失电子守恒和电荷守恒配平离子反应方程式为: 。切断
K,合闭K、K 通直流电,电极A、B及氢氧化钾溶液构成电解池,B极上得H,A极上得到O,B极上
1 2 3 2 2
气体体积是A极上气体体积的2倍,在标准状况下A、B处共收集到气体672mL,则n(H )=
2
,n(O )= ,由电极方程式 可
2
知转移0.04mol电子,烧杯中n(Ag+)=0.5L×0.04mol/L=0.02mol,则烧杯中先发生,转移0.02mol电子,可知生成0.02molH+,然后发生电解水的反
应 ,转移0.02mol电子,n(H+)不变,则此时烧杯中 c(H⁺)= =0.4mol/L,
烧杯中产生的气体物质的量为0.02mol× +0.01mol+0.01mol× =0.02mol,标况下气体的体积为
0.02mol×22.4L/mol=0.448L=488mL。
【小问6详解】
若电解一段时间后,A、B中均有气体包围电极.此时切断K、K,闭合K,构成氢氧燃料电池,观察到
2 3 1
检流计的指针移动。
19. 某化学小组为了探究外界条件对化学反应速率的影响,进行了如下实验。
[实验原理]
[实验内容及记录]
试管中所加试剂及其用量/mL
实
实
验
验 溶液褪
温
编 0.6mol∙L−1HC O 3mol∙L−1HSO 0.05mol∙L−1KMnO 至无色
度 / 2 2 4 HO 2 4 4
号 溶液 2 溶液 溶液 所需时
℃
间/ min
I 25 3.0 2.0 2.0 3.0 t
1
Ⅱ 25 2.0 3.0 2.0 3.0 t
2
III 35 2.0 3.0 2.0 3.0 t
3
(1)I、Ⅱ实验目的是___________。
(2)实验Ⅰ中加入2.0mL水的原因是___________。
(3)若将实验Ⅱ中: 溶液换成6mol∙L−1盐酸,溶液褪至无色所需时间变短,可能原因
是___________(用离子方程式表示)。(4)探究温度对化学反应速率的影响,应选择实验___________(填实验编号)。
(5)该小组同学查阅已有实验资料发现,该实验过程中 随时间变化的实际趋势如图所示。
该小组同学根据图中所示信息提出了新的假设,并设计实验方案④继续进行实验探究。
25℃, 试管中所加试剂及其用量/mL
实 溶液褪
再 加 入
验 至无色
0.05 某 种 固
编 0.6mol∙L−1HC O 3mol∙L−1HSO 所需时
2 2 4 HO 2 4 mol∙L−1KMnO 体
号 溶液 2 溶液 4 间/ min
溶液
IV 2.0 V V 3.0 MnSO t
1 2 4 4
①小组同学提出的假设是___________。
②V=___________, t~t 中数值最大的是___________。
1 1 4
【答案】(1)探究其他条件相同时,草酸浓度对化学反应速率的影响
(2)为了保持溶液总体积为10.0mL,从而保证其他反应物浓度不变
(3)
(4)Ⅱ、Ⅲ (5) ①. Mn2+对该反应有催化作用 ②. 3.0 ③. t
2
【解析】
【分析】实验I和实验II对比温度相同,其他条件相同,草酸浓度不同,探究的是草酸浓度不同对反应速
率的影响,实验II和实验III温度不同,其他条件相同,探究的是温度对反应速率的影响,加入水的目的
是让总体积相同;
【小问1详解】
实验I和实验II对比温度相同,其他条件相同,草酸浓度不同,探究的是草酸浓度不同对反应速率的影响;
【小问2详解】
实验I加入2ml水的目的是让溶液的总体积为10ml,保证其他反应物浓度不变,只改变一个条件对反应速
率的影响;
【小问3详解】
盐酸中的Cl-具有还原性,也能与酸性高锰酸钾溶液反应,使溶液褪色的时间变短,反应的离子方程式为:;
【小问4详解】
对比实验II和实验III,其他条件相同,温度不同,探究温度对化学反应速率的影响,应选择实验II和实验
III;
【小问5详解】
由图像可知,Mn2+的物质的量开始缓慢增加,然后迅速增加,最后又缓慢增加,说明Mn2+对该反应有催化
作用;实验IV和实验II对比,其他条件均相同,加入MnSO ,增大Mn2+的浓度,探究Mn2+对反应的催化
4
作用,因此V=3.0,V=2.0,褪色的时间小于t,实验I到实验IV中反应速率最慢的是实验II, t~t 数值
1 2 2 1 4
最大的是t。
2
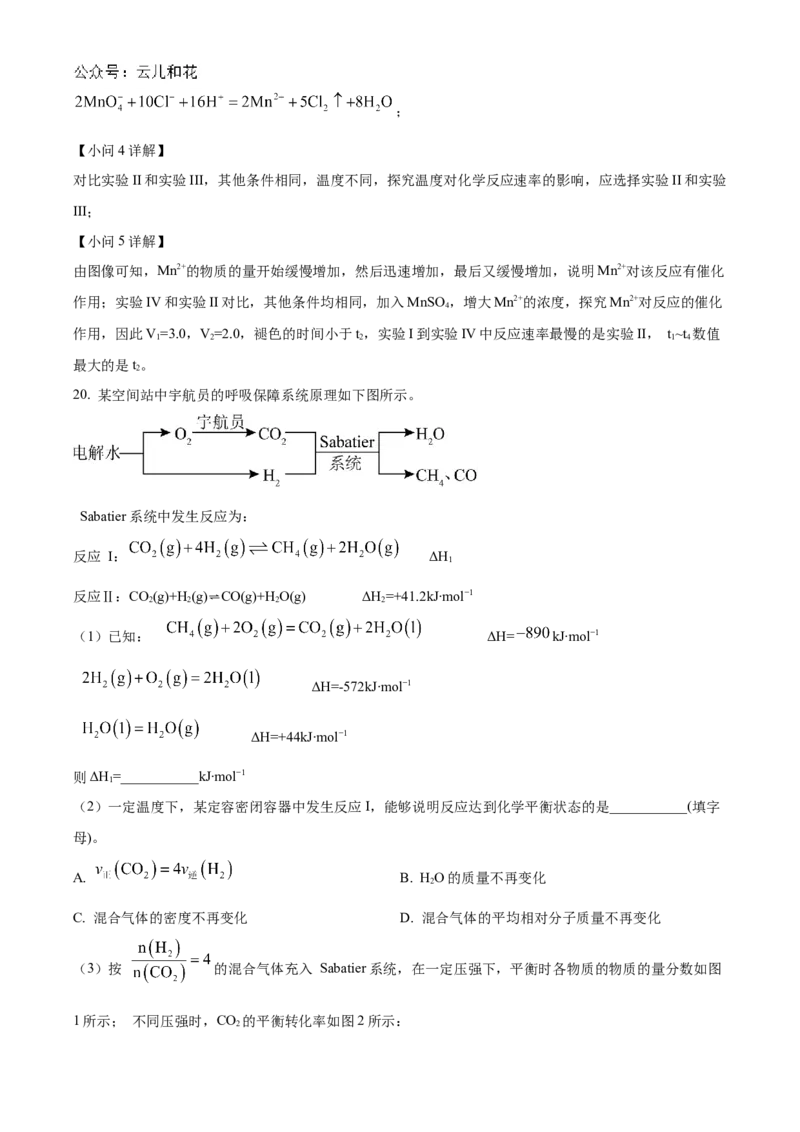
20. 某空间站中宇航员的呼吸保障系统原理如下图所示。
Sabatier系统中发生反应为:
反应 Ⅰ: ΔH
1
反应Ⅱ:CO
2
(g)+H
2
(g)⇌CO(g)+H
2
O(g) ΔH
2
=+41.2kJ∙mol−1
(1)已知: ΔH= kJ∙mol−1
ΔH=-572kJ∙mol−1
ΔH=+44kJ∙mol−1
则ΔH=___________kJ∙mol−1
1
(2)一定温度下,某定容密闭容器中发生反应I,能够说明反应达到化学平衡状态的是___________(填字
母)。
A. B. HO的质量不再变化
2
C. 混合气体的密度不再变化 D. 混合气体的平均相对分子质量不再变化
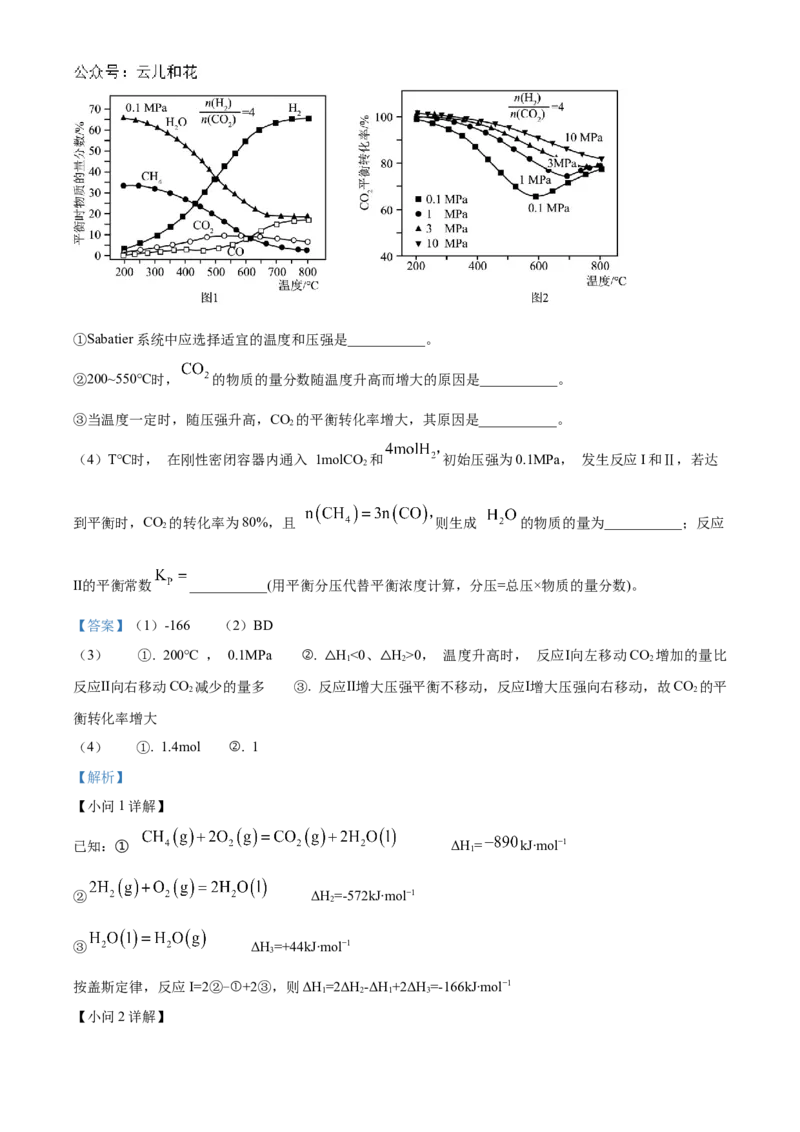
(3)按 的混合气体充入 Sabatier系统,在一定压强下,平衡时各物质的物质的量分数如图
1所示; 不同压强时,CO 的平衡转化率如图2所示:
2①Sabatier系统中应选择适宜的温度和压强是___________。
②200~550℃时, 的物质的量分数随温度升高而增大的原因是___________。
③当温度一定时,随压强升高,CO 的平衡转化率增大,其原因是___________。
2
(4)T℃时, 在刚性密闭容器内通入 1molCO 和 初始压强为0.1MPa, 发生反应I和Ⅱ,若达
2
到平衡时,CO 的转化率为80%,且 则生成 的物质的量为___________;反应
2
Ⅱ的平衡常数 ___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】(1)-166 (2)BD
(3) ①. 200℃ , 0.1MPa ②. H<0、 H>0, 温度升高时, 反应Ⅰ向左移动CO 增加的量比
1 2 2
反应Ⅱ向右移动CO 减少的量多 ③. 反△应Ⅱ增大△压强平衡不移动,反应Ⅰ增大压强向右移动,故CO 的平
2 2
衡转化率增大
(4) ①. 1.4mol ②. 1
【解析】
【小问1详解】
已知:① ΔH= kJ∙mol−1
1
② ΔH=-572kJ∙mol−1
2
③ ΔH=+44kJ∙mol−1
3
按盖斯定律,反应 Ⅰ=2②-①+2③,则ΔH=2ΔH -ΔH +2ΔH =-166kJ∙mol−1
1 2 1 3
【小问2详解】一定温度下,某定容密闭容器中发生反应I:
A. 中出现2个反应方向的速率,但速率数值比不等于化学计量数,说明此时正
反应和逆反应速率不相等,则不能表明上述反应已达到平衡状态,若 才说明正反应
和逆反应速率相等,A错误;
B.HO的质量不再变化,符合化学平衡特征,B正确;
2
C.气体质量、容积体积、气体密度均始终不变,故混合气体的密度不变不能说明已平衡,C错误;
D.气体质量始终不变,气体的物质的量、混合气体的平均摩尔质量会随着反应而变,混合气体的平均相
对分子质量不变说明反应已达平衡,D正确;
选BD。
【小问3详解】
①产物的物质的量分数越大,反应物的转化率越高,Sabatier系统中CO、H 为反应物,CH、HO(g)、
2 2 4 2
CO为产物,由图所示,200℃ , 0.1MPa时转化率CO 最高,CH、HO(g)的物质的量分数最大,则
2 4 2
Sabatier系统中应选择适宜的条件是200℃ , 0.1MPa;
②反应I放热,升温平衡左移,反应Ⅱ吸热,升温平衡右移,则200~550℃时, 的物质的量分数随温
度升高而增大的原因是:△H<0、△H>0, 温度升高时, 反应Ⅰ向左移动CO 增加的量比反应Ⅱ向右移动
1 2 2
CO 减少的量多;
2
③温度不变增大气体压强时,平衡向着气体分子总数减小的方向移动,则当温度一定时,随压强升高,
CO 的平衡转化率增大,其原因是:反应Ⅱ增大压强平衡不移动,反应Ⅰ增大压强向右移动,故CO 的平衡
2 2
转化率增大。
【小问4详解】
初始 和 的物质的量分别为4mol、1mol,若达到平衡时,CO 的转化率为80%,发生上述I反应:
2
, 发 生 上 述 Ⅱ 反 应 :
, 根 据 n(CH)= 3n(CO) , 得
4
n(CH)=xmol=3n(CO)=3(0.8-x)mol,得 x=0.6,则平衡时 n(CO)=0.2mol,n(H )=1.4mol,n(CO)=0.2mol,
4 2 2n(H O)=1.4mol,n(CH)=0.6mol,混合气体共 3.8mol,结合
2 4
反 应 ① 的 平 衡 常 数
。