文档内容
2024/2025学年度第一学期
联盟校第一次学情调研检测高一年级化学试题
(总分100分 考试时间75分钟)
注意事项:
1.本试卷中所有试题必须作答在答题纸上规定的位置,否则不给分。
2.答题前,务必将自己的姓名、准考证号用0.5毫米黑色墨水签字笔填写在试卷及
答题纸上。
3.作答非选择题时必须用黑色字迹0.5毫米签字笔书写在答题纸的指定位置上,作
答选择题必须用2B铅笔在答题纸上将对应题目的选项涂黑。如需改动,请用橡皮擦干净
后,再选涂其它答案,请保持答题纸清洁,不折叠、不破损。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5 Zn-65 Fe-56
第Ⅰ卷 (选择题 共 39 分)
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1. 杭州亚运会秉持绿色办赛理念,下列做法不符合该理念的是( )
...
A. 加大燃油汽车使用 B. 设计自然通风系统
C. 采用光伏发电系统 D. 竹子用作代塑材料
2. Cu与KCN溶液反应的化学方程式为:2Cu+8KCN+2H
2
第1页/共9页
学科网(北京)股份有限公司
O = 2 K [Cu(CN)]
3 4
+2KOH+H ↑。下列说法正确的是( )
2
A. 中子数为35的铜原子: 32 59 C u
B. K⁺的结构示意图:
C. CN⁻的电子式为: : C N : −
D. K Cu(CN) 中存在极性键和非极性键
3
4
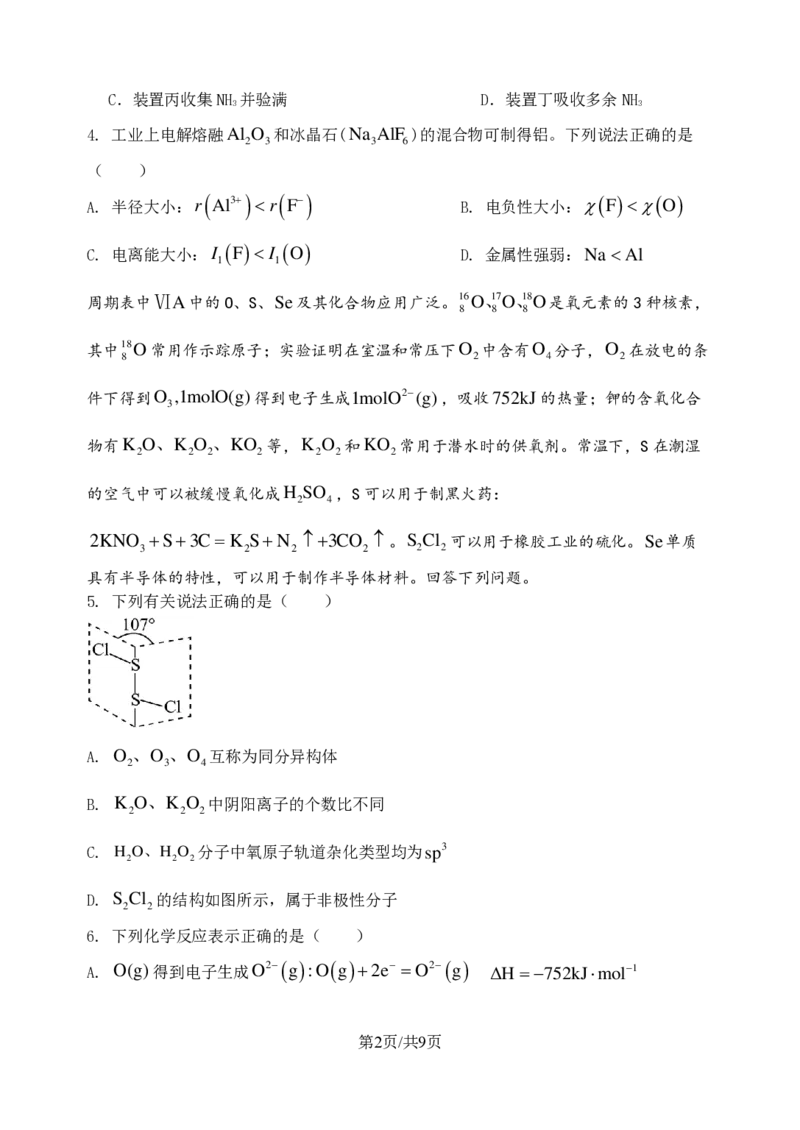
3. 实验室采用下列装置制取氨气,正确的是( )
A.装置甲生成NH B.装置乙干燥NH
3 3
{#{QQABKQYAogCgApBAAAgCUwE4CgCQkBEAAagOAFAMIAAAiRFABCA=}#}C.装置丙收集NH 并验满 D.装置丁吸收多余NH
3 3
4. 工业上电解熔融Al O 和冰晶石(Na AlF )的混合物可制得铝。下列说法正确的是
2 3 3 6
( )
A. 半径大小:
第2页/共9页
学科网(北京)股份有限公司
r ( A l 3 + ) r ( F − ) B. 电负性大小: ( F ) ( O )
C. 电离能大小: I
1
( F ) I
1
( O ) D. 金属性强弱: N a A l
周期表中ⅥA中的O、S、Se及其化合物应用广泛。 18 6 O 、 18 7 O 、 18 8 O 是氧元素的3种核素,
其中 18 8 O 常用作示踪原子;实验证明在室温和常压下 O
2
中含有 O
4
分子, O
2
在放电的条
件下得到 O
3
, 1 m o l O ( g ) 得到电子生成 1 m o l O 2 − ( g ) ,吸收752kJ的热量;钾的含氧化合
物有K O、K O 、KO 等,K O 和
2 2 2 2 2 2
K O
2
常用于潜水时的供氧剂。常温下,S在潮湿
的空气中可以被缓慢氧化成 H
2
S O
4
,S可以用于制黑火药:
2 K N O
3
+ S + 3 C = K
2
S + N
2
+ 3 C O
2
。S Cl 可以用于橡胶工业的硫化。
2 2
S e 单质
具有半导体的特性,可以用于制作半导体材料。回答下列问题。
5. 下列有关说法正确的是( )
A. O 、O、O 互称为同分异构体
2 3 4
B. K
2
O 、 K
2
O
2
中阴阳离子的个数比不同
C. H
2
O 、 H
2
O
2
分子中氧原子轨道杂化类型均为 s p 3
D. S
2
C l
2
的结构如图所示,属于非极性分子
6. 下列化学反应表示正确的是( )
A. O(g)得到电子生成O2−(g):O(g)+2e− =O2−(g) ΔH=−752kJmol−1
{#{QQABKQYAogCgApBAAAgCUwE4CgCQkBEAAagOAFAMIAAAiRFABCA=}#}B. KO 与水的反应:KO +H O=K+ +OH− +O
2 2 2 2
C. S在潮湿的空气中氧化成
第3页/共9页
学科网(北京)股份有限公司
H
2
S O
4
的反应: 2 S + 3 O
2
+ 2 H
2
O = 2 H
2
S O
4
D. 酸性KMnO 溶液与H 18O 反应:
4 2 2
2 K M n O
4
+ H 1 82 O
2
+ 3 H
2
S O
4
= K
2
S O
4
+ 2 M n S O
4
+ 3 1 8 O
2
+ 4 H
2
O
7. 下列物质结构与性质或物质性质与用途具有对应关系的是( )
A. S具有还原性,可用于制造黑火药
B. N
2
分子中存在 N N 键,N 的沸点比
2
O
2
低
C. Se是非金属元素,可以用于制作半导体材料
D. H O分子中O上有孤对电子对,可与H+形成配位键
2
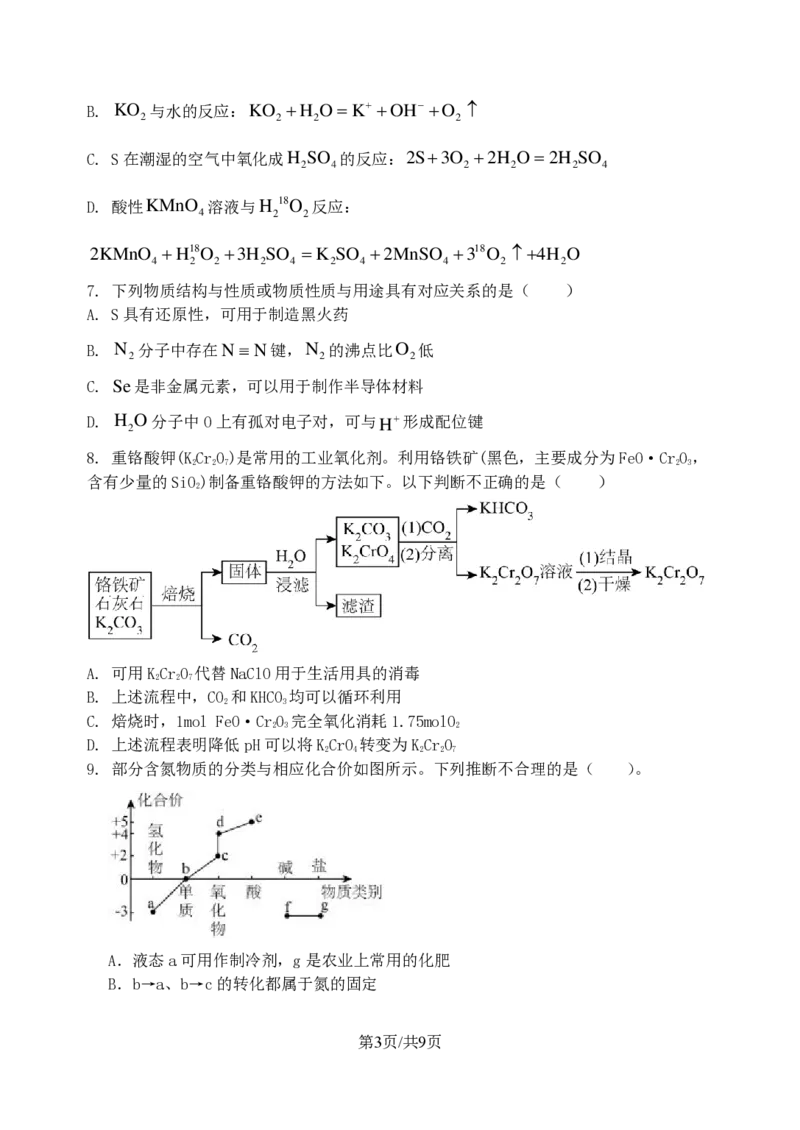
8. 重铬酸钾(KCrO)是常用的工业氧化剂。利用铬铁矿(黑色,主要成分为FeO·CrO,
2 2 7 2 3
含有少量的SiO)制备重铬酸钾的方法如下。以下判断不正确的是( )
2
A. 可用KCrO 代替NaClO用于生活用具的消毒
2 2 7
B. 上述流程中,CO 和KHCO 均可以循环利用
2 3
C. 焙烧时,1mol FeO·CrO 完全氧化消耗1.75molO
2 3 2
D. 上述流程表明降低pH可以将KCrO 转变为KCrO
2 4 2 2 7
9. 部分含氮物质的分类与相应化合价如图所示。下列推断不合理的是( )。
A.液态a可用作制冷剂,g是农业上常用的化肥
B.b→a、b→c的转化都属于氮的固定
{#{QQABKQYAogCgApBAAAgCUwE4CgCQkBEAAagOAFAMIAAAiRFABCA=}#}C.工业上由b出发制备e的路线:
D.足量e的稀溶液与6.4g铜粉反应时,可以生成4.48L气体d
10. 苯并唑酮类化合物X常用于植物保护剂,结构如图。关于X的说法错误的是
..
( )
A. 分子中所有原子不可能全部共面
B. 能使酸性高锰酸钾溶液褪色,但不能使溴水褪色
C. X与足量
第4页/共9页
学科网(北京)股份有限公司
H
2
加成后所得产物分子中手性碳原子数目为4个
D. 1mol X与足量NaOH溶液充分反应,最多可消耗4molNaOH
11. 下列实验操作及现象不能得到相应结论的是( )
选
实验操作及现象 结论
项
将乙醇与浓硫酸的混合物加热至170℃,并将产生的气体
乙醇发生了消
A 干燥后通入少量溴的四氯化碳溶液中,溴的四氯化碳溶
去反应
液褪色
向淀粉溶液中先加入稀硫酸并加热,再加入碘水,溶液 淀粉未发生水
B
变蓝 解或部分水解
铜与稀HNO
3
向稀HNO 溶液中加入铜片并加热,试管口观察到红棕色
3
C 溶液反应生成
气体
NO
2
向浓度均为0.1 mol·L-1的NaCl、NaI混合溶液中滴加1~2 K (AgCl)>
sp
D
滴0.01 mol·L-1的AgNO 溶液,产生黄色沉淀 K (AgI)
3 sp
A.A B.B C.C D.D
{#{QQABKQYAogCgApBAAAgCUwE4CgCQkBEAAagOAFAMIAAAiRFABCA=}#}12. 下列对有关事实的解释中正确的是( )
A.常温下,浓硝酸、浓硫酸均可用铝槽贮存,说明铝既不与浓硝酸反应也不与浓硫酸反
应
B.SiO 可与NaOH溶液反应,也可与氢氟酸反应,说明SiO 为两性氧化物
2 2
C.浓硝酸在光照条件下颜色变黄,说明浓硝酸不稳定且见光容易分解
D.Fe与稀HNO 、稀
3
第5页/共9页
学科网(北京)股份有限公司
H
2
S O
4
反应均有气泡产生,说明Fe与两种酸均发生了置换反应
13.NaOH活化过的 P t / T i O
2
催化剂对甲醛氧化为 C O
2
具有较好的催化效果,有学者提出
该催化反应的机理如下。下列说法不正确的是( )
A. 步骤Ⅰ中存在非极性键的断裂
B. 步骤Ⅰ可理解为HCHO中带部分负电荷的O与催化剂表面的-OH发生作用
催化剂
C. 步骤Ⅱ中发生的反应可表示为HCOOH CO+H O
2
D. 该催化剂对苯的催化氧化效果优于对HCHO的催化氧化效果
{#{QQABKQYAogCgApBAAAgCUwE4CgCQkBEAAagOAFAMIAAAiRFABCA=}#}第Ⅰ卷 (选择题 共61分)
二、非选择题:共4题,61分。
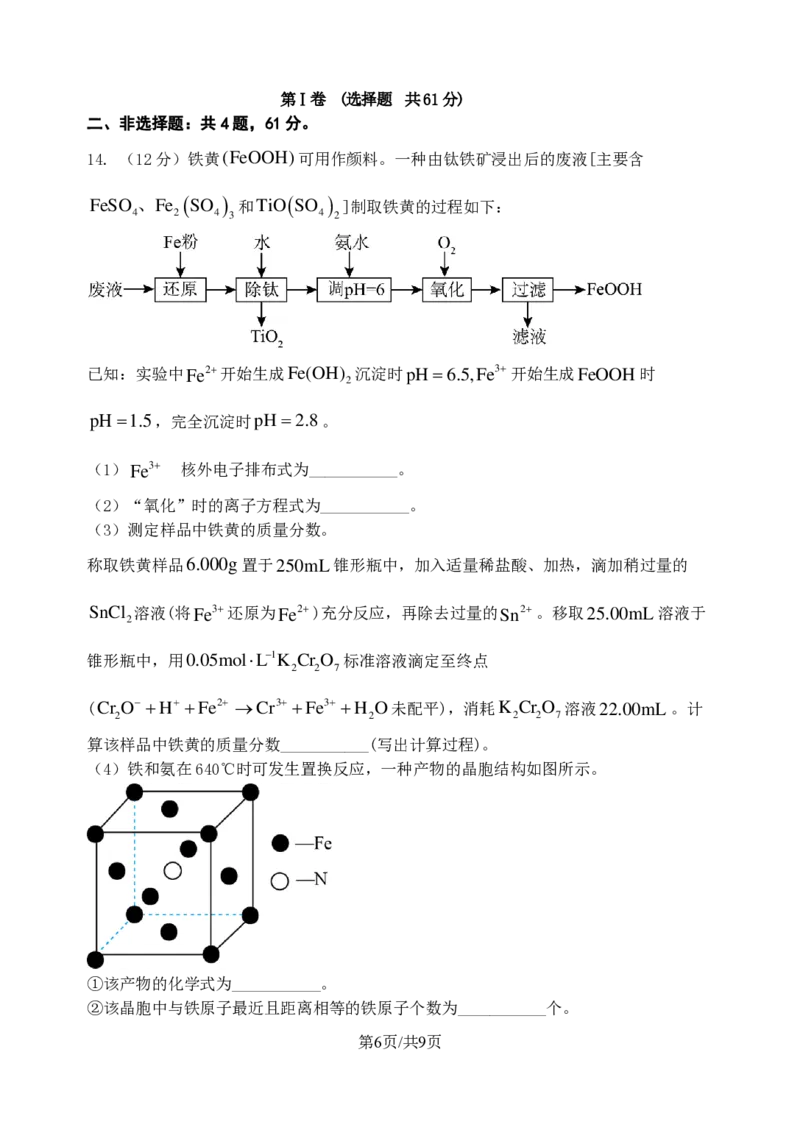
14. (12分)铁黄(FeOOH)可用作颜料。一种由钛铁矿浸出后的废液[主要含
第6页/共9页
学科网(北京)股份有限公司
F e S O 、4 F e
2
( S O
4
)
3
和 T i O ( S O
4
)
2
]制取铁黄的过程如下:
已知:实验中 F e 2 + 开始生成 F e ( O H )
2
沉淀时 p H = 6 .5 , F e 3 + 开始生成 F e O O H 时
p H = 1 . 5 ,完全沉淀时 p H = 2 .8 。
(1) F e 3 + 核外电子排布式为___________。
(2)“氧化”时的离子方程式为___________。
(3)测定样品中铁黄的质量分数。
称取铁黄样品 6 . 0 0 0 g 置于 2 5 0 m L 锥形瓶中,加入适量稀盐酸、加热,滴加稍过量的
S n C l
2
溶液(将 F e 3 + 还原为 F e 2 + )充分反应,再除去过量的Sn2+。移取 2 5 .0 0 m L 溶液于
锥形瓶中,用 0 . 0 5 m o l L − 1 K
2
C r
2
O
7
标准溶液滴定至终点
( C r
2
O − + H + + F e 2 + → C r 3 + + F e 3 + + H
2
O 未配平),消耗 K
2
C r
2
O
7
溶液 2 2 .0 0 m L 。计
算该样品中铁黄的质量分数___________(写出计算过程)。
(4)铁和氨在640℃时可发生置换反应,一种产物的晶胞结构如图所示。
①该产物的化学式为___________。
②该晶胞中与铁原子最近且距离相等的铁原子个数为___________个。
的
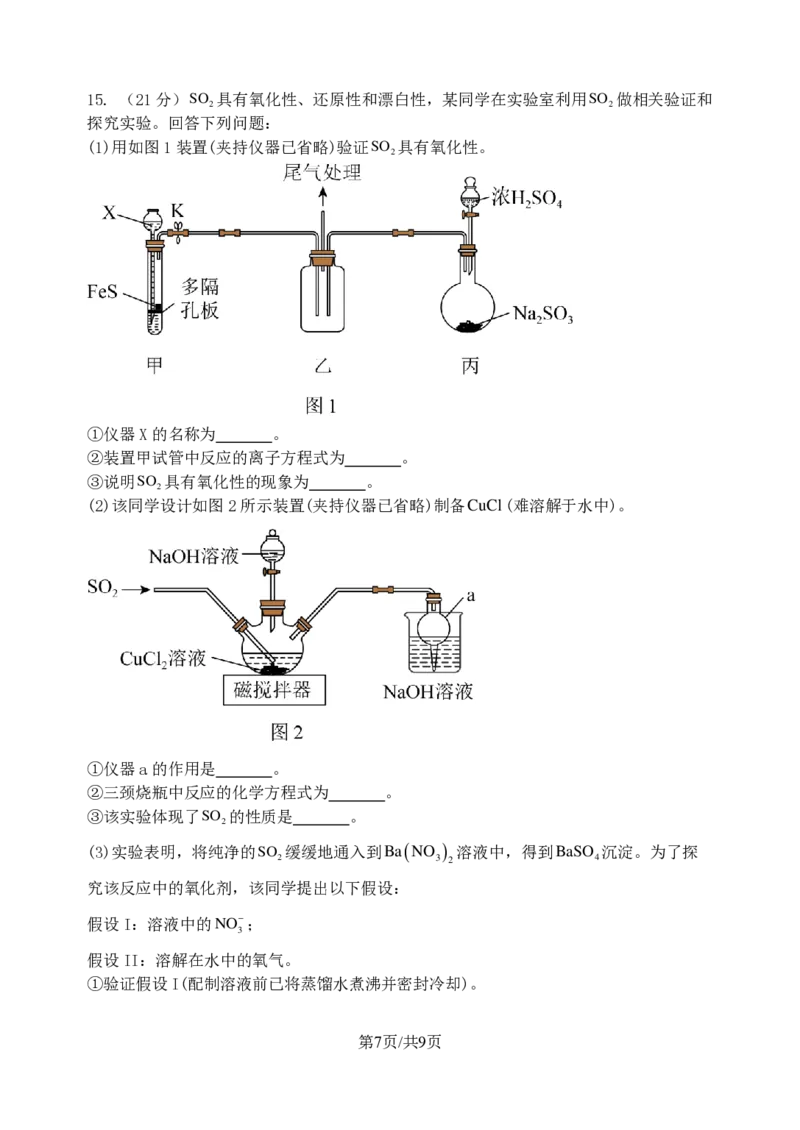
{#{QQABKQYAogCgApBAAAgCUwE4CgCQkBEAAagOAFAMIAAAiRFABCA=}#}15. (21分)
第7页/共9页
学科网(北京)股份有限公司
S O
2
具有氧化性、还原性和漂白性,某同学在实验室利用 S O
2
做相关验证和
探究实验。回答下列问题:
(1)用如图1装置(夹持仪器已省略)验证 S O
2
具有氧化性。
①仪器X的名称为 。
②装置甲试管中反应的离子方程式为 。
③说明 S O
2
具有氧化性的现象为 。
(2)该同学设计如图2所示装置(夹持仪器已省略)制备 C u C l (难溶解于水中)。
①仪器a的作用是 。
②三颈烧瓶中反应的化学方程式为 。
③该实验体现了SO 的性质是 。
2
(3)实验表明,将纯净的SO 缓缓地通入到Ba(NO ) 溶液中,得到BaSO 沉淀。为了探
2 3 2 4
究该反应中的氧化剂,该同学提出以下假设:
假设I:溶液中的NO−;
3
假设II:溶解在水中的氧气。
①验证假设I(配制溶液前已将蒸馏水煮沸并密封冷却)。
{#{QQABKQYAogCgApBAAAgCUwE4CgCQkBEAAagOAFAMIAAAiRFABCA=}#}实验步 实验现
实验操作 结论
骤 象
实验ⅰ 向
第8页/共9页
学科网(北京)股份有限公司
B a C l
2
溶液中缓慢通入纯净的SO 气体
2
假设I成
立 向
实验ⅱ
B a ( N O
3
)
2
溶液的烧杯中缓慢通入纯净的 S O
2
气体
实验ⅰ现象为 ,实验ⅱ的现象为 。
②验证假设II.请完成下列表格:
实验步骤 实验现象 实验目的
实验ⅲ 同实验ⅰ步骤 同实验ⅰ的相关现象 作对照实验
实验ⅳ 产生白色沉淀
实验iv的步骤为 ,实验目的是 。
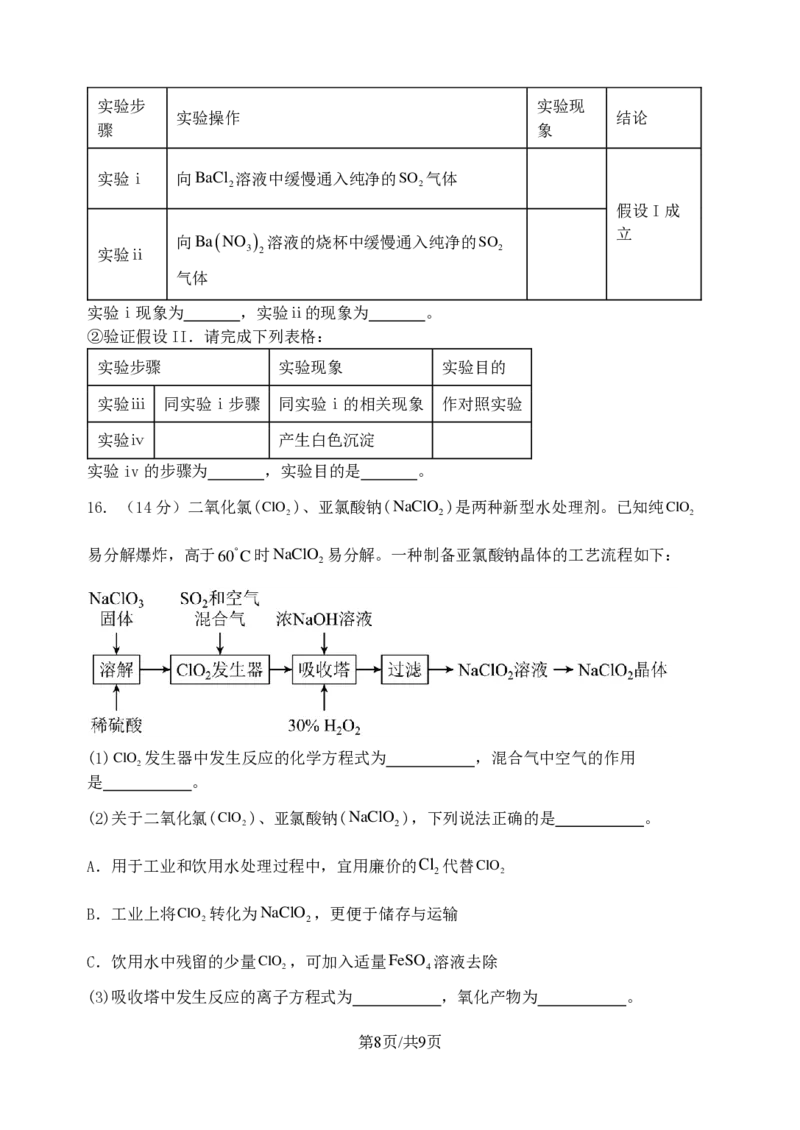
16. (14分)二氧化氯( C lO
2
)、亚氯酸钠( N a C lO
2
)是两种新型水处理剂。已知纯 C lO
2
易分解爆炸,高于60C时NaClO 易分解。一种制备亚氯酸钠晶体的工艺流程如下:
2
(1) C lO
2
发生器中发生反应的化学方程式为 ,混合气中空气的作用
是 。
(2)关于二氧化氯(ClO )、亚氯酸钠(
2
N a C lO
2
),下列说法正确的是 。
A.用于工业和饮用水处理过程中,宜用廉价的Cl 代替
2
C lO
2
B.工业上将ClO 转化为
2
N a C lO
2
,更便于储存与运输
C.饮用水中残留的少量ClO ,可加入适量FeSO 溶液去除
2 4
(3)吸收塔中发生反应的离子方程式为 ,氧化产物为 。
{#{QQABKQYAogCgApBAAAgCUwE4CgCQkBEAAagOAFAMIAAAiRFABCA=}#}(4)吸收塔中要严格控制温度低于20C,目的是 。
(5)每生成
第9页/共9页
学科网(北京)股份有限公司
1 m o lN a C lO
2
,理论上需消耗标准状态下 S O
2
的体积为 L。
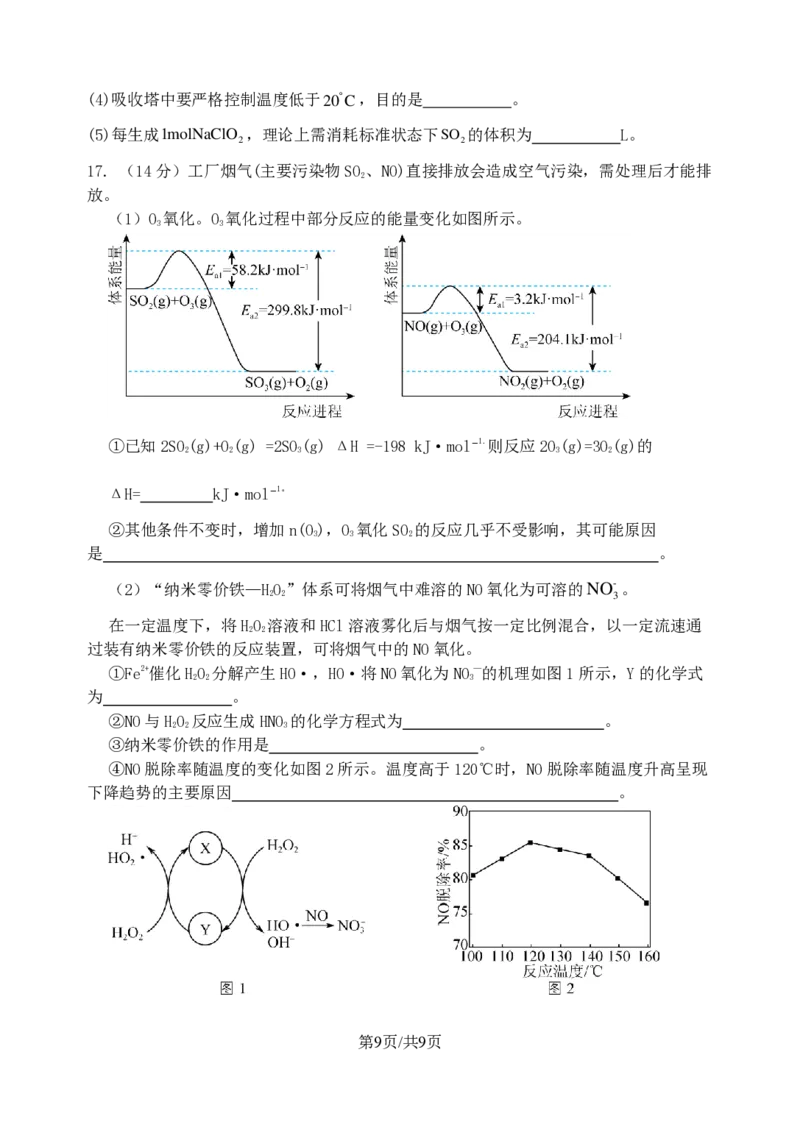
17. (14分)工厂烟气(主要污染物SO、NO)直接排放会造成空气污染,需处理后才能排
2
放。
(1)O 氧化。O 氧化过程中部分反应的能量变化如图所示。
3 3
①已知2SO(g)+O(g) =2SO(g) ΔH =-198 kJ·mol−1.则反应2O(g)=3O(g)的
2 2 3 3 2
ΔH= kJ·mol−1。
②其他条件不变时,增加n(O),O 氧化SO 的反应几乎不受影响,其可能原因
3 3 2
是 。
(2)“纳米零价铁—HO”体系可将烟气中难溶的NO氧化为可溶的
2 2
N O -3 。
在一定温度下,将HO 溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通
2 2
过装有纳米零价铁的反应装置,可将烟气中的NO氧化。
①Fe2+催化HO 分解产生HO·,HO·将NO氧化为NO—的机理如图1所示,Y的化学式
2 2 3
为 。
②NO与HO 反应生成HNO 的化学方程式为 。
2 2 3
③纳米零价铁的作用是 。
④NO脱除率随温度的变化如图2所示。温度高于120℃时,NO脱除率随温度升高呈现
下降趋势的主要原因 。
{#{QQABKQYAogCgApBAAAgCUwE4CgCQkBEAAagOAFAMIAAAiRFABCA=}#}