文档内容
盐城市 2025 届高三年级第一学期期中考试
化学试题
注意事项:
1.本试卷考试时间为75分钟,试卷满分100分,考试形式闭卷;
2.本试卷中所有试题必须作答在答题卡上规定的位置,否则不给分;
3.答题前,务必将自己的学校、班级、姓名用0.5毫米黑色墨水的签字笔填写在答题卡上。
可能用到的相对原子质量:H 1 O 16 Cl 35.5 K 39 Cr 52 Fe 56 Cu 64
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1.我国探月工程取得重大进展。月壤中含有 、 、 ,下列关于三种微粒说法正确的是(
)
A.是同一种核素 B.是同一种原子
C.互为同位素 D.是不同种元素
2.反应 ,可用于吸收溴。下列说法正确的是( )
A.基态Br原子的价电子排布式 B. 中既含离子键又含共价键
C. 的结构示意图为 D. 的空间构型为直线形
3.实验室利用以下装置制备 。下列相关原理、装置及操作正确的是( )
A.制取 B.
C.分离 D.制取
4.铝铵矾 是一种重要的工业原料。下列说法正确的是( )
A.键角: B.半径:C.沸点: D.电负性:
阅读下列材料,完成5~7题:
氯及其化合物应用广泛。 在化学工业上用于生产 、 、 等化工产品,实验室可
由 与㳖盐酸共热得到;NaCl是制备氯气、纯碱的主要原料;HCl是“洁厕灵”的主要成分,也可与
反应制备 [ ]; 溶液可用于刻蚀覆
钢板; 、次氯酸盐可用于自来水消毒,在稀硫酸和 的混合溶液中通入 气体可制得
。
5.下列说法正确的是( )
A.Fe在少量 中燃烧生成
B.一旦发现氯气泄漏,可用蘸有肥皂水的湿毛巾捂住口鼻自救
C. 与HCl反应中,催化剂 能减小该反应的焓变
D. 与HCl反应中,增大压强或升高温度均能提高HCl的转化率
6.下列反应的方程式表示正确的是( )
A.用“洁厕灵”清除污垢中的碳酸钙:
B.侯氏制碱法:
C. 与浓盐酸共热制
D.制取
7.下列物质的性质与用途具有对应关系的是( )
A. 具有挥发性,可用于萃取碘水中碘 B.盐酸有强酸性,可用于除去铁锈
C. 易水解,可用于刻蚀覆铜板 D.HClO不稳定,可用于自来水消毒剂
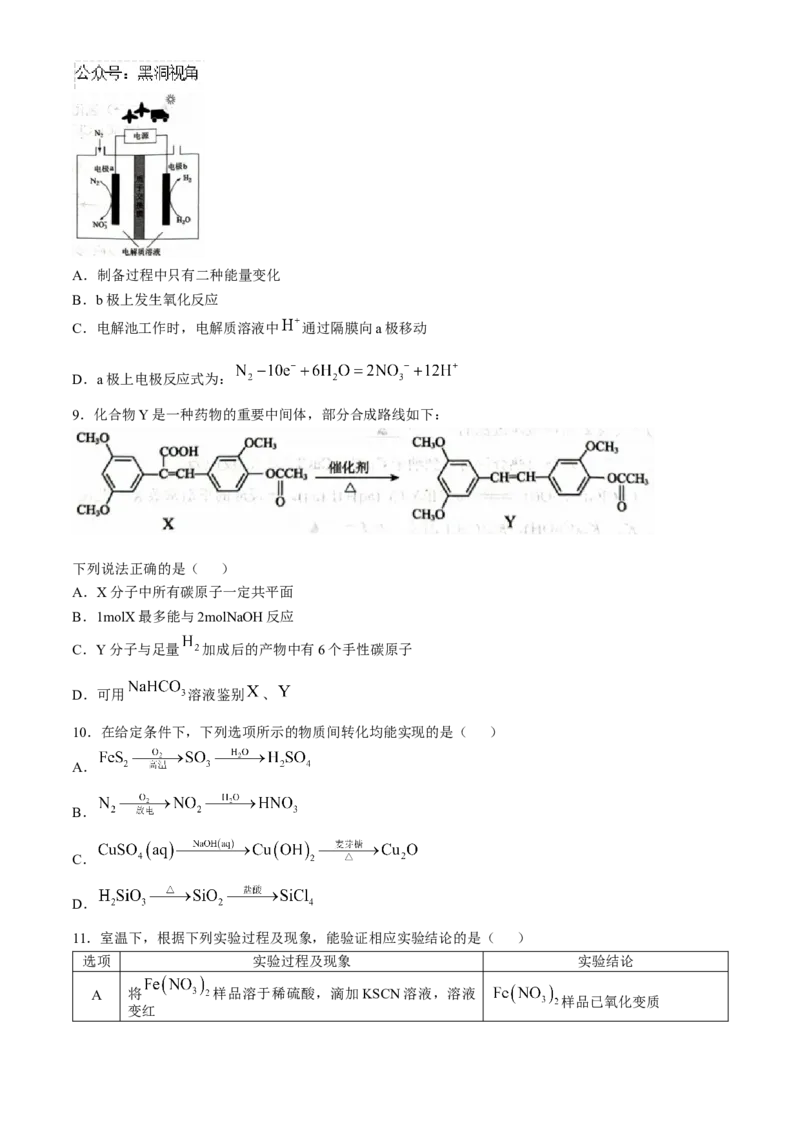
8.研究表明可以用电解法以 为氮源直接制备 ,其原理示意如图所示。下列叙述正确的是
( )A.制备过程中只有二种能量变化
B.b极上发生氧化反应
C.电解池工作时,电解质溶液中 通过隔膜向a极移动
D.a极上电极反应式为:
9.化合物Y是一种药物的重要中间体,部分合成路线如下:
下列说法正确的是( )
A.X分子中所有碳原子一定共平面
B.1molX最多能与2molNaOH反应
C.Y分子与足量 加成后的产物中有6个手性碳原子
D.可用 溶液鉴别 、
10.在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.
B.
C.
D.
11.室温下,根据下列实验过程及现象,能验证相应实验结论的是( )
选项 实验过程及现象 实验结论
A 将 样品溶于稀硫酸,滴加KSCN溶液,溶液
样品已氧化变质
变红室温下,用pH计测量醋酸溶液、盐酸的pH,比较溶液
B
pH大小 是弱电解质
C 溴乙烷与NaOH溶液共热后,滴加 溶液,未出 溴乙烷未发生水解
现淡黄色沉淀
将 溶液滴入 NaOH溶液中至不再有
D
沉淀产生,再滴加 溶液,先有白色沉
淀生成,后变为浅蓝色沉淀。
12.室温下,通过下列实验探究 的性质。已知 、 。
实验1: 溶液,测得溶液 。
实验2:将等浓度 、 的溶液等体积混合,测得溶液 。
实验3:向 溶液中加入 溶液,有白色沉淀生成。
下列说法正确的是( )
A.实验1所得溶液中:
B.实验2所得溶液中:
C.实验2所得溶液中:
D.实验3所得上层清液中:
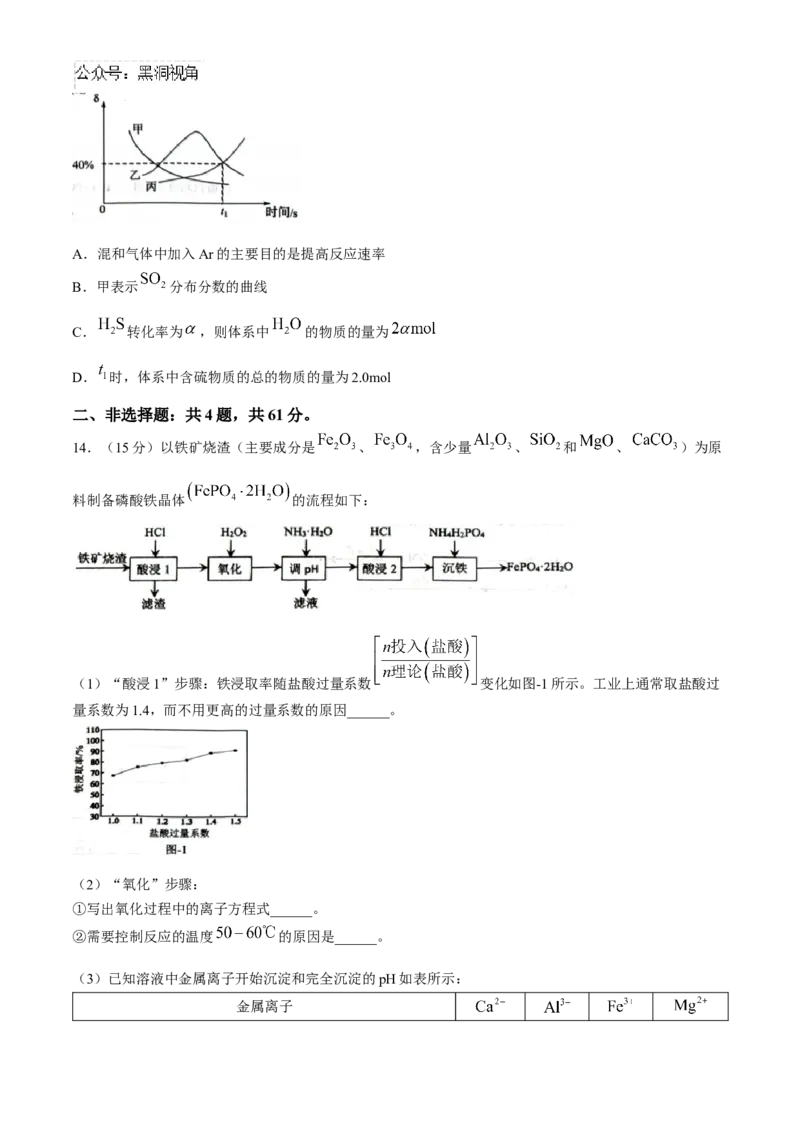
13.天然气开采过程中产生大量的含硫废气(硫元素的主要存在形式为 ),需要回收处理并加以利用,
有关反应如下:
恒压条件下,向密闭容器中充入 、 、 。若仅考虑上述反应,反应过程中含硫
物种的分布分数 [如: ]随时间变化如图所示。下列说法正确的是(
)A.混和气体中加入Ar的主要目的是提高反应速率
B.甲表示 分布分数的曲线
C. 转化率为 ,则体系中 的物质的量为
D. 时,体系中含硫物质的总的物质的量为2.0mol
二、非选择题:共4题,共61分。
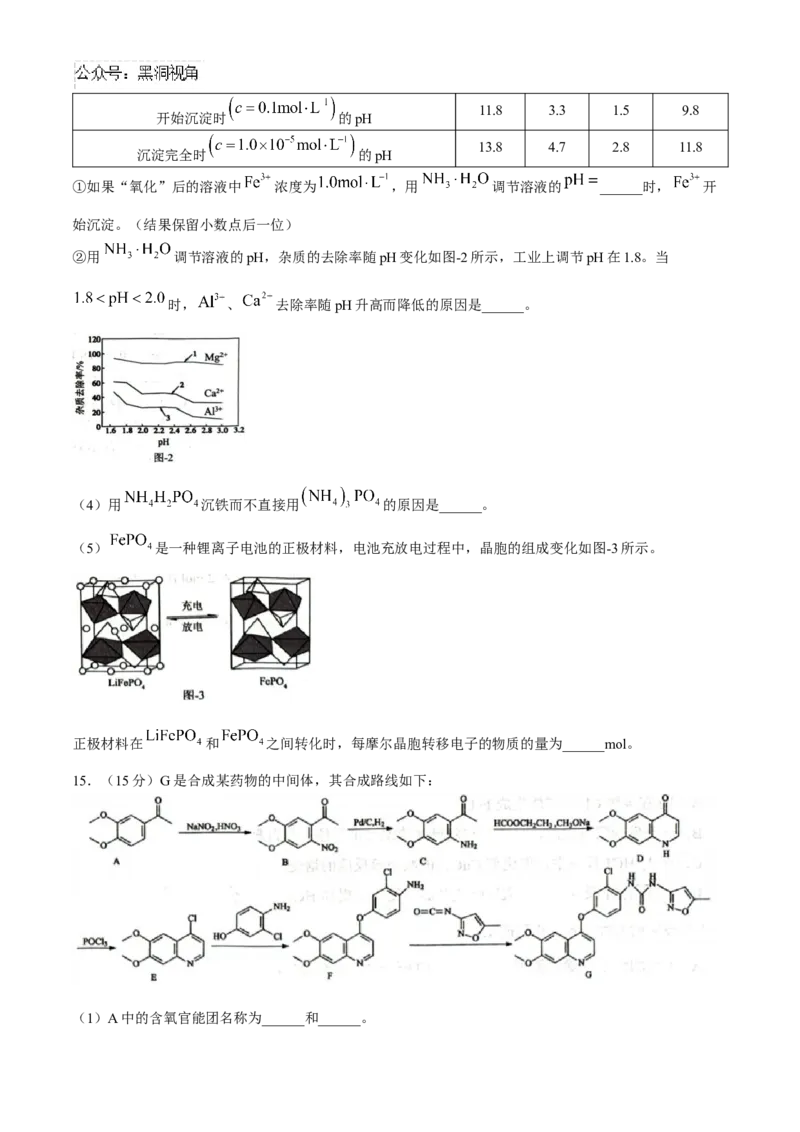
14.(15分)以铁矿烧渣(主要成分是 、 ,含少量 、 和 、 )为原
料制备磷酸铁晶体 的流程如下:
(1)“酸浸1”步骤:铁浸取率随盐酸过量系数 变化如图-1所示。工业上通常取盐酸过
量系数为1.4,而不用更高的过量系数的原因______。
(2)“氧化”步骤:
①写出氧化过程中的离子方程式______。
②需要控制反应的温度 的原因是______。
(3)已知溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
金属离子11.8 3.3 1.5 9.8
开始沉淀时 的pH
13.8 4.7 2.8 11.8
沉淀完全时 的pH
①如果“氧化”后的溶液中 浓度为 ,用 调节溶液的 ______时, 开
始沉淀。(结果保留小数点后一位)
②用 调节溶液的pH,杂质的去除率随pH变化如图-2所示,工业上调节pH在1.8。当
时, 、 去除率随pH升高而降低的原因是______。
(4)用 沉铁而不直接用 的原因是______。
(5) 是一种锂离子电池的正极材料,电池充放电过程中,晶胞的组成变化如图-3所示。
正极材料在 和 之间转化时,每摩尔晶胞转移电子的物质的量为______mol。
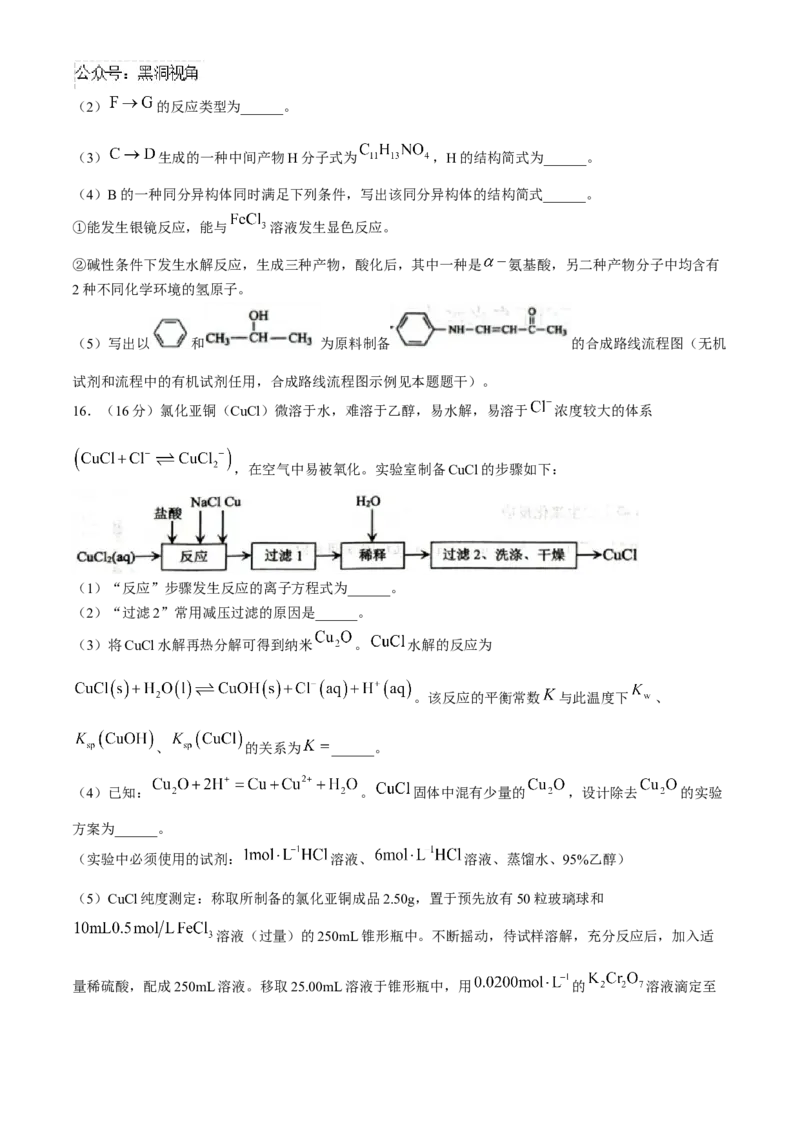
15.(15分)G是合成某药物的中间体,其合成路线如下:
(1)A中的含氧官能团名称为______和______。(2) 的反应类型为______。
(3) 生成的一种中间产物H分子式为 ,H的结构简式为______。
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式______。
①能发生银镜反应,能与 溶液发生显色反应。
②碱性条件下发生水解反应,生成三种产物,酸化后,其中一种是 氨基酸,另二种产物分子中均含有
2种不同化学环境的氢原子。
(5)写出以 和 为原料制备 的合成路线流程图(无机
试剂和流程中的有机试剂任用,合成路线流程图示例见本题题干)。
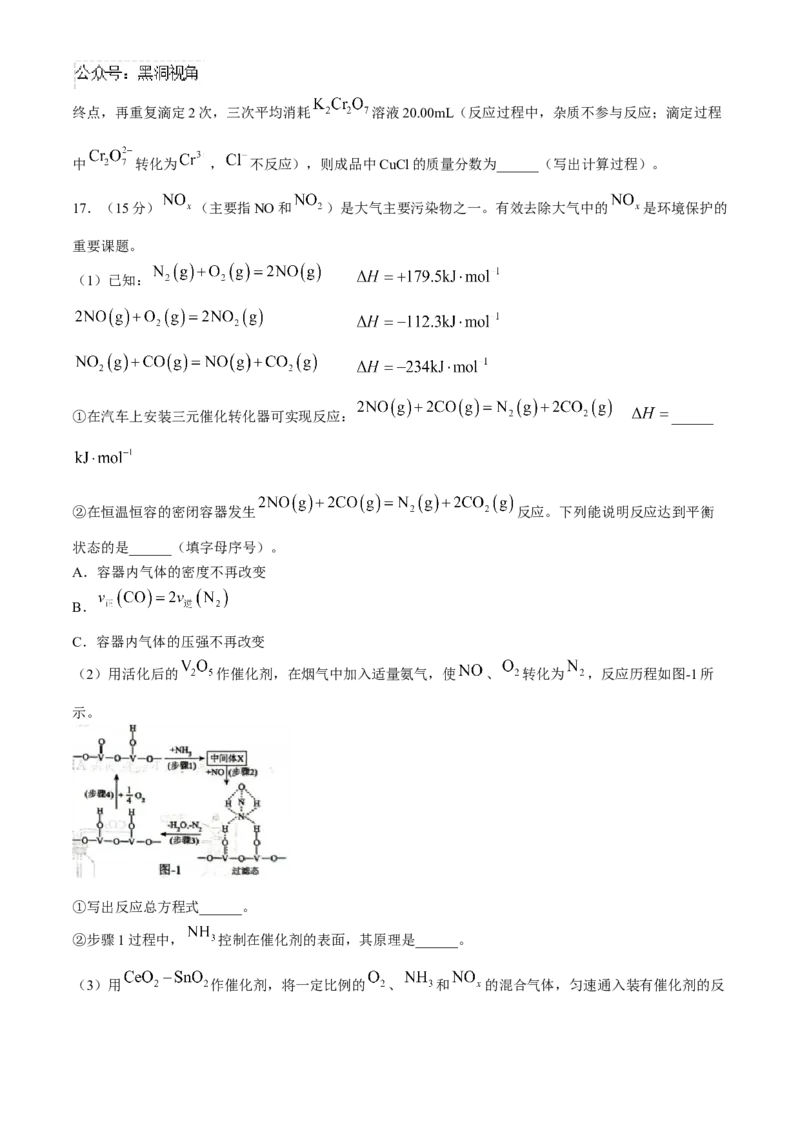
16.(16分)氯化亚铜(CuCl)微溶于水,难溶于乙醇,易水解,易溶于 浓度较大的体系
,在空气中易被氧化。实验室制备CuCl的步骤如下:
(1)“反应”步骤发生反应的离子方程式为______。
(2)“过滤2”常用减压过滤的原因是______。
(3)将CuCl水解再热分解可得到纳米 。 水解的反应为
。该反应的平衡常数 与此温度下 、
、 的关系为 ______。
(4)已知: 。 固体中混有少量的 ,设计除去 的实验
方案为______。
(实验中必须使用的试剂: 溶液、 溶液、蒸馏水、95%乙醇)
(5)CuCl纯度测定:称取所制备的氯化亚铜成品2.50g,置于预先放有50粒玻璃球和
溶液(过量)的250mL锥形瓶中。不断摇动,待试样溶解,充分反应后,加入适
量稀硫酸,配成250mL溶液。移取25.00mL溶液于锥形瓶中,用 的 溶液滴定至终点,再重复滴定2次,三次平均消耗 溶液20.00mL(反应过程中,杂质不参与反应;滴定过程
中 转化为 , 不反应),则成品中CuCl的质量分数为______(写出计算过程)。
17.(15分) (主要指NO和 )是大气主要污染物之一。有效去除大气中的 是环境保护的
重要课题。
(1)已知:
①在汽车上安装三元催化转化器可实现反应: ______
②在恒温恒容的密闭容器发生 反应。下列能说明反应达到平衡
状态的是______(填字母序号)。
A.容器内气体的密度不再改变
B.
C.容器内气体的压强不再改变
(2)用活化后的 作催化剂,在烟气中加入适量氨气,使 、 转化为 ,反应历程如图-1所
示。
①写出反应总方程式______。
②步骤1过程中, 控制在催化剂的表面,其原理是______。
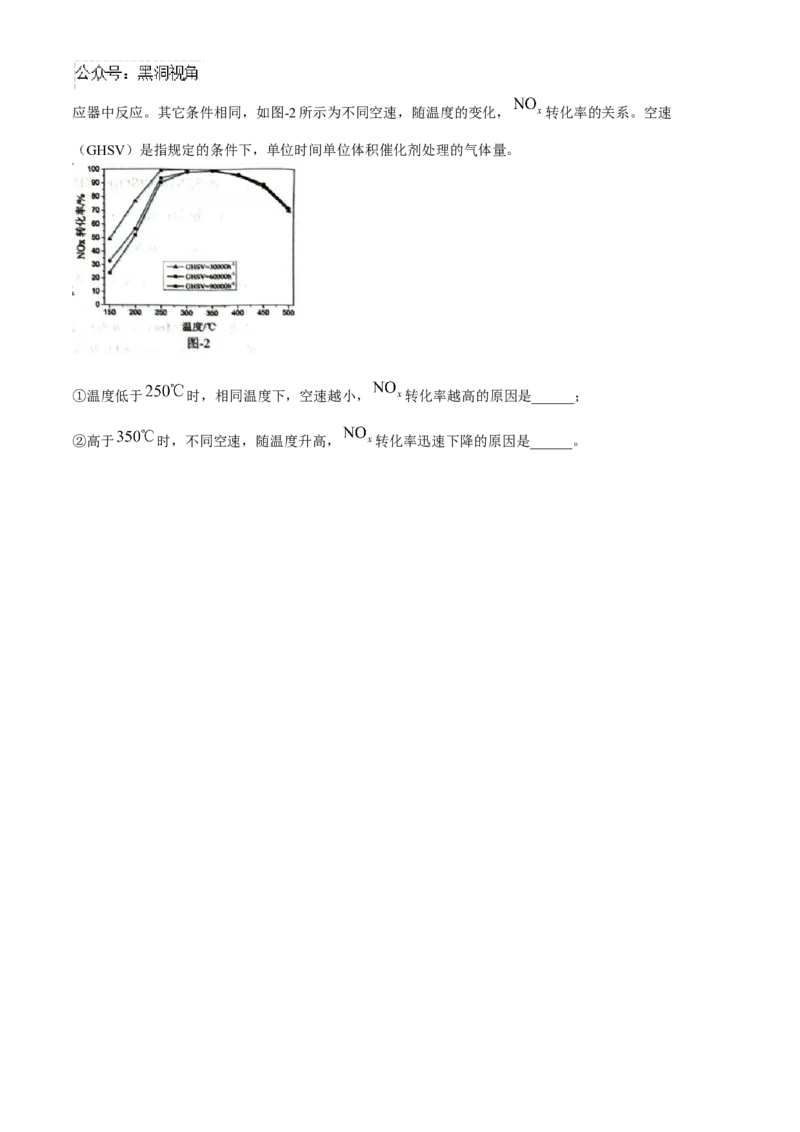
(3)用 作催化剂,将一定比例的 、 和 的混合气体,匀速通入装有催化剂的反应器中反应。其它条件相同,如图-2所示为不同空速,随温度的变化, 转化率的关系。空速
(GHSV)是指规定的条件下,单位时间单位体积催化剂处理的气体量。
①温度低于 时,相同温度下,空速越小, 转化率越高的原因是______;
②高于 时,不同空速,随温度升高, 转化率迅速下降的原因是______。盐城市 2025 届高三年级第一学期期中考试
化学试题参考答案
一、单项选择题:共13题,每题3分,共39分
1.C 2.A 3.B 4.A 5.B 6.D 7.B 8.D 9.D 10.C 11.D 12.C 13.C
二、非选择题:共4题,共61分
14.(15分)
(1)(2分)HCl过量系数1.4时,铁浸出率已经达到了 ,超过1.4时,铁浸出率提高不大(1分),
但消耗大量的HCl使成本过高,使其后续氨化除杂成本增加(1分)。
(2)① (2分)
②温度低,反应速率慢;温度高, 分解(2分)。
(3)①1.1或1.2(2分)
②当 ,随着pH增大, 、 水解产生的 、 胶体吸附 、
随铁沉淀下来(3分)。
(4) 溶液比 碱性强,生成 同时生成 沉淀,使产品纯度
降低。(2分)
(5)4(2分)
15.(15分)
(1)醚键、(酮)羰基(2分)
(2)加成反应(2分)
(3) 或 (3分)
(4) (3分)
(5)(5分)16.(16分)
(1) (2分)
(2)加快过滤的速度,防止CuCl在空气中被氧化。(2分)
(3) (2分)
(4)(5分)向所得的CuCl固体中滴加 溶液(1分),使固体充分溶解,过滤(1分),
向滤液中加水稀释至不再产生沉淀为止,过滤(1分)、用 溶液洗涤(1分)、再用 乙
醇洗涤、干燥(1分),得到纯净的CuCl固体。
(5)(5分)25mL溶液中: (1分)
(2分)
CuCl的质量分数为 (2分)
17.(15分)
(1)① (2分)
②BC(2分)
(2)① (3分)
②步骤1: 中N和 中的H,形成 氢键; 中H和 中的O形成
氢键(2分)
(3)①(3分)反应温度较低时,反应速率慢(1分)。此时空速越大,反应气体与催化剂的接触时间越
短,反应不够充分, 转化率越低。空速越小,反应气体与催化剂的接触时间长,反应充分, 转
化率越高(1分)。
②(3分)高于 时,温度升高,催化剂活性下降(1分); 与 反应生成了