文档内容
配套《高中必刷题 化学 必修第一册 LK》使用
第3章 物质的性质与转化
第1节 铁的多样性
课时1铁盐和亚铁盐
一、铁盐、亚铁盐的性质与检验
常见的铁盐有Fe (SO )、FeCl 等,常见的亚铁盐有FeSO 、FeCl 等。
2 4 3 3 4 2
1.与KSCN溶液的反应——Fe3+的检验
Fe2+ Fe3+
溶液的颜色 浅绿色 棕黄色
滴加KSCN溶液 无明显现象 溶液变红色
反应原理 不反应 Fe3++3SCN-===Fe(SCN)
3
应用 在含有Fe3+的盐溶液中滴加 KSCN 溶液 ,检验Fe3+的存在
2.实验探究Fe2+、Fe3+的性质
(1)从化合价角度预测Fe2+和Fe3+的性质
①Fe3+——能降低到 + 2 价或0 价,具有氧化性。
②
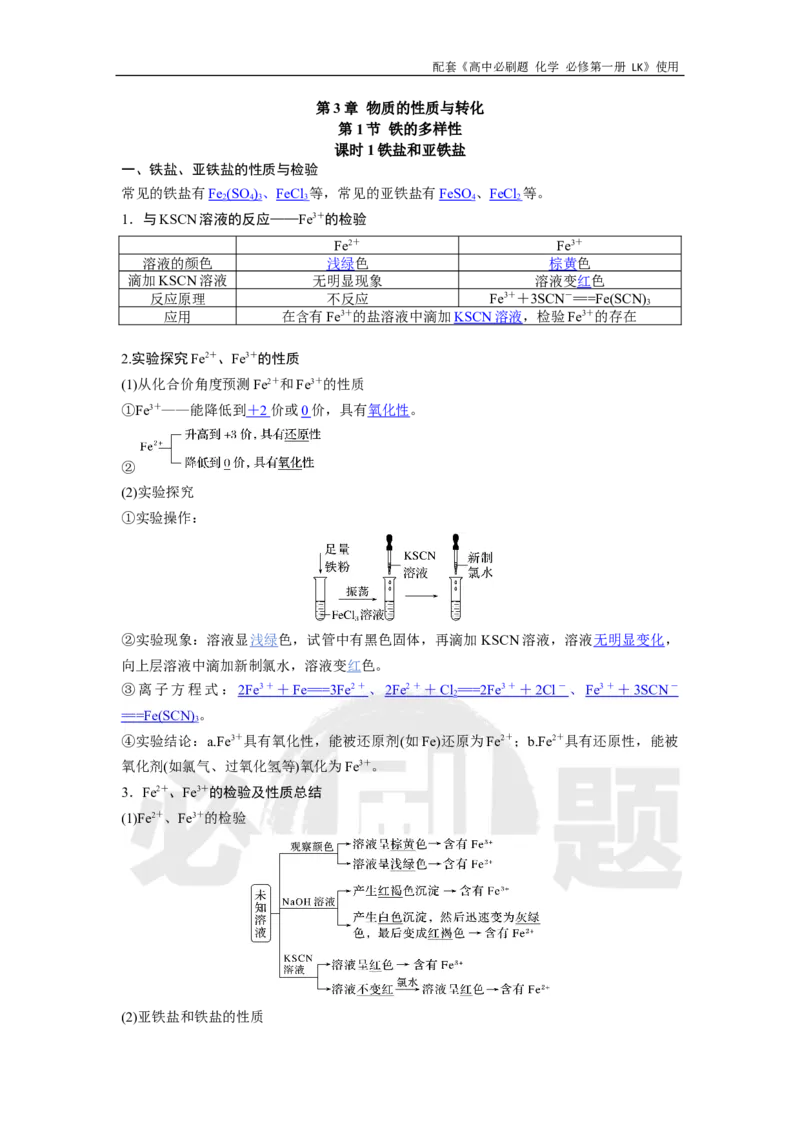
(2)实验探究
①实验操作:
②实验现象:溶液显浅绿色,试管中有黑色固体,再滴加KSCN溶液,溶液无明显变化,
向上层溶液中滴加新制氯水,溶液变红色。
③离子方程式: 2Fe 3 + + Fe == = 3Fe 2 + 、 2Fe 2 + + Cl == = 2Fe 3 + + 2Cl - 、 Fe 3 + + 3SCN -
2
== = Fe(SCN) 。
3
④实验结论:a.Fe3+具有氧化性,能被还原剂(如Fe)还原为Fe2+;b.Fe2+具有还原性,能被
氧化剂(如氯气、过氧化氢等)氧化为Fe3+。
3.Fe2+、Fe3+的检验及性质总结
(1)Fe2+、Fe3+的检验
(2)亚铁盐和铁盐的性质配套《高中必刷题 化学 必修第一册 LK》使用
混合溶液中Fe2+、Fe3+的检验
(1)Fe2+和Fe3+的混合溶液中检验Fe2+的方法
①通常向溶液中滴加适量酸性KMnO 溶液,溶液紫红色褪去,说明含有Fe2+(注意:Cl-等
4
还原性的离子对Fe2+的检验有干扰)。
②向溶液中加入K[Fe(CN) ]溶液,产生蓝色沉淀,说明含有Fe2+。
3 6
(2)Fe2+和Fe3+的混合溶液中检验Fe3+,可用KSCN试剂,现象为溶液变红。
二、Fe、Fe2+、Fe3+的转化关系及应用
1.Fe、Fe2+、Fe3+的转化关系
铁元素不同价态之间的转化需要通过氧化还原反应来实现,氧化剂、还原剂的强弱不同,
转化产物也不同。
价态变化 转化关系 反应方程式
0→+2 Fe→Fe2+ Fe+2H+=== Fe 2 + + H ↑
2
0→+3 Fe→Fe3+ 2Fe+3Cl=====2FeCl
2 3
Fe2+→Fe3+
2Fe2++Cl=== 2Fe 3 + + 2Cl -
2
+2→+3 Fe(OH) →
2
4Fe(OH) +O+2HO===4Fe(OH)
2 2 2 3
+2→0 Fe(OH)
3
FeO+CO===== Fe + CO
2
FeO→Fe
+3→0 Fe O→Fe 3CO+Fe O=====2Fe+3CO
2 3 2 3 2
+3→+2 Fe3+→Fe2+ 2Fe3++Fe=== 3Fe 2 +