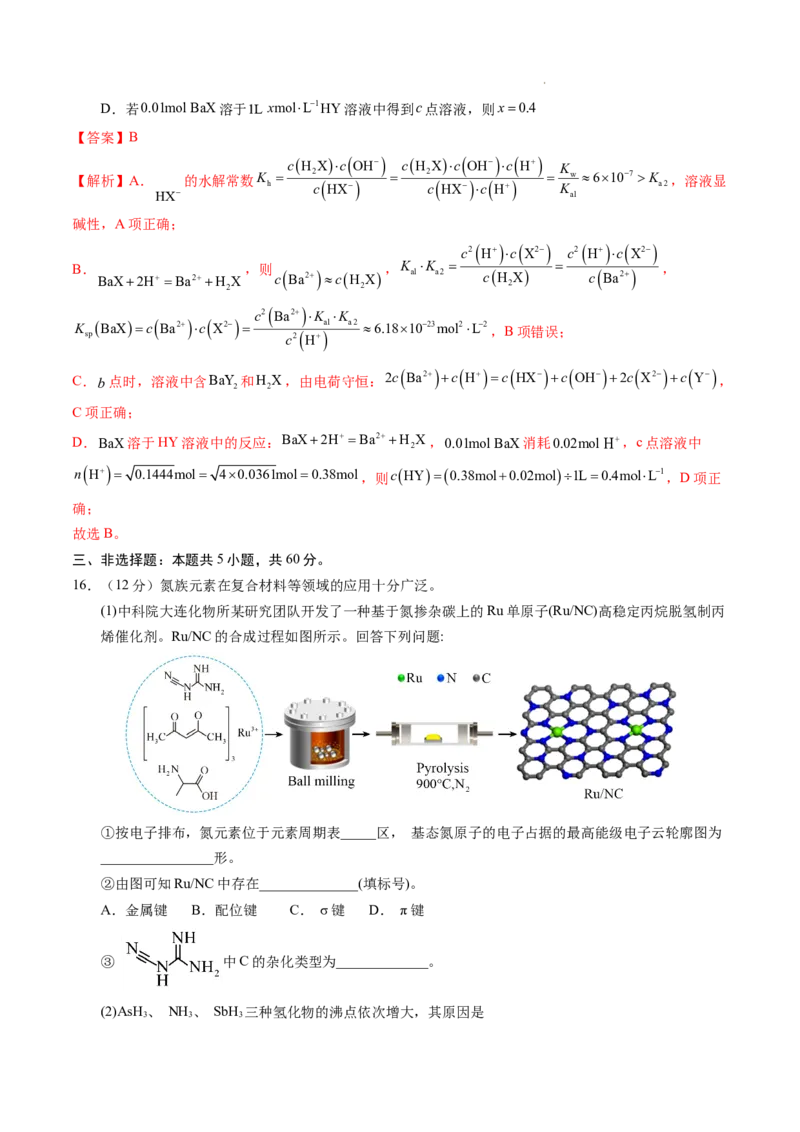
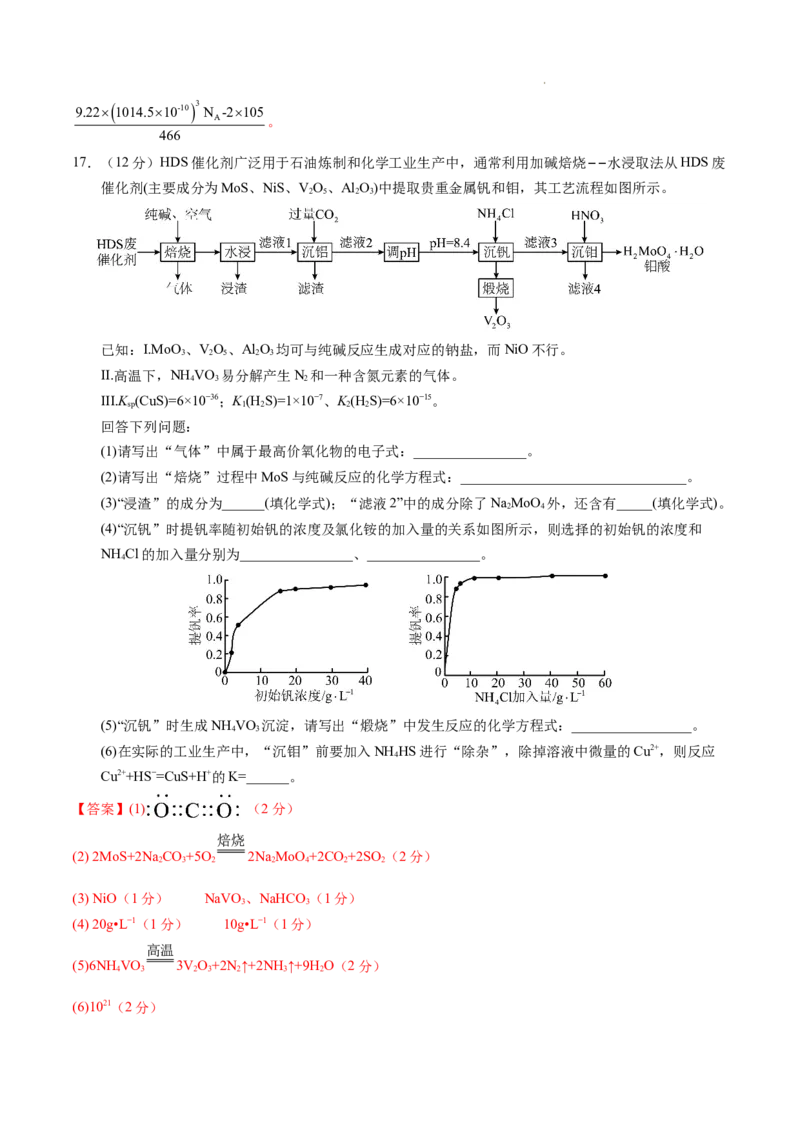
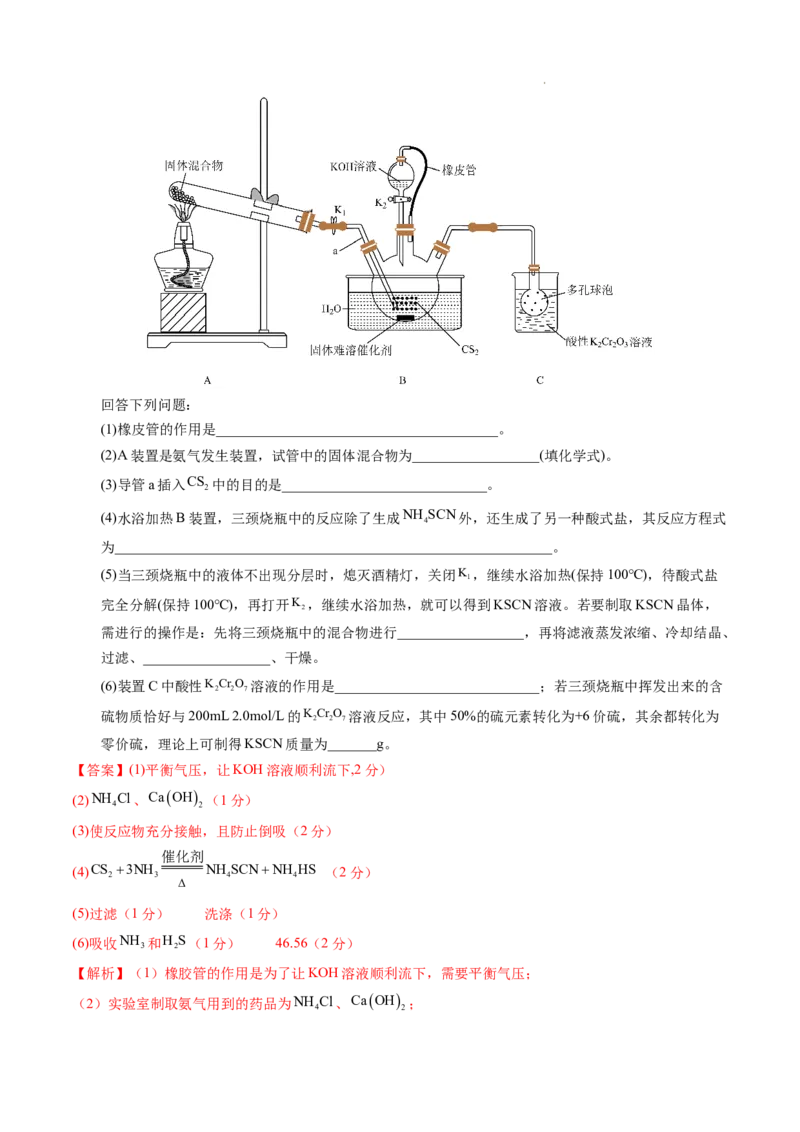
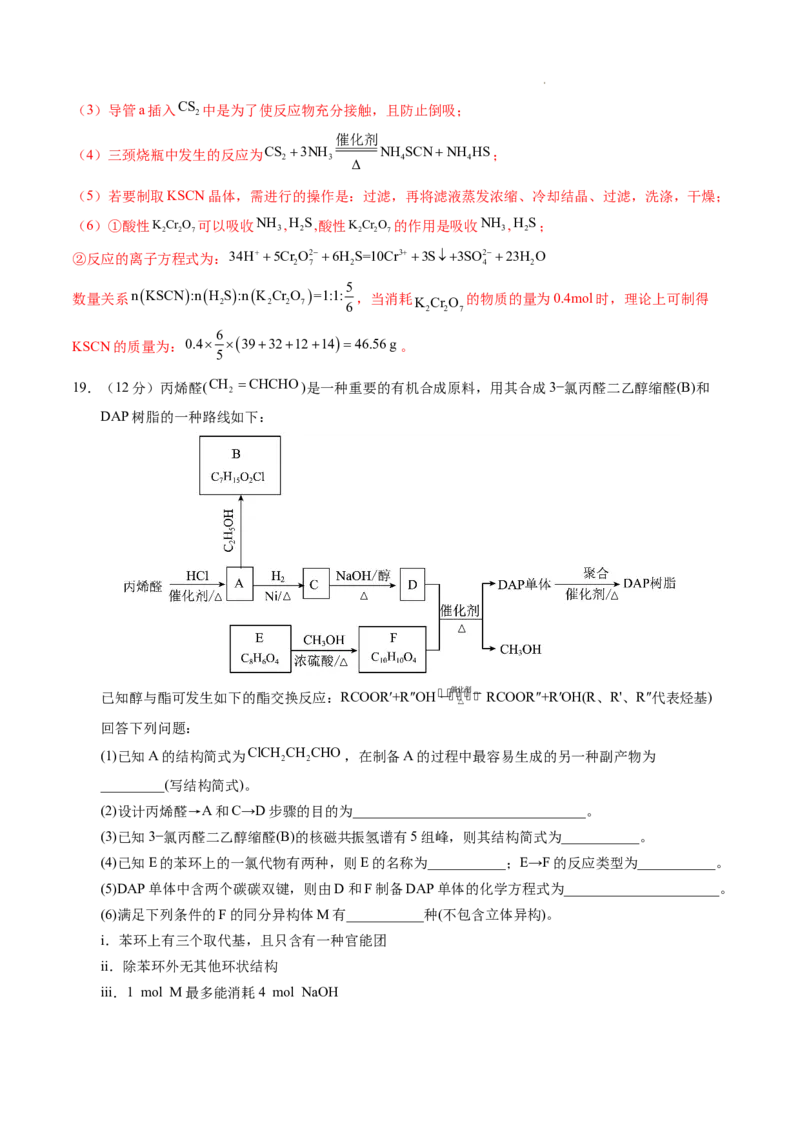
文档内容
2023 年高考考前押题密卷(山东卷)
化学·全解全析
本卷满分100分,考试时间90分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改动,用橡
皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 P 31 S 32 K 39
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.山东历史悠久,文化底蕴深厚,是中华文明的发祥地之一。下列有关叙述正确的是
A.图甲文物玉璧的主要成分是CaCO
3
B.图乙文物表面的绿色物质可用饱和NH Cl溶液除去
4
C.图丙中演员挥舞的丝绸主要成分为纤维素
D.图丁中山东剪纸的材料遇水迅速水解
【答案】B
【解析】A.玉璧主要成分是SiO 、Al O 等,故A错误;
2 2 3
B.图乙文物的主要成分是铜的合金,表面绿色物质是碱式碳酸铜,碱式碳酸铜易溶于酸性溶液,可以用
饱和氯化铵溶液除去,故B正确;
C.丝绸的主要成分是蛋白质,故C错误;
D.纸的成分是纤维素,水解缓慢且需要一定条件,故D错误;
选B。
2.拟在实验室完成一系列实验:①粗盐提纯;②利用提纯后的NaCl模拟“侯氏制碱法”制备纯碱;③用
盐酸标准液滴定纯碱溶液以测定NaCO 含量。在实验过程中,下列仪器不可能用到的是
2 3
学科网(北京)股份有限公司A. B. C. D.
【答案】D
【解析】A.粗盐提纯中需要过滤操作,能用到漏斗,故A不符合题意;
B.模拟“侯氏制碱法”制备纯碱需要向溶有氨气的饱和食盐水中通入二氧化碳生成小苏打,需要B装置,
故B不符合题意;
C.用盐酸标准液滴定纯碱溶液以测定NaCO 含量,需要使用酸式滴定管,故C不符合题意;
2 3
D.系列实验中没有使用到冷凝管,故D符合题意;
故选D。
3.下列说法正确的是
A.二氧化硫气体能用浓硫酸干燥,是因为二氧化硫无还原性
B.由于四水合铜离子
CuH 2 O 4
2
为蓝色,则铜盐溶液均为蓝色
C.可向食盐溶液中滴加淀粉溶液,观察是否变蓝,判断食盐中是否加碘
D.植物油中含有碳碳双键,具有还原性,能使酸性高锰酸钾溶液褪色
【答案】D
【解析】A.二氧化硫具有还原性,但不能被浓硫酸氧化,选项A错误;
B.氯化铜溶液中含有CuCl 2 ,CuCl 2 是黄色的,CuCl 溶液由于同时含有[Cu(H O) ]2+和CuCl 2
4 4 2 2 4 4
以及Cl和H
2
O的混合配离子,通常为黄绿色或绿色,选项B错误;
C.食盐中含有碘酸钾,不能使淀粉变蓝,选项C错误;
D.植物油中含有碳碳双键,具有还原性,能发生氧化反应,使酸性高锰酸钾溶液褪色,选项D正确;
答案选D。
4.铁铝铅榴石主要成分为Fe Al Pb SiO ,其组成也可写成的氧化物形式:Fe O Al O 3PbO5SiO 。
3 2 3 4 5 3 x 2 3 2
下列说法正确的是
A.组成元素均位于元素周期表的p区
B.晶体硅的熔点比二氧化硅晶体高
C.基态铝原子核外电子有7种不同的空间运动状态
D.Fe O 中Fe(II)与Fe(III)的个数比为2∶1
3 x
【答案】C
【解析】A.组成元素中O、Al、Si、Pb均位于元素周期表的p区,但Fe位于d区,A错误;
B.已知Si(s)和SiO(s)均为原子晶体,且键长为:Si−Si键>Si−O键,通常键长越短键能越大,即键能:
2
学科网(北京)股份有限公司Si−O键>Si−Si键,键能越大,熔化需要的能量越高,其熔点越高,即二氧化硅的熔点高于晶体硅的熔点,
B错误;
C.已知Al是13号元素,其核外电子排布式为:1s22s22p33s23p1,故基态铝原子核外电子占据7各原子轨
道,即有7种不同的空间运动状态,C正确;
D.由原子手恒可知,Fe O 中x=4,设Fe O 中Fe(II)为a个,则有2a+3(3−a)=8,即得a=1,即设Fe O 中
3 x 3 x 3 x
Fe(II)与Fe(III)的个数比为1∶2,D错误;
故答案为:C。微信搜索“高中试卷君”公众号 领取押题卷联考卷
5.某同学按图示装置进行实验,大头针固定固体,塑料瓶盛放液体试剂。实验时先打开止水夹,手指压
紧小孔并挤压塑料瓶,使液体试剂沿玻璃管上升至完全充满,排尽玻璃管中空气,立即关闭止水夹,
一会儿后,手指堵住小孔,打开止水夹。下列所加液体试剂、对应现象及结论均正确的是
选项 固体 液体试剂 现象 结论
钠块熔化成小球并浮在水面上;打开止水夹,点
A 钠块 水 钠块与水反应产生氢气
燃气体,火焰呈淡蓝色
先有沉淀生成,后沉淀溶解;打开止水夹,点燃 铝条与氢氧化钠溶液反
B 铝条 NaOH溶液
气体,火焰呈淡蓝色 应产生氢气
铜丝与稀硝酸反应产生
C 铜丝 稀HNO 产生红棕色气体,溶液呈蓝色
3
NO
2
打开止水夹,并松开小孔片刻,关闭止水夹,发
D 铁丝 食盐水 铁丝发生了吸氧腐蚀
现塑料瓶中液面下降
【答案】A
【解析】A.若固体是钠块,液体试剂为水,钠块熔化成小球并浮在水面上,说明钠熔点低,且产生了气
体,打开止水夹,点燃气体,火焰呈淡蓝色,说明产生了氢气,可以证明钠块与水反应产生氢气,选项A
正确;B.若固体是铝条,液体试剂为氢氧化钠溶液,铝单质与氢氧化钠溶液反应生成偏铝酸钠,不会产生
沉淀,选项B错误;C.若固体是铜丝,液体试剂为稀硝酸,铜单质与稀硝酸反应生成一氧化氮, 选项C
错误;D.若固体是铁丝,液体试剂为食盐水,食盐水呈中性,铁丝发生了吸氧腐蚀,打开止水夹,并松开
小孔片刻,关闭止水夹,发现玻璃管中液面.上升,但由于塑料瓶直径较大,较难观察其液面变化,选项D
错误;答案选A。
学科网(北京)股份有限公司6.呋喃( )和四氢呋喃( )常用作有机溶剂,呋喃中含 大 键。下列说法错误的是
π6 π
5
A.呋喃与H 的加成产物有三种
2
B.呋喃在乙醇中溶解度小于苯中的
C.呋喃与四氢呋喃中含σ键数目比为9∶13
D.COC键角:呋喃>四氢呋喃
【答案】B
【解析】A.呋喃与 的加成产物有 、 、 ,共三种,故A正确;
H
2
B.呋喃分子中含有一个氧原子,它可以作为氢键受体,与乙醇中的氢键供体部分相互作用,所以呋喃在
乙醇中溶解度大于在苯中的溶解度,故B错误;
C.呋喃分子中含有9个σ键,四氢呋喃中含13个σ键,故C正确;
D.呋喃中含π6大π键,呋喃中氧原子的孤电子对减少,所以COC键角:呋喃>四氢呋喃,故D正确;
5
选B。
7.2022年诺贝尔化学奖授予对点击化学和生物正交化学做出贡献的三位科学家。我国科学家合成一种点
击化学试剂X YM Q,X分别与Y、Z、M形成原子个数为3、6、4的18e分子,19Q衰变方程:
2 2 2
19Q16 M21n1H。下列说法错误的是
a b 0 1
A.X的简单离子半径一定是周期表中最小的
B.
16M
和
18M
组成上属于同一种物质
2 2
C.同一周期中,第一电离能小于Z的有5种元素
D.Y、M形成简单氢化物的还原性:YM
【答案】A
【分析】X分别与Y、Z、M形成原子个数为3、6、4的18e分子,X为H元素;M的质量数为16,M为
O元素与H形成HO 含18e−、Y为S元素与H形成HS含18e−、Z为N元素与H形成NH 含18e−。根据
2 2 2 2 4
19Q衰变方程,Q的质子数为9,Q是F元素。
【解析】A.H−的半径大于Li+,故A错误;
B.
16O
和
18O
都是氧气分子,故B正确;
2 2
C.同一周期中,第一电离能小于N的有Li、Be、B、C、O,共5种元素,故C正确;
D.S的非金属性小于O,还原性H SH O,故D正确;
2 2
选A。
8.某学校实验探究小组利用碎铜屑和浓硫酸制备CuSO ·5H O大晶体,实验步骤如下:
4 2
i.将过量铜屑加入一定量浓硫酸中,加热,生成的气体通入到浓碱液中;
ii.在反应混合体系中加入稍过量的CuO,过滤,除去虑渣:
学科网(北京)股份有限公司iii.将虑液蒸发至饱和溶液状态,冷却,在饱和溶液中悬挂晶种,静置24小时。
下列说法错误的是
A.i中将气体通入浓碱液中的目的是防止尾气污染
B.反应混合体系中加入CuO的目的是除去剩余的硫酸
C.过滤后的滤渣中含有Cu、CuO等物质
D.该实验用到的仪器有酒精灯、漏斗、容量瓶、烧杯等
【答案】D微信搜索“高中试卷君”公众号 领取押题卷联考卷
【解析】A.铜和浓硫酸反应生成的气体为二氧化硫,二氧化硫可以和氢氧化钠反应,A正确;
B.氧化铜和硫酸反应生成硫酸铜,同时可以除去过量的硫酸,B正确;
C.随着反应的进行,浓硫酸变为稀硫酸,反应停止,则铜会剩余,在除去过量的硫酸的时候,加入的氧
化铜是过量的,故过滤后的滤渣中含有Cu、CuO等物质,C正确;
D.加热时需要酒精灯,过滤时需要漏斗,反应时需要烧杯,不需要容量瓶,D错误;
故选D。
9.利用废料Ce
2
O
3
制备CeSO
4
2
的工作原理如图,下列说法错误的是
电解
A.电极b为阴极,发生还原反应 B.电解总方程式:Ce O 8H 2Ce43H OH
2 3 2 2
C.离子交换膜为阴离子交换膜 D.X可以是H SO 溶液
2 4
【答案】C
【分析】由图可知,与直流电源正极相连的电极a为阳极,酸性条件下三氧化二铈在阳极失去电子发生氧
化反应生成铈离子和水,电极b为阴极,氢离子在阴极得到电子发生还原反应生成氢气,则X为硫酸溶液,
电解
铈离子通过阳离子交换膜由阳极室移向阴极室,电解的总反应方程式为Ce O 8H 2Ce43H OH 。
2 3 2 2
【解析】A.由分析可知,电极b为阴极,氢离子在阴极得到电子发生还原反应生成氢气,故A正确;
电解
B.由分析可知,电解的总反应方程式为Ce O 8H 2Ce43H OH ,故B正确;
2 3 2 2
C.由分析可知,电解时,铈离子通过阳离子交换膜由阳极室移向阴极室,故C错误;
D.由分析可知,X为硫酸溶液,故D正确;
故选C。
10.反应2COg2NOg 2CO
2
gN
2
g ΔH=620.9kJmol1分三步进行,各步的相对能量变化如
图I、II、III所示:
学科网(北京)股份有限公司下列说法错误的是
A.三步分反应中决定总反应速率的是反应I
B.I、II两步的总反应为COg2NOgN
2
OgCO
2
g
ΔH513.5kJmol1
C.根据图像无法判断过渡状态a、b、c的稳定性相对高低
D.反应III逆反应的活化能E (逆)554.9kJmol1
aIII
【答案】B
【解析】A.活化能越大,反应速率越慢,根据图中信息反应I活化能最大,因此三步分反应中决定总反
应速率的是反应I,故A正确;
B.根据图中信息和盖斯定律得到I、II两步的总反应为COg2NOgN OgCO g
2 2
ΔH314.3kJmol1,故B错误;
C.由于CO(g)的能量不清楚,因此根据图像无法判断过渡状态a、b、c的稳定性相对高低,故C正确;
D.根据总反应2COg2NOg 2CO
2
gN
2
g ΔH=620.9kJmol1和
COg2NOgN
2
OgCO
2
g
ΔH314.3kJmol1,得到反应III的
N
2
OgCO
2
g+COg2CO
2
gN
2
g ΔH306.6kJmol1,逆反应的活化能E
aIII
(逆)
(248.3306.6)kJmol1 554.9kJmol1,故D正确。
综上所述,答案为B。
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得
4分,选对但不全的得2分,有选错的得0分。
11.下列实验操作不能达到实验目的的是
选项 实验目的 实验操作
将固体溶于水配制成溶液,分别以酚酞和甲
A 测定NaHCO 与NaCO 混合物中碳酸钠质量分数
3 2 3
基橙为指示剂,用标准盐酸滴定
用pH计测量相同浓度NaClO溶液和
B 比较HClO与CHCOOH的酸性
3
CHCOONa溶液的pH
3
学科网(北京)股份有限公司向盛有3 mL 0.1 mol·L1 AgNO 溶液的试管中滴加
3
2滴0.1 mol·L1 NaCl溶液,振荡试管,再向试管
C K AgI ”或“=”)0。
a a
(2)总压恒定为100 kPa,向密闭容器中充入2 mol H S、3 mol O 、95 mol Ar,发生反应i和反应ii ,
2 2
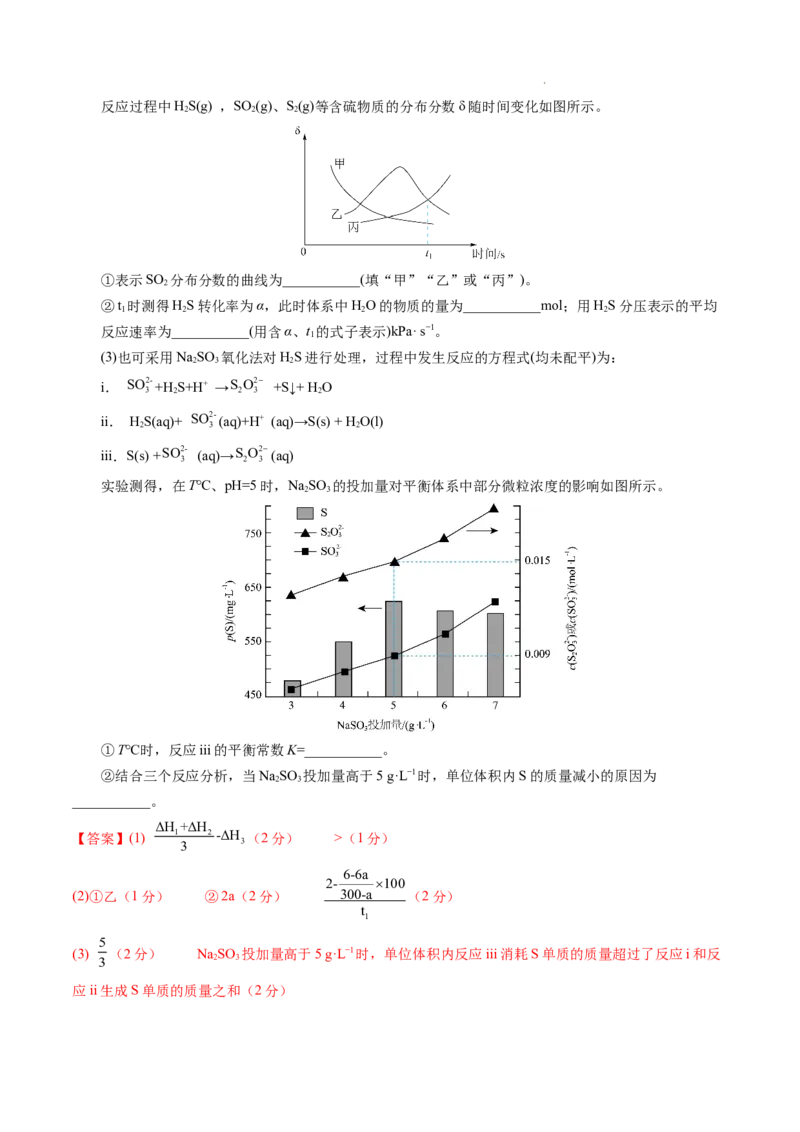
学科网(北京)股份有限公司反应过程中HS(g) ,SO (g)、S(g)等含硫物质的分布分数δ随时间变化如图所示。
2 2 2
①表示SO 分布分数的曲线为___________(填“甲”“乙”或“丙”)。
2
②t 时测得HS转化率为α,此时体系中HO的物质的量为___________mol;用HS分压表示的平均
1 2 2 2
反应速率为___________(用含α、t 的式子表示)kPa· s−1。
1
(3)也可采用NaSO 氧化法对HS进行处理,过程中发生反应的方程式(均未配平)为:
2 3 2
i. SO2- +H S+H+ →S O2 +S↓+ H O
3 2 2 3 2
ii. HS(aq)+ SO2- (aq)+H+ (aq)→S(s) + H O(l)
2 3 2
iii.S(s) +SO2- (aq)→S O2 (aq)
3 2 3
实验测得,在T℃、pH=5时,NaSO 的投加量对平衡体系中部分微粒浓度的影响如图所示。
2 3
①T℃时,反应iii的平衡常数K=___________。
②结合三个反应分析,当NaSO 投加量高于5 g·L−1时,单位体积内S的质量减小的原因为
2 3
___________。
ΔH +ΔH
【答案】(1) 1 2 -ΔH (2分) >(1分)
3 3
6-6a
2- 100
(2)①乙(1分) ②2a(2分) 300-a (2分)
t
1
5
(3) (2分) NaSO 投加量高于5 g·L−1时,单位体积内反应iii消耗S单质的质量超过了反应i和反
3 2 3
应ii生成S单质的质量之和(2分)
学科网(北京)股份有限公司i+ii ΔH +ΔH
【解析】(1)由盖斯定律可知,反应 -iii可得硫化氢热分解反应,则反应ΔH= 1 2 -ΔH ;由反
3 3 3
应的活化能E(正)大于E(逆)可知该反应为吸热反应,反应焓变ΔH>0;
a a
(2)①由方程式可知,反应i中硫化氢与氧气反应生成二氧化硫,反应ii中二氧化硫与硫化氢反应生成
S,则硫化氢的分布分数减小、二氧化硫的分布分数先增大后减小、S 的分布分数增大,故选乙;
2 2
②设t 时,反应i生成二氧化硫为2a mol、反应ii消耗二氧化硫为2b mol,由题意可建立如下三段式:
1
2H Sg+ 3O g 2SO g+ 2H Og
2 2 2 2
起(mol) 2 3 0 0
变(mol) 2a 3a 2a 2a
平(mol) 2-2a 3-3a 2a 2a
4H Sg+ 2SO g 2S g+ 4H Og
2 2 2 2
起(mol) 2-2a 3-3a 0 2a
变(mol) 4b 2b 2b 4b
平(mol) 2-2a-4b 3-3a-2b 2b 2a+4b
a+2b
由硫化氢转化率为α可得: =α,由图可知,二氧化硫和S 分布分数相等,则3−1.5a−b=b,解联立方
2 2
程可得a=3−2α、b=1.5α−1.5,则水的物质的量为(3−2α)mol×2+(1.5α−1.5) mol×4=2αmol,硫化氢的分压变化
6-6a
2- 100
量为( 6-6a )Pa,平均反应速率为 300-a kPa· s−1;
2- 100
300-a t
1
(3)①由图可知,T℃、pH为5反应达到平衡时,硫代硫酸根离子浓度为0.015 mol/L、亚硫酸根离子浓
0.015 5
度为0.009 mol/L,则反应iii的平衡常数K= = ;
0.009 3
②结合三个反应分析,当NaSO 投加量高于5 g·L−1时,单位体积内S的质量减小说明NaSO 投加量高于5
2 3 2 3
g·L−1时,单位体积内反应iii消耗S单质的质量超过了反应i和反应ii生成S单质的质量之和。
学科网(北京)股份有限公司学科网(北京)股份有限公司