文档内容
吉林省2018年中考化学真题试题
可能用到的相对原子质量:H-1 O-16 Na-23 C1-35.5
一、单项选择题(每小题1分,共10分)
1.物质的下列性质中,属于化学性质的是( )
A.可燃性 B.状态 C.气味 D.硬度
【答案】A
【解析】可燃性属于物质的化学性质;状态、气味和硬度,属于物质的物理性质。故选A。
2.空气是一种宝贵的资源,空气中体积分数最大的气体是( )
A.稀有气体 B.二氧化碳 C.氧气 D.氮气
【答案】D
【解析】空气中体积分数:稀有气体0.94%,二氧化碳 0.03%,氧气21%,氮气78%。故选D。
3.生活中可以使硬水软化成软水的常用方法是( )
A.沉降 B.消毒 C.煮沸 D.过滤
【答案】C
【解析】生活中通过加热煮沸的方法把硬水软化成软水。故选C。
4.下列实验操作正确的是( )
【答案】A
【解析】把导管的一端放入盛有水的烧杯中 ,双手紧贴容器外壁,观察现象,若导管口有气泡
产生 ,且松开手后,烧杯中的导管内形成一段稳定的液柱,则装置不漏气;用灯帽盖灭酒精
灯,吹灭酒精灯易导致灯内酒精着火,甚至引起酒精灯爆炸;量取液体时,视线没与液体的凹
液面最低处保持水平;用坩埚钳夹取蒸发皿。故选A。
5.有关物质的用途, 错误的是( )
A.石墨做电极B.干冰用于人工降雨C.NHCl当做复合肥使用D.小苏打用于焙制糕点
4
【答案】C
【解析】石墨具有导电性,可做电极;干冰升华吸热,有利于水汽凝华,可用于人工降雨;NHCl
4
含有氮元素,可作氮肥使用;小苏打受热易分解,可用于焙制糕点,使糕点膨松。故选C。
6.化学方程式_____+3CO 2Fe+3CO 中,所缺物质的化学式为( )
2
1A. FeO B. FeO C. FeO D. FeCO
2 3 3 4 3
【答案】B
【解析】根据质量守恒定律判断该物质的化学式为FeO。故选B。
2 3
7.“保护好我们的环境”是每位公民应尽的义务。下列说法正确的是( )
A.农药本身有毒,应该禁止施用农药B.有害气体和烟尘会对空气造成污染
C.煤燃烧产生的二氧化碳会造成酸雨D.工业废水不经处理就可以排放到江河里
【答案】B
【解析】农药本身有毒,应该合理施用农药,可以杀死害虫,提高产量;有害气体和烟尘会对空
气造成污染,对人体有害;煤燃烧产生的二氧化硫会造成酸雨;工业废水达标处理才能排放
到江河里。故选B。
8.关于电解水实验的下列说法中正确的是( )
A.从现象上判断:正极产生的是氢气
B.从变化上分类: 该变化属于物理变化
C.从宏观上分析:水是由氢气和氧气组成的
D.从微观上分析:水分子是由氢原子和氧原子构成的
【答案】D
【解析】电解水时,从现象上判断:正极产生的是氧气;从变化上分类: 该变化属于化学变化;
从宏观上分析:水是由氢、氧元素组成;从微观上分析:水分子是由氢原子和氧原子构成的。
故选D。
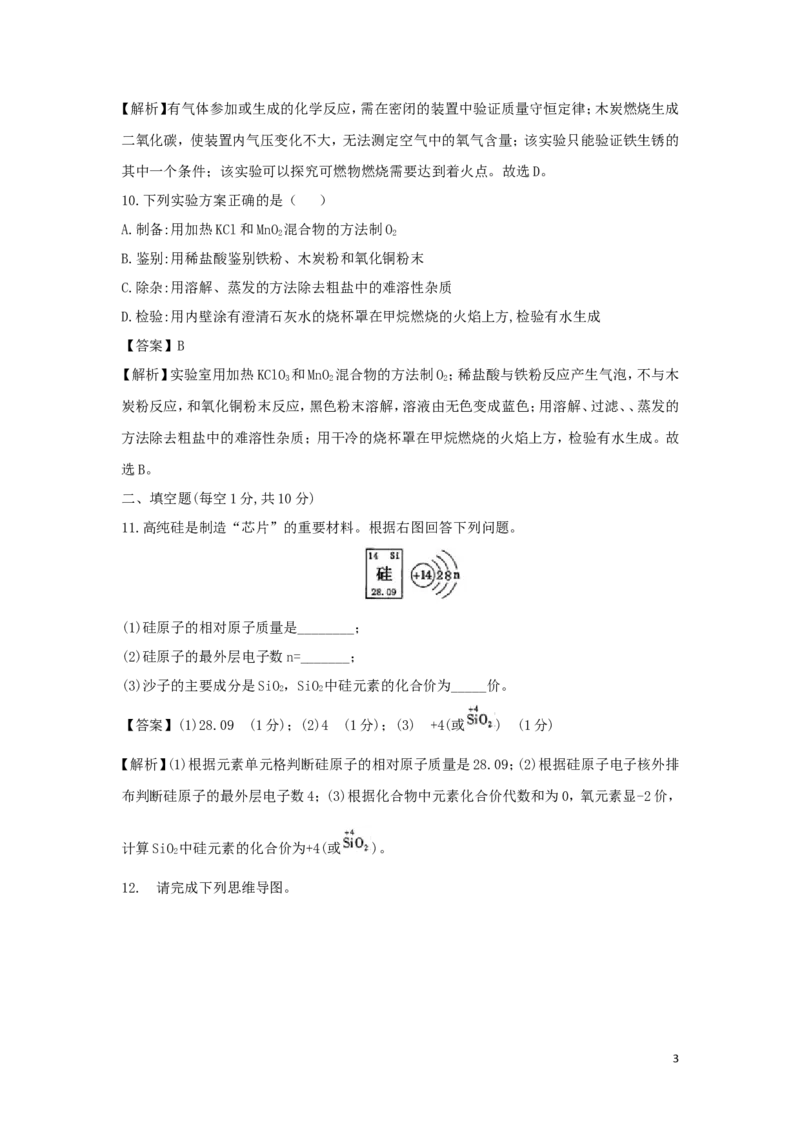
9.下列实验设计能够实现其对应实验目的的是( )
【答案】D
2【解析】有气体参加或生成的化学反应,需在密闭的装置中验证质量守恒定律;木炭燃烧生成
二氧化碳,使装置内气压变化不大,无法测定空气中的氧气含量;该实验只能验证铁生锈的
其中一个条件;该实验可以探究可燃物燃烧需要达到着火点。故选D。
10.下列实验方案正确的是( )
A.制备:用加热KCl和MnO 混合物的方法制O
2 2
B.鉴别:用稀盐酸鉴别铁粉、木炭粉和氧化铜粉末
C.除杂:用溶解、蒸发的方法除去粗盐中的难溶性杂质
D.检验:用内壁涂有澄清石灰水的烧杯罩在甲烷燃烧的火焰上方,检验有水生成
【答案】B
【解析】实验室用加热KClO 和MnO 混合物的方法制O;稀盐酸与铁粉反应产生气泡,不与木
3 2 2
炭粉反应,和氧化铜粉末反应,黑色粉末溶解,溶液由无色变成蓝色;用溶解、过滤、、蒸发的
方法除去粗盐中的难溶性杂质;用干冷的烧杯罩在甲烷燃烧的火焰上方,检验有水生成。故
选B。
二、填空题(每空1分,共10分)
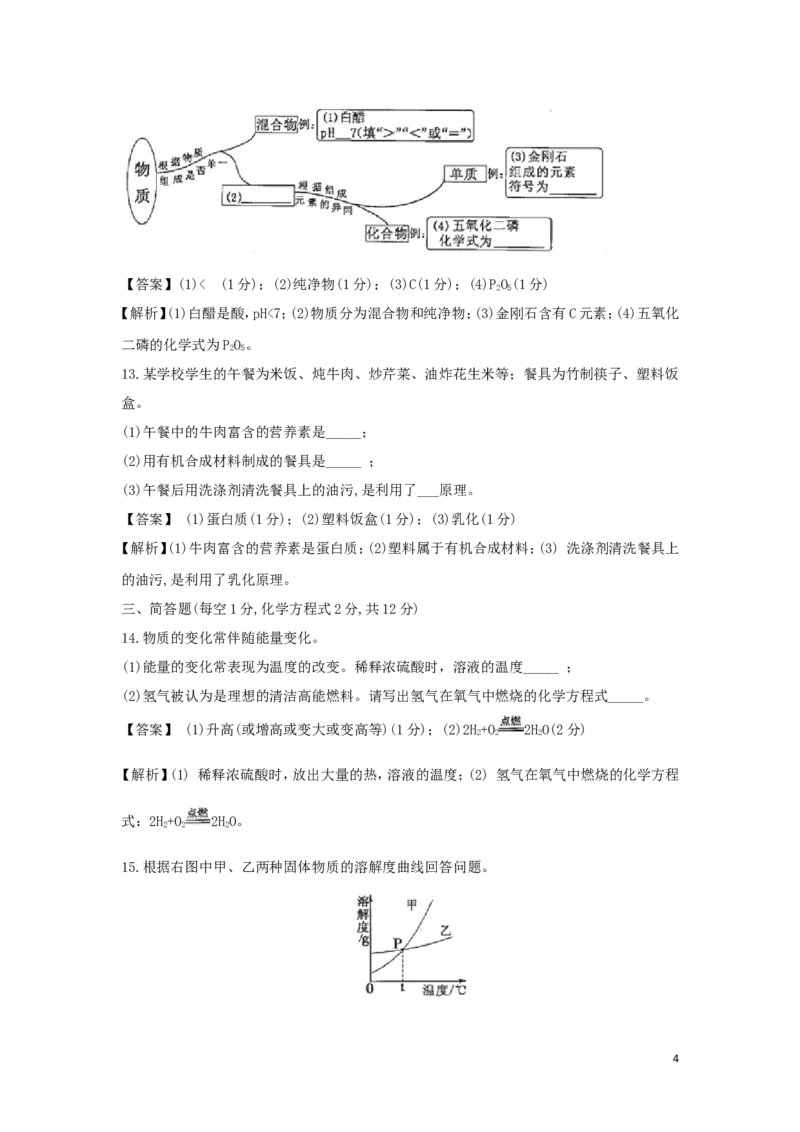
11.高纯硅是制造“芯片”的重要材料。根据右图回答下列问题。
(1)硅原子的相对原子质量是________;
(2)硅原子的最外层电子数n=_______;
(3)沙子的主要成分是SiO,SiO 中硅元素的化合价为_____价。
2 2
【答案】(1)28.09 (1分);(2)4 (1分);(3) +4(或 ) (1分)
【解析】(1)根据元素单元格判断硅原子的相对原子质量是28.09;(2)根据硅原子电子核外排
布判断硅原子的最外层电子数4;(3)根据化合物中元素化合价代数和为0,氧元素显-2价,
计算SiO 中硅元素的化合价为+4(或 )。
2
12. 请完成下列思维导图。
3【答案】(1)< (1分);(2)纯净物(1分);(3)C(1分);(4)PO(1分)
2 5
【解析】(1)白醋是酸,pH<7;(2)物质分为混合物和纯净物;(3)金刚石含有C元素;(4)五氧化
二磷的化学式为PO。
2 5
13.某学校学生的午餐为米饭、炖牛肉、炒芹菜、油炸花生米等;餐具为竹制筷子、塑料饭
盒。
(1)午餐中的牛肉富含的营养素是_____;
(2)用有机合成材料制成的餐具是_____ ;
(3)午餐后用洗涤剂清洗餐具上的油污,是利用了___原理。
【答案】 (1)蛋白质(1分);(2)塑料饭盒(1分);(3)乳化(1分)
【解析】(1)牛肉富含的营养素是蛋白质;(2)塑料属于有机合成材料;(3) 洗涤剂清洗餐具上
的油污,是利用了乳化原理。
三、简答题(每空1分,化学方程式2分,共12分)
14.物质的变化常伴随能量变化。
(1)能量的变化常表现为温度的改变。稀释浓硫酸时,溶液的温度_____ ;
(2)氢气被认为是理想的清洁高能燃料。请写出氢气在氧气中燃烧的化学方程式_____。
【答案】 (1)升高(或增高或变大或变高等)(1分);(2)2H+O 2HO(2分)
2 2 2
【解析】(1) 稀释浓硫酸时,放出大量的热,溶液的温度;(2) 氢气在氧气中燃烧的化学方程
式:2H+O 2HO。
2 2 2
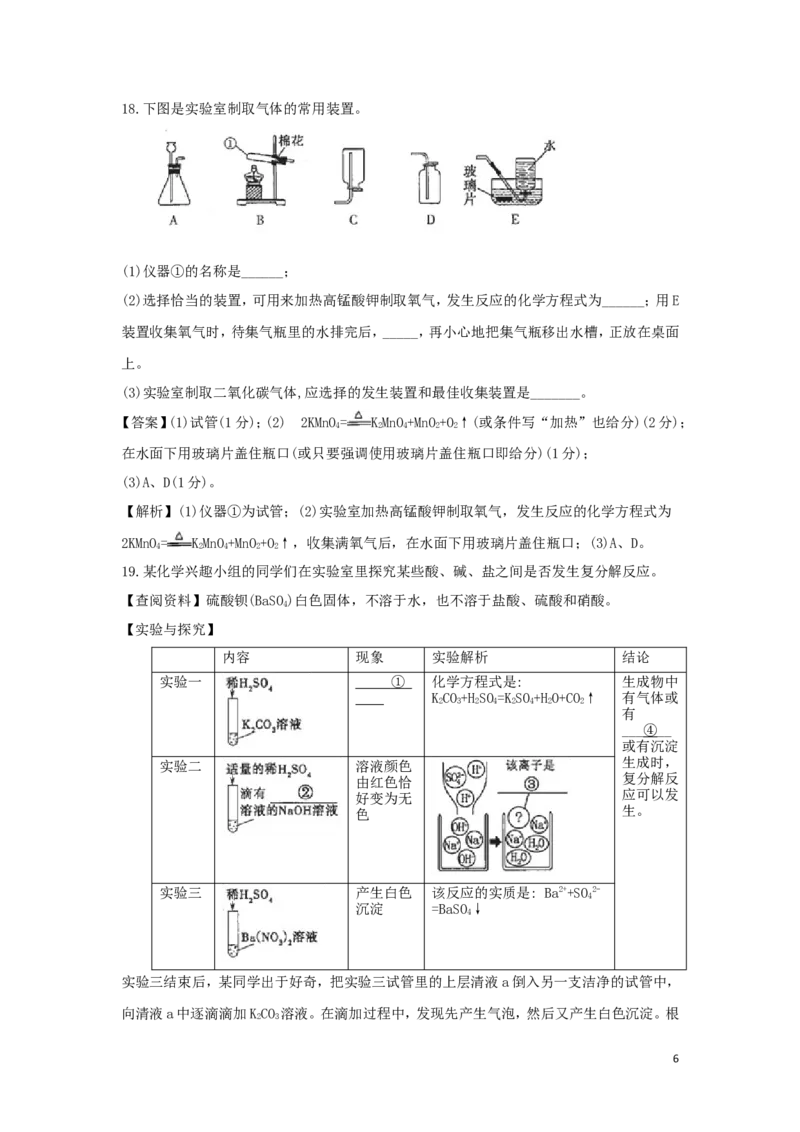
15.根据右图中甲、乙两种固体物质的溶解度曲线回答问题。
4(1)P点的含义:在t℃时,甲与乙的溶解度____;
(2)在温度不变的情况下,把乙的不饱和容液变为饱和溶液的方法是_____;
(3)甲中含有少量的乙,若提纯甲应采用的结晶方法是_____。
【答案】 (1)相等(或相同)(1分)(2) 加入乙物质(或加入溶质或蒸发溶剂或蒸发水或减少水
等,但改变温度不给分)(1分);(3)根据溶解度曲线判断甲溶解度受温度升高影响比乙大,甲
中含有少量的乙,可以通过降温结晶(或冷却热饱和溶液)来提纯。
【解析】(1) t℃时,甲与乙的溶解度相等(或相同);(2)在温度不变的情况下,把乙的不饱和
容液变为饱和溶液的方法是加入乙物质(或加入溶质或蒸发溶剂或蒸发水或减少水等);(3)
根据溶解度曲线判断甲溶解度受温度升高影响比乙大,甲中含有少量的乙,可以通过降温结
晶(或冷却热饱和溶液)来提纯。
16.结合化学知识回答下列问题。
(1)试举一个能说明分子之间有间隔的例子:_________;
(2)CO 与CO的化学性质有很大不同的原因是_________。
2
【答案】(1)气体容易被压缩(或热胀冷缩或相同质量的同一物质在固态、液态和气态时所
占的体积不同或体现物质三态变化等)(1分);(2)分子构成不同(或分子结构不同
或分子种类不同)(1分)。
【解析】(1)气体容易被压缩(或热胀冷缩或相同质量的同一物质在固态、液态和气态时所
占的体积不同或体现物质三态变化等);(2) CO 与CO的化学性质有很大不同的原因是分子
2
构成不同(或分子结构不同或分子种类不同)。
17.用铝丝、洁净的铜丝、稀盐酸、AgNO 溶液,验证Al、Cu Ag的活动性顺序。
3
(1)把打磨过的铝丝和洁净的铜丝分别浸入稀盐酸中,观察到铝丝表面有气泡产生,铜丝表
面无明显现象,由此判断出Al和Cu的活动性强弱顺序为_____>(H)>____;发生反应的基本
反应类型是____ ;铝丝使用前需用砂纸打磨的原因是___;
(2)为了达到实验目的,除(1)中实验外,还需要进行的实验是______。
【答案】(1)Al、Cu(或铝、铜)(1分);置换反应(1分);除去铝表面致密的氧化铝薄
膜,防止其影响反应(或除去铝表面的氧化膜或除去铝表面的氧化物等,合理均可)(1分);
(2)将铜丝浸入硝酸银溶液中(只要用不超出所给四种试剂,就能得出正确结论的即可给
分)(1分)
【解析】(1)Al与稀盐酸反应,属于置换反应,Cu不与稀盐酸反应,说明Al>(H)> Cu;氧
化铝薄膜覆盖在铝表面,致使稀盐酸先于氧化铝反应,再与铝反应;(2)将铜丝浸入硝酸银
溶液中,证明Cu>Ag。
四、实验与探究题(每空1分,化学方程式2分,共12分)
518.下图是实验室制取气体的常用装置。
(1)仪器①的名称是______;
(2)选择恰当的装置,可用来加热高锰酸钾制取氧气,发生反应的化学方程式为______;用E
装置收集氧气时,待集气瓶里的水排完后,_____,再小心地把集气瓶移出水槽,正放在桌面
上。
(3)实验室制取二氧化碳气体,应选择的发生装置和最佳收集装置是_______。
【答案】(1)试管(1分);(2) 2KMnO= KMnO+MnO+O↑(或条件写“加热”也给分)(2分);
4 2 4 2 2
在水面下用玻璃片盖住瓶口(或只要强调使用玻璃片盖住瓶口即给分)(1分);
(3)A、D(1分)。
【解析】(1)仪器①为试管;(2)实验室加热高锰酸钾制取氧气,发生反应的化学方程式为
2KMnO= KMnO+MnO+O↑,收集满氧气后,在水面下用玻璃片盖住瓶口;(3)A、D。
4 2 4 2 2
19.某化学兴趣小组的同学们在实验室里探究某些酸、碱、盐之间是否发生复分解反应。
【查阅资料】硫酸钡(BaSO)白色固体,不溶于水,也不溶于盐酸、硫酸和硝酸。
4
【实验与探究】
内容 现象 实验解析 结论
实验一 ____ _ ① _ 化学方程式是: 生成物中
____ KCO+HSO=KSO+HO+CO↑ 有气体或
2 3 2 4 2 4 2 2
有
___④__
或有沉淀
实验二 溶液颜色 生成时,
由红色恰 复分解反
好变为无 应可以发
色 生。
实验三 产生白色 该反应的实质是: Ba2++SO2-
4
沉淀 =BaSO↓
4
实验三结束后,某同学出于好奇,把实验三试管里的上层清液a倒入另一支洁净的试管中,
向清液a中逐滴滴加KCO 溶液。在滴加过程中,发现先产生气泡,然后又产生白色沉淀。根
2 3
6据上述现象,请你判断原清液a中的溶质是___⑤___。
【拓展与应用】将稀盐酸、Ca(OH) 溶液、NaCl溶液和NaCO 溶液任意两种溶液相混合,写出能
2 2 3
发生反应且有沉淀生成的化学方程式________。
【答案】①有气泡产生(1分);②酚酞(1分);③SO2-(或硫酸根离子或硫酸根均可) (1分);
4
④水(或HO)(1分);⑤HNO 和Ba(NO)(或硝酸和硝酸钡)(1分);
2 3 3 2
⑥Ca(OH)+NaCO==CaCO↓+2NaOH(2分)。
2 2 3 3
【解析】①KCO 与HSO 反应有气泡产生;②氢氧化钠溶液使无色酚酞变红;③酸碱中和的实
2 3 2 4
质是H++OH-=HO,③是SO2-(或硫酸根离子或硫酸根均可);④复分解反应条件有气体、水(或
2 4
HO)或沉淀生成;⑤KCO 与Ba(NO) 生成BaCO 沉淀,BaCO 沉淀与HNO 反应生成二氧化碳,
2 2 3 3 2 3 3 3
即原清液a中的溶质是硝酸和硝酸钡;⑥Ca(OH) 溶液和NaCO 溶液反应:
2 2 3
Ca(OH)+NaCO==CaCO↓+2NaOH。
2 2 3 3
五、计算题(6分)
20.现有溶质质量分数为20%的NaOH溶液20g,与-定质量的稀盐酸恰好完全反应。
计算:(1)NaOH溶液中溶质的质量为______g
(2)生成NaCl的质量。
【答案】(1)4;(2)5.85g。
【解析】(1))NaOH溶液中溶质的质量:20g×20%=4g;
(2)设反应生成的NaCl的质量为x
NaOH+HCl=NaCl+HO
2
40 58.5
4g x
40/4g=58.5/x
x=5.85g
答:反应生成的NaCl的质量为5.85g。
7