文档内容
题型 04 物质结构与元素推断综合题
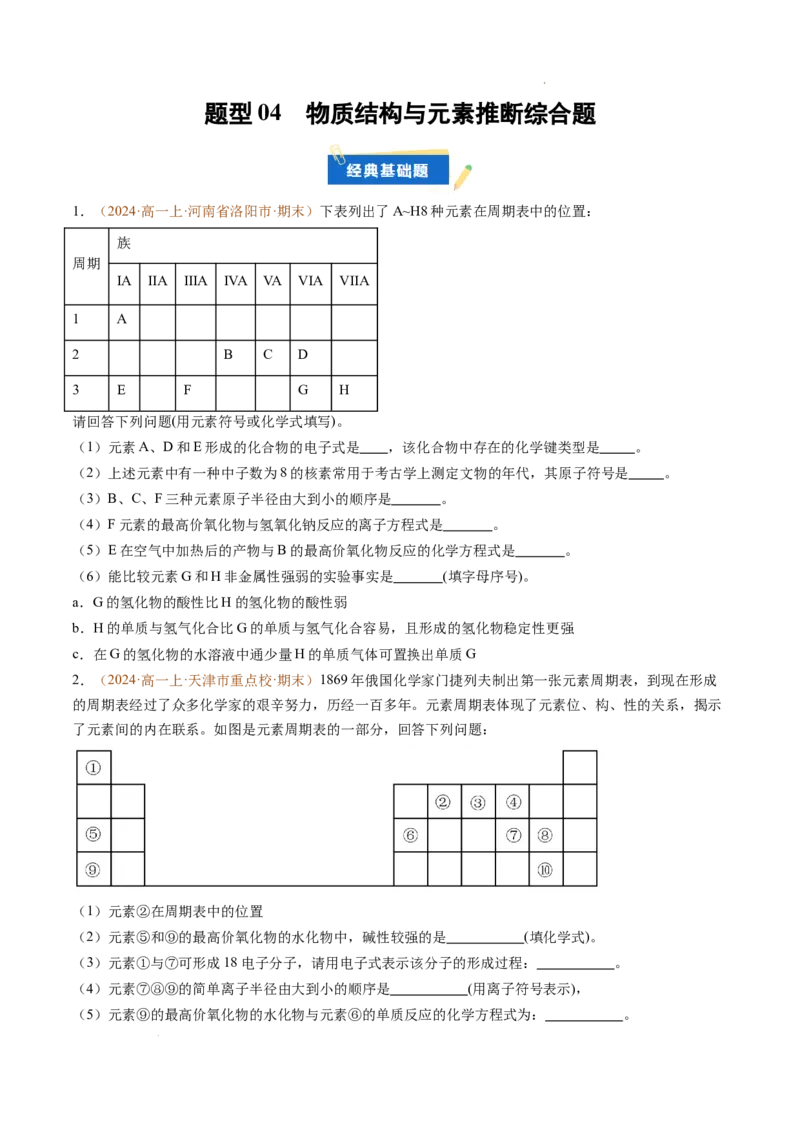
1.(2024·高一上·河南省洛阳市·期末)下表列出了A~H8种元素在周期表中的位置:
族
周期
IA IIA IIIA IVA VA VIA VIIA
1 A
2 B C D
3 E F G H
请回答下列问题(用元素符号或化学式填写)。
(1)元素A、D和E形成的化合物的电子式是 ,该化合物中存在的化学键类型是 。
(2)上述元素中有一种中子数为8的核素常用于考古学上测定文物的年代,其原子符号是 。
(3)B、C、F三种元素原子半径由大到小的顺序是 。
(4)F元素的最高价氧化物与氢氧化钠反应的离子方程式是 。
(5)E在空气中加热后的产物与B的最高价氧化物反应的化学方程式是 。
(6)能比较元素G和H非金属性强弱的实验事实是 (填字母序号)。
a.G的氢化物的酸性比H的氢化物的酸性弱
b.H的单质与氢气化合比G的单质与氢气化合容易,且形成的氢化物稳定性更强
c.在G的氢化物的水溶液中通少量H的单质气体可置换出单质G
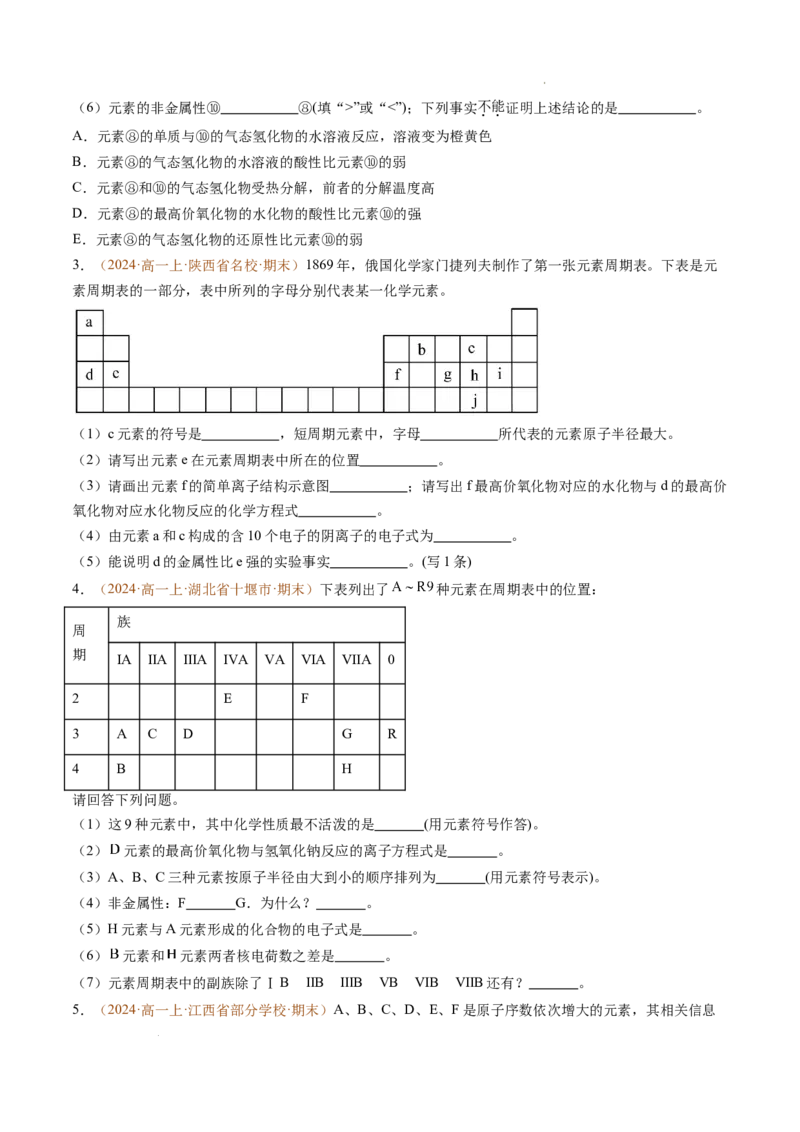
2.(2024·高一上·天津市重点校·期末)1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成
的周期表经过了众多化学家的艰辛努力,历经一百多年。元素周期表体现了元素位、构、性的关系,揭示
了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
(1)元素②在周期表中的位置
(2)元素⑤和⑨的最高价氧化物的水化物中,碱性较强的是 (填化学式)。
(3)元素①与⑦可形成18电子分子,请用电子式表示该分子的形成过程: 。
(4)元素⑦⑧⑨的简单离子半径由大到小的顺序是 (用离子符号表示),
(5)元素⑨的最高价氧化物的水化物与元素⑥的单质反应的化学方程式为: 。
学科网(北京)股份有限公司(6)元素的非金属性⑩ ⑧(填“>”或“<”);下列事实不能证明上述结论的是 。
A.元素⑧的单质与⑩的气态氢化物的水溶液反应,溶液变为橙黄色
B.元素⑧的气态氢化物的水溶液的酸性比元素⑩的弱
C.元素⑧和⑩的气态氢化物受热分解,前者的分解温度高
D.元素⑧的最高价氧化物的水化物的酸性比元素⑩的强
E.元素⑧的气态氢化物的还原性比元素⑩的弱
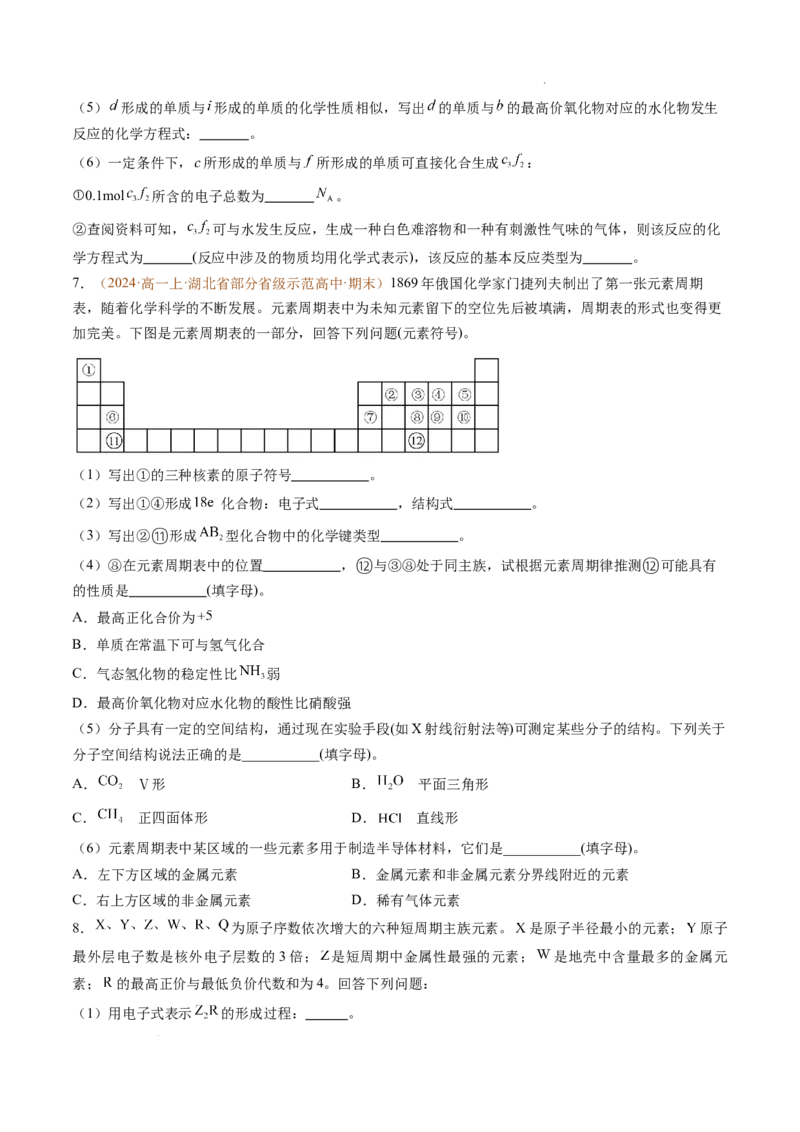
3.(2024·高一上·陕西省名校·期末)1869年,俄国化学家门捷列夫制作了第一张元素周期表。下表是元
素周期表的一部分,表中所列的字母分别代表某一化学元素。
(1)c元素的符号是 ,短周期元素中,字母 所代表的元素原子半径最大。
(2)请写出元素e在元素周期表中所在的位置 。
(3)请画出元素f的简单离子结构示意图 ;请写出f最高价氧化物对应的水化物与d的最高价
氧化物对应水化物反应的化学方程式 。
(4)由元素a和c构成的含10个电子的阴离子的电子式为 。
(5)能说明d的金属性比e强的实验事实 。(写1条)
4.(2024·高一上·湖北省十堰市·期末)下表列出了 种元素在周期表中的位置:
族
周
期
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2 E F
3 A C D G R
4 B H
请回答下列问题。
(1)这9种元素中,其中化学性质最不活泼的是 (用元素符号作答)。
(2) 元素的最高价氧化物与氢氧化钠反应的离子方程式是 。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为 (用元素符号表示)。
(4)非金属性:F G.为什么? 。
(5)H元素与A元素形成的化合物的电子式是 。
(6) 元素和 元素两者核电荷数之差是 。
(7)元素周期表中的副族除了ⅠB ⅡB ⅢB ⅤB ⅥB ⅦB还有? 。
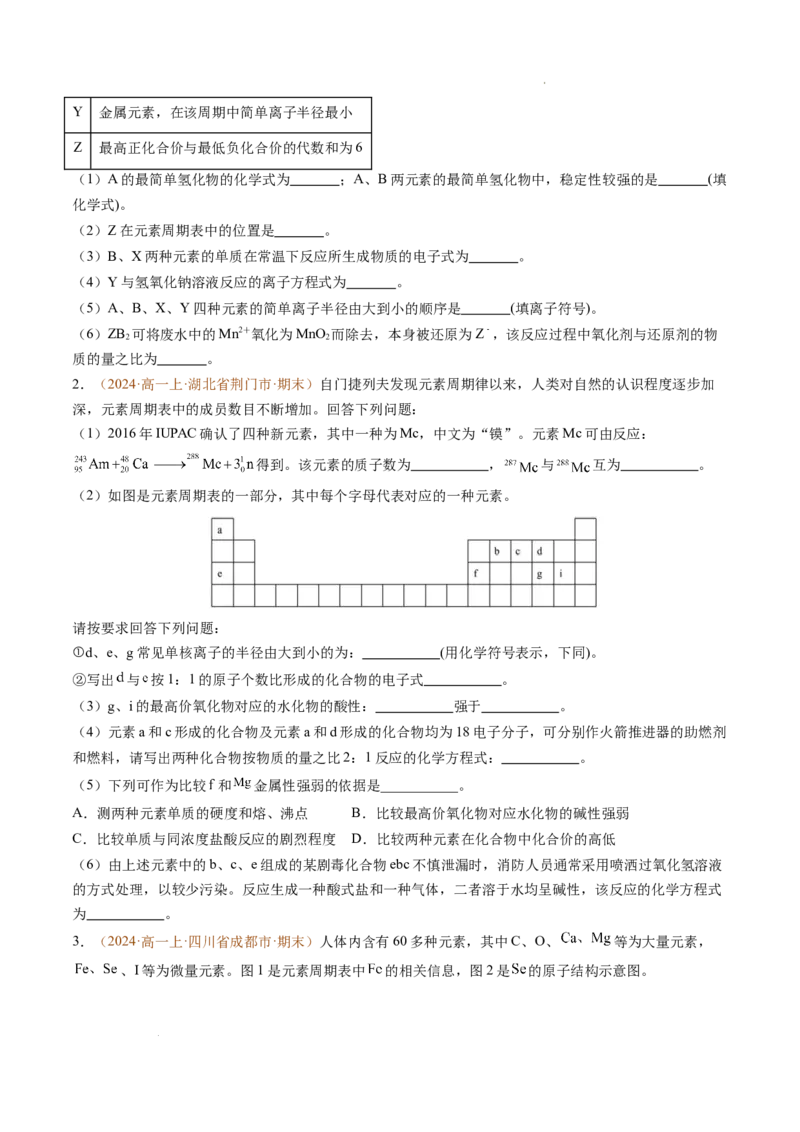
5.(2024·高一上·江西省部分学校·期末)A、B、C、D、E、F是原子序数依次增大的元素,其相关信息
学科网(北京)股份有限公司如下。
元素 特征 元素 特征
A 该元素的某种原子不含中子 B 简单氢化物的分子结构模型为
C 在人体中含量最多 D 该元素形成的化合物灼烧时火焰呈现黄色
该元素形成的单质常温下是黄绿色的有毒 由该元素形成的合金是目前我国用途最广的
E F
气体 合金
回答下列问题:
(1)元素A和E形成的化合物的电子式为 ,该化合物含有的化学键类型是 。
(2)元素B在元素周期表中的位置为 ,其原子结构示意图为 。
(3)元素D形成的单质在元素C形成的单质中燃烧的化学方程式为 ;元素D形成的单质久置
于空气中最终得到的化合物的化学式为 。
(4)元素F形成的单质在元素E形成的单质中燃烧生成的化合物的化学式为 ;向一个
小烧杯中加入 蒸馏水,加热至沸腾,向沸水中逐滴加入5~6滴该化合物的饱和溶液,继续煮沸至液
体呈红褐色,停止加热,最终得 (填物质名称),可用 (填方法)检验。
(5)下列事实,能证明元素E的非金属性强于S(硫)的非金属性的是___________(填字母)。
A.酸性:
B. 通入 溶液能产生黄色沉淀
C.氢化物稳定性:
D.常温下, 的单质为气态, 的单质为固态
6.(2024·高一上·湖北省十堰市·期末)下表列出了 9种元素在元素周期表中的位置:
族
周期
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2
3
4
回答下列问题:
(1)观察 的燃烧时,发现火焰呈 色。
(2)简单离子半径: (填“>”“<”或“=”) 。
(3)最简单氢化物的稳定性: (填“>”“<”或“=”) 。
(4) 、 、 三种元素分别形成的最简单氢化物的沸点由高到低的顺序为 (填化学式)。
学科网(北京)股份有限公司(5) 形成的单质与 形成的单质的化学性质相似,写出 的单质与 的最高价氧化物对应的水化物发生
反应的化学方程式: 。
(6)一定条件下, 所形成的单质与 所形成的单质可直接化合生成 :
①0.1mol 所含的电子总数为 。
②查阅资料可知, 可与水发生反应,生成一种白色难溶物和一种有刺激性气味的气体,则该反应的化
学方程式为 (反应中涉及的物质均用化学式表示),该反应的基本反应类型为 。
7.(2024·高一上·湖北省部分省级示范高中·期末)1869年俄国化学家门捷列夫制出了第一张元素周期
表,随着化学科学的不断发展。元素周期表中为未知元素留下的空位先后被填满,周期表的形式也变得更
加完美。下图是元素周期表的一部分,回答下列问题(元素符号)。
(1)写出①的三种核素的原子符号 。
(2)写出①④形成 化合物:电子式 ,结构式 。
(3)写出②⑪形成 型化合物中的化学键类型 。
(4)⑧在元素周期表中的位置 ,⑫与③⑧处于同主族,试根据元素周期律推测⑫可能具有
的性质是 (填字母)。
A.最高正化合价为
B.单质在常温下可与氢气化合
C.气态氢化物的稳定性比 弱
D.最高价氧化物对应水化物的酸性比硝酸强
(5)分子具有一定的空间结构,通过现在实验手段(如X射线衍射法等)可测定某些分子的结构。下列关于
分子空间结构说法正确的是___________(填字母)。
A. Ⅴ形 B. 平面三角形
C. 正四面体形 D. 直线形
(6)元素周期表中某区域的一些元素多用于制造半导体材料,它们是___________(填字母)。
A.左下方区域的金属元素 B.金属元素和非金属元素分界线附近的元素
C.右上方区域的非金属元素 D.稀有气体元素
8. 为原子序数依次增大的六种短周期主族元素。 是原子半径最小的元素; 原子
最外层电子数是核外电子层数的3倍; 是短周期中金属性最强的元素; 是地壳中含量最多的金属元
素; 的最高正价与最低负价代数和为4。回答下列问题:
(1)用电子式表示 的形成过程: 。
学科网(北京)股份有限公司(2)W在周期表中的位置是 。
(3)ZYX的电子式为 , 中含有的化学键类型为 。
(4) 三种元素对应的简单离子半径由大到小的顺序是 (用元素的离子符号表示)。
(5)下列说法能证明非金属性 强于 的是 。(填字母)。
a.简单阴离子的还原性: b.简单氢化物热稳定性:
c.氧化物对应的水化物的酸性: d. 的单质能从 溶液中置换出 单质
(6) 的单质与 的最高价氧化物对应的水化物反应的化学方程式为 。
9.(23-24高一上·安徽省合肥市六校联盟·期末)针对表中10种元素及由这些元素形成的单质和化合物,
完成以下问题。
族周
IA IIA IIIA IVA VA VIA VIIA
期
2 ① ② ③
3 ④ ⑤ ⑥ ⑦ ⑧ ⑨
4 ⑩
(1)最活泼的金属元素是 (填元素符号),酸性最强的最高价氧化物对应水化物是
(填化学式)。
(2)写出⑤和⑨两种元素组成的化合物的电子式 ,该化合物中含有 (填“离子键”“共
价键”)
(3)③④⑤⑧的简单离子半径由大到小的顺序为 (填离子符号)。
(4)写出元素⑥的单质与元素④最高价氧化物对应水化物反应的化学方程式 。
(5)能够比较元素⑧与⑨的非金属性强弱的依据是 (填序号)。
a.氢化物酸性:⑧弱于⑨
b.⑨单质能与⑧氢化物成应得到⑧单质
c.单质与 反应:⑨比⑧容易
d.含氧酸的酸性;⑨强于⑧
1.(2024·高一上·重庆·期末)A、B、X、Y、Z为短周期原子序数依次增大的主族元素,有关信息如下
表:
A 第VA族元素
B 地壳中含量最多的元素
X 短周期原子半径最大的元素
学科网(北京)股份有限公司Y 金属元素,在该周期中简单离子半径最小
Z 最高正化合价与最低负化合价的代数和为6
(1)A的最简单氢化物的化学式为 ;A、B两元素的最简单氢化物中,稳定性较强的是 (填
化学式)。
(2)Z在元素周期表中的位置是 。
(3)B、X两种元素的单质在常温下反应所生成物质的电子式为 。
(4)Y与氢氧化钠溶液反应的离子方程式为 。
(5)A、B、X、Y四种元素的简单离子半径由大到小的顺序是 (填离子符号)。
(6)ZB 可将废水中的Mn2+氧化为MnO 而除去,本身被还原为Z﹣,该反应过程中氧化剂与还原剂的物
2 2
质的量之比为 。
2.(2024·高一上·湖北省荆门市·期末)自门捷列夫发现元素周期律以来,人类对自然的认识程度逐步加
深,元素周期表中的成员数目不断增加。回答下列问题:
(1)2016年IUPAC确认了四种新元素,其中一种为Mc,中文为“镆”。元素Mc可由反应:
得到。该元素的质子数为 , 与 互为 。
(2)如图是元素周期表的一部分,其中每个字母代表对应的一种元素。
请按要求回答下列问题:
①d、e、g常见单核离子的半径由大到小的为: (用化学符号表示,下同)。
②写出 与 按1:1的原子个数比形成的化合物的电子式 。
(3)g、i的最高价氧化物对应的水化物的酸性: 强于 。
(4)元素a和c形成的化合物及元素a和d形成的化合物均为18电子分子,可分别作火箭推进器的助燃剂
和燃料,请写出两种化合物按物质的量之比2:1反应的化学方程式: 。
(5)下列可作为比较 和 金属性强弱的依据是___________。
A.测两种元素单质的硬度和熔、沸点 B.比较最高价氧化物对应水化物的碱性强弱
C.比较单质与同浓度盐酸反应的剧烈程度 D.比较两种元素在化合物中化合价的高低
(6)由上述元素中的b、c、e组成的某剧毒化合物ebc不慎泄漏时,消防人员通常采用喷洒过氧化氢溶液
的方式处理,以较少污染。反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式
为 。
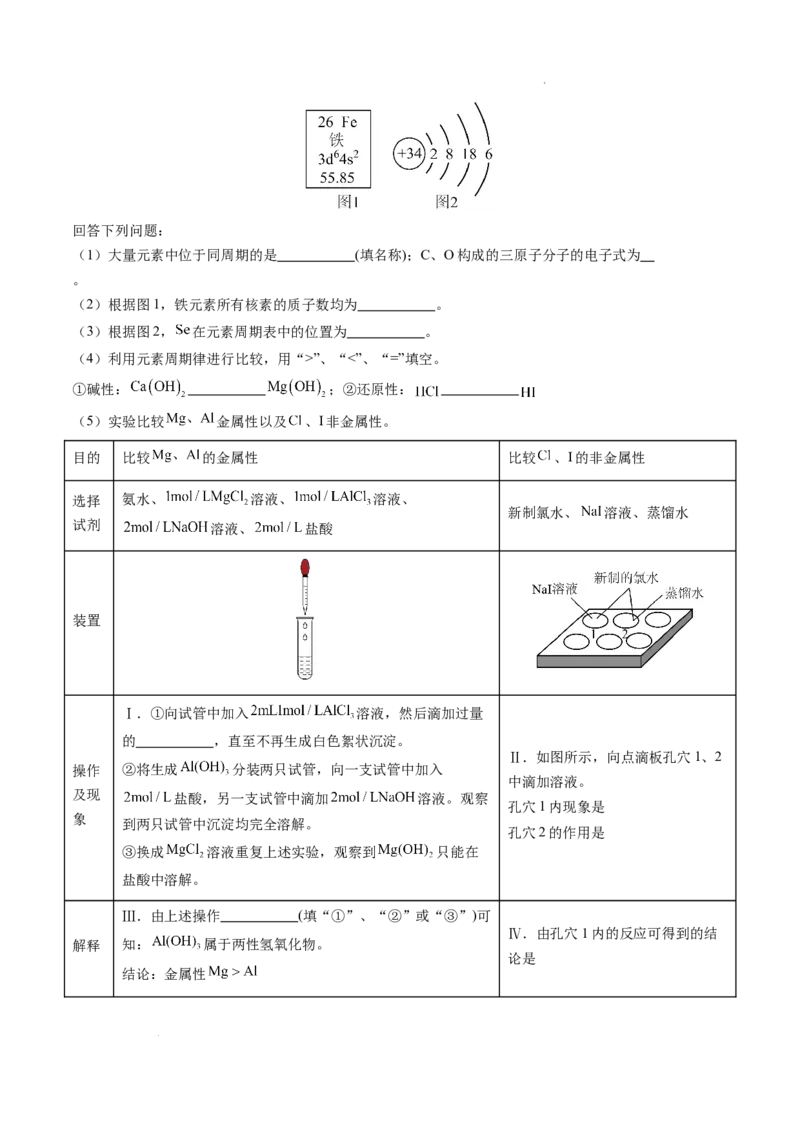
3.(2024·高一上·四川省成都市·期末)人体内含有60多种元素,其中C、O、 等为大量元素,
、I等为微量元素。图1是元素周期表中 的相关信息,图2是 的原子结构示意图。
学科网(北京)股份有限公司回答下列问题:
(1)大量元素中位于同周期的是 (填名称);C、O构成的三原子分子的电子式为
。
(2)根据图1,铁元素所有核素的质子数均为 。
(3)根据图2, 在元素周期表中的位置为 。
(4)利用元素周期律进行比较,用“>”、“<”、“=”填空。
①碱性: ;②还原性:
(5)实验比较 金属性以及 、I非金属性。
目的 比较 的金属性 比较 、I的非金属性
选择 氨水、 溶液、 溶液、
新制氯水、 溶液、蒸馏水
试剂 溶液、 盐酸
装置
Ⅰ.①向试管中加入 溶液,然后滴加过量
的 ,直至不再生成白色絮状沉淀。
Ⅱ.如图所示,向点滴板孔穴1、2
操作 ②将生成 分装两只试管,向一支试管中加入
中滴加溶液。
及现 盐酸,另一支试管中滴加 溶液。观察
孔穴1内现象是
象
到两只试管中沉淀均完全溶解。
孔穴2的作用是
③换成 溶液重复上述实验,观察到 只能在
盐酸中溶解。
Ⅲ.由上述操作 (填“①”、“②”或“③”)可
Ⅳ.由孔穴1内的反应可得到的结
解释 知: 属于两性氢氧化物。
论是
结论:金属性
学科网(北京)股份有限公司学科网(北京)股份有限公司