文档内容
2024-2025 学年高一化学上学期第一次月考卷
(考试时间:75 分钟 试卷满分:100 分)
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考证号
填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡
皮擦干净后,再选涂其他答案标号。写在本试卷上无效。
3.回答第Ⅱ卷时,将答案写在答题卡上。写在本试卷上无效。
4.测试范围:第 1 章(人教版 2019 必修第一册)。
5.难度系数:0.68
6.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16
第Ⅰ卷(选择题 共 44 分)
一、选择题:本题共 16 个小题,共 44 分。第 1~10 小题,每小题 2 分;第 11~16 小题,每小题 4 分。在
每小题给出的四个选项中,只有一项是符合题目要求的。
1.智能机器人在生活中发挥着重要作用,以下应用过程中涉及化学变化的是
A.导览讲解 B.送餐服务 C.消防灭火 D.清扫灰尘
【答案】C
【解析】A.导览讲解的过程中没有新物质生成,属于物理变化,A 不符合题意;
B.送餐服务的过程中没有新物质生成,属于物理变化,B 不符合题意;
C.消防灭火的过程中有新物质生成(如使用灭火剂发生化学反应灭火),属于化学变化,C 符合题意;
D.清扫灰尘的过程中没有新物质生成,属于物理变化,D 不符合题意。
故选 C。
2.2024 年 1 月,我国第一架四座氢内燃机飞机完成了原型机首飞。该飞机所用燃料液氢为
A.单质 B.化合物 C.溶液 D.混合物
【答案】A
【解析】液氢是氢气(H )的液态形式,是仅由氢一种元素(H)组成的纯净物,属于单质,故合理选项是 A。
2
/3.某饮料含有蔗糖、 、 、 、 等,用于运动后补充电解质。下列物质不属于电解质的是
A.蔗糖 B. C. D.
【答案】A
【分析】电解质是溶于水或熔融时能导电的化合物。
【解析】A.蔗糖为有机物,溶解时不电离,属于非电解质,A 符合题意;
B. KCl 为离子化合物,溶解或熔融时均可电离出离子,属于电解质,B 不符合题意;
C. CaCl 为离子化合物,溶解或熔融时均可电离出离子,属于电解质,C 不符合题意;
2
D .NaCl 为离子化合物,溶解或熔融时均可电离出离子,属于电解质,D 不符合题意;
故答案为 A。
4.分类法是化学研究中常用的方法。下列分类正确的是
A.化合物:二氧化锰、四氧化三铁、水
B.复合肥:硝酸钾、硝酸铵、碳酸铵
C.空气污染物:二氧化氮、二氧化硫、二氧化碳
D.金属材料:钛合金、铝、玻璃钢
【答案】A
【解析】A.二氧化锰、四氧化三铁、水均为不同元素组成的纯净物,属于化合物,A 正确;
B.硝酸钾含钾和氮,是复合肥,硝酸铵和碳酸铵仅含氮,属于氮肥,B 错误;
C.二氧化氮、二氧化硫是空气污染物,但二氧化碳是空气成分而非污染物,C 错误;
D.钛合金和铝是金属材料,但玻璃钢是复合材料,D 错误;
故答案选 A。
5.以 Fe、CuO 和 H SO 三种物质为原料,用两种方法制取 Cu,下列涉及的反应不属于氧化还原反应的
4
是
A. B.
C. D.
【答案】C
【解析】A.Fe 与 HSO 反应生成 FeSO 和 H,Fe 的化合价从 0 升至+2,H 的化合价从+1 降至 0,属
2 4 4 2
于氧化还原反应,A 不符合题意;
B.CuO 与 H 反应生成 Cu 和 HO,Cu 的化合价从+2 降至 0,H 的化合价从 0 升至+1,属于氧化还原
2 2
反应,B 不符合题意;
C.CuO 与 HSO 反应生成 CuSO 和 HO,Cu、S、H、O 的化合价均未变化,属于复分解反应,不属
2 4 4 2
于氧化还原反应,C 符合题意;
D.Fe 与 CuSO 反应生成 FeSO 和 Cu,Fe 的化合价从 0 升至+2,Cu 的化合价从+2 降至 0,属于氧化
4 4
还原反应,D 不符合题意;
/故选 C。
6.下列各组离子能在溶液中大量共存的是
A. B.
C. D.
【答案】A
【解析】A. 均为可溶性离子,彼此间不生成沉淀或气体,也不发生氧化还原反应,
能大量共存,A 正确;
B.Fe3+具有强氧化性,I-具有还原性,两者在溶液中会发生氧化还原反应生成 Fe2+和 I,不能大量共存,
2
B 错误;
C.Fe2+与 OH-结合生成 Fe(OH) 沉淀,Ca2+与 OH-在较高浓度时生成微溶的 Ca(OH) ,因此不能大量共
2 2
存,C 错误;
D.H+ 与 反应生成 CO
2
和 H
2
O,两者不能共存,D 错误;
故选 A。
7.“奋斗者号”载人深海潜水器在海底拍到如图所示的壮丽景象。其中的光柱主要源于
A.分子运动 B.丁达尔效应 C.光的反射 D.海水的流动
【答案】B
【解析】在海水中含有大量微小悬浮颗粒,当光线透入海水时,这些颗粒会使光发生散射,形成明显的
“光柱”现象,这正是丁达尔效应。分子运动、光的反射或海水流动均不足以产生如图所示的光柱,故选
B。
8.依据下列实验事实证据,所得结论正确的是
铜丝能导电 固体不导电
A.铜是电解质 B. 固体中不含离子
溶液能导电 熔融 能导电
/C. 在通电条件下发生电离 D. 是电解质
【答案】D
【解析】A.铜是单质,既不是电解质也不是非电解质,A 项错误;
B. 固体中含 Na+ 、Cl-,但要溶于水或熔融态离子才可以自由移动,才能导电,B 项错误;
C. 在溶于水或熔融态发生电离,C 项错误;
D.电解质指在水或熔融态能导电的化合物, 是电解质,D 项正确;
答案选 D。
9.欲除去粗盐中含有的 ,下列加入三种除杂试剂顺序方案,不可行的是
A. B.
C. D.
【答案】D
【解析】加过量的 NaOH 溶液可将 Mg2+转化为 Mg(OH) 沉淀而除去,加过量的 NaCO 溶液可将 Ca2+
2 2 3
转化为 CaCO 沉淀而除去,加过量的 BaCl 溶液可将 转化为 而除去,而过量的 NaOH 溶液、
3 2
NaCO 溶液后续加入盐酸可除去,过量的 BaCl 溶液需加 NaCO 溶液除去,为使实验步骤简单,BaCl
2 3 2 2 3 2
溶液要在 NaCO 溶液之前加入(加入 NaOH 溶液除去 Mg2+在试剂使用顺序上无要求),因此三种试剂使
2 3
用顺序可以是 NaOH、BaCl 、NaCO 或 BaCl 、NaCO、NaOH 或 BaCl 、NaOH、NaCO,而不能按
2 2 3 2 2 3 2 2 3
NaCO、NaOH、BaCl 的顺序,故选 D。
2 3 2
10.《天工开物》中记载:“凡火药以硝石、硫黄为主,草木灰为辅”。黑火药爆炸时发生的反应为 S
+2KNO +3C KS+N↑+3CO ↑。下列说法正确的是
3 2 2 2
A.在反应中作氧化剂只有 KNO
3
B.S 元素的化合价降低,发生氧化反应
C.反应的还原产物是 KS 和 CO
2 2
D.每生成 1 个 CO 分子转移的电子数为 4 个
2
【答案】D
11.如图-1 所示,向一定量滴有酚酞的 溶液,匀速、逐滴加入稀硫酸,滴加过程中测得溶液电导
率的变化如图-2 所示。下列说法不正确的是
/A.烧杯中产生白色沉淀,液体的红色变浅直至无色
B.a 点导电的原因是溶液中存在自由移动的 和
C.b 点时能说明 与硫酸恰好完全反应
D.用 溶液代替稀硫酸重新实验,电导率变化与图-2 相同
【答案】D
【解析】A.硫酸与氢氧化钡反应生成硫酸钡沉淀和水,溶液由碱性逐渐变成中性,再滴加稀硫酸,又
变成酸性,观察到烧杯中产生白色沉淀,液体的红色变浅直至无色,故 A 不符合题意;
B.a 点导电的原因是溶液中存在自由移动的钡离子和氢氧根离子,故 B 不符合题意;
C.由图知,b 点的电导率几乎为零,此时溶液中自由移动的离子很少,说明氢氧化钡与硫酸恰好完全
反应,故 C 不符合题意;
D.硫酸钠与氢氧化钡反应生成硫酸钡沉淀和氢氧化钠,溶液中含有钠离子和氢氧根离子,溶液的电导
率变化不大,故 D 符合题意。
故选 D。
12.甲烷催化制甲醇的示意图如下(按顺序发生反应①②),有关说法不正确的是
A.反应①中 被氧化 B.CuO 是整个反应的催化剂
C.反应②中 为还原剂 D.反应得到的产物有 和
【答案】C
【解析】A.在反应①中,CH 转化为 CHOH,碳元素的化合价从-4 价升高到-2 价,化合价升高被氧
4 3
化,A 正确;
B.从整个反应过程来看,CuO 在反应①中参与反应,在反应②中又生成,其质量和化学性质在反应前
后不变,是整个反应的催化剂,B 正确;
C.在反应②中, HO 与 Cu O 反应生成 H 和 CuO,HO 中氢元素化合价从+1 价降低到 0 价,故 HO
2 2 2 2 2
是氧化剂,不是还原剂,C 错误;
D.由反应示意图可知,反应①生成 CHOH,反应②生成 H,所以反应得到的产物有 CHOH 和 H,
3 2 3 2
D 正确;
故答案选 C。
13.我国是世界产盐大国,海水晒盐得到的粗盐中含有 、 、 ,粗盐经过如图步骤得到精盐。
下列说法错误的是
/A.“除杂”时,可依次加入 溶液、 溶液、 溶液
B.通入 是为了除去滤液中的 和
C.“操作 X”为蒸发结晶,可将多余的 HCl 除去
D.向“滤液”中先加过量稀硝酸,再滴加 溶液,有白色沉淀生成
【答案】A
【分析】粗盐溶解后过滤除去不溶性杂质,向滤液中加入过量氢氧化钠溶液除去镁离子,加入过量氯
化钡溶液除去硫酸根离子,加入过量碳酸钠溶液除去钙离子和过量的钡离子,则加入氢氧化钠和氯化
钡溶液的顺序可以调换,但加入碳酸钠溶液必须在加入氯化钡溶液之后,待杂质转化为沉淀后,过滤,
再向滤液中加入适量盐酸,除去过量氢氧根离子和碳酸根离子,最后经蒸发结晶得到精盐,则“操作 X”
为蒸发结晶,据此解答。
【解析】A.由分析可知,加入 溶液必须在加入 溶液之后,A 错误;
B.由分析可知,滤液中含有过量的 和 ,则通入 是为了除去滤液中的 和 ,B
正确;
C.由分析可知,“操作 X”为蒸发结晶,HCl 易挥发,则“操作 X”可将多余的 HCl 除去,C 正确;
D.滤液含有 NaOH、NaCO 和 NaCl,向“滤液”中先加过量稀硝酸排除了氢氧化钠和碳酸钠的干扰,
2 3
再滴加 溶液,有白色沉淀(AgCl)生成,D 正确;
故选 A。
14.向一定体积的 Ba(OH) 溶液中逐滴加入稀 HSO ,所测混合液的导电能力随时间变化曲线如图,下列
2 2 4
分析正确的是
A.溶液中发生反应的离子方程式:
B.a 时刻溶液的导电能力为 0,说明溶液中几乎没有自由移动的离子,溶液呈中性
C.AB 段溶液的导电能力不断减弱,说明生成的 BaSO 不是电解质
4
D.用 NaOH 溶液代替 Ba(OH) 重复上述实验,溶液导电能力随时间变化与上图相同
2
【答案】B
【解析】A.向一定体积的溶液中逐滴加入稀硫酸,先生成硫酸钡和水,溶液中发生反应的离子方程式:
,A 错误;
B.a 时刻溶液的导电能力为 0,说明溶液中几乎没有自由移动的离子,两者恰好完全反应,溶液呈中
性,故 B 正确;
/C.AB 段溶液的导电能力不断减弱,不断生成硫酸钡沉淀,氢氧化钡物质的量不断减小,硫酸钡是难
溶于水的盐,是电解质,C 错误;
D.用 NaOH 溶液代替 Ba(OH) 重复上述实验,生成的硫酸钠易溶于水,溶液中始终有较多自由移动离
2
子,导电能力不会降至 0,与图示曲线不同,D 错误;
故选 B。
15.将 SO 气体与足量 Fe (SO ) 溶液完全反应后, 再加入 KCr O 溶液, 发生如下两个化学反应: SO
2 2 4 3 2 2 7 2
+2Fe3++2H
2
O= +2Fe2++4H+ ,Cr
2
O +6Fe2++14H⁺=2Cr3++6Fe3++7H
2
O,有关说法正确的是
A.Cr O 中 Cr 元素为+5 价
2
B.还原性
C.两个反应中 Fe (SO ) 均作还原剂
2 4 3
D.Cr O 能将 SO 氧化成 SO
2 2
【答案】D
【分析】在同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原
产物的还原性,SO
2
+2Fe3++2H
2
O= +2Fe2++4H+ ,说明还原性 ,Cr
2
O +
6Fe2++14H⁺=2Cr3++6Fe3++7H O,说明还原性 ,则还原性 。
2
【解析】A.Cr O 中氧为-2 价,则 Cr 元素为+6 价,A 错误;
2
B.由分析,还原性 ,B 错误;
C.第一个反应中 Fe (SO ) 中铁化合价降低,作氧化剂,第二个反应中 Fe (SO ) 为氧化产物,C 错误;
2 4 3 2 4 3
D.由反应可知,Cr O 氧化性大于铁离子大于二氧化硫,则 Cr O 能将 SO 氧化成 SO ,D 正确;
2 2 2
故选 D。
16.工业副产物 可用 Deacon 催化法制成 ,实现氯资源再利用。下图为该法的一种催化机理。下列
说法不正确的是
A.①为化合反应,③为分解反应 B.⑤中反应的 和 个数比为
C.反应④中, 为还原产物 D.总反应为
【答案】B
【解析】A.①为 CuO 与 HCl 反应生成 Cu(OH)Cl,属于化合反应,③为 Cu OCl 生成 CuCl 和 CuO,
2 2 2
属于分解反应,A 正确;
B.⑤中反应 , 和 个数比为 ,B 错误;
/C.反应④中, ,化合价降低,为还原产物,C 正确;
D.结合机理,总反应为 ,D 正确;
故选 B。
第 II 卷(非选择题 共 56 分)
二、非选择题:共 4 题,共 56 分。
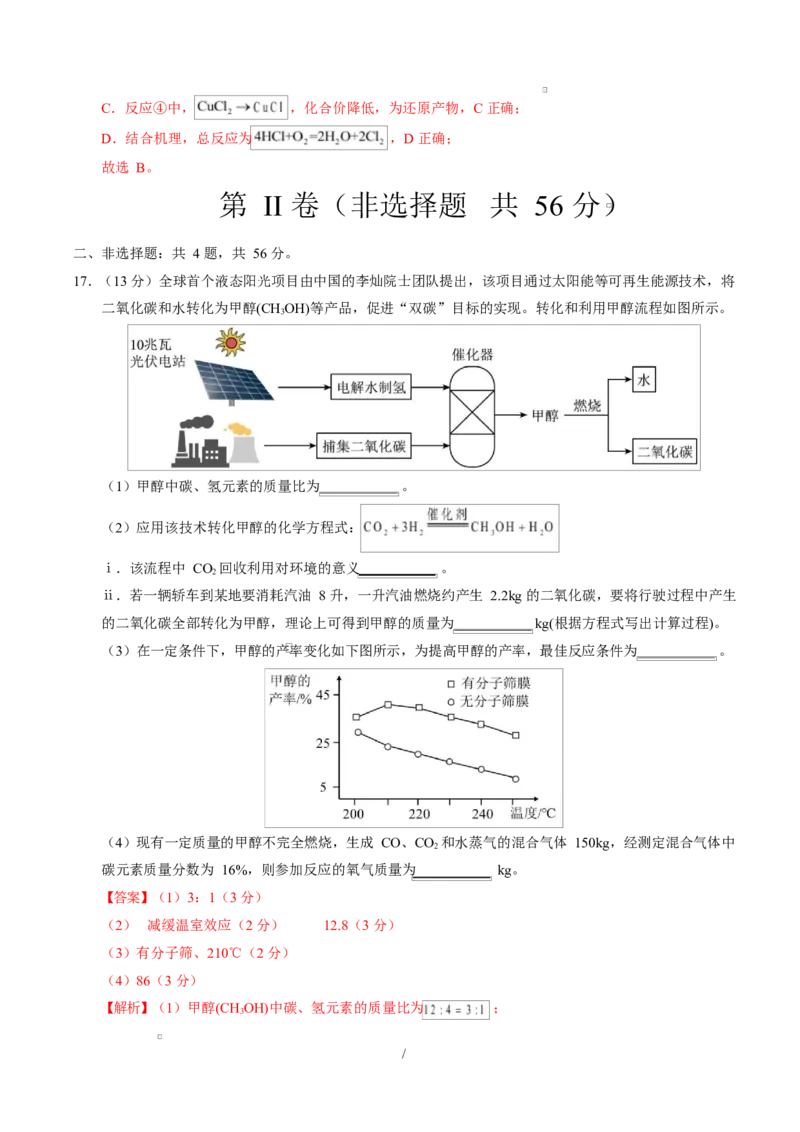
17.(13 分)全球首个液态阳光项目由中国的李灿院士团队提出,该项目通过太阳能等可再生能源技术,将
二氧化碳和水转化为甲醇(CHOH)等产品,促进“双碳”目标的实现。转化和利用甲醇流程如图所示。
3
(1)甲醇中碳、氢元素的质量比为 。
(2)应用该技术转化甲醇的化学方程式:
ⅰ.该流程中 CO 回收利用对环境的意义 。
2
ⅱ.若一辆轿车到某地要消耗汽油 8 升,一升汽油燃烧约产生 2.2kg 的二氧化碳,要将行驶过程中产生
的二氧化碳全部转化为甲醇,理论上可得到甲醇的质量为 kg(根据方程式写出计算过程)。
(3)在一定条件下,甲醇的产率变化如下图所示,为提高甲醇的产率,最佳反应条件为 。
(4)现有一定质量的甲醇不完全燃烧,生成 CO、CO 和水蒸气的混合气体 150kg,经测定混合气体中
2
碳元素质量分数为 16%,则参加反应的氧气质量为 kg。
【答案】(1)3:1(3 分)
(2) 减缓温室效应(2 分) 12.8(3 分)
(3)有分子筛、210℃(2 分)
(4)86(3 分)
【解析】(1)甲醇(CHOH)中碳、氢元素的质量比为 ;
3
/(2)ⅰ.应用该技术转化甲醇的化学方程式: ,该流程中 CO 回收利
2
用,可减少二氧化碳的排放,减缓温室效应;
ⅱ.设理论上可得到甲醇的质量为 x, , ,解得
,即理论上可得到甲醇的质量为 12.8kg;
(3)由图知,甲醇的产率在 210℃、有分子筛膜时最高,则为提高甲醇的产率,最佳反应条件为有分
子筛膜、210℃;
(4)一定质量的甲醇不完全燃烧,生成 CO、CO 和水蒸气的混合气体 150kg,经测定混合气体中碳元
2
素质量分数为 16%,其中碳元素质量为 ,碳元素守恒,参加反应甲醇的质量为
,则参加反应的氧气质量为 。
18.(16 分)Ⅰ、储氢碳纳米管的研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的碳
纳米颗粒杂质。这种碳纳米颗粒可用氧化气化法提纯反应的方程式为:3C+2K Cr O+8H SO =3CO ↑+
2 2 7 2 4 2
2KSO +2Cr (SO )+8H O。
2 4 2 4 3 2
(1)用双线桥标明电子转移方向和数目 。
(2)该反应中被还原的元素是 (填元素符号),还原产物是 (填化学式)。
(3)HSO 在该反应中表现出 (填字母)。
2 4
A.只有酸性 B.只有氧化性
C.酸性和氧化性 D.酸性和还原性
(4)该反应每生成 1 个 CO 分子时,转移 个电子。
2
Ⅱ、某一反应体系有反应物和生成物共五种物质:O、HCrO、Cr(OH) 、HO、HO 已知该反应中
2 2 4 3 2 2 2.
HO 只发生如下过程:HO →O。
2 2 2 2 2
(5)该反应中的还原剂是 (填化学式)。
(6)写出该反应的化学方程式 。
(7)向双氧水中加入铜块和稀硫酸,一段时间后溶液变蓝色,请用离子方程式解释其原
因 。
【答案】(1) (2 分)
(2)Cr(2 分) Cr (SO )(2 分)
2 4 3
/(3)A(2 分)
(4)4(2 分)
(5)HO(2 分)
2 2
(6)2HCrO+3H O=3O ↑+2Cr(OH) +2H O(2 分)
2 4 2 2 2 3 2
(7) (2 分)
【解析】(1)反应中 C 元素的化合价由 0 升高为+4 价,Cr 元素的化合价由+6 价降低为+3 价,由化合
价前后的变化分析可得双线桥法如下:
;
(2)反应中铬化合价降低,被还原,得到还原产物 Cr (SO );
2 4 3
(3)HSO 在该反应中没有元素化合价改变,反应生成硫酸盐,表现出酸性,故选 A;
2 4
(4)由(1)分析,该反应每生成 1 个 CO 分子时,转移 4 个电子。
2
(5)反应中过氧化氢中氧化合价-1 变为 0,升高被氧化为氧气,还原剂为 HO,则 HCrO 会被还原
2 2 2 4
为 Cr(OH) ,铬化合价由+6 变为+3,结合电子守恒,反应为:2HCrO+3H O=3O ↑+
3 2 4 2 2 2
2Cr(OH) +2H O;
3 2
(6)由(5)分析,反应为 2HCrO+3H O=3O ↑+2Cr(OH) +2H O;
2 4 2 2 2 3 2
(7)向双氧水中加入铜块和稀硫酸,一段时间后溶液变蓝色,说明酸性条件下,过氧化氢氧化铜单质
生成硫酸铜,同时生成水,反应为: 。
19.(15 分)通过对物质进行分类,我们可以更好地认识某类物质的性质。回答下列问题:
(1)根据酸电离出 的数目可将酸分为一元酸(如 HCl)、二元酸(如 )、三元酸(如 ),二
元酸能与碱反应生成一种正盐(如 )和一种酸式盐(如 );三元酸能与碱反应生成一种正盐
(如 )和两种酸式盐(如 、 )。 、 、 中属于二元酸的是 (填
化学式), 与 NaOH 溶液反应生成酸式盐的化学方程式为 。
(2)现有如下物质转化:
a.该转化过程中属于电解质的是 (填序号)。
b.反应Ⅳ为 (填基本反应类型)反应。
c.写出反应Ⅱ的化学方程式,并用单线桥标注电子转移的方向和数目: 。
d.向煮沸的蒸馏水中逐滴加入 5~6 滴 饱和溶液,继续煮沸至液体呈 色,停止加热,得
/到 胶体。关于 胶体与 溶液的说法正确的是 (填字母)。
A. 胶体粒子的直径为 1~100nm
B. 胶体带电
C.用丁达尔效应可区分 胶体与 溶液
D.用过滤的方法分离 胶体与 溶液
【答案】(1) 、 (2 分) (2 分)
(2)④⑦⑨(3 分) 复分解(2 分) (2 分)
红褐(2 分) AC(2 分)
【解析】(1) 、 均能电离出 2 个 H+ ,均属于二元酸;H
2
S 与 NaOH 溶液反应生成酸式盐(NaHS)
和 HO,反应的化学方程式为: 。
2
(2)a.①C 是单质,既不是电解质也不是非电解质;
②O 是单质,既不是电解质也不是非电解质;
2
③CO 在水溶液中和熔融状态下均不能电离出自由移动的离子,不能导电,属于非电解质;
④Fe O 在熔融状态下能电离出自由移动的离子,能导电,属于电解质;
2 3
⑤Fe 是单质,既不是电解质也不是非电解质;
⑥Cl 是单质,既不是电解质也不是非电解质;
2
⑦FeCl 是在水溶液和熔融状态下均能导电的化合物,属于电解质;
3
⑧NaOH 溶液是混合物,既不是电解质也不是非电解质;
⑨Fe(OH) 在水溶液中,虽溶解度很小,但溶解的那一小部分能电离出可自由移动的 Fe3+和 OH-,从而
3
具备导电的能力;且在熔融状态下,Fe(OH) 也能电离出可自由移动的 Fe3+和 OH-,从而导电,则 Fe
3
(OH) 属于电解质;所以该转化过程中所列物质属于电解质的是④⑦⑨;
3
b.反应Ⅳ化学方程式为:FeCl +3NaOH=Fe(OH) +3NaCl,该反应为复分解反应;
3 3
c.反应②中,C 元素化合价从+2 价升高至+4 价,CO 被氧化生成 CO,Fe 元素化合价从+3 价降低至
2
0 价,Fe O 被还原为 Fe,即 CO 失去电子被 Fe O 得到,则用单线桥标注电子转移的方向和数目为:
2 3 2 3
;
d.向煮沸的蒸馏水中逐滴加入 5~6 滴 FeCl 饱和溶液,继续煮沸至液体呈红褐色,停止加热,得到 Fe
3
(OH) 胶体;
3
A.胶体粒子的直径为 1~100nm,则 Fe(OH) 胶体粒子的直径为 1~100nm,故 A 正确;
3
B.Fe(OH) 胶体粒子带电,Fe(OH) 胶体不带电,故 B 错误;
3 3
C.胶体能产生丁达尔效应,溶液则不能,所以用丁达尔效应可区分 Fe(OH) 胶体与 FeCl 溶液,故 C
3 3
/正确;
D.因 Fe(OH) 胶体与 FeCl 溶液均能透过滤纸,则不能用过滤的方法分离 Fe(OH) 胶体与 FeCl 溶液,
3 3 3 3
可用渗析的方法分离其两者,故 D 错误;
故答案为 AC。
20.(12 分)氢氧化钙,俗称熟石灰或消石灰,是一种白色粉末状固体。氢氧化钙是重要的建筑材料。冬天,
树木过冬防虫,树木根部以上涂 80 cm 的石灰浆。工业上常用下列方法制备氢氧化钙。具体过程为:
将石灰石煅烧成氧化钙后,经精选与水按 1∶(3~3.5)的比例混合,生成的石灰乳经净化分离除渣,再经
离心脱水,干燥,即为氢氧化钙成品。
(1)上述短文中提供的物质,属于电解质的是 。
(2)实验室采用其它方法制备氢氧化钙,步骤包括 2Ca+O=2CaO,CaO+HO=Ca(OH) ,与这方法
2 2 2
比较,工业常用生产方法具有 等优点(任写一个)。
(3)从物质类别和元素价态视角,下列有关 CaO 的预测正确的是 (填字母)。
A.CaO 中 Ca2+具有较强还原性 B.Ca(OH) 受热易分解为 CaO
2
C.CaO 可与稀盐酸反应 D.CaO 可与 NaOH 反应
(4)农药中的波尔多液正是利用石灰乳和硫酸铜水溶液按照一定的比例配制而成的。若向波尔多液中
加入过量盐酸,最终生成蓝色澄清溶液。写出加入盐酸后主要发生的离子方程式: 。
(5)已知:CO+Ca(OH) =CaCO ↓+HO,CaCO +CO+HO=Ca(HCO ),且 Ca(HCO ) 易溶于水。
2 2 3 2 3 2 2 3 2 3 2
若向澄清石灰水中不断通入 CO 至过量。下列四个图中, (填字母)能比较准确地反映出溶液的
2
导电能力和通入 CO 气体量的关系(x 轴表示 CO 通入的量,y 轴表示导电能力)。
2 2
A. B. C. D.
【答案】(1)氢氧化钙、碳酸钙、氧化钙(3 分)
(2)原料(石灰石)来源丰富,成本低,能得到副产品二氧化碳等(2 分)
(3)BC(2 分)
(4) (3 分)
(5)D(2 分)
【解析】(1)电解质是溶于水或在熔融状态下能够导电的化合物,包括酸、碱、盐、水和多数的金属
氧化物;上述短文中提供的物质,属于电解质的是氢氧化钙、碳酸钙、氧化钙;
(2)工业常用生产方法优点为原料(石灰石)来源丰富,成本低,能得到副产品二氧化碳等;
(3)A.CaO 中 Ca2+处于钙的高价态,没有较强还原性,错误;
B.Ca(OH) 受热分解为 CaO 和水,正确;
2
C.CaO 为碱性氧化物,可与稀盐酸反应生成氯化钙和水,正确;
/D.CaO 为碱性氧化物,不可与 NaOH 反应,错误;
故选 C;
(4)石灰乳和硫酸铜生成氢氧化铜蓝色沉淀,加入盐酸,盐酸和氢氧化铜生成氯化铜和水:
;
(5)溶液或熔融电解质导电的原因是存在自由移动的离子,向澄清石灰水中不断通入 CO 至过量,开
2
始氢氧化钙转化为碳酸钙沉淀和水,恰好反应时,溶液导电性几乎为 0,二氧化碳过量,和碳酸钙反应
生成碳酸氢钙,碳酸氢钙电离出钙离子和碳酸氢根离子,溶液导电性又增强,最后溶液导电性恒定,
故选 D。
/