文档内容
2025-2026 学年高一化学上学期第一次月考卷
(考试时间:75 分钟,分值:100 分)
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考证
号填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡
皮擦干净后,再选涂其他答案标号。写在本试卷上无效。
3.回答第Ⅱ卷时,将答案写在答题卡上。写在本试卷上无效。
4.测试范围:第一章(人教版2019必修第一册)。
5.考试结束后,将本试卷和答题卡一并交回。
6.难度系数:0.7。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Fe 56 Cu 64
第Ⅰ卷(选择题 共 42 分)
一、选择题:本题共14个小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目
要求的。
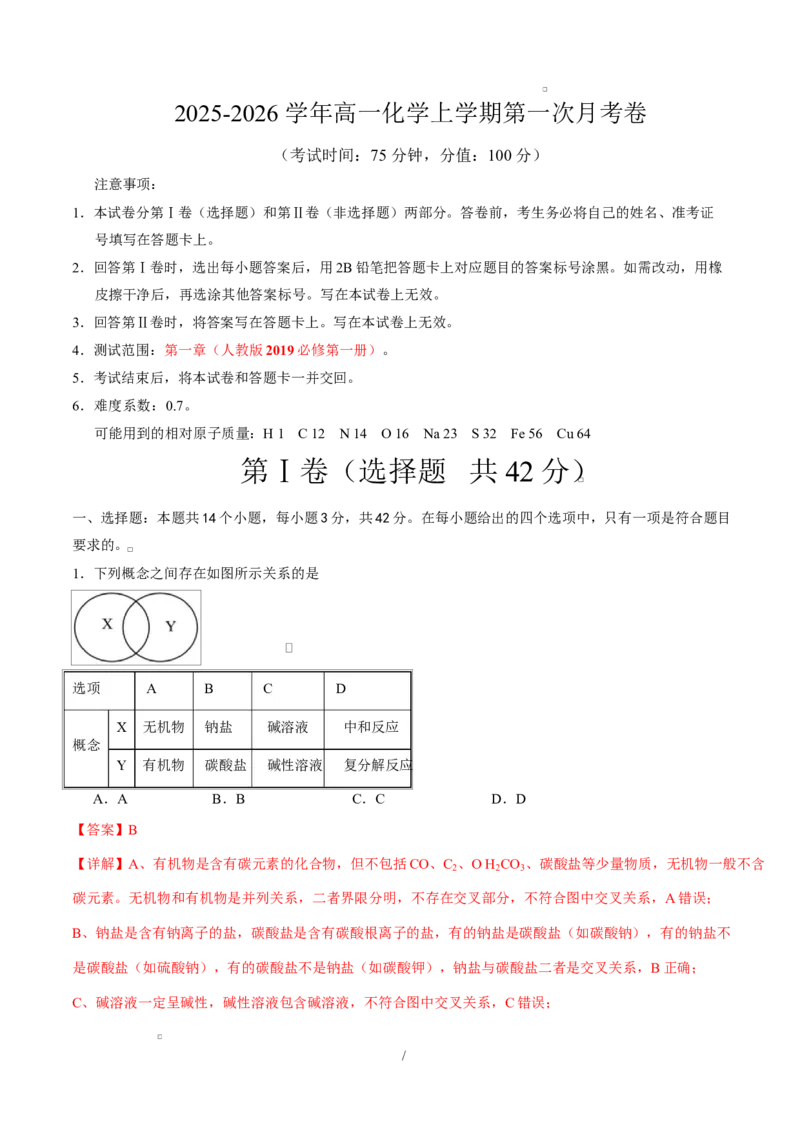
1.下列概念之间存在如图所示关系的是
选项 A B C D
X 无机物 钠盐 碱溶液 中和反应
概念
Y 有机物 碳酸盐 碱性溶液 复分解反应
A.A B.B C.C D.D
【答案】B
【详解】A、有机物是含有碳元素的化合物,但不包括CO、C 、O H CO 、碳酸盐等少量物质,无机物一般不含
2 2 3
碳元素。无机物和有机物是并列关系,二者界限分明,不存在交叉部分,不符合图中交叉关系,A错误;
B、钠盐是含有钠离子的盐,碳酸盐是含有碳酸根离子的盐,有的钠盐是碳酸盐(如碳酸钠),有的钠盐不
是碳酸盐(如硫酸钠),有的碳酸盐不是钠盐(如碳酸钾),钠盐与碳酸盐二者是交叉关系,B正确;
C、碱溶液一定呈碱性,碱性溶液包含碱溶液,不符合图中交叉关系,C错误;
/D、中和反应是酸和碱生成盐和水的反应,属于复分解反应的一种,是包含关系,不是交叉关系,D错误;
故选B。
2.下列各组物质的分类正确的是
①氯水、氨水、碱石灰、福尔马林、淀粉均属于混合物
②含有氧元素的化合物叫氧化物
③非金属氧化物为酸性氧化物,金属氧化物为碱性氧化物
④根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
⑤强电解质溶液的导电能力一定强
⑥盐酸属于混合物,而液氯、冰醋酸均属于纯净物
⑦有单质参加的反应或有单质生成的反应是氧化还原反应
⑧能电离出 的纯净物属于酸
A.全部正确 B.①②⑤⑦ C.②③⑥⑧ D.①⑥
【答案】D
【详解】氯水、氨水、福尔马林都是溶液,属于混合物,碱石灰是 和 的混合物,淀粉是高分子聚
合物,属于混合物,①正确;
氧化物是指由两种元素组成且其中一种是氧元素的化合物,含有氧元素的化合物不一定是氧化物,如
,②错误;
和 不属于酸性氧化物, 是两性氧化物,所以并不是所有非金属氧化物都是酸性氧化物或所
有金属氧化物都是碱性氧化物,③错误;
利用分散质微粒直径的大小不同,将分散系分为溶液、胶体和浊液,不是根据否具有丁达尔效应,④错
误;
强电解质的稀溶液离子浓度小,导电能力弱,⑤错误;
盐酸中含 和水,属于混合物,而液氯、冰醋酸均属于纯净物,⑥正确;
有单质参加的反应或有单质产生的反应不一定是氧化还原反应,如同素异形体之间的转化是非氧化还原反
应,⑦错误;
电离出的阳离子全部为 的纯净物才属于酸, 也能电离出 ,但不属于酸,⑧错误;
正确的是①⑥,故选D项.
阅读下列材料,回答下列小题。
元代郑允端用诗描述豆腐:“磨砻流玉乳,蒸煮结清泉。色比土酥净,香逾石髓坚。”制作豆腐是我国的一
/项传统手工技艺,包含了丰富的化学知识,蕴含着丰富的文化价值。豆腐的传统制作过程包括:①泡豆;
②磨豆;③滤浆;④煮浆;⑤点卤;⑥成形。
3.豆腐的传统制作过程①~④中,一定发生化学变化的是
A.① B.② C.③ D.④
4.“④煮浆”后得到的分散系中分散质粒子的直径在1~100nm之间,该分散系是
A.溶液 B.胶体 C.悬浊液 D.乳浊液
【答案】3.D 4.B
【解析】3.化学变化有新物质生成,有旧键断开,新键的生成,泡豆、磨豆、滤浆都没有新物质生成,煮浆
过程有蛋白质变性,属于化学变化;
答案选D;
4.分散质粒子直径在1~100nm之间的分散系属于胶体;
答案选B。
5.以下物质间的转化,在一定条件下均能一步实现的是
① ②
③ ④
A.①②③ B.①②④ C.①③④ D.①②③④
【答案】D
【详解】①中: ,均能一步实现;
②中: ,均能一步实现;
③中: ,均能一步实现;
④中: ,均能一步实现;
故①②③④都能实现一步转化,选D。
6.某校化学社团调查了以下生活生产实例,下列说法不正确的是
A.面粉工厂利用静电除尘可以证明胶体是带电的
B.尿毒症等疾病引起的血液中毒,可利用血液透析进行治疗
C.阳光穿透清晨的树林时形成的光柱,是胶体的丁达尔效应的体现
D.长江三角洲形成的主要原因是胶体的聚沉
【答案】A
【详解】A.利用胶体粒子的电性能够使胶体发生电泳,如用静电除尘器吸附带电的飘尘,而使之电泳除
/去,证明胶体粒子带电,并非是胶体带电,A错误;
B.血液属于胶体,胶体粒子不能透过半透膜,尿毒症等疾病引起的血液中毒,可利用血液透析进行治
疗,B正确;
C.阳光穿透清晨的树林时形成的光柱,是胶体的丁达尔效应的体现,C正确;
D.长江三角洲的形成是河水遇到海水中的电解质溶液发生的胶体聚沉,D正确;
故选A。
7.向一定质量的 溶液中滴加 溶液一段时间后,改为滴加稀盐酸,所得溶液总质量随加入试
剂总质量的变化趋势如图所示。下列有关说法不正确的是
A.a点时溶液中一定没有 B.ac段可观察到蓝色沉淀逐渐消失
C.b点时溶液中至少含有两种溶质 D.d点时溶液呈酸性
【答案】A
【详解】硫酸铜与氢氧化钠反应生成氢氧化铜沉淀和硫酸钠方程式为 ,
a点时溶液质量最小,此时停止加入氢氧化钠。如氢氧化钠过量,则氢氧化钠先和盐酸反应,溶液增加质量
为盐酸质量。然后盐酸和氢氧化铜反应,溶液增加质量为盐酸质量与反应的氢氧化铜质量。氢氧化铜反应完
后,溶液增加质量为加入盐酸质量。而a点后曲线只有2段,且ac段增加幅度比cd段大,所以无氢氧化钠剩
余,a点硫酸铜可能剩余。ac段发生氢氧化铜和盐酸反应生成氯化铜和水,c点后盐酸过量。
A.由分析可知,a点时溶液中可能存在硫酸铜,故溶液中可能存在铜离子,A错误;
B.ac段氢氧化铜与盐酸反应生成氯化铜和水,观察到蓝色沉淀逐渐消失,B正确;
C.b点时氢氧化铜没有被完全反应掉,a点时硫酸铜有剩余,则溶质为硫酸铜、硫酸钠和氯化铜,若a点硫
酸铜恰好完全反应,则溶质为硫酸钠、氯化铜,所以b点溶液中至少含有两种溶质,C正确;
D.c点时氢氧化铜恰好完全反应,d点时盐酸有剩余,溶液显酸性,D正确。
故选A。
8.判断下列有关化学基本概念的依据正确的是
A.溶液与胶体:二者本质不同的原因是能否发生丁达尔效应
/B.纯净物与混合物:是否仅含有一种元素
C.氧化还原反应:元素化合价是否变化
D.电解质与非电解质:物质本身的导电性
【答案】C
【详解】A.溶液与胶体本质不同的原因是微粒直径不同,胶体的微粒直径在1-100nm之间,溶液的微粒直
径小于1nm;,故A错误;
B.纯净物与混合物:看是否为同一物质组成,仅含有一种元素的也可能是混合物,如氧气和臭氧仅含有
一种元素,但是混合物,故B错误;
C.氧化还原反应的判断依据是元素化合价是否变化,有元素化合价变化的是氧化还原反应,否则不是,
故C正确;
D.强弱电解质的区别是电解质的电离程度,完全电离的是强电解质,部分电离的是弱电解质,不是看导
电能力,故D错误。
答案选C。
9.能正确表示下列反应的离子方程式的是
A.醋酸溶液除去水垢中的CaCO
3
:CaCO
3
+2H+=Ca2++H
2
O +CO
2
↑
B.碳酸钡溶于稀硫酸: +2H+=H
2
O +CO
2
↑
C.将铜丝插入硝酸银溶液中:Cu +2Ag+=Cu2++2Ag
D.氢氧化钡与硫酸铜反应:Ba2++ =BaSO ↓
4
【答案】C
【详解】A.醋酸是弱酸不拆分,醋酸溶液除去水垢中的CaCO :
3
,A错误;
B.碳酸钡溶于稀硫酸,碳酸钡不能拆,反应的离子方程式:Ba CO
3
+ 2H++ = BaSO
4
+H
2
O+ CO
2
↑,B
错误;
C.将铜丝插入硝酸银溶液中发生置换反应,离子方程式:Cu+ 2Ag+= Cu2++ 2Ag,C正确;
D.氢氧化钡和硫酸铜反应生成硫酸钡和氢氧化铜,反应的离子方程式:
,D错误;
故选C。
10.下列各组离子在酸性条件下可以大量共存的是
/A. B.
C. D.
【答案】C
【详解】A. 与 会发生氧化还原反应,不能大量共存,A不符合题意;
B. 与 会发生反应生成HClO,不能大量共存,B不符合题意;
C. 与 不发生反应,能大量共存,C符合题意;
D. 、 、 与 均能反应,不能大量共存,D不符合题意;
故选C。
11.二氧化铅常用于火柴、焰火、电极等制造。已知二氧化铅与浓盐酸反应的方程式为: (浓)
,根据该反应的有关叙述错误的是
A. 作氧化剂 B.HCl仅作还原剂
C.氧化性: D.生成 转移0.2mol电子
【答案】B
【详解】A.在反应中 中铅的化合价从 降到 价,得电子, 作氧化剂,A正确;
B.HCl中一部分Cl从 价升到0价,这部分HCl作还原剂,还有一部分HCl中的Cl的化合价不变,生成
,起酸的作用,故HCl仅作还原剂不正确,B错误;
C. 为氧化产物,故氧化性: ,C正确;
D. 的物质的量为 ,Cl从 价升到0价,故生成 转移0.2m o l电子,D
正确;
故选B。
12.已知有如下反应:
① ;
② ;
③ 。
根据上述反应,判断下列结论中错误的是
A.仅根据反应①也能判断氧化性:
B.还原性强弱的顺序为:
C.溶液中可发生:
/D. 在反应②中既是氧化产物又是还原产物
【答案】B
【分析】 中, 的化合价升高,故 为还原剂, 为氧化产物, 的化合
价降低,故 为氧化剂, 为还原产物,故氧化性 ,还原性 ;
② 中, 中 的化合价升高,故 为还原剂, 为氧化产物,
中 的化合价降低,故 为氧化剂, 为还原产物,故氧化性 ,还原性 ;
③ 中, 中 的化合价升高,故 为还原剂, 为氧化产物, 中 的
化合价降低,故 为氧化剂, 为还原产物,故氧化性 ,还原性 ,综上可得,还
原性 ,氧化性: ,据此回答。
【详解】A.由分析知,在①中, 作为氧化剂, 作为还原剂,故氧化性 ,A正确;
B.由分析知,还原性 ,B错误;
C. 中, 中 的化合价降低, 为氧化剂, 中 的化
合价升高, 为还原剂,则 为氧化产物, 为还原产物,还原剂 的还原性大于还原产物 的
还原性,氧化剂 的氧化性大于氧化产物Fe3+的氧化性,故该反应能发生,C正确;
D.由分析知,反应②中, 既是氧化产物又是还原产物,D正确;
故选B。
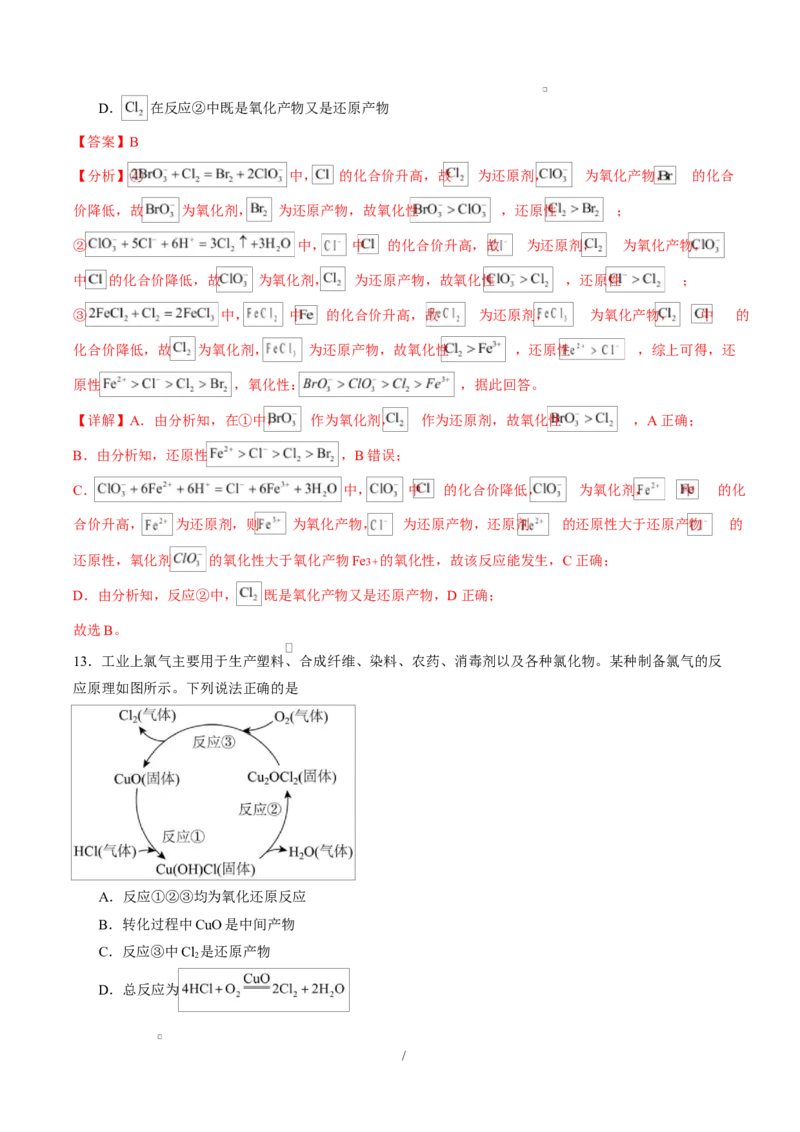
13.工业上氯气主要用于生产塑料、合成纤维、染料、农药、消毒剂以及各种氯化物。某种制备氯气的反
应原理如图所示。下列说法正确的是
A.反应①②③均为氧化还原反应
B.转化过程中CuO是中间产物
C.反应③中Cl 是还原产物
2
D.总反应为
/【答案】D
【详解】A.反应①中CuO和HCl反应生成Cu(OH)Cl,没有化合价变化,反应②中Cu(OH)Cl反应生成Cu OCl
2 2
和H O,化合价也未发生变化,因此是非氧化还原反应,故A错误;
2
B.转化过程中CuO的质量与化学性质没有发生变化,是催化剂,故B错误;
C.反应③中Cu OCl 与O 生成 ,氯元素价态升高,因此 是氧化产物,故C错误;
2 2 2
D.根据反应①②③得到总反应为 ,故D正确;
故选D。
14.已知 溶液在一定条件下与 反应的离子方程式为 。下列有
关说法错误的是
A. B.Y是
C. 发生氧化反应 D. 为还原产物
【答案】B
【详解】A.由元素的化合价变化及电子守恒、元素质量守恒、电荷守恒可知, 、 、Y为 ,A项正
确;
B.Y为 ,B项错误;
C. 中溴元素化合价升高,该物质发生氧化反应,C项正确;
D.得到电子的产物为还原产物, 为还原产物,D项正确;
答案选B。
第 II 卷(非选择题 共 58 分)
二、非选择题:本题共4个小题,共58分(除标注外,每空2分)。
15.(14分)央视《每周质量报告》曝光了一些明胶企业将皮革废料熬制成工业明胶,最终变成药用胶
囊。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)已知工业明胶含有 会对人体造成伤害,其中铬元素是 价,则其中铁元素是 价,
属于 (填“酸”、“碱”、“盐”或“氧化物”)。
(2)明胶的水溶液和 溶液共同具备的性质是 (填序号)。
a.都不稳定,密封放置会产生沉淀
b.分散质粒子都可以通过滤纸
c.二者均有丁达尔效应
/(3)已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯明胶的装置是下列中
的 (填序号)。
A. B. C.
(4)实验室常用向煮沸的蒸馏水中滴加饱和 溶液制备 胶体,证明有胶体生成的最常用的实验
操作是 。
(5)下列关于 胶体的说法正确的是_______。
A.利用丁达尔效应分离 胶体和 溶液
B. 胶体的胶粒带正电荷,在通电情况下胶粒向直流电源的负极移动,这种现象称为电泳
C.向 胶体中加入带相反电性胶粒的胶体会出现沉淀
D.向沸腾的 稀溶液中边滴加 饱和溶液,边用玻璃棒搅动,然后继续煮沸,也可制备
胶体
(6)明矾化学式是_______,其溶于水能够生成胶体,具有_______性,可以用来净水。
【答案】(1 (1分) 盐(1分)
(2)b
(3)C
(4)让一束可见光通过制得的分散系,从侧面观察到一条光亮的“通路”,说明制得的是胶体
(5)BC
(6)KAl(SO )·12H O 吸附
4 2 2
【详解】(1) 中,Cr元素是 价,O元素是-2价,则Fe元素的化合价为+2价; 是一种酸根
离子, 由金属阳离子和酸根离子构成,属于盐。
(2)a.明胶的水溶液为胶体,胶体和溶液都具有稳定性,a项不选;
b.胶体和溶液的分散质粒子都可以通过滤纸,b 项选;
c.胶体有丁达尔效应,而溶液没有,c项不选;
答案选b;
(3)明胶属于胶体,胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜,故提纯明
胶的装置为C;
/(4)可利用丁达尔效应检验胶体,具体操作为:让一束可见光通过制得的分散系,从侧面观察到一条光
亮的“通路”,说明制得的是胶体;
(5)A.利用丁达尔效应可以区分 胶体和 溶液,但不能将二者分离,A项错误;
B. 胶体的胶粒带正电荷,在通电情况下胶粒向直流电源的负极移动,这种现象称为电泳,B项正
确;
C.向 胶体中加入带相反电性胶粒的胶体,破坏了胶体的稳定,会出现沉淀,C项正确;
D.向沸腾的 稀溶液中边滴加 饱和溶液,边用玻璃棒搅动,产生 沉淀,不是
胶体,D项错误;
答案选BC。
16.(16分)Ⅰ、现有下列 10 种物质:①铝,②硫酸,③CO,④盐酸,⑤NaOH,⑥熔融KCl,⑦
2
FeSO 溶液,⑧白酒,⑨碳酸钙。
4
(1)上述物质中属于电解质的有 ,非电解质的有 ,能导电的是 。(填序号)
(2)向⑤的溶液中通入少量③,发生反应的化学方程式为 。
(3)④在水中的电离方程式为 。
(4)⑥与⑤的溶液混合,会产生 (填写颜色)沉淀。
Ⅱ、NaHSO 通常为晶体,易溶于水,它溶于水时电离出三种不同的离子,溶液显酸性。NaHSO 受热熔
4 4
化时只能电离出两种不同离子。试回答下列问题:
(5)NaHSO 在熔融状态下电离方程式为: 。
4
(6)NaHSO 在物质分类中属于(酸、碱、盐)中哪一类物质? 。
4
【答案】(1②) ⑤⑥⑨ ③①④⑥⑦
(2)CO +2NaOH=Na CO +H O
2 2 3 2
(3)H
2
SO
4
= 2H++SO
(4)红褐色
(5)NaHSO
4
(熔融)= Na++ HSO
(6)盐
【详解】(1)①铝是金属单质,不是化合物,因此不属于电解质,也不属于非电解质;金属铝中含有自由
移动的电子,因此能够导电;②硫酸是由分子构成,在水溶液中能够发生电离产生自由移动的离子而能够
导电,因此硫酸属于电解质,纯硫酸由分子构成,无自由移动的离子,因此不能导电;③CO 是由分子构
2
成,在水溶液中和熔融状态下都不能因自身发生电离而导电,因此CO 属于非电解质;④盐酸是HCl的水溶
2
/液,在水溶液中能够发生电离产生自由移动的离子而能够导电,但是盐酸属于混合物,既不是电解质也不
是非电解质;⑤NaOH是强碱,属于电解质,NaOH中含有离子但离子不能自由移动,因此不能导电;⑥
熔融KCl是纯净物,含有自由移动的离子,因此能够导电,也属于电解质;⑦Fe SO 溶液是混合物,在
4
Fe SO 溶液中含有自由移动的离子,因此能够导电;⑧乙醇C H OH是由分子构成的共价化合物,在熔融状
4 2 5
态下和水溶液都不能发生电离,因此C H OH属于非电解质,白酒主要成分为乙醇的水溶液,是混合物,
2 5
不能导电,也不属于非电解质;⑨碳酸钙属于电解质,碳酸钙中含有离子但离子不能自由移动,因此不能
导电;
上述物质中属于电解质的有 ②⑤⑥⑨ ,非电解质的有③,能导电的是①④⑥⑦;
(2)⑤的溶液中通入少量③,氢氧化钠和二氧化碳反应生成碳酸钠和水,CO +2NaOH=Na CO +H O;
2 2 3 2
(3)④在水中完全电离出氢离子和硫酸根离子,电离方程式为H
2
SO
4
= 2H++SO ;
(4)⑥与⑤的溶液混合,氢氧化钠和氯化铁反应生成氢氧化铁红褐色沉淀;
(5)NaHSO
4
在熔融状态下完全电离出钠离子和硫酸氢根离子,方程式为:NaHSO
4
(熔融)= Na++ HSO ;
(6)NaHSO 是由钠金属阳离子离子和酸根阴离子构成的化合物,属于盐。
4
17.(14分)氧化还原反应在高中化学中是一类重要的反应类型。 、 、 、 是
中学化学中常用的氧化剂。回答下列问题:
(1)下列基本反应类型中一定属于氧化还原反应的是_______(填字母)。
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
(2)实验室迅速制备少量氯气可利用如下反应: 。上
述反应中被氧化的元素为 (填元素符号);还原产物为 (填化学式)。
(3) 溶液能与Cu反应制作印刷电路板,其制作原理可用 表示。
①上式中X的化学式为 。
②该反应的离子方程式为 。
(4)已知方程式: 。用双线桥法标出电子转移的方向和数
目 。
(5)某反应的反应物与生成物有 、KCl、 、 、HCl(浓)、 ,已知氧化性:
,写出并配平该化学方程式: 。
【答案】(1)C
(2) Cl
(3)
/(4)
(5)
【详解】(1)在四大基本反应类型中,置换反应一定属于氧化还原反应,故答案选C;
(2)Cl元素化合价由-1价变为0价,化合价升高,被氧化;Mn元素化合价由+7价变为+2价,化合价降
低,被还原,故还原产物为 ;
(3)① ,根据质量守恒定律可知,X为Fe Cl ;
2
②反应 中, 、 和 均为易溶的强电解质,可拆,而Cu为单质,不
能拆,故离子方程式为 ;
(4)
反应中KClO →Cl ,Cl元素化合价由+5价变为0价,1个KClO 得到5个电子;HCl→Cl ,Cl元素化合价由-1
3 2 3 2
价变为0价,5个HCl体现还原性,共失去5个电子,则双线桥法标出电子转移的方向和数目为
;
(5)某反应的反应物与生成物有 、KCl、 、 、HCl浓( )、 ,已知氧化性: ,
则 为氧化剂, 为氧化产物, 中Cr元素化合价降低,转化为 ,HCl中Cl元素化合价升
高,转化为 ,根据得失电子守恒及质量守恒定律可配平,得到化学方程式为
。
18.(14分)已知碳酸亚铁在隔绝空气的条件下,受热易分解生成氧化亚铁和二氧化碳。某化学兴趣小组
用下图所示的装置模拟炼铁过程,并测定某样品中碳酸亚铁的含量(该装置气密性良好,B中氢氧化钠溶液
足量),
实验过程中,先打开K通入一氧化碳再加热;装置A中固体质量不再减少后,停止加热,待装置A冷却到室
温后关闭K。实验测得装置A中固体减少了 ,装置B中液体质量增加了 。回答下列问题:
/(1)写出装置A中发生的反应的化学方程式 ;步骤“装置A中固体质量不再减少后,停止加热,
待装置A冷却到室温后关闭K的目的是 。
(2)能判断生成的二氧化碳全部被装置B吸收的依据是:装置B中质量增加且 。
(3)若生成的二氧化碳全部被装置B吸收,不考虑水的蒸发且该样品中所含杂质不参加反应,则a
(填“ ”、“ ”或“ ”)b。
(4)D处为收集尾气的装置,应选择 装置(填“甲”、“乙”或“丙”)。
(5)碳酸亚铁在空气中加热则生成四氧化三铁和二氧化碳,该反应的化学方程式是 。
【答案】(1) 、 (每个方程式2分) 防止灼热的铁被空
气中氧气氧化
(2)C中澄清的石灰水不变浑浊
(3)<
(4)乙
(5)
【分析】先打开K通入一氧化碳净排装置中空气,后加热,装置A中固体质量不再减少后,此时已经完全反
应,停止加热,待装置A冷却到室温后关闭K;生成气体通过氢氧化钠溶液吸收,通过C装置检验吸收完
全,尾气有毒需要使用乙装置吸收处理。
【详解】(1)已知碳酸亚铁在隔绝空气的条件下,受热易分解生成氧化亚铁和二氧化碳,一氧化碳能还原
金属氧化物,则装置A中发生的反应有碳酸亚铁受热分解生成氧化亚铁和二氧化碳,一氧化碳还原氧化亚
铁,反应的化学方程式为: 、 ;待装置A冷却到室温后关闭K的
目的是防止灼热的铁被空气中氧气氧化;
(2)判断生成的二氧化碳全部被装置B吸收的依据是:装置B的质量增加并且C中澄清的石灰水不变浑浊;
(3)装置A中固体减少的质量为碳酸亚铁中碳氧元素质量,装置B中增加的质量为二氧化碳的质量,装置B
中的二氧化碳除了碳酸亚铁中的C和O,还包含了CO中的C和O,则B中吸收二氧化碳的质量大于A装置减小
的质量,故a< b;
(4)一氧化碳有毒,排放到空气中会污染大气,所以要进行尾气处理,乙装置能用排水法收集尾气,故
选乙;
/(5)碳酸亚铁在空气中加热则生成四氧化三铁和二氧化碳,根据质量守恒可知,空气中氧气也参与反
应,故该反应的化学方程式是 。
/