文档内容
2025-2026 学年高一年级化学上学期第一次月考卷
(考试时间:75 分钟 试卷满分:100 分)
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考证号
填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡
皮擦干净后,再选涂其他答案标号。写在本试卷上无效。
3.回答第Ⅱ卷时,将答案写在答题卡上。写在本试卷上无效。
4.测试范围:第一章(人教版 2019)。
5.难度系数:0.7
6.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 Cl-35.5 K-39
Ca-40 Ti-48 Cr-52 Fe-56 Ni-59 Cu-64 Ba-137
第Ⅰ卷(选择题 共 45 分)
一、选择题:本题共 15 个小题,每小题 3 分,共 45 分。在每小题给出的四个选项中,只有一项是符合题
目要求的。
1.唐代诗人刘禹锡《浪淘沙》诗“日照澄洲江雾开,淘金女伴满江限。美人首饰侯王印,尽是沙中浪底来。”
描述了古代淘金的场景。下列说法错误的是
A.雾是一种常见的气溶胶 B.雾中分散质的粒径比钠离子小
C.阳光透过雾会产生丁达尔效应 D.金从“沙中浪底来”不涉及化学变化
【答案】B
【详解】A.雾是胶体,由于分散剂是空气,所以是气溶胶,A 正确;
B.根据分散质颗粒粒子直径大小不同,把分散系分为溶液、胶体与浊液,胶体粒子的微粒直径在 1
~100nm 之间,分散质微粒直径小于 1nm 的是溶液,大于 100nm 的是浊液,雾中分散质的粒径比钠离子
大,B 错误;
C.雾是胶体,阳光透过雾会产生丁达尔效应,C 正确;
D.金的化学性质稳定,可以单质的形式存在于自然界,金从“沙中浪底来”,该过程没有新物质生成,
属于物理变化,D 正确;
故答案为:B。
2.下列物质分类正确的是
A. 、 、 均为酸性氧化物
/B. 、有色玻璃、鸡蛋清均为混合物
C.浓硫酸、NaClO、 均能做氧化剂
D.冰、冰醋酸、干冰均为电解质
【答案】C
【详解】A.NO 与碱发生氧化还原反应,不属于酸性氧化物,SiO 和 CO 均能与碱(前者和强碱)反应
2 2 2
生成盐和水,属于酸性氧化物,A 错误;
B.CuSO ·5H O 是纯净物,有色玻璃和鸡蛋清是混合物,B 错误;
4 2
C.浓硫酸(+6 价 S)、NaClO(+1 价 Cl)、HO(-1 价 O)均具有强氧化性,均可作氧化剂,C 正确;
2 2
D.冰(HO)和冰醋酸(CHCOOH)是电解质,干冰(CO)是非电解质,D 错误;
2 3 2
故选 C。
3.下列说法错误的是
A.胶体粒子的直径大小在 1~100nm 之间
B.当光束通过 NaCl 溶液时会产生丁达尔效应
C.氢氧化铝胶体粒子具有较强的吸附能力,可作净水剂
D.向沸水中逐滴加入少量饱和 FeCl 溶液,可制得 Fe(OH) 胶体
3 3
【答案】B
【详解】A.根据分散质粒子大小不同将分散系分为溶液、胶体、浊液,胶体粒子的直径大小在 1
~100nm 之间,A 正确;
B.NaCl 溶液属于溶液,溶液没有丁达尔效应,B 错误;
C.氢氧化铝胶体有吸附能力,可作净水剂,C 正确;
D.沸水中滴加氯化铁饱和溶液,继续加热至液体呈红褐色可以制备氢氧化铁胶体,D 正确;
故选 B。
4.实现下列物质之间的转化,需要加入氧化剂才能实现的是
A.SO →HSO B.Cu→Cu(NO ) C.CO→CO D.CaO→Ca(OH)
3 2 4 3 2 2 2
【答案】B
【详解】A.SO →HSO 元素化合价没有变化,不是氧化还原反应,不需要加氧化剂,A 错误;
3 2 4
B.Cu→Cu(NO ),Cu 元素化合价升高被氧化,需要价氧化剂,B 正确;
3 2
C.CO→CO,C 的化合价降低被还原,需要价还原剂,C 错误;
2
D.CaO→Ca(OH) ,元素化合价没有变化,不属于氧化还原反应,不需要加氧化剂,D 错误;
2
答案选 B。
5.氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是
/A.
B.
C.
D.
【答案】A
【详解】A.该反应有元素化合价的变化,属于氧化还原反应,且不属于四大基本反应类型,A 符合题
意;
B.该反应有元素化合价的变化,属于氧化还原反应,也属于置换反应,B 不符合题意;
C.该反应属于分解反应,但无元素化合价的变化,不属于氧化还原反应,C 不符合题意;
D.该反应有元素化合价的变化,属于氧化还原反应,属于化合反应,D 不符合题意;
故选 A。
6.磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性。制备时将含等量的 和
的溶液混合再滴入稍过量的 溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒
子直径为 的磁流体。下列说法中正确的是
A.该磁流体与 溶液的分散质粒子直径相同
B.用光束照射磁流体时,可以产生丁达尔效应
C.该磁流体可以通过过滤的方法提纯
D.该磁流体的制备过程只涉及物理变化
【答案】B
【详解】A.该磁流体分散质粒子直径为 5.5 ~ 36 nm,属于胶体;而氯化钠溶液分散质微粒直径小于 1 nm,
属于溶液,二者是不同种分散系,A 错误;
B.该磁流体分散质粒子直径为 5.5 ~ 36 nm,属于胶体,用一束光照射该磁流体时,可以观察到一条光
亮的“通路”,即发生丁达尔效应,B 正确;
C.该磁流体分散质微粒直径比较小,能够通过滤纸,不能用过滤的方法分离提纯,C 错误;
D.制备时该磁流体时,将含等量的 FeSO 和 Fe (SO ) 的溶液混合再滴入稍过量的 NaOH 溶液,它们
4 2 4 3
发生了复分解反应,随后加入油酸钠溶液,即可生成黑色的、分散质粒子直径为 5.5 ~ 36 nm 的磁流体,
制取时发生了化学变化,D 错误;
故答案为 B。
/7.下列各组离子,能够大量共存于同一溶液中的是
A.H+、K+、NO 、CO B.Ba2+、NO 、OH-、Cu2+
C.Na+、Cl-、Mg2+、SO D.Ba2+、Na+、NO 、SO
【答案】C
【详解】A.H+与 CO 反应生成二氧化碳气体,A 不符合;
B. OH-、Cu2+反应生成氢氧化铜沉淀,B 不符合;
C. Na+、Cl-、Mg2+、SO 互不反应、可以大量共存,C 符合;
D. Ba2+、SO 反应生成硫酸钡沉淀, D 不符合;
答案选 C。
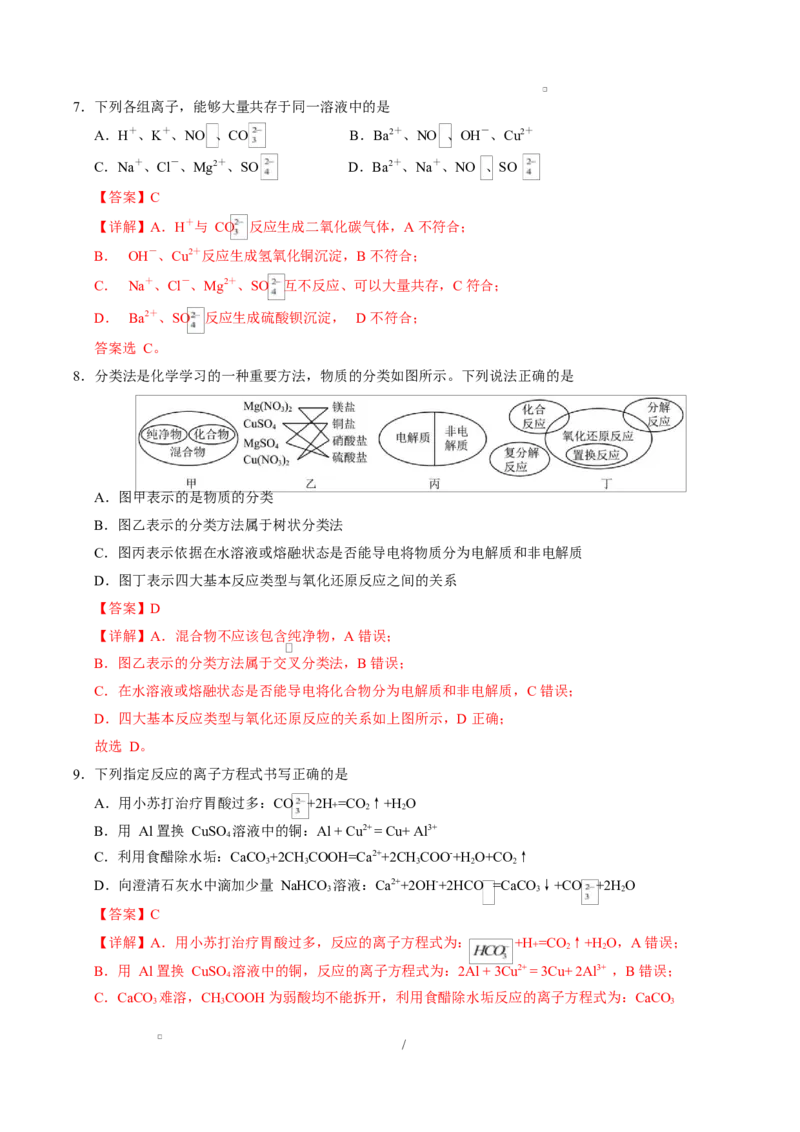
8.分类法是化学学习的一种重要方法,物质的分类如图所示。下列说法正确的是
A.图甲表示的是物质的分类
B.图乙表示的分类方法属于树状分类法
C.图丙表示依据在水溶液或熔融状态是否能导电将物质分为电解质和非电解质
D.图丁表示四大基本反应类型与氧化还原反应之间的关系
【答案】D
【详解】A.混合物不应该包含纯净物,A 错误;
B.图乙表示的分类方法属于交叉分类法,B 错误;
C.在水溶液或熔融状态是否能导电将化合物分为电解质和非电解质,C 错误;
D.四大基本反应类型与氧化还原反应的关系如上图所示,D 正确;
故选 D。
9.下列指定反应的离子方程式书写正确的是
A.用小苏打治疗胃酸过多:CO +2H+=CO
2
↑+H
2
O
B.用 Al 置换 CuSO 溶液中的铜:Al + Cu2+ = Cu+ Al3+
4
C.利用食醋除水垢:CaCO +2CH COOH=Ca2++2CH COO-+H O+CO↑
3 3 3 2 2
D.向澄清石灰水中滴加少量 NaHCO 溶液:Ca2++2OH-+2HCO =CaCO ↓+CO +2H O
3 3 2
【答案】C
【详解】A.用小苏打治疗胃酸过多,反应的离子方程式为: +H+=CO
2
↑+H
2
O,A 错误;
B.用 Al 置换 CuSO 溶液中的铜,反应的离子方程式为:2Al + 3Cu2+ = 3Cu+ 2Al3+ ,B 错误;
4
C.CaCO 难溶,CHCOOH 为弱酸均不能拆开,利用食醋除水垢反应的离子方程式为:CaCO
3 3 3
/+2CH COOH=Ca2++2CH COO-+H O+CO↑,C 正确;
3 3 2 2
D.向澄清石灰水中滴加少量 NaHCO 溶液反应生成 CaCO 、NaOH 和 HO,反应的离子方程式为:Ca2
3 3 2
++OH-+ =CaCO
3
↓+H
2
O,D 错误;
故选 C。
10.下列各氧化还原反应方程式中电子转移表示方法正确的是
A. B.
C. D.
【答案】B
【详解】A.该反应中水中 H 得电子,O 失电子,且转移电子数为 4,故 A 错误;
B.Fe 元素共得到 8 个电子,C 元素共失去 8 个电子,双线桥表示正确,故 B 正确;
C.氯气在反应中既得电子也失去电子,电子转移数为 1,故 C 错误;
D.反应中 Cl 元素化合价从+5 降为 0,得电子,HCl 中 Cl 元素化合价从-1 升高为 0,失电子,反应
转移 5 mol 电子,表示方法错误,故 D 错误;
答案选 B。
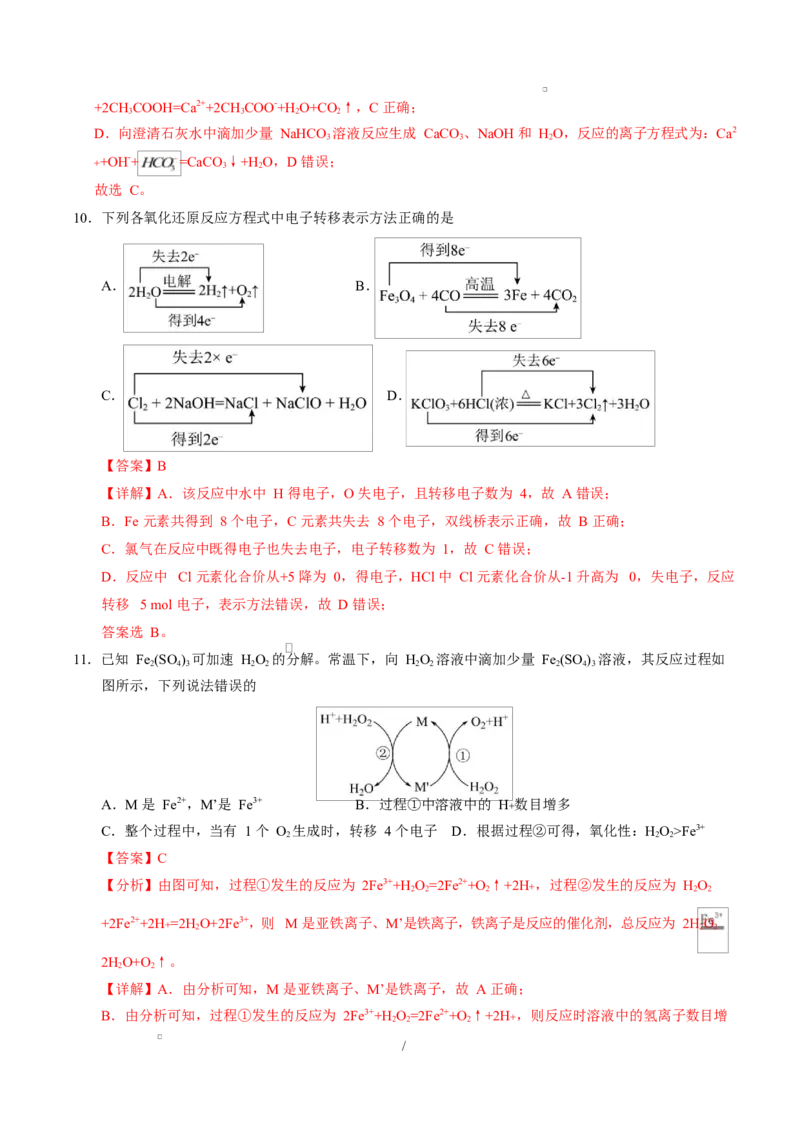
11.已知 Fe (SO ) 可加速 HO 的分解。常温下,向 HO 溶液中滴加少量 Fe (SO ) 溶液,其反应过程如
2 4 3 2 2 2 2 2 4 3
图所示,下列说法错误的
A.M 是 Fe2+,M’是 Fe3+ B.过程①中溶液中的 H+ 数目增多
C.整个过程中,当有 1 个 O 生成时,转移 4 个电子 D.根据过程②可得,氧化性:HO>Fe3+
2 2 2
【答案】C
【分析】由图可知,过程①发生的反应为 2Fe3++H
2
O
2
=2Fe2++O
2
↑+2H+ ,过程②发生的反应为 H
2
O
2
+2Fe2++2H+=2H
2
O+2Fe3+,则 M 是亚铁离子、M’是铁离子,铁离子是反应的催化剂,总反应为 2H
2
O
2
2HO+O↑。
2 2
【详解】A.由分析可知,M 是亚铁离子、M’是铁离子,故 A 正确;
B.由分析可知,过程①发生的反应为 2Fe3++H
2
O
2
=2Fe2++O
2
↑+2H+ ,则反应时溶液中的氢离子数目增
/多,故 B 正确;
C.由分析可知,总反应为 2HO 2HO+O↑,则有 1 个氧气生成时,转移 2 个电子,故 C 错误;
2 2 2 2
D.由分析可知,过程②发生的反应为 H
2
O
2
+2Fe2++2H+=2H
2
O+2Fe3+,反应中氧元素的化合价降低被还
原,过氧化氢是反应的氧化剂,铁元素的化合价升高被氧化,铁离子是反应的氧化产物,则由氧化剂
的氧化性强于氧化产物可知,过氧化氢的氧化性强于铁离子,故 D 正确;
故选 C。
12.粗盐中常含有杂质 和 ,为将杂质除尽,设计如下实验方案:
下列有关说法中,不正确的是
A.试剂①、②、③分别是
B.除去 的主要反应:
C.加稀盐酸是为了除去过量的 和
D.检验 是否除净的方法:取滤液,加稀盐酸酸化,再加 溶液,观察是否产生沉淀
【答案】A
【分析】除去粗盐中的 MgCl 、CaCl 和 NaSO 杂质,所用的试剂是 NaOH、NaCO、BaCl ,为了能
2 2 2 4 2 3 2
完全除去杂质,除杂试剂要过量,过量的 NaOH、NaCO 可用稀盐酸调节 pH 除去,过量的 BaCl 可
2 3 2
用 NaCO 除去,故除杂试剂的添加顺序是 NaOH 、BaCl 、NaCO 或 BaCl 、NaOH、NaCO,据此
2 3 2 2 3 2 2 3
分析解答。
【详解】A.经分析除去粗盐中的 MgCl 、CaCl 和 NaSO 所加试剂顺序是 NaOH 、BaCl 、NaCO
2 2 2 4 2 2 3
或 BaCl 、NaOH、NaCO,碳酸钠必须在氯化钡之后加入,故 A 错误;
2 2 3
B.除去 Ca2+的主要试剂是 NaCO,则除去 Ca2+的主要反应是 ,故 B 正确;
2 3
C.经分析,除杂试剂要过量,过量的 NaOH、NaCO 可用稀盐酸调节 pH 除去,故 C 正确;
2 3
D.检验滤液中是否有 的方法是取适量滤液,加稀盐酸酸化,再加 BaCl 溶液,若有沉淀,则有
2
,否则就没有,故 D 正确;
本题答案 A。
13.亚硝酸钠 具有致癌作用,许多腌制食品中含 。酸性 溶液与亚硝酸钠反应的离
子方程式为 (未配平),下列叙述错误的是
A.生成 1 个 Mn2+,转移 5 个电子 B.该反应中氮元素被氧化
C.配平后,水的化学计量数为 3 D.反应中氧化产物与还原产物的粒子个数之比为 2:5
【答案】D
【分析】根据得失电子守恒、原子守恒、电荷守恒,配平离子方程式为
/,据此分析;
【详解】A.反应过程中,Mn 元素的化合价由+7 价降至+2 价,生成 1 个 Mn2+,转移 5 个电子,A 正
确;
B.N 元素的化合价由+3 价升至+5 价,N 元素化合价升高被氧化,B 正确;
C.根据分析可知,配平后,水的化学计量数为 3,C 正确;
D.根据上述分析, 为还原产物, 为氧化产物,氧化产物与还原产物的物质的量之比为 ,
D 错误;
故选 D;
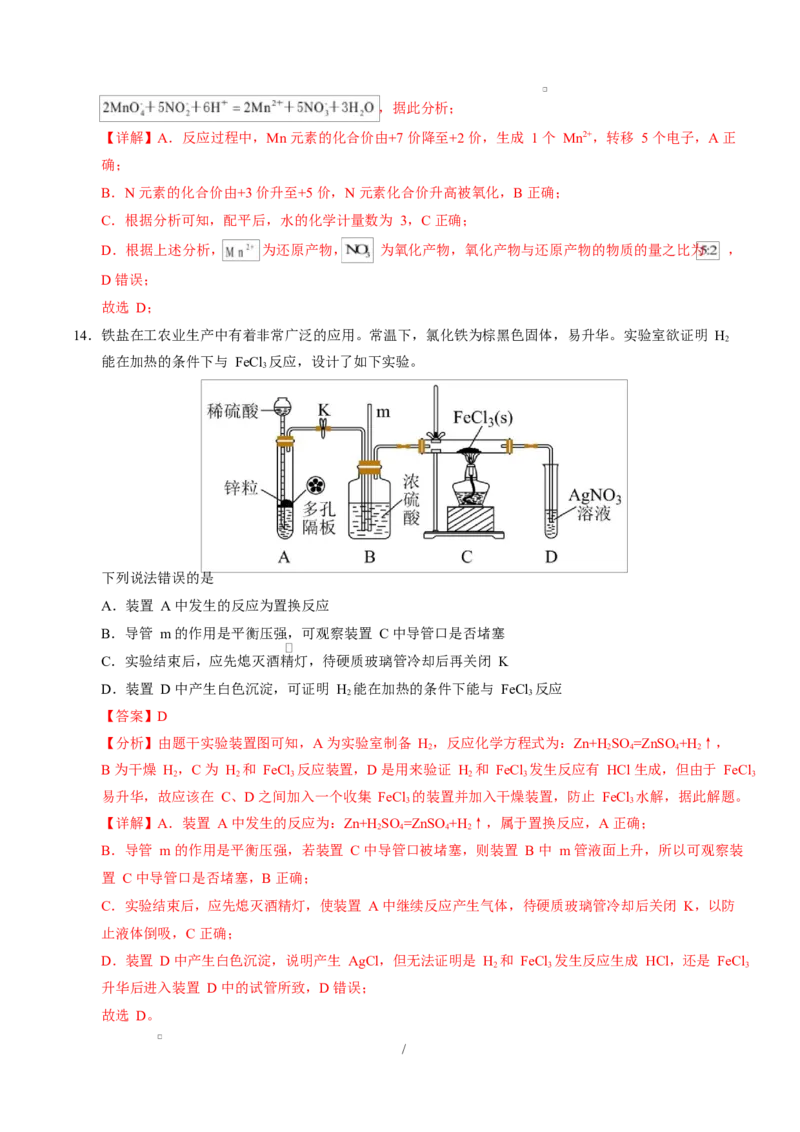
14.铁盐在工农业生产中有着非常广泛的应用。常温下,氯化铁为棕黑色固体,易升华。实验室欲证明 H
2
能在加热的条件下与 FeCl 反应,设计了如下实验。
3
下列说法错误的是
A.装置 A 中发生的反应为置换反应
B.导管 m 的作用是平衡压强,可观察装置 C 中导管口是否堵塞
C.实验结束后,应先熄灭酒精灯,待硬质玻璃管冷却后再关闭 K
D.装置 D 中产生白色沉淀,可证明 H 能在加热的条件下能与 FeCl 反应
2 3
【答案】D
【分析】由题干实验装置图可知,A 为实验室制备 H,反应化学方程式为:Zn+H SO =ZnSO +H ↑,
2 2 4 4 2
B 为干燥 H,C 为 H 和 FeCl 反应装置,D 是用来验证 H 和 FeCl 发生反应有 HCl 生成,但由于 FeCl
2 2 3 2 3 3
易升华,故应该在 C、D 之间加入一个收集 FeCl 的装置并加入干燥装置,防止 FeCl 水解,据此解题。
3 3
【详解】A.装置 A 中发生的反应为:Zn+H SO =ZnSO +H ↑,属于置换反应,A 正确;
2 4 4 2
B.导管 m 的作用是平衡压强,若装置 C 中导管口被堵塞,则装置 B 中 m 管液面上升,所以可观察装
置 C 中导管口是否堵塞,B 正确;
C.实验结束后,应先熄灭酒精灯,使装置 A 中继续反应产生气体,待硬质玻璃管冷却后关闭 K,以防
止液体倒吸,C 正确;
D.装置 D 中产生白色沉淀,说明产生 AgCl,但无法证明是 H 和 FeCl 发生反应生成 HCl,还是 FeCl
2 3 3
升华后进入装置 D 中的试管所致,D 错误;
故选 D。
/15.某无色溶液 X 可能含有:Na+ 、Cu2+、 、Mg2+、Ba2+、 、Cl-、 中的若干种离子,且各离
子数目相同,依次进行下列实验(已知 ):
①取少量溶液 X,加入足量 NaOH 溶液,有沉淀 A 产生;微热闻到刺激性气味。
②过滤①中的混合物,在滤液中加入足量 Ba(OH) 溶液,有白色沉淀 B 产生,再加入足量的稀硝酸,
2
沉淀不溶解。
根据上述实验,判断以下说法正确的是
A.溶液 X 中一定含有 、Mg2+、 ,可能含有
B.溶液 X 中不能确定是否含有 Na+
C.溶液 X 中一定没有 ,但一定含有 Cl-
D.沉淀 A 是混合物,沉淀 B 是纯净物
【答案】C
【分析】由题干信息可知,溶液无色,则原溶液中一定不存在 Cu2+,①取少量溶液 X,加入足量氢氧
化钠溶液,有沉淀 A 产生,微热闻到刺激性气味,则原溶液中一定含有 、Mg2+,一定不含有
,沉淀 A 为 Mg(OH) ;②过滤①中的混合物,在滤液中加入足量的氢氧化钡溶液,有白色沉淀 B
2
产生,再加入足量的稀硝酸,沉淀不溶解,沉淀 B 为 BaSO,则原溶液中一定含有 ,一定不含有
4
Ba2+,原溶液中各离子浓度相同,且 2c(Mg2+)+c( )>2c( ),则原溶液中还含有 Cl-,所以原溶液
中一定含有 、Mg2+、Cl-、 ,一定不含有 K+ 、Na+ 、Cu2+、Ba2+、 ,据此分析解答。
【详解】A.由上述分析可知,原溶液中一定不含有 ,A 错误;
B.由上述分析可知,原溶液中一定不含有 K+ 、Na+ ,B 错误;
C.由上述分析可知,原溶液中一定含有 、Mg2+、Cl-、 ,一定不含有 K+ 、Na+ 、Cu2+、Ba2+、
,C 正确;
D.由分析可知,沉淀 A 为 Mg(OH) ,属于纯净物,沉淀 B 是 BaSO,属于纯净物,D 错误;
2 4
故答案为:C。
第 II 卷(非选择题 共 55 分)
二、非选择题:本题共 4 个小题,共 58 分。
16.(15 分)化学与生活、工业生产息息相关。利用所学化学知识回答下列问题。
(1)吸入人体内的氧气有 2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服
用亚硒酸钠 能消除人体内的活性氧,由此推断 在反应中体现_______(填“氧化性”或
“还原性”)。
(2)牙膏是常见的日用化学品, 和 是两种牙膏的摩擦剂。利用两者化学性质完成下列填空:
/① 具有酸性氧化物的性质,可与强碱反应,写出 与 反应生成 的离子方程式
_______。
②牙膏中的摩擦剂碳酸钙可以用以下两种方案制备:
方案甲:石灰石 生石灰 熟石灰 碳酸钙
方案乙:石灰石 氯化钙 碳酸钙
食品包装袋中常用以上两方案中的物质_______(填化学式)做干燥剂。若步骤③加入纯碱,则该步反应
的化学方程式是_______。两种方案相比,方案乙的优势是_______。
(3)某同学利用 制备 ,制备路线及相关物质之间的转化关系如图,回答下列问
题:
①B 的化学式为__________________。
② 的实验现象是______________________。
③ 的离子方程式为_____________________________。
【答案】除备注外,每空 2 分
(1)还原性(1 分)
(2) CaO 步骤简单,
节约能源
(3) Cu(OH) 黑色固体变为红色
2
【详解】(1)“活性氧”具有极强的氧化性,服用亚硒酸钠 能消除人体内的活性氧,由此推断
被活性氧氧化, 在反应中体现还原性;
(2) 和二氧化碳反应生成碳酸钠和氧气,常用作呼吸面具的供氧剂,供氧原理是
; 和水反应生成氢氧化钠和氧气,将 固体投入到含有
和 的溶液中, 反应生成 ,反应完毕后, 、 数目增加、
Cl-数目不变, 的数目将减少。
(3)① 与 反应生成 和水,反应的离子方程式为 。
②生石灰是氧化钙,氧化钙和水反应生成氢氧化钙,氧化钙可用作干燥剂,食品包装袋中常用以上两
方案中的物质 CaO 做干燥剂。若步骤③加入纯碱,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,
则该步反应的化学方程式是 。
两种方案相比,方案乙的优势是步骤简单,不用高温分解碳酸钙,节约能源。
/(4)A 与 Fe 反应生成 Cu,则 A 是 , 和氢氧化钠反应生成氢氧化铜沉淀,B 是 Cu
(OH) ,C 能与氢气在加热条件下反应生成 Cu,则 C 是 CuO,
2
①根据以上分析,B 的化学式为 Cu(OH) 。
2
② 是 CuO 与氢气在加热条件下反应生成 Cu 和水,实验现象是黑色固体变为红色。
③ 是铁和硫酸铜反应生成硫酸亚铁和铜,反应的离子方程式为 。
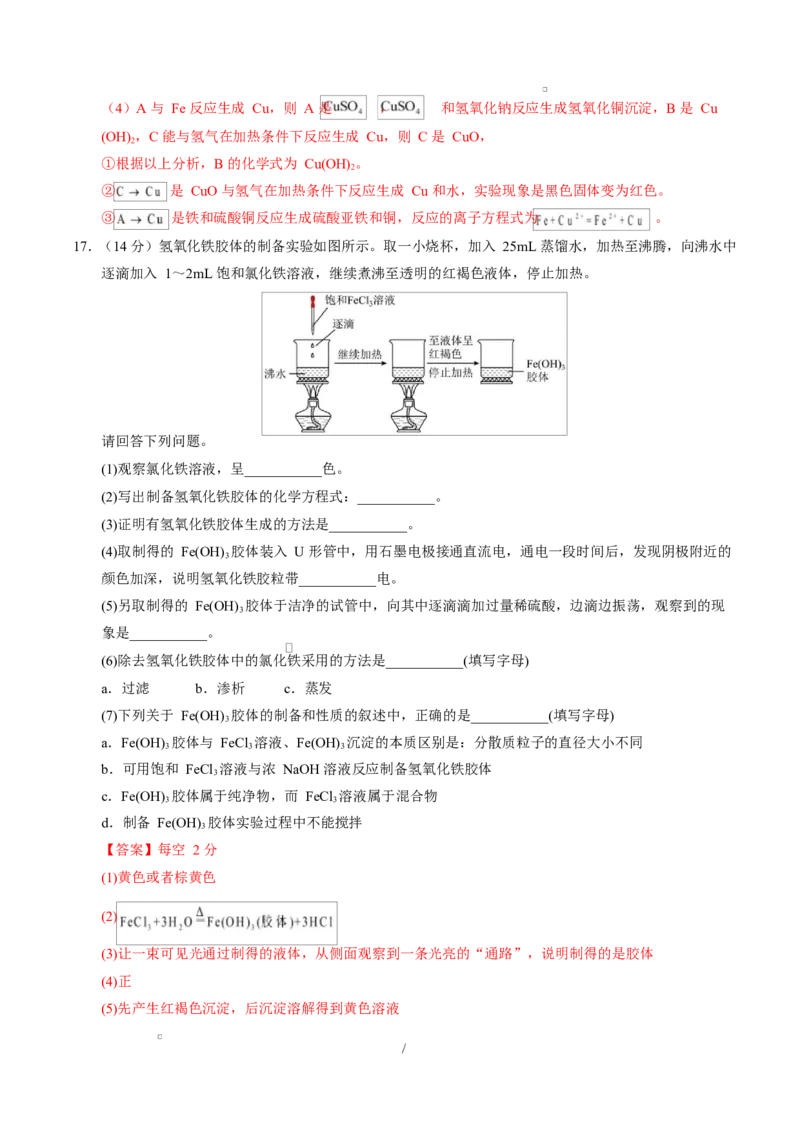
17.(14 分)氢氧化铁胶体的制备实验如图所示。取一小烧杯,加入 25mL 蒸馏水,加热至沸腾,向沸水中
逐滴加入 1~2mL 饱和氯化铁溶液,继续煮沸至透明的红褐色液体,停止加热。
请回答下列问题。
(1)观察氯化铁溶液,呈___________色。
(2)写出制备氢氧化铁胶体的化学方程式:___________。
(3)证明有氢氧化铁胶体生成的方法是___________。
(4)取制得的 Fe(OH) 胶体装入 U 形管中,用石墨电极接通直流电,通电一段时间后,发现阴极附近的
3
颜色加深,说明氢氧化铁胶粒带___________电。
(5)另取制得的 Fe(OH) 胶体于洁净的试管中,向其中逐滴滴加过量稀硫酸,边滴边振荡,观察到的现
3
象是___________。
(6)除去氢氧化铁胶体中的氯化铁采用的方法是___________(填写字母)
a.过滤 b.渗析 c.蒸发
(7)下列关于 Fe(OH) 胶体的制备和性质的叙述中,正确的是___________(填写字母)
3
a.Fe(OH) 胶体与 FeCl 溶液、Fe(OH) 沉淀的本质区别是:分散质粒子的直径大小不同
3 3 3
b.可用饱和 FeCl 溶液与浓 NaOH 溶液反应制备氢氧化铁胶体
3
c.Fe(OH) 胶体属于纯净物,而 FeCl 溶液属于混合物
3 3
d.制备 Fe(OH) 胶体实验过程中不能搅拌
3
【答案】每空 2 分
(1)黄色或者棕黄色
(2)
(3)让一束可见光通过制得的液体,从侧面观察到一条光亮的“通路”,说明制得的是胶体
(4)正
(5)先产生红褐色沉淀,后沉淀溶解得到黄色溶液
/(6)b
(7)ad
【详解】(1)氯化铁溶液为黄色或者棕黄色;
(2)制取 红褐色胶体应该向煮沸的蒸馏水中滴加饱和氯化铁溶液至混合物变红褐色,反应为:
;
(3)光束通过胶体时,光线能够发生散射作用而产生丁达尔效应,而通入其它分散系时不能产生丁达
尔效应;胶体的丁达尔效应可以区别胶体和溶液,故操作为:让一束可见光通过制得的液体,从侧面
观察到一条光亮的“通路”,说明制得的是胶体;
(4)通电一段时间后,发现阴极附近的颜色加深,说明氢氧化铁胶粒带正电荷,通电后向阴极移动;
(5)取制得的 Fe(OH) 胶体于洁净的试管中,向其中逐滴滴加过量稀硫酸,稀硫酸破坏胶体稳定性,
3
发生聚沉产生红褐色沉淀,稀硫酸过量和氢氧化铁沉淀反应生成黄色氯化铁溶液,观察到的现象是:
先产生红褐色沉淀,后沉淀溶解得到黄色溶液;
(6)胶体不能透过半透膜,溶液中粒子能透过半透膜,故除去氢氧化铁胶体中的氯化铁采用的方法是
渗析,故选 b;
(7)a.胶体是分散质粒子大小在 1nm~100nm 的分散系;溶液是分散质粒子小于 1nm 的分散系;浊
液是分散质粒子大于 100nm 的分散系;Fe(OH) 胶体与 FeCl 溶液、Fe(OH) 沉淀的本质区别是分散质
3 3 3
直径大小不同,a 正确;
b.饱和 FeCl 溶液与浓 NaOH 溶液反应生成氢氧化铁沉淀,不能制备氢氧化铁胶体,b 错误;
3
c.Fe(OH) 胶体、FeCl 溶液均属于分散系,都属于混合物,c 错误;
3 3
d.搅拌会引起胶体的聚沉,因此制备 Fe(OH) 胶体实验过程中不能搅拌,d 正确;
3
故选 ad。
18.(13 分)α﹣Fe O 在催化、吸附、传感器、磁性材料及生物医学等领域已经展现出广阔的应用前景,
2 3
国内目前主要用铁鳞(或铁屑)、精选磁铁矿两种原料生产,其工艺流程如图:
回答下列问题:
(1)Fe O 的俗名是___________。
2 3
(2)上述流程中精选磁铁矿通过“操作 I”加入①②来制备亚铁盐溶液的总反应的离子方程式是
___________。
(3)K FeO 的制备常用两种方法:
2 4
I.湿法制备 KFeO(夹持装置略)
2 4
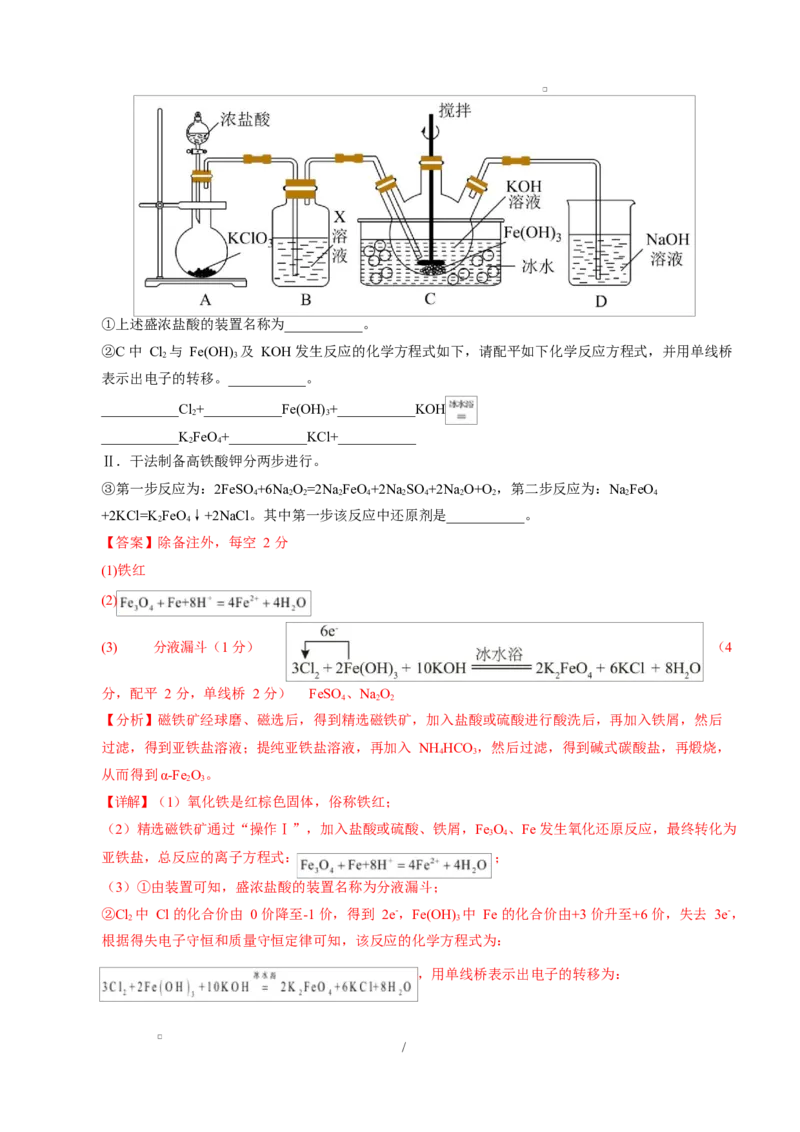
/①上述盛浓盐酸的装置名称为___________。
②C 中 Cl 与 Fe(OH) 及 KOH 发生反应的化学方程式如下,请配平如下化学反应方程式,并用单线桥
2 3
表示出电子的转移。___________。
___________Cl+___________Fe(OH) +___________KOH
2 3
___________KFeO+___________KCl+___________
2 4
Ⅱ.干法制备高铁酸钾分两步进行。
③第一步反应为:2FeSO +6Na O=2Na FeO+2Na SO +2Na O+O,第二步反应为:NaFeO
4 2 2 2 4 2 4 2 2 2 4
+2KCl=K FeO↓+2NaCl。其中第一步该反应中还原剂是___________。
2 4
【答案】除备注外,每空 2 分
(1)铁红
(2)
(3) 分液漏斗(1 分) (4
分,配平 2 分,单线桥 2 分) FeSO 、NaO
4 2 2
【分析】磁铁矿经球磨、磁选后,得到精选磁铁矿,加入盐酸或硫酸进行酸洗后,再加入铁屑,然后
过滤,得到亚铁盐溶液;提纯亚铁盐溶液,再加入 NH HCO ,然后过滤,得到碱式碳酸盐,再煅烧,
4 3
从而得到α-Fe O。
2 3
【详解】(1)氧化铁是红棕色固体,俗称铁红;
(2)精选磁铁矿通过“操作Ⅰ”,加入盐酸或硫酸、铁屑,Fe O、Fe 发生氧化还原反应,最终转化为
3 4
亚铁盐,总反应的离子方程式: ;
(3)①由装置可知,盛浓盐酸的装置名称为分液漏斗;
②Cl 中 Cl 的化合价由 0 价降至-1 价,得到 2e-,Fe(OH) 中 Fe 的化合价由+3 价升至+6 价,失去 3e-,
2 3
根据得失电子守恒和质量守恒定律可知,该反应的化学方程式为:
,用单线桥表示出电子的转移为:
/;
③根据第一步反应化学方程式可知,FeSO 中 Fe 元素化合价升高,发生氧化反应,则 FeSO 为还原剂,
4 4
NaO 中 O 元素化合价即降低也升高,则 NaO 即是氧化剂也是还原剂。
2 2 2 2
19.(13 分)在氯氧化法处理含 CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性
仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)①熔融的 NaCl②Fe③酒精④NaHSO 溶液⑤碳酸钠溶液⑥Ba(OH) 溶液⑦ ⑧NaHCO 溶液⑨
4 2 3
CaO⑩稀盐酸,上述物质中,属于非电解质的是_______(填序号,下同),属于电解质的是_______。
(2)某厂废水中 KCN,其浓度为 650 mg·L-1.现用氯氧化法处理,发生如下反应(其中 N 均为-3 价、O 均
为-2 价):KCN+2KOH+Cl =KOCN+2KCl+H O,该反应中被氧化的元素是___________。
2 2
(3)投入过量液氯,可将氰酸盐进一步氧化为氮气。请用单线桥法标出电子转移的方向和数目:2KOCN
+4KOH+3Cl =2CO ↑+N ↑+6KCl+2H O___________。
2 2 2 2
(4)若处理上述废水 20.0L,使 KCN 完全转化为无毒物质,至少需要液氯___________g。
(5)P O 是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用 PO 干燥的是___________。
2 5 2 5
a.NH b.HI c.SO d.CO
3 2 2
(6)KClO 可用于实验室制 O,若不加催化剂,400℃ 时分解只生成两种盐,其中一种是无氧酸盐,另
3 2
一种盐的阴阳离子个数比为 1︰1.写出该反应的化学方程式:___________。(已知:氯元素最高化合价
为+7 价)
【答案】除备注外,每空 2 分
(1) ③⑦ ①⑨
(2)C
(3)
(4)35.5
(5)b(1 分)
(6)KClO KCl+3KClO
3 4
【详解】(1)在水溶液和熔融状态下不能导电的化合物为非电解质,属于非电解质的是酒精、二氧化
碳,答案选③⑦;
在水溶液或熔融状态下能够导电的化合物属于电解质,属于电解质的是熔融的 NaCl、CaO,混合物不
是电解质,答案是①⑨;
(2)该反应中,Cl 元素化合价由 0 价变为−1 价,C 元素化合价由+2 价变为+4 价,所以被氧化的元
素是 C 元素,故答案为 C。
/(3)反应中 KOCN→N,N 元素化合价由−3 价升高为 0 价,共升高 6 价,Cl→KCl,Cl 元素化合价
2 2
由 0 价降低为−1 价,共降低 2 价,化合价升降最小公倍数为 6,故 N 系数为 1,Cl 系数为 3,结合原
2 2
子守恒配平其它物质的系数,平衡后方程式为:2KOCN+4KOH+3Cl═2CO +N+6KCl+2HO,电
2 2 2 2
子转移为 ,故答案为
。
(4)废水中 KCN 的质量为 650mg/L×20L=13000mg=13g,物质的量为 n= ,使 KCN
完全转化为无毒物质,应生成 CO、N,整个过程中 C 元素化合价由+2 价升高为+4 价,N 元素化合
2
价由−3 价升高为 0 价,Cl 元素化合价由 0 价降低为−1 价,电子转移守恒可知 2×n(Cl )=0.2mol×(4−2)
2
+0.2mol×[0−(−3)],解得 n(Cl )=0.5mol,故需要氯气的质量为 0.5mol×71g/mol=35.5g,故答案为 35.5。
2
(5)浓硫酸具有强氧化性、酸性,不能干燥具有还原性、碱性的气体,
a.NH 为碱性气体,不能用浓硫酸和五氧化二磷干燥,可用碱石灰干燥,故 a 错误;
3
b.HI 为还原性气体,不能利用浓硫酸干燥,可以利用 PO 干燥,故 b 正确;
2 5
c.二氧化硫为酸性气体,可以用浓硫酸、五氧化二磷或无水氯化钙干燥,故 c 错误;
d.二氧化碳为酸性气体,可以用浓硫酸、五氧化二磷或无水氯化钙干燥,故 d 错误;
故答案选 b。
(6)KClO 可用于实验室制 O,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,
3 2
另一种盐的阴阳离子个数比为 1:1,则该无氧酸为 KCl,KCl 中氯元素化合价为−1,说明氯酸钾中氯
元素化合价降低,则另一种含氧酸盐中氯元素化合价会升高,由于氯酸钾中氯元素化合价为+5,则氯
元素化合价升高只能被氧化成高氯酸钾,根据氧化还原反应中化合价升降相等配平该反应为 KClO
3
KCl+3KClO ,故答案为 KClO KCl+3KClO 。
4 3 4
/