文档内容
2025-2026 学年高一化学上学期第一次月考卷
(考试时间:75 分钟 试卷满分:100 分)
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考证号
填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡
皮擦干净后,再选涂其他答案标号。写在本试卷上无效。
3.回答第Ⅱ卷时,将答案写在答题卡上。写在本试卷上无效。
4.测试范围:第 1 章(人教版 2019 必修第一册)。
5.难度系数:0.67
6.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16
第Ⅰ卷(选择题 共 42 分)
一、选择题:本题共 14 小题,每小题 3 分,共 42 分。在每小题给出的四个选项中,只有一项是符合题目
要求的。
1.分类是学习和研究化学的重要方法,下列分类不合理的是
A. 属于钾盐、碳酸盐 B. 属于可溶性强碱
C.液氧属于混合物 D.CaO 属于碱性氧化物
2.碱石灰(CaO 与 NaOH 固体混合物)可作干燥剂,不能与其发生反应的物质是
A.SO B.KNO C.HNO D.HO
3 3 3 2
3.科学家将 在 作用下首次制得环形碳分子 ,总反应为 。下列说法不正确的是
A.X 为 B. 和 互为同素异形体
C. 为电解质 D.该反应为氧化还原反应
4.某同学往一定量饱和食盐水中滴入 3 滴一定质量分数的盐酸后,用光束照射上层清液时出现丁达尔效应。
下列说法错误的是
A.向盐酸中滴加紫色石蕊试液,溶液变红
B.丁达尔效应是由胶体粒子对光线散射形成的
C.上层清液的分散质粒子直径大于 100 nm
D.往上层清液中加入 溶液,会有白色沉淀产生
/5.下列电离方程式中书写正确的是
A. B.
C. D.
6.氧化还原反应是一种重要的化学反应类型.下列说法错误的是
A.化合反应一定是氧化还原反应
B. 是常见的氧化剂
C.燃料的燃烧属于氧化还原反应
D.以 为原料制 涉及到氧化还原反应
7.下列变化中,需加入适当的氧化剂才能完成的是
A.Fe→FeCl B.CuO→Cu C.HNO→NO D.SO →HSO
2 3 3 2 4
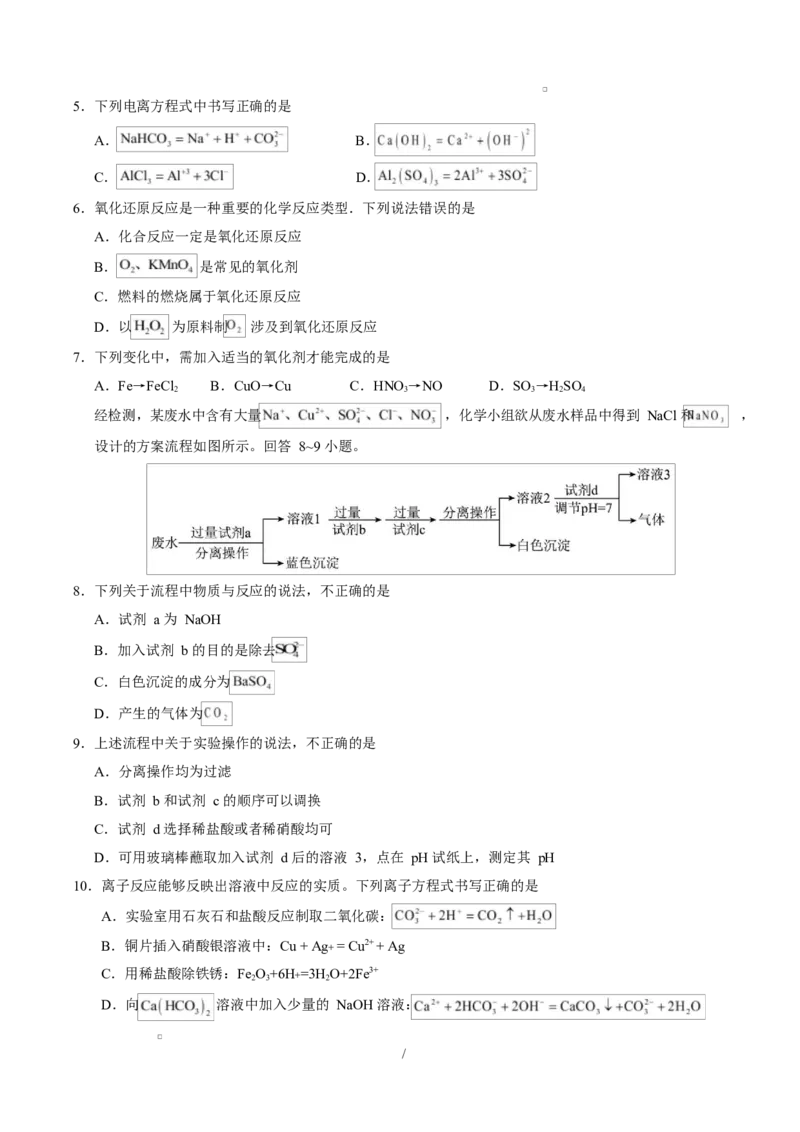
经检测,某废水中含有大量 ,化学小组欲从废水样品中得到 NaCl 和 ,
设计的方案流程如图所示。回答 8~9 小题。
8.下列关于流程中物质与反应的说法,不正确的是
A.试剂 a 为 NaOH
B.加入试剂 b 的目的是除去
C.白色沉淀的成分为
D.产生的气体为
9.上述流程中关于实验操作的说法,不正确的是
A.分离操作均为过滤
B.试剂 b 和试剂 c 的顺序可以调换
C.试剂 d 选择稀盐酸或者稀硝酸均可
D.可用玻璃棒蘸取加入试剂 d 后的溶液 3,点在 pH 试纸上,测定其 pH
10.离子反应能够反映出溶液中反应的实质。下列离子方程式书写正确的是
A.实验室用石灰石和盐酸反应制取二氧化碳:
B.铜片插入硝酸银溶液中:Cu + Ag+ = Cu2+ + Ag
C.用稀盐酸除铁锈:Fe
2
O
3
+6H+=3H
2
O+2Fe3+
D.向 溶液中加入少量的 NaOH 溶液:
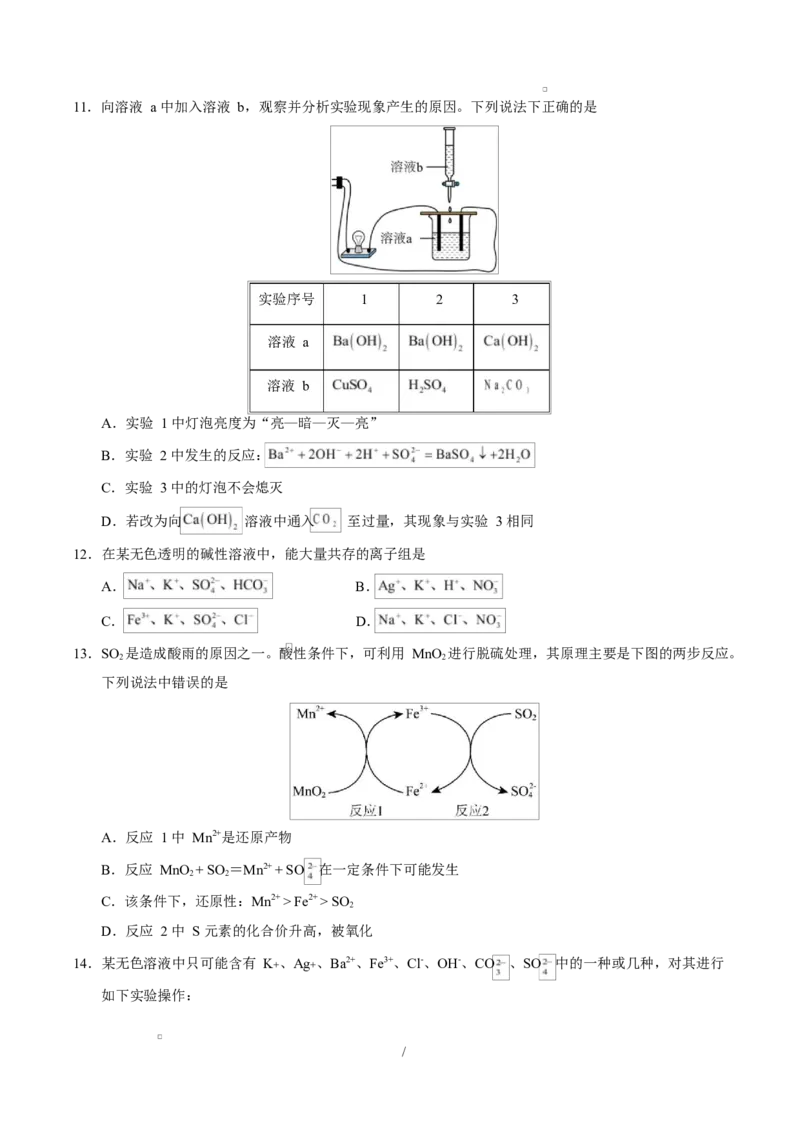
/11.向溶液 a 中加入溶液 b,观察并分析实验现象产生的原因。下列说法下正确的是
实验序号 1 2 3
溶液 a
溶液 b
A.实验 1 中灯泡亮度为“亮—暗—灭—亮”
B.实验 2 中发生的反应:
C.实验 3 中的灯泡不会熄灭
D.若改为向 溶液中通入 至过量,其现象与实验 3 相同
12.在某无色透明的碱性溶液中,能大量共存的离子组是
A. B.
C. D.
13.SO 是造成酸雨的原因之一。酸性条件下,可利用 MnO 进行脱硫处理,其原理主要是下图的两步反应。
2 2
下列说法中错误的是
A.反应 1 中 Mn2+是还原产物
B.反应 MnO + SO =Mn2+ + SO 在一定条件下可能发生
2 2
C.该条件下,还原性:Mn2+ > Fe2+ > SO
2
D.反应 2 中 S 元素的化合价升高,被氧化
14.某无色溶液中只可能含有 K+ 、Ag+ 、Ba2+、Fe3+、Cl-、OH-、CO 、SO 中的一种或几种,对其进行
如下实验操作:
/(1)取少量溶液,滴加无色酚酞试液,酚酞变红;
(2)另取少量溶液,加入足量 Ba(NO ) 溶液,产生白色沉淀;
3 2
(3)向(2)所得混合物中加足量硝酸,沉淀部分溶解,并有无色气体生成;
(4)将(3)所得混合物过滤,向滤液中加入 AgNO 溶液,有白色沉淀生成。
3
下列对溶液的说法正确的是
A.一定不含有 Ag+ 、Ba2+、Fe3+、Cl- B.可能含有 Cl-
C.一定含有 K+ D.无法判断
第 II 卷(非选择题 共 58 分)
二、非选择题:本题共 4 小题,共 58 分。
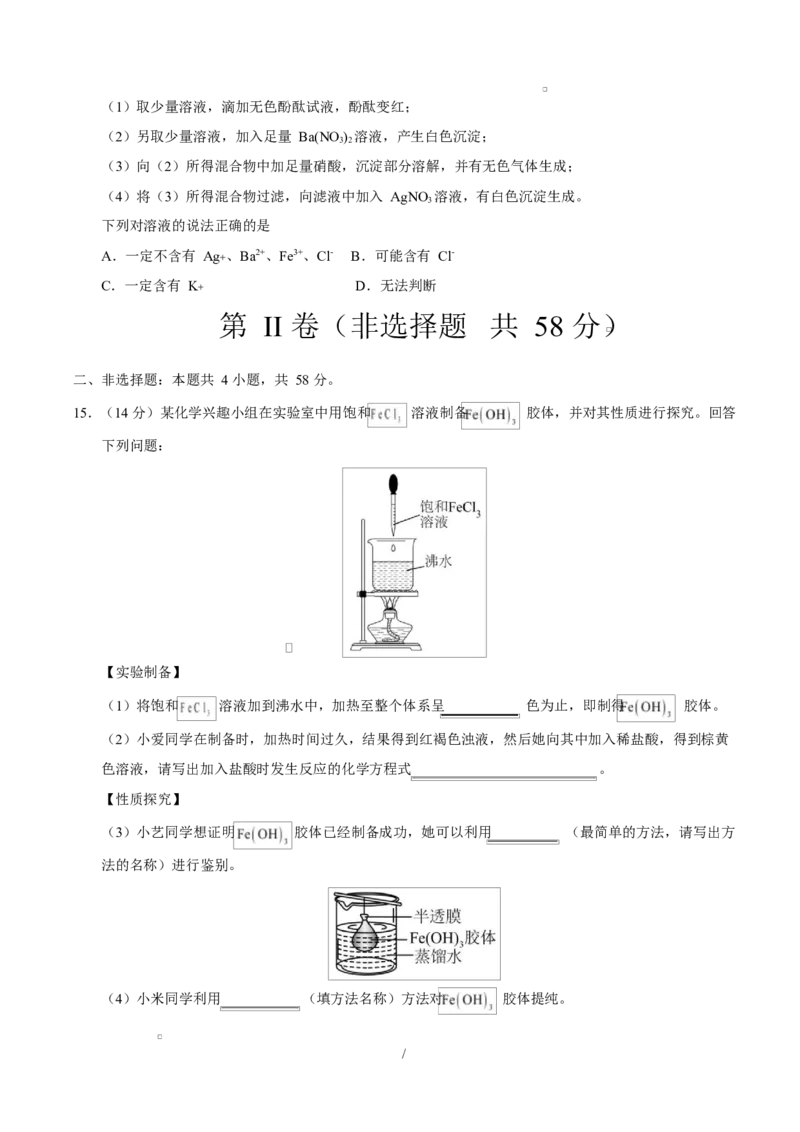
15.(14 分)某化学兴趣小组在实验室中用饱和 溶液制备 胶体,并对其性质进行探究。回答
下列问题:
【实验制备】
(1)将饱和 溶液加到沸水中,加热至整个体系呈 色为止,即制得 胶体。
(2)小爱同学在制备时,加热时间过久,结果得到红褐色浊液,然后她向其中加入稀盐酸,得到棕黄
色溶液,请写出加入盐酸时发生反应的化学方程式 。
【性质探究】
(3)小艺同学想证明 胶体已经制备成功,她可以利用 (最简单的方法,请写出方
法的名称)进行鉴别。
(4)小米同学利用 (填方法名称)方法对 胶体提纯。
/(5)小苹同学将提纯后的 胶体置于 U 形管中(如图),通入直流电一段时间后,观察到与电
源 极(填“正”或“负”)相连的那个电极附近的颜色变深,说明 (写出分
析理由),化学上把这种现象称为 。
16.(15 分)化学与生产、生活密切相关。以下是几种常见的物质:① NaHCO ②HO ③SO
3 2 2
④NaHSO ⑤氢氧化钠溶液 ⑥O ⑦ 乙酸 ⑧盐酸 ⑨Ba(OH) 固体 ⑩NaCO
4 3 2 2 3
回答下列问题:
(1)上述物质中③属于___________(填字母)。
A.化合物 B.电解质 C.酸性氧化物 D.碱性氧化物
(2)上述物质中② 电解质(填“是”或“不是”)。
(3)O 和物质⑥是氧元素的 。
2
(4)从不同的角度对物质进行分类,物质⑩从其组成的阳离子来看,属于钠盐;从其组成的阴离子来
看,则属于碳酸盐。以上分类方法采用的是 分类法。
(5)写出④溶于水的电离方程式 。
(6)上述物质中①可用于治疗胃酸过多,写出其与胃酸反应的离子方程式: 。
(7)上述物质中有两种物质之间可发生离子反应,其离子方程式为 ,则该离子反应对应
的化学方程式为 。
(8)写出④与⑨混合后水溶液恰好呈中性的化学反应方程式 。
17.(14 分)亚硝酸钠( )是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠
必须严格控制用量。某化学兴趣小组设计实验探究 的性质。回答下列问题:
(1)根据 中 N 的化合价是 ,推测 有 (填“氧化性”、“还原性”
或“氧化性和还原性”)。
(2)已知 能发生如下反应: 。用双线桥标出该反应的
电子转移方向和数目: 。
/(3)实验操作如表所示,请完善表格中的实验现象和结论(已知 遇淀粉变蓝)。
实验 实验操作及现象或结果 结论
取 5mL 溶液于试管中,加入少量 KI 溶液,充分反
应 1
具有①
后,再滴加淀粉溶液,溶液变蓝
取 2mL 溶液(先酸化好)于试管中,滴加足量的
2 具有还原性
溶液,可观察到的实验现象为②
3 固体与 70%硫酸反应生成了 NO 和 两种气体 具有氧化性和还原性
③通过上述实验可知, 、 、 的氧化性由强到弱的顺序为 。
④写出实验 3 中发生反应的化学方程式: 。
18.(15 分)高铁酸钾( ,极易溶于水)是常见的水处理剂,其原理如图所示。
【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对
胶体的聚沉作用,简称胶体的聚沉。
回答下列问题:
(1)过程①中活性菌表现了 (填“氧化”或“还原”)性,该过程的还原产物是 (填离子
符号);过程③属于 (填“物理”或“化学”)变化。
(2)根据上述原理分析,作水处理剂时, 的作用有 (填两个)。
(3)制备高铁酸钾常用的反应原理为 (反应未配平)。
①该反应中,Cl 元素的化合价由 价变为 价;通过该反应说明:在碱性条件下,氧化性
(填“>”、“=”或“<”) 。
②配平该反应的化学方程式,并用双线桥法表示电子转移的方向和数目: ,将该反
应改写为离子方程式: 。
/