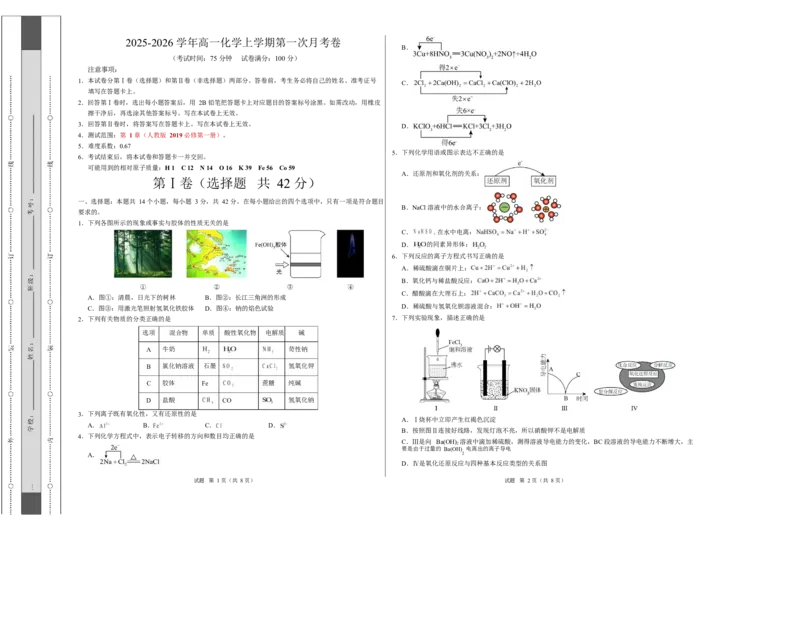
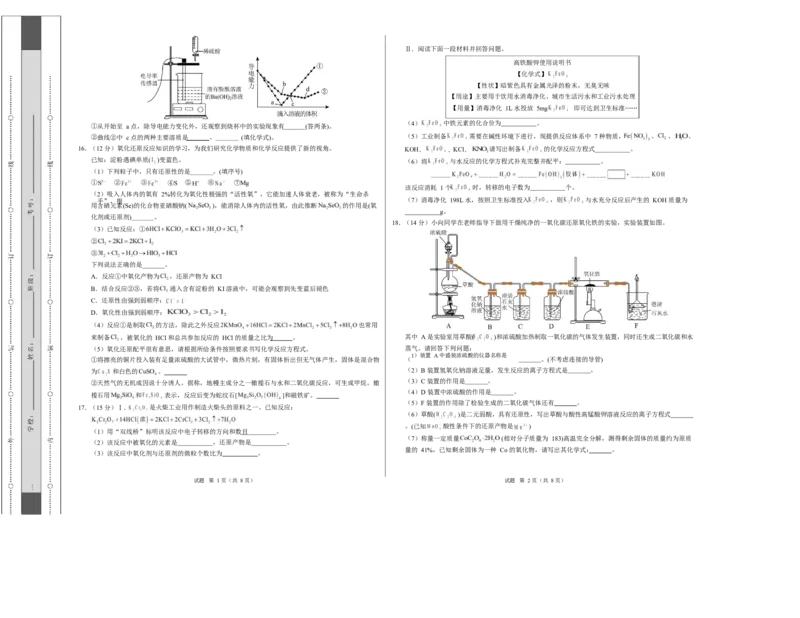
文档内容
2025-2026 学年高一化学上学期第一次月考卷
B.
(考试时间:75 分钟 试卷满分:100 分)
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考证号
C.
填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮
擦干净后,再选涂其他答案标号。写在本试卷上无效。
3.回答第Ⅱ卷时,将答案写在答题卡上。写在本试卷上无效。
D.
4.测试范围:第 1 章(人教版 2019 必修第一册)。
5.难度系数:0.67
5.下列化学用语或图示表达不正确的是
6.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 K 39 Fe 56 Co 59
A.还原剂和氧化剂的关系:
第Ⅰ卷(选择题 共 42 分)
一、选择题:本题共 14 个小题,每小题 3 分,共 42 分。在每小题给出的四个选项中,只有一项是符合题目
B.NaCl 溶液中的水合离子:
要求的。
1.下列各图所示的现象或事实与胶体的性质无关的是
C. 在水中电离:
D. 的同素异形体:
6.下列反应的离子方程式书写正确的是
A.稀硫酸滴在铜片上:
B.氧化钙与稀盐酸反应:
C.醋酸滴在大理石上:
A.图①:清晨,日光下的树林 B.图②:长江三角洲的形成
C.图③:用激光笔照射氢氧化铁胶体 D.图④:钠的焰色试验
D.稀硫酸与氢氧化钡溶液混合:
2.下列有关物质的分类正确的是 7.下列实验现象,描述正确的是
选项 混合物 单质 酸性氧化物 电解质 碱
A 牛奶 苛性钠
B 氯化钠溶液 石墨 氢氧化钾
C 胶体 Fe 蔗糖 纯碱
D 盐酸 CO 氢氧化钠
3.下列离子既有氧化性,又有还原性的是
A.Ⅰ烧杯中立即产生红褐色沉淀
A. B. C. D.
B.按照图Ⅱ连接好线路,发现灯泡不亮,所以硝酸钾不是电解质
4.下列化学方程式中,表示电子转移的方向和数目均正确的是
C.Ⅲ是向 Ba(OH) 溶液中滴加稀硫酸,测得溶液导电能力的变化,BC 段溶液的导电能力不断增大,主
2
要是由于过量的 Ba(OH) 电离出的离子导电
A. 2
D.Ⅳ是氧化还原反应与四种基本反应类型的关系图
试题 第 1 页(共 8 页) 试题 第 2 页(共 8 页)8.物质的分类、氧化还原反应原理可以帮助我们推测物质的性质以及反应的产物。已知:元素铬( Cr)的几种 B.向一定溶质质量分数的稀硫酸中加入
化合物存在如下图转化关系:
C.向一定体积的 溶液中滴加稀硫酸
D.向 和 的混合固体中逐滴滴加稀硫酸并搅拌
13.用黄铜矿(主要成分为 ,其中 Cu、Fe 的化合价均为+2 价)制备氯化亚铜(CuCl)的流程图如图。
已知:反应②的化学方程式为
下列说法不正确的是
A.Cr O 可能是两性氧化物
2 3
B.反应②③是氧化还原反应
C.反应②的化学方程式中 R 的化学式为 KOH
已知:CuCl 是一种白色粉末,微溶于水,难溶于乙醇,在空气中易被氧化;加水的目的是使 转
D.水溶液中 与 H⁺不能大量共存 化为 CuCl 固体。下列叙述中错误的是
A.“浸取”时发生的反应属于氧化还原反应
9.在某酸性溶液中,分别用相同个数的 、 、 、 氧化足量的 ( ),已知其自身
B.加入浓盐酸后发生的反应是非氧化还原反应
的变化规律为: , , , ,得到 最多的是
C.加水时, →CuCl 的过程中发生了氧化还原反应
A. B. C. D.
D.抽滤后对固体进行洗涤时,用乙醇洗涤比用水洗涤更好
10.有一包白色固体粉末,其中可能含有 、 、 、 中的一种或几种,现做以下实
14.以太阳能为热源分解 ,经热化学铁氧化合物循环分解水制 ,其过程如下:过程 I:
验(所加试剂均足量):
(未配平);过程 II: ,(未配平)。下列说法错误的是
则下列说法正确的是
A.过程 I 的反应中还原产物是 FeO
A.白色沉淀乙是
B.过程 II 的反应中 FeO 和 的化学计量数之比为 2:1
B.滤渣与稀硝酸反应的离子方程式为:
C.该方法制 ,具有成本低、产物易分离等优点
C.原粉末中一定有 、 ,可能有
D.过程 I 的反应中每生成 12 个 FeO 转移 8 个电子
D.原粉末中一定没有 ,可能有
第 II 卷(非选择题 共 58
11.下列各项操作中,发生“先沉淀后溶解”现象的有
①向澄清石灰水中通入 至过量 分)
二、非选择题:本题共 4 小题,共 58 分。
②向饱和 溶液中通入过量
15.(16 分)现有以下几种物质:① ;②铝;③固体氧化钙;④二氧化碳气体;⑤固体 ;⑥固体
③向 胶体中逐滴滴入过量稀
;⑦氢氧化铁胶体;⑧固体 ;⑨稀硝酸;⑩纯醋酸( );⑪稀硫酸;⑫乙醇。
A.①③ B.②③ C.①②③ D.仅有②
(1)上述物质中属于电解质的是 (填序号,下同);属于非电解质的是 ,能导电的为
12.常温下,下列实验过程中所产生的变化与所示图像不相符的是
。
(2)上述物质中 和 (填序号)的溶液之间反应可用离子方程式: 表示。
(3)实验室制备⑦的离子方程式为 。利用半透膜提纯⑦的方法称为 。
(4)向⑤溶液中滴加少量⑥溶液,发生反应的离子方程式为 。
(5)在两份相同的 溶液中,分别滴入浓度相等的 、 溶液,其导电能力随滴入
溶液体积变化的曲线如下图所示。
A.向一定质量接近饱和的 溶液中不断加入 固体
试题 第 7 页(共 8 页) 试题 第 8 页(共 8 页)Ⅱ.阅读下面一段材料并回答问题。
高铁酸钾使用说明书
【化学式】
【性状】暗紫色具有金属光泽的粉末,无臭无味
【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理
【用量】消毒净化 1L 水投放 5mg 即可达到卫生标准……
(4) 中铁元素的化合价为 。
①从开始至 a 点,除导电能力变化外,还观察到烧杯中的实验现象有 (答两条)。
②曲线②中 c 点的两种主要溶质是 、 (填化学式)。 (5)工业制备 需要在碱性环境下进行,现提供反应体系中 7 种物质, 、 、 、
16.(12 分)氧化还原反应知识的学习,为我们研究化学物质和化学反应提供了新的视角。 KOH、 、KCl、 请写出制备 的化学反应方程式 。
已知:淀粉遇碘单质( )变蓝色。 (6)将 与水反应的化学方程式补充完整并配平: 。
(1)下列粒子中,只有还原性的是 。(填序号)
① ② ③ ④S ⑤ ⑥ ⑦Mg
该反应消耗 1 个 时,转移的电子数为 个。
(2)吸入人体内的氧有 2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀
手”,服 (7)消毒净化 198L 水,按照卫生标准投入 ,则 与水充分反应后产生的 KOH 质量为
用含硒元素(Se)的化合物亚硒酸钠( ),能消除人体内的活性氧,由此推断 的作用是(氧
g。
化剂或还原剂) 。
18.(14 分)小向同学在老师指导下做用干燥纯净的一氧化碳还原氧化铁的实验,实验装置如图。
(3)已知反应:①
②
③
下列说法正确的是_______。
A.反应①中氧化产物为 ,还原产物为 KCl
B.结合反应②③,若将 通入含有淀粉的 KI 溶液中,可能会观察到先变蓝后褪色
C.还原性由强到弱顺序:
D.氧化性由强到弱顺序:
(4)反应①是制取 的方法,除此之外反应 也常用
来制备 ,被氧化的 HCl 和总共参加反应的 HCl 的质量之比为 。 其中 A 是实验室用草酸( )和浓硫酸加热制取一氧化碳的气体发生装置,同时还生成二氧化碳和水
(5)氧化还原配平很有意思,请根据所给条件按照要求书写化学反应方程式。 蒸气。请回答下列问题:
1)装置 A 中盛装浓硫酸的仪器名称是
①将擦亮的铜片投入装有足量浓硫酸的大试管中,微热片刻,有固体析出但无气体产生,固体是混合物 ( 。(不考虑连接的导管)
为 和白色的 。 (2)B 装置氢氧化钠溶液足量,发生反应的离子方程式是 。
②天然气的无机成因说十分诱人。据称,地幔主成分之一橄榄石与水和二氧化碳反应,可生成甲烷。橄 (3)C 装置的作用是 。
(4)D 装置中浓硫酸的作用是 。
榄石用 和 表示,反应后变为蛇纹石[ ]和磁铁矿。
(5)F 装置的作用除了检验生成的二氧化碳气体还有 。
17.(15 分)Ⅰ. 是火柴工业用作制造火柴头的原料之一。已知反应:
(6)草酸( )是二元弱酸,具有还原性,写出草酸与酸性高锰酸钾溶液反应的离子方程式
。(已知 酸性条件下的还原产物是 )
(1)用“双线桥”标明该反应中电子转移的方向和数目 。
(7)称量一定质量 (相对分子质量为 183)高温完全分解,测得剩余固体的质量约为原质
(2)该反应中被氧化的元素是 ,还原产物是 。
量的 41%,已知剩余固体为一种 Co 的氧化物,请写出其化学式: 。
(3)该反应中氧化剂与还原剂的微粒个数比为 。
试题 第 1 页(共 8 页) 试题 第 2 页(共 8 页)