文档内容
2025-2026 学年高一化学上学期第一次月考卷
(考试时间:75 分钟 试卷满分:100 分)
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考证号
填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡
皮擦干净后,再选涂其他答案标号。写在本试卷上无效。
3.回答第Ⅱ卷时,将答案写在答题卡上。写在本试卷上无效。
4.测试范围:第 1 章(人教版 2019 必修第一册)。
5.难度系数:0.65
6.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16
第Ⅰ卷(选择题 共 45 分)
一、选择题:本题共 15 小题,每小题 3 分,共 45 分。在每小题给出的四个选项中,只有一项是符合题目
要求的。
1.在社会不断进步和科技迅猛发展的背景下,化学与其他学科形成交叉和相互渗透,成为自然科学领域中
一门“中心的、实用的和创造性的”基础科学。下列说法错误的是
A.实验和理论是学习化学的两种重要途径
B.材料的研制和开发都是以研究和优化物质的组成、结构和性能为基础的
C.化学家可以通过化学反应创造出新的原子、分子和具有特殊性质的新物质
D.化学科学促进医学科学的发展,帮助研制新药,为人类提供健康保障
【答案】C
【详解】A.化学是一门以实验为基础的学科,实验和理论是学习化学的两种重要途径,A 正确;
B.无论是依据组成分类的金属材料、无机非金属材料、合成高分子材料和复合材料等,还是按照功能分类
的航空航天材料、电子信息材料、新型能源材料、生物医用材料和智能材料等,它们的研制和开发都是以
研究和优化物质的组成、结构和性能为基础的,B 正确;
C.创造新的原子属于核反应,不是化学反应,C 错误;
D.根据 B 分析,化学科学可以开发研制新型生物医用材料,促进医学科学的发展,帮助研制新药,为人
类提供健康保障,D 正确;
故选 C。
2.下列关于物质的分类正确的是
/酸 碱 混合物 碱性氧化物 酸性氧化物
A 碘酒
B 石灰石
C
D 冰水
A.A B.B C.C D.D
【答案】B
【详解】A.CO 是不成盐氧化物,不是碱性氧化物,故 A 错误;
B.HClO 属于酸, 属于碱,石灰石属于盐, 是碱性氧化物,SO 是酸性氧化物,故 B 正确;
2
C. 属于盐,不是碱, 是结晶水合物,属于化合物不是混合物,故 C 错误;
D. 属于盐,冰水混合物的成分是水、属于纯净物不属于混合物,NO 是不成盐氧化物,故 D 错误;
故选 B。
3.古诗文是中华民族历代传承的文化瑰宝,下列古诗文描述的场景,不涉及氧化还原反应的是
A.日照香炉生紫烟,遥看瀑布挂前川——李白《望庐山瀑布》
B.春蚕到死丝方尽,蜡炬成灰泪始干——李商隐《无题》
C.爆竹声中一岁除,春风送暖入屠苏——王安石《元日》
D.曾青得铁则化为铜——刘安《淮南万毕术》
【答案】A
【详解】A.产生的“紫烟”本质上是水雾对光的折射,不涉及氧化还原反应,A 符合;
B.涉及蜡烛燃烧,涉及氧化还原反应,B 不符合;
C.涉及爆竹中火药的爆炸,涉及氧化还原反应,C 不符合;
D.涉及铁置换出铜,和氧化还原反应有关,D 不符合;
答案选 A。
4.《天工开物》记载了盐的提纯方法:“凡淋煎法,掘坑尺许,以竹木架芦席于上;将盐料铺于席上,以
海水灌淋,渗下坑中;所淋之汁,入锅煎炼”。文中不涉及到的实验操作是
A.溶解 B.过滤 C.蒸发 D.灼烧
【答案】D
【详解】A.“将盐料铺于席上,以海水灌淋”,涉及盐的溶解,故不选 A;
B.“将盐料铺于席上,以海水灌淋,渗下坑中”,利用过滤原理,故不选 B;
C.“所淋之汁,入锅煎炼”操作为蒸发,故不选 C;
D.文中没有涉及到的实验操是灼烧,故选 D;
/选 D。
5.下列转化中,需要加入氧化剂才能实现的是
A. B. C. D.
【答案】B
【详解】A. 中溴的化合价从 0 降至-1,被还原,需还原剂,A 不符合题意;
B. 中铁的化合价从 0 升至+2,被氧化,需加入氧化剂,B 符合题意;
C. 中碳的化合价均为+4,未发生氧化还原反应,无需氧化剂,C 不符合题意;
D. 中氯的化合价从+7 降至 0,被还原,需还原剂,D 不符合题意;
故选 B。
6.某溶液中只含有 、 、 、 四种离子,已知前三种离子的个数比为 ,则溶液中 和
的离子个数比为
A. B. C. D.
【答案】B
【详解】假设溶液中 为 a 个、Na+ 为 3 个,则 Al3+为 2 个,Cl-为 1 个,由溶液中电荷守恒得:2a
+1=3+3×2,解得 a=4,则 和 的个数比为 3:4;
故选 B。
7.宋代著名法医学家宋慈所著的《洗冤集录》中有“银针验毒”的记载。“银针验毒”的原理是
。下列关于该反应的说法正确的是
A. 被氧化 B. 的氧化性强于
C. 发生氧化反应,作还原剂 D. 既是氧化产物,也是还原产物
【答案】B
【详解】A.O 是氧化剂,被还原,A 错误;
2
B.O 是氧化剂,Ag 被氧化生成 Ag S,Ag S 是氧化产物,氧化剂的氧化性大于氧化产物的氧化性,即 O
2 2 2 2
的氧化性强于 Ag S,B 正确;
2
C. 中 H 和 S 的化合价都没有变化,HS 既不是氧化剂也不是还原剂,C 错误;
2
D.由反应式可知,Ag 被氧化生成 Ag S,则 Ag S 是氧化产物,D 错误;
2 2
故选 B。
8.下列说法错误的是
A.江河入海口三角洲的形成通常与胶体的性质有关
B.向 胶体中逐滴滴加盐酸,开始产生红褐色沉淀,后沉淀逐渐溶解并消失
C. 胶体在通电后可作定向移动,是因为 胶体带电
D.可用渗析法分离淀粉胶体和 溶液
/【答案】C
【详解】A.江河水中的泥沙等胶体粒子,在入海口遇到海水中的电解质,发生聚沉,从而形成三角洲,A
正确;
B.向 胶体中逐滴滴加盐酸, 盐酸是电解质溶液,先使胶体发生聚沉,产生红褐色 沉淀 ,
继续滴加盐酸, 与盐酸发生中和反应: ,沉淀逐渐溶解并消失,B 正
确;
C. 胶体在通电后可作定向移动,是因为 胶粒带电,而胶体是呈电中性的,C 错误;
D.淀粉胶体粒子不能透过半透膜, 溶液中的离子能透过半透膜,所以可用渗析法分离淀粉胶体和
溶液,D 正确;
故选 C。
9.下列离子方程式书写正确的是
A. 溶液与少量 溶液反应:
B.向 溶液加入 NaOH 溶液:
C.铁和稀盐酸反应:
D. 溶液与稀硫酸反应:
【答案】A
【详解】A.NaHCO 溶液与少量 Ca(OH) 反应时, 提供的 OH-与 按 1:1 反应生成 和 HO,
3 2 2
Ca2+与 结合生成 CaCO 沉淀。总反应式为 ,符合反应
3
比例,A 正确;
B.KHSO
4
在溶液中完全离解为 K+ 、H+ 和 ,与 NaOH 反应时实际是 H+ 与 OH-中和生成 H
2
O,而非
直接参与,方程式为: ,B 错误;
C.铁与稀盐酸反应生成 Fe2+而非 Fe3+,正确离子方程式为: ,C 错误;
D.Ba(OH)
2
与稀硫酸反应时,除生成 BaSO
4
沉淀外,H+ 与 OH-应中和生成 H
2
O,方程式为:
,D 错误;
故选 A。
10.下列选项所示的物质转化均能一步实现的是
A. B.
C. D.
【答案】B
/【详解】A. 在点燃条件下与 反应生成 , 不能与水反应生成 ,A 错误;
B. 与稀硫酸反应生成 和水, 与 发生复分解反应生成 ,B 正确;
C. 与 反应生成 ,C 错误;
D. 不能与 反应,D 错误;
答案选 B。
11.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在无色溶液中: 、 、 、
B.在硝酸银溶液中: 、 、 、
C.在加入酚酞变红的溶液中: 、 、 、
D.在 溶液中: 、 、 、
【答案】C
【详解】A. 为蓝色,不符合无色溶液的条件,A 不符合题意;
B.硝酸银溶液中的 会与 生成 AgCl 沉淀,B 不符合题意;
C.酚酞变红说明溶液呈碱性, 、 、 、 在碱性条件下不反应,C 符合题意;
D. 会与 反应生成 沉淀,D 不符合题意;
故选 C。
12.关于物质的性质和分类,下列说法正确的是
A. 、 为酸性氧化物
B.酸一定能电离出 ,但能电离出 的不一定是酸
C.纯净物:盐酸、干冰、液氯
D.已知 是正盐,则 属于三元酸
【答案】B
【详解】A.NO、 均不是酸性氧化物,NO 属于不成盐氧化物,二氧化氮与氢氧化钠发生氧化还原反
应,故 A 错误;
B.酸是电离时产生的阳离子全部是氢离子的化合物,不管是无氧酸还是含氧酸,一定能电离出 H+ ,但能
电离出 H+ 的物质不一定是酸,也可能是酸式盐如 NaHSO
4
或水,故 B 正确;
C.盐酸是氯化氢气体的水溶液、是混合物,干冰是二氧化碳固体、液氯是液态氯气,这二者均为纯净物,
故 C 错误;
D.已知 是正盐,则一个 分子能电离出一个氢离子, 属于一元弱酸,故 D 错误;
选 B。
13.对于某些离子的检验及结论正确的是
A.加入稀硝酸后再加入硝酸银,产生白色沉淀,原溶液中一定有
/B.加氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,原溶液中一定有
C.某溶液中加入碳酸钠溶液有白色沉淀生成,再加盐酸,白色沉淀消失,一定有
D.加稀盐酸产生无色气体,该气体能使澄清石灰水变浑浊,原物质中一定有
【答案】A
【详解】A.银离子和氯离子生成不溶于酸的氯化银沉淀,则加入稀硝酸后再加入硝酸银,产生白色沉淀,
原溶液中一定有 ,A 正确;
B.加氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,原溶液中有硫酸根离子或银离子,B 错误;
C.某溶液中加入碳酸钠溶液有白色沉淀生成,再加盐酸,白色沉淀消失,不一定有钙离子,也有可能是钡
离子,C 错误;
D.加稀盐酸产生无色气体,该气体能使澄清石灰水变浑浊,原物质可能含碳酸盐或碳酸氢盐或亚硫酸盐或
亚硫酸氢盐,D 错误;
故选 A。
14.某无色溶液中只可能含有 K+ 、Ag+ 、Ba2+、Fe3+、Cl-、OH-、CO 、SO 中的一种或几种,对其进行
如下实验操作:
(1)取少量溶液,滴加无色酚酞试液,酚酞变红;
(2)另取少量溶液,加入足量 Ba(NO ) 溶液,产生白色沉淀;
3 2
(3)向(2)所得混合物中加足量硝酸,沉淀部分溶解,并有无色气体生成;
(4)将(3)所得混合物过滤,向滤液中加入 AgNO 溶液,有白色沉淀生成。
3
下列对溶液的说法正确的是
A.一定不含有 Ag+ 、Ba2+、Fe3+、Cl- B.可能含有 Cl-
C.一定含有 K+ D.无法判断
【答案】C
【详解】溶液无色,则一定不含有颜色的 Fe3+;
(1)取少量溶液,滴加无色酚酞试液,酚酞变红,说明溶液呈碱性,则原溶液中含 OH-,不可能大量存在
Ag+ ;
(2)另取少量溶液,加入足量 Ba(NO ) 溶液,产生白色沉淀,白色沉淀至少是 BaCO 、BaSO 中的一种;
3 2 3 4
(3)向(2)所得混合物中加足量硝酸,沉淀部分溶解,并有无色气体生成,说明沉淀为 BaCO 、BaSO,
3 4
则原溶液中一定含有 CO 、SO ,一定不含 Ba2+;
(4)将(3)所得混合物过滤,向滤液中加入 AgNO 溶液,有白色沉淀生成,该沉淀为 AgCl,说明原溶
3
液含有 Cl-,由溶液呈电中性可知,原溶液一定含有 K+ ;综上,原溶液中一定含有 K+ 、OH-、Cl-、CO 、
SO ,一定不含有 Ag+ 、Ba2+、Fe3+,据此分析解答。
A.由上述分析可知,原溶液一定不含有 Ag+ 、Ba2+、Fe3+,Cl-一定含有,故 A 错误;
B.Cl-一定含有,故 B 错误;
/C.根据分析可知,一定含有 K+ ,故 C 正确;
D.可分析出原溶液中一定含有 K+ 、OH-、Cl-、CO 、SO ,一定不含有 Ag+ 、Ba2+、Fe3+,故 D 错误。
答案选 C。
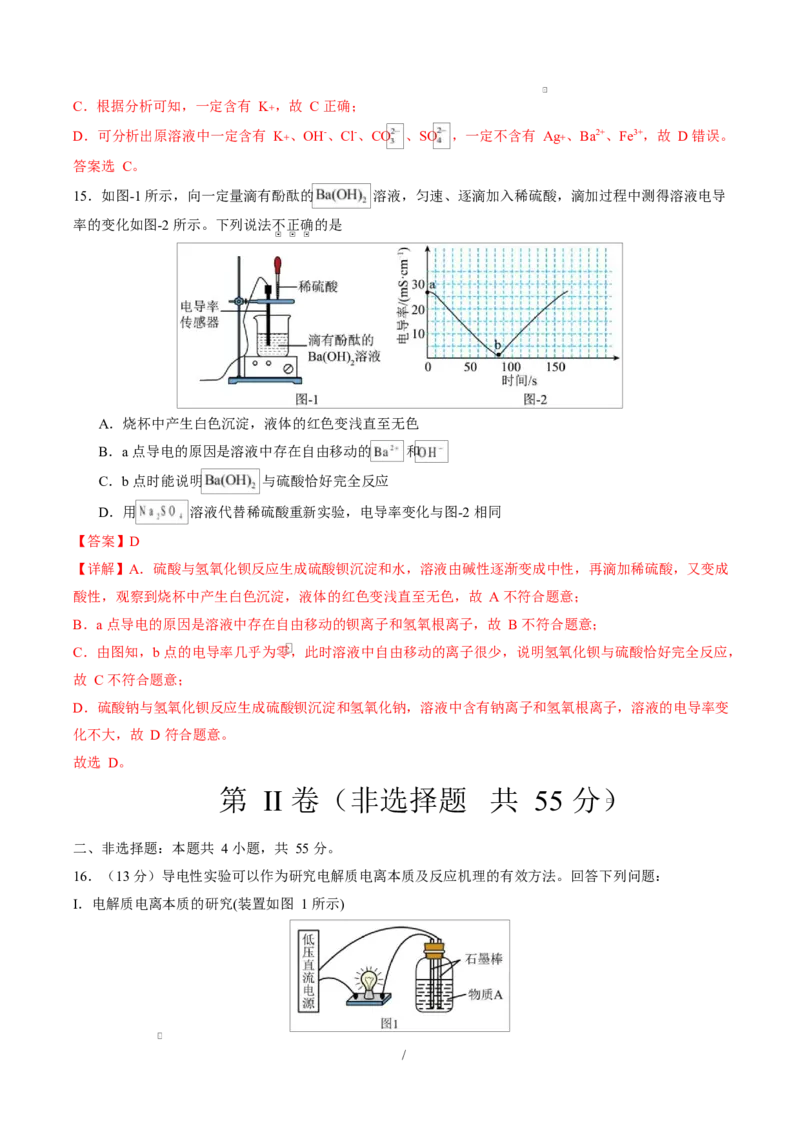
15.如图-1 所示,向一定量滴有酚酞的 溶液,匀速、逐滴加入稀硫酸,滴加过程中测得溶液电导
率的变化如图-2 所示。下列说法不正确的是
A.烧杯中产生白色沉淀,液体的红色变浅直至无色
B.a 点导电的原因是溶液中存在自由移动的 和
C.b 点时能说明 与硫酸恰好完全反应
D.用 溶液代替稀硫酸重新实验,电导率变化与图-2 相同
【答案】D
【详解】A.硫酸与氢氧化钡反应生成硫酸钡沉淀和水,溶液由碱性逐渐变成中性,再滴加稀硫酸,又变成
酸性,观察到烧杯中产生白色沉淀,液体的红色变浅直至无色,故 A 不符合题意;
B.a 点导电的原因是溶液中存在自由移动的钡离子和氢氧根离子,故 B 不符合题意;
C.由图知,b 点的电导率几乎为零,此时溶液中自由移动的离子很少,说明氢氧化钡与硫酸恰好完全反应,
故 C 不符合题意;
D.硫酸钠与氢氧化钡反应生成硫酸钡沉淀和氢氧化钠,溶液中含有钠离子和氢氧根离子,溶液的电导率变
化不大,故 D 符合题意。
故选 D。
第 II 卷(非选择题 共 55 分)
二、非选择题:本题共 4 小题,共 55 分。
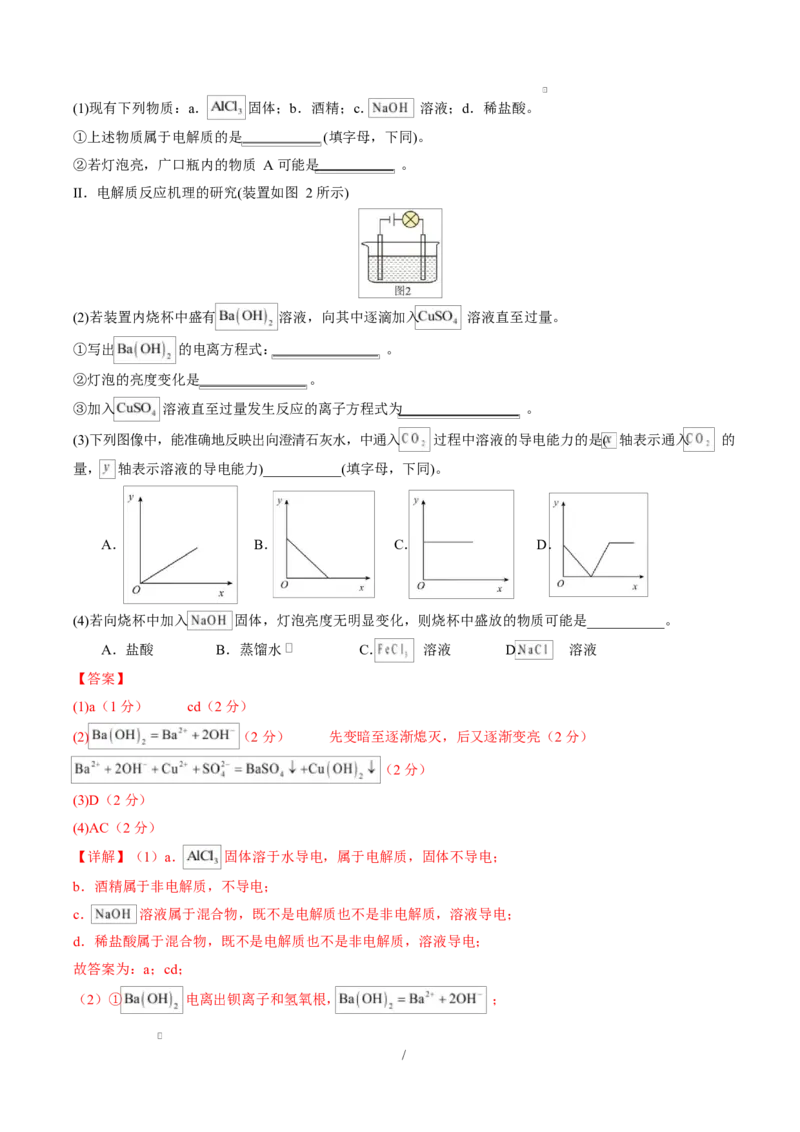
16.(13 分)导电性实验可以作为研究电解质电离本质及反应机理的有效方法。回答下列问题:
I.电解质电离本质的研究(装置如图 1 所示)
/(1)现有下列物质:a. 固体;b.酒精;c. 溶液;d.稀盐酸。
①上述物质属于电解质的是 (填字母,下同)。
②若灯泡亮,广口瓶内的物质 A 可能是 。
II.电解质反应机理的研究(装置如图 2 所示)
(2)若装置内烧杯中盛有 溶液,向其中逐滴加入 溶液直至过量。
①写出 的电离方程式: 。
②灯泡的亮度变化是 。
③加入 溶液直至过量发生反应的离子方程式为 。
(3)下列图像中,能准确地反映出向澄清石灰水,中通入 过程中溶液的导电能力的是( 轴表示通入 的
量, 轴表示溶液的导电能力)___________(填字母,下同)。
A. B. C. D.
(4)若向烧杯中加入 固体,灯泡亮度无明显变化,则烧杯中盛放的物质可能是___________。
A.盐酸 B.蒸馏水 C. 溶液 D. 溶液
【答案】
(1)a(1 分) cd(2 分)
(2) (2 分) 先变暗至逐渐熄灭,后又逐渐变亮(2 分)
(2 分)
(3)D(2 分)
(4)AC(2 分)
【详解】(1)a. 固体溶于水导电,属于电解质,固体不导电;
b.酒精属于非电解质,不导电;
c. 溶液属于混合物,既不是电解质也不是非电解质,溶液导电;
d.稀盐酸属于混合物,既不是电解质也不是非电解质,溶液导电;
故答案为:a;cd;
(2)① 电离出钡离子和氢氧根, ;
/故答案为: ;
②装置内烧杯中盛有 溶液,向其中逐滴加入 溶液,先生成 BaSO 沉淀和 Cu(OH) 沉淀,溶
4 2
液中没有自由移动的离子,亮度变弱至熄灭,所加硫酸铜过量后,溶液中自由移动离子增多,灯泡亮度增
加;
故答案为:先变暗至逐渐熄灭,后又逐渐变亮;
③装置内烧杯中盛有 溶液,向其中逐滴加入 溶液,生成 BaSO 沉淀和 Cu(OH) 沉淀,
4 2
;
故答案为: ;
(3)电解质溶液为 Ca(OH) 溶液,向溶液中逐渐通入 CO,反应生成碳酸钙沉淀和水,溶液中离子浓度减
2 2
小,导电性减弱,恰好反应时溶液中几乎不存在自由移动的离子,导电性为零,继续通入二氧化碳,碳酸
钙与二氧化碳和水生成碳酸氢钙,离子浓度又增大,溶液又导电,根据钙元素守恒可知,反应前后,溶液
中自由移动的离子浓度不变,所带电荷也不变,故导电能力与之前相同;
故答案为:D;
(4)A.烧杯中盛放盐酸,加入 固体,生成 NaCl 溶液,为强电解质,故灯泡亮度几乎不变,A 符合
题意;
B.烧杯中盛放蒸馏水,加入 固体,溶液中自由移动离子增多,浓度增大,则灯泡亮度变大,B 不符
合题意;
C.烧杯中盛放 溶液,向烧杯中加入 固体,生成 Fe(OH) 沉淀和 NaCl 溶液,为强电解质,故灯
3
泡亮度几乎不变,C 符合题意;
D.烧杯中盛放 溶液,向烧杯中加入 固体,溶液中离子浓度增大,灯泡亮度增大,D 不符合题意;
故答案为:AC。
17.(14 分)化学存在于我们的生活中,我们的衣食住行都和化学密切相关,完成下列问题。
(1)水质净化研究过程中发现高铁酸盐是一种新型、高效、多功能绿色水处理剂,已知高铁酸钾溶于水发生
反应生成氧气和具有吸附性的氢氧化铁胶体。
。
①反应中 中铁元素化合价为 。
②反应中生成的 (胶体)有吸附性,可以用来去水中的泥沙。往沸水中滴加饱和氯化铁溶液可以制备
该胶体,写出该制备过程的化学方程式 。
③根据化合价,推测 能和下列 反应(填标号)。
A. B. C. D.
(2) 也是一种多功能的环保消毒剂,有“绿色氧化剂”的美称。从 氧元素的化合价可推测, 既
具有氧化性,又具有还原性。某实验小组同学设计实验探究 在某强酸性反应体系中的性质。
/①实验一:向含 5% 的酸性溶液中滴加淀粉 溶液,溶液变蓝(淀粉遇 变蓝)。该反应过程中 做
(填 “氧化剂”或“还原剂”)。
②实验二:向含 5% 的溶液中滴加酸性 紫色溶液。已知反应物和生成物共有六种粒子: 、
、 、 、 、 。实验②的实验现象为 ,若该反应中 只发生了如下过
程: ↑,写出该反应的离子方程式 。
(3)将双氧水滴加到 溶液中,也会产生有趣的现象。
虽说 可以 将氧化为 ,可是反应中依然有气体生成。研究表明,在此主要涉及到 、 和
发生的循环反应(如图)。请根据图示,写该循环反应的总离子方程式 。
【答案】
(1)+6(1 分) FeCl +3H O Fe(OH) (胶体)+3HCl(2 分) AB(2 分)
3 2 3
(2)氧化剂(2 分) 紫色退去,并有气泡产生(2 分) 6 +2 +5 =5 ↑+2 +8
(3 分)
(3)2H O 2HO+O↑(2 分)
2 2 2 2
【详解】(1)根据正负化合价代数和为 0, 中 O 为-2 价,Fe 为+6 价;
由 FeCl 制备胶体的化学方程式为:FeCl +3H O Fe(OH) (胶体)+3HCl;
3 3 2 3
中 Fe 为+6 价,处于最高价,只有氧化性,能够与还原性的物质反应,HS 和 KI 具有还原性,故答
2
案为 AB;
(2)淀粉遇碘变蓝色,KI 生成 I 被氧化,HO 做氧化剂;
2 2 2
KMnO 具有氧化性,HO 具有还原性,二者发生氧化还原反应生成 O、Mn2+等,现象是 KMnO 紫色退去,
4 2 2 2 4
并有气体 O 生成;
2
根据电荷守恒、电子守恒和原子守恒,反应的离子方程式为:6 +2 +5 =5 ↑+2 +8 ;
(3)由图示可知,Fe2+是催化剂,总反应我 HO 分解为 HO 和 O,方程式为:2HO 2HO+O↑。
2 2 2 2 2 2 2 2
18.(13 分)Ⅰ.某无色透明溶液中可能大量存在 、 、 、 、 中的几种。
已知:①取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。再取①
中的滤液,加入过量的氢氧化钠溶液,出现白色沉淀。请回答下列问题:
(1)原溶液中一定存在的离子是 ,一定不存在的离子是 。
/(2)原溶液可能大量共存的阴离子是 (填字母)。
a.Cl- b.OH- c. d.
Ⅱ.现有三种可溶物质 A、B、C,其中 A、B 是盐,A 是正盐,B 是酸式盐,C 是碱,它们溶于水后电离
产生的所有离子如表所示:
阳离子 、 、
阴离子 、 、
请根据下列叙述回答问题:
(3)C 的化学式为 。
(4)A 溶液与 B 溶液反应可生成气体 X,该反应的离子方程式为 。
(5)A、B 溶液与 C 溶液反应可分别生成白色沉淀 D 和 E,其中 D 可溶于稀硝酸。鉴别溶液中 B 的阴离子的
方法是 。
【答案】
(1)Ag+ 、Mg2+(2 分) Fe3+、Cu2+(2 分)
(2)d(2 分)
(3)Ba(OH) (2 分)
2
(4)2H++CO =H
2
O+CO
2
↑(2 分)
(5)先加入过量稀盐酸,再向上层溶液中加入 BaCl 溶液,若有白色沉淀生成,则证明溶液中有 SO (3 分)
2
【详解】Ⅰ.溶液无色,肯定不含有颜色的离子,原溶液中不存在 Cu2+、Fe3+;取少量原溶液,加入过量稀
盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明含有 Ag+ ;再取①中的滤液,加入过量的氢
氧化钠溶液,出现白色沉淀,说明原溶液含有 Mg2+;
Ⅱ.由给出的离子可知,H+ 只能与 共存,Ba2+只能与 OH-共存,A 是正盐,B 是酸式盐,C 是碱,A 与
B 反应生成气体,C 与 A、B 均反应生成沉淀,白色沉淀 D 可溶于稀硝酸,则 D 为碳酸钡,E 为硫酸钡,
可知 A 为 NaCO,B 为 NaHSO,C 为 Ba(OH) ;
2 3 4 2
(1)溶液无色,肯定不含有颜色的离子,则原溶液中不存在 Cu2+、Fe3+;加入过量稀盐酸,有白色沉淀生
成,再加入过量稀硝酸,沉淀不消失,说明含有 Ag+ ;再取①中的滤液,加入过量的氢氧化钠溶液,出现白
色沉淀,说明原溶液含有 Mg2+。溶液中一定不存在的离子是 Fe3+、Cu2+,一定存在的离子是 Ag+ 、Mg2+;
(2)原溶液中存在 Ag+ ,则 Cl-、 、OH-不能与其大量共存,原溶液中肯定有 Mg2+,故 、OH-不
能与其大量共存,硝酸根离子不与所给的任何离子发生反应,故溶液中可能大量存在的离子是 ;
(3)由分析可知,C 的化学式为 Ba(OH) ;
2
(4)根据分析,A 溶液与 B 溶液反应可生成气体 CO,该反应的化学反应为 2NaHSO
2 4
+Na
2
CO
3
=2Na
2
SO
4
+CO
2
↑+H
2
O,离子方程式为:2H++CO =H
2
O+CO
2
↑;
(5)由分析可知,B 为 NaHSO,鉴别溶液中 B 的阴离子的方法是:先加入过量稀盐酸,再向上层溶液中
4
/加入 BaCl 溶液,若有白色沉淀生成,则证明溶液中有 SO 。
2
19.(15 分)次磷酸(H PO )是一种精细磷化工产品,具有较强还原性。HPO 与足量的 NaOH 溶液反应,
3 2 3 2
只生成 NaH PO 。回答下列问题:
2 2
(1)H PO 是一种中强酸,它属于 (填“电解质”、“非电解质”)。
3 2
(2)H PO 及 NaH PO 均可将溶液的 Ag+还原为银,从而可用于化学镀银。
3 2 2 2
①HPO 中,P 元素的化合价为 。
3 2
②NaH PO 为 (填正盐或酸式盐)。
2 2
③利用 HPO 进行化学镀银反应中,氧化剂与还原剂的个数之比为 4︰1,则氧化产物为 。(填
3 2
化学式)
(3)H PO 的工业制法是:将白磷(P )与 Ba(OH) 溶液反应生成 PH 气体和 Ba(HPO ),后者再与 HSO 反应,
3 2 4 2 3 2 2 2 2 4
写出白磷与 Ba(OH) 溶液反应的化学方式 。
2
(4)一种以白磷(P )为原料制备次磷酸钠晶体的工艺流程如下:
4
①过滤操作所用到的玻璃仪器有 。
②滤渣 2 的主要成分是 。
③由滤液得到 NaH PO ·H O 的操作为 、过滤、洗涤、干燥。
2 2 2
【答案】
(1)电解质(2 分)
(2)+1(1 分) 正盐(1 分) HPO (2 分)
3 4
(3)6H O+2P+3Ba(OH) =2PH↑+3Ba(H PO )(3 分)
2 4 2 3 2 2 2
(4)漏斗、烧杯、玻璃棒(2 分) CaCO (2 分) 加热浓缩,冷却结晶(2 分)
3
【详解】由题给流程可知,白磷与消石灰反应生成磷化氢气体和次磷酸钙,过滤得到滤渣 1 和滤液;向滤
液中通入过量的二氧化碳中和过量的氢氧化钙,向反应后的溶液中加入碳酸钠溶液,碳酸钠溶液与次磷酸
钙溶液反应生成碳酸钙沉淀和次磷酸钠,过滤得到含有碳酸钙的滤渣 2 和滤液;滤液经蒸发浓缩、冷却结
晶、过滤得到一水次磷酸钠;
(1)次磷酸是一元中强酸,在水溶液里能部分电离生成氢离子和次磷酸根离子,属于电解质;
(2)①次磷酸中氢元素化合价为+1 价、氧元素的化合价为-2 价,由化合价的代数和为 0 可知,分子中磷
元素的化合价为+1 价;
②由题意可知,次磷酸与足量的氢氧化钠溶液反应,只生成 NaH PO ,说明 NaH PO 是正盐;
2 2 2 2
③由题意可知,利用次磷酸进行化学镀银反应时,银元素的化合价降低被还原,银离子是反应的氧化剂,
磷元素的化合价升高被氧化,次磷酸是还原剂,设氧化产物中磷元素的化合价为+a 价,反应中氧化剂与还
/原剂的物质的量之比为 4:1,由得失电子数目守恒可得:1×4=(a—1)×1,解得 a=5,则氧化产物为磷酸,化
学式为 HPO ;
3 4
(3)由题意可知,白磷与氢氧化钡溶液反应生成磷化氢气体和次磷酸钡,反应的化学方程式为 6HO
2
+2P +3Ba(OH) =2PH↑+3Ba(H PO );
4 2 3 2 2 2
(4)①过滤操作所用到的玻璃仪器为漏斗、烧杯、玻璃棒;
②由分析可知,滤渣 2 的主要成分为碳酸钙;
③从滤液获得晶体的操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
/