文档内容
2024-2025 学年高一化学上学期第一次月考卷
(考试时间:60分钟 试卷满分:100分)
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.选出选择题每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净
后,再选涂其他答案标号。写在本试卷上无效。
3.测试范围:1、4章(沪科版2020必修第一册)。
4.难度系数:0.60
5.考试结束后,将本试卷和答题卡一并交回。
一.实验室配置碳酸钠溶液(16 分)
1.某实验需要98 mL 0.5000 mol/L的NaCO 溶液,配制步骤包括:
2 3
①把称量好的 固体放入烧杯中,加适量蒸馏水溶解;
②待烧杯中的溶液冷却到室温后,转入___________;
③用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。
④继续加蒸馏水至液面距刻度线1~2 cm处,改用___________滴加蒸馏水至溶液凹液面与刻度线相切;
⑤将容量瓶塞紧,充分摇匀;
回答下列问题:
(1)用电子天平称量所需 晶体的质量为 g。
(2)实验步骤中使用的仪器分别为② 、④ 。
(3)所配溶液取出10 mL,取出的溶液Na+物质的量浓度是 ,将取出溶液加水稀释至50 mL,所得溶液
的物质的量浓度为 ,取出溶液中溶质的质量为 g。
(4)下列关于容量瓶的操作,正确的是___________。
A. B. C. D.
学科网(北京)股份有限公司(5)容量瓶使用前内壁沾有水珠,所配溶液浓度 (填“偏高”、“偏低”或“无影响”)。
【答案】(1)14.3000(必须精确到小数点后4位)(2分)
(2) 100mL容量瓶(2分) 胶头滴管(2分)
(3) 1.00 mol/L(2分) 0.10 mol/L (2分) 0.53(2分)
(4)C(2分)
(5)无影响(2分)
【解析】(1)配制90mL0.5mol/L Na CO 溶液,选择100mL规格的容量瓶,则所需 的质
2 3
量为0.100L×0.5mol/L×286g/mol=14.3g;
(2)实验步骤中使用的仪器分别为②100mL容量瓶配制溶液、④胶头滴管滴加液体;
(3)溶液是均一稳定的,所配溶液取出10 mL,取出的溶液Na+物质的量浓度是0.50 mol/L×2=1.00
mol/L,将取出溶液加水稀释至50 mL,所得溶液的物质的量浓度为 ,取出
溶液中溶质的质量为0.50mol/L×0.01L×106g/mol=0.53g;
(4)A.摇匀要盖紧玻璃塞上下颠倒摇匀,A错误;
B.定容时,视线要与刻度线相平,B错误;
C.图示是移液,操作正确,C正确;
D.摇匀时要一个手托住容量瓶,另一个手按紧玻璃塞,上下颠倒,D错误;
故选C。
(5)配制溶液时,容量瓶使用前内壁沾有水珠,不会影响溶质的物质的量和溶液的体积,对溶液的物质
的量浓度不会产生影响。
二、阿伏伽德罗定律的考察(19 分)
2.I、按要求填空
(1)如果ag某气体中含有的分子数b,则cg该气体在标准状况下占有的体积应表示 L。
(2)8.4gN 与9.6g某单质R 所含原子个数相同,且分子数之比为3:2,则R的相对原子质量是 ,x值为
2 x
,9.6g单质R 所含原子个数为 。
x
(3)由KSO 、Al (SO )、KCl形成的混合溶液,其中K+、Al3+、Cl-的物质的量之比为4:3:1,且SO 的
2 4 2 4 3
物质的量浓度为3.6mol·L-1,则此溶液中Cl-的物质的量浓度为 mol·L-1
学科网(北京)股份有限公司(4)在标准状况下①6.72LCH 3.01×1023个HCl分子③13.6gH S 0.2molNH ,下列对这四种气体的关系从
4 2 3
大到小表达正确的是 ② ④
a.体积②> > > b.密度②> > >
c.质量②>①>③>④ d.氢原子个③数①④> ①> >
II、室温下①,某③容积④固定的密闭容器由可③移动④的活②塞隔成A、B两室,向A中充入一定量H、O 的混合气
2 2
体,向B中充入1molN ,此时活塞的位置如图所示。
2
(5)A室混合气体的物质的量为 mol。
(6)实验测得A室混合气体的质量为34g,则A室混合气体的平均摩尔质量为 ,其中氧气的质量为
g。
【答案】(1) (2分)
(2) 16 (2分) 3 (2分) 0.6 N 或 3.612×1023(2分)
A
(3)0.6(2分)
(4)bd(3分,对一个1分,两个3分,错一个0分)
(5)2(2分)
(6) 17 g/mol (2分) 32(2分)
【解析】(1)ag某气体中含有的分子数b,设该气体分子的摩尔质量为M, ,V=V ·n,则cg
m
该气体在标准状况下占有的体积应表示:
(2)8.4gN 的物质的量为0.3mol,含有原子数为0.6N ,由于两者所含原子数相同,9.6g某单质R 所含原
2 A x
子个数为0.6N ,且分子数之比为3:2,可知R 的物质的量为0.2mol,R 的摩尔质量,9.6g÷0.2mol=48g/
A x 3
mol,则R的相对原子质量是16,x值为3,9.6g单质R 所含原子个数为0.6N ;
x A
(3)由KSO 、Al (SO )、KCl形成的混合溶液,其中K+、Al3+、Cl-的物质的量之比为4:3:1,,根据
2 4 2 4 3
电荷守恒可知,K+、Al3+、Cl-、SO 的物质的量之比为4:3:1:6,SO 的物质的量浓度为3.6mol·L-1,
学科网(北京)股份有限公司则此溶液中Cl-的物质的量浓度为0.6mol·L-1;
(4)在标准状况下①6.72LCH 的物质的量为0.3mol,②3.01×1023个HCl分子的物质的量为0.5mol,
4
③13.6gH S的物质的量为0.4mol,④0.2molNH ,
2 3
a.体积等于物质的量之比②> > > ,错误;
b.密度之比等于摩尔质量之比③,②①> ④> > ,正确;
c.质量②> > > ,错误 ③ ④ ①
d.氢原子个③数等①于④物质的量乘以每个分子中氢原子数①> > > ,正确;
故选bd; ③ ④ ②
(5)A、B两室压强与温度相同,气体的物质的量之比等于其体积之比,A室的物质的量为1mol
;
(6)实验测得A室混合气体的质量为34g,则A室混合气体的物质的量为2mol,平均摩尔质量为17g/
mol,其中氧气的物质的量为ymol,氢气为xmol, ,x=y=1mol,氧气质量为32g;
三.实验室测定镁元素的相对原子质量(19 分)
3.学生甲利用如图所示实验装置来测定镁元素的相对原子质量。将一定质量的镁带和过量的1mol•L-1稀硫
酸在Y形管中完全反应,通过计算测出镁元素的相对原子质量。
(1)实验中配置100mL的1mol•L-1稀硫酸需要 mL的密度为1.84g/mL浓度为98%的浓硫酸。
(2)配制该稀硫酸过程中需要使用的玻璃仪器有 、 、 、 、 。
学科网(北京)股份有限公司(3)配制稀硫酸的过程中,以下操作对硫酸溶液浓度的影响(填“偏高”、“偏低”、“无影响”)。
洗涤液未转移入容量瓶 ;转移过程中溶液溅到桌面 ;未冷却至室温即转移并定容 ;使用的容量瓶不干
燥 。
(4)Y形管中发生反应化学方程式为 。
(5)学生甲的实验数据如下:消耗镁带的质量为0.025g,产生H 的体积(已折合成标准状况)为24mL,由此
2
计算得出镁元素的相对原子质量为 (保留1位小数),相对偏差为 。目前国际公认的镁元素的相对原子质
量为24.3,则如果测得的镁原子量偏小,在实验中可能引起误差的原因是 (填编号,多选扣分)
A.镁带中含有与硫酸不反应的杂质 B.没有除去镁带表面的氧化镁
C.镁带中含有杂质铝 D.所用稀硫酸不足量
【答案】(1)5.4(2分)
(2) 10mL量筒(1分) 烧杯 (1分) 玻璃棒(1分) 胶头滴管(1分) 100mL容量
瓶(1分)
(3) 偏低(1分) 偏低(1分) 偏高(1分) 无影响(1分)
(4)Mg+HSO =MgSO +H ↑(2分)
2 4 4 2
(5) 23.3(2分) 4.1%(2分) C(2分)
【解析】(1)由 ,溶液稀释前后物质的量不变,
n=cV=0.1L×1mol•L-1=V L× 18.4mol/L,解得V=0.0054L=5.4mL;
(2)配制一定物质的量浓度的溶液需要的仪器有:10mL量筒、烧杯、玻璃棒、胶头滴管以及100mL容量
瓶;
(3)洗涤液未转移入容量瓶,部分溶质损失,稀硫酸溶液浓度偏低;
少量液体溅出,即由部分溶质损失,稀硫酸溶液浓度偏低;
未恢复至室温就转移入容量瓶,定容后冷却,液面下降,体积偏小,稀硫酸溶液浓度偏高;
定容时需加蒸馏水,使用的容量瓶不干燥,对稀硫酸浓度无影响;
(4)Y形管中是Mg和稀硫酸反应生成硫酸镁和氢气,发生反应化学方程式为Mg+HSO =MgSO +H ↑;
2 4 4 2
(5)由化学方程式 可计算Mg的相对分子质量M=23.3;相对偏差为
;
学科网(北京)股份有限公司A.镁带中含有跟硫酸不反应的杂质,对反应生成氢气量减少,体积偏小,计算的Mg的相对分子质量数
值偏大;
B.镁条表面的氧化物没有除,部分氧化物和硫酸反应而没有气体生成,会导致气体体积偏小,计算的Mg
的相对分子质量数值偏大;
C.镁带中含有少量的铝,相同质量的镁和铝,铝生成的氢气多,所以会导致气体体积偏大,计算的Mg
的相对分子质量数值偏小;
D.所用稀硫酸不足量,镁条不能全部反应,生成氢气减小,体积偏小,计算的Mg的相对分子质量数值
偏大;
故答案为:C;
四.元素的推断与性质(13 分)
4. 是原子序数依次增大的四种短周期元素,R最常见同位素的原子核中不含中子。 与
可形成两种稳定的化合物: 和 。工业革命以来,人类使用的化石燃料在燃烧过程中将大量
排入大气,在一定程度导致地球表面平均温度升高。 与 是同一主族的元素。
(1)W元素的某种核素用于考古,则该核素为 。
(2) 的电子式是 。
(3) 中,稳定性较高的是 (填化学式)。
(4) 与 是同一主族的元素,且在元素周期表中与 相邻。
根据元素周期律、下列推断正确的是 (填字母序号)。
A. 的最低负化合价为 价
B. 的还原性比 强
C. 的酸性比 强
( )室温下向 固体表面吹入 ,得到两种单质和 ,该反应的化学方程式为 。 在一
5
定条件下可与 溶液反应,生成一种正盐和水,该正盐化学式为 。
学科网(北京)股份有限公司【答案】(1) (2分)
(2) (2分)
(3)H O(2分)
2
(4) AB (3分,对一个1分,两个3分,错一个0分)
(5) 3SeO+4NH=3Se+2N +6H O(2分) NaSeO(2分)
2 3 2 2 2 3
【解析】(1)W为C元素,核素用于考古,则该核素为 ;
(2)
W为C元素、X为O元素,C最外层为4个电子,O最外层6个电子,WX 为CO,电子式为:
2 2
;
(3)R X、R Y分别为HO和HS,O与S为同主族元素,O的电子层数小于S,O的原子半径小于S,O
2 2 2 2
的原子核对核外电子吸引能力大于S原子,O的非金属性强于S,故HO的稳定性大于HS,稳定性较高
2 2
的是HO;
2
(4)A.Se的最外层电子数为6,最高正化合价为+6价,最低负价为-2价,A正确;B.非金属性S大于
Se,则HSe的还原性比HS强,B正确;C.HSeO 为弱酸,HSO 为强酸,HSeO 的酸性比HYO 弱,
2 2 2 3 2 4 2 3 2 4
C错误;故选AB。
(5)室温下向SeO 固体表面吹入NH ,可得到两种单质和HO,Se的化合价由+4价降低为0价,N的的
2 3 2
化合价由-3价升高为0价,根据化合价升降守恒和原子守恒,则得该反应的化学方程式为:
3SeO+4NH=3Se+2N +6H O;
2 3 2 2
SeO 在一定条件下可与NaOH溶液反应,生成一种正盐和水,SeO 为酸性氧化物,根据元素守恒,该正盐
2 2
化学式为:NaSeO。
2 3
五.元素周期表的推断(18 分)
5.回答下列问题:
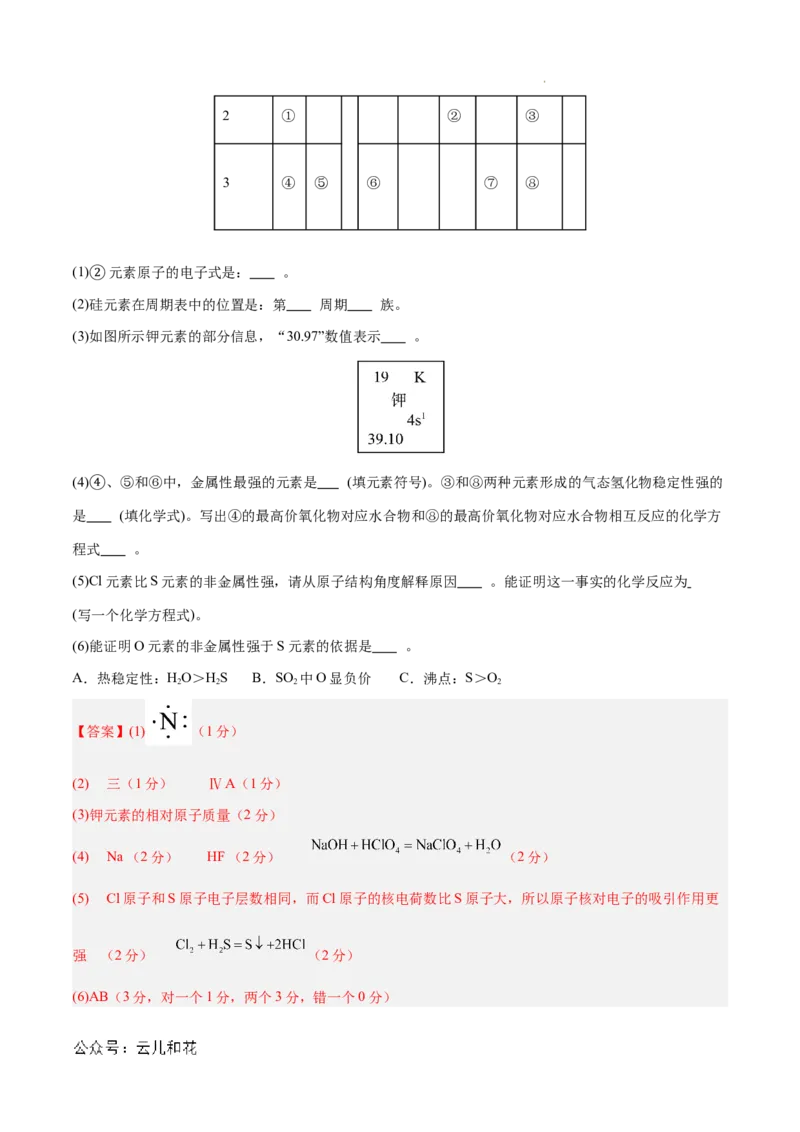
族周
ⅠA 0
期
1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
学科网(北京)股份有限公司2 ① ② ③
3 ④ ⑤ ⑥ ⑦ ⑧
(1) 元素原子的电子式是: 。
(2)②硅元素在周期表中的位置是:第 周期 族。
(3)如图所示钾元素的部分信息,“30.97”数值表示 。
(4) 、⑤和⑥中,金属性最强的元素是 (填元素符号)。③和⑧两种元素形成的气态氢化物稳定性强的
是 ④ (填化学式)。写出④的最高价氧化物对应水合物和⑧的最高价氧化物对应水合物相互反应的化学方
程式 。
(5)Cl元素比S元素的非金属性强,请从原子结构角度解释原因 。能证明这一事实的化学反应为
(写一个化学方程式)。
(6)能证明O元素的非金属性强于S元素的依据是 。
A.热稳定性:HO>HS B.SO 中O显负价 C.沸点:S>O
2 2 2 2
【答案】(1) (1分)
(2) 三(1分) ⅣA(1分)
(3)钾元素的相对原子质量(2分)
(4) Na (2分) HF (2分) (2分)
(5) Cl原子和S原子电子层数相同,而Cl原子的核电荷数比S原子大,所以原子核对电子的吸引作用更
强 (2分) (2分)
(6)AB(3分,对一个1分,两个3分,错一个0分)
学科网(北京)股份有限公司【解析】(1)
②为N,电子式为
(2)硅元素在周期表中的位置是:第三周期ⅣA族;
(3)如图所示,30.97代表K元素的相对原子质量;
(4)④为Na、⑤为Mg、⑥为Al,同周期元素,从左往右金属性逐渐减弱,即金属性最强的为Na;③为
F,⑧为Cl,同周期元素,从左往右非金属性逐渐增强,非金属性越强,气态氢化物稳定性越强,即HF的
稳定性更强;④为Na、⑧为Cl,④的最高价氧化物对应水合物和⑧的最高价氧化物对应水合物相互反
应,即NaOH与HClO 的反应,其化学方程式为: ;
4
(5)Cl元素比S元素的非金属性强,是因为从结构层面看来,Cl原子和S原子电子层数相同,而Cl原子
的核电荷数比S原子大,所以原子核对电子的吸引作用更强;反应: 可证明这一事
实;
(6)A.非金属性越强,简单氢化物的稳定性越强,A正确;
B.SO 中O显负价,即O得到电子的能力更强,非金属性更强,B正确;
2
C.单质沸点不能证明非金属性强弱,C错误;
故选AB;
六、元素的性质与结构(15 分)
6.完成下列问题
(1)下列物质中:①液氯和氯气 ②16O、17O和18O 金刚石与“足球烯”C 白磷和红磷⑤O 与O
60 2 3
H、D和T,互为同素异形体的有 (填序号,③下同),属于同位素的有 ④ ,属于同一种物质的 。
⑥(2)R元素的气态氢化物化学式为RH,其最高价氧化物的水化物化学式为 。
3
(3) 该元素在元素周期表中的位置 ;
(4)0.5 mol 16OH-中有 mol质子, mol中子, 个电子。
(5)硅元素存在三种天然同位素数据如下:
学科网(北京)股份有限公司硅的同位
同位素的相对原子质量 丰度
素
28Si 27.977 92.23%
29Si 28.976 4.67%
30Si 29.974 3.10%
请列出硅元素的相对原子质量的计算式 ;(只列式,不计算)
【答案】(1) (2分) ②⑥(2分) ①(2分)
(2)H RO 或HR③O (④2⑤分)
3 4 3
(3)第三周期第 ⅥA族(2分)
(4) 4.5(1分) 4 (1分) 5N (1分)
A
(5)27.977×92.23%+28.976×4.67%+29.974×3.10%(2分)
【解析】(1)①液氯和氯气的构成微粒只有Cl,因此二者属于同一物质;
2
16O、17O和18O的质子数相同,都是8个,而中子数不相同,因此它们互为同位素;
②③金刚石与“足球烯”C 是碳元素的不同性质的单质,二者互为同素异形体;
60
④白磷和红磷是磷元素的不同性质的单质,二者互为同素异形体;
O 与O 是氧元素的不同性质的单质,二者互为同素异形体;
2 3
⑤H、D和T的质子数相同,都是1个,而中子数不相同,因此它们互为同位素。
⑥综上所述可知:互为同素异形体的有③④⑤;属于同位素的有②⑥;属于同一物质的有①;
(2)R元素的气态氢化物化学式为RH,其最低化合价为-3价,根据同一元素最高化合价与最低化合价价
3
电子的和为0,可知该元素最高化合价为+5价,因此该元素的最高价氧化物的水化物化学式为HRO 或
3 4
HRO ;
3
(3) 表示的微粒是S2-,该元素是16号元素,原子核外电子排布是2、8、6,根据原子结构与元素位
置关系可知:因此该元素在元素周期表中的位置是位于第三周期第ⅥA族;
(4)16OH-核内有9个质子,9个中子,原子核外有10个电子,则0.5 mol中16OH-核内有4.5 mol质子,4.5
mol中子,原子核外有5 mol电子,含有的电子数目是5N 个;
A
(5)根据元素的相对原子质量与其同位素原子的相对原子质量关系,可知Si元素的相对原子质量的计算
式为A=27.977×92.23%+28.976×4.67%+29.974×3.10%。
学科网(北京)股份有限公司