文档内容
2024-2025 学年高一化学上学期第一次月考卷
一、选择题:本题共13个小题,每小题3分,共39分。在每小题给出的四个选项中,只有一项是符合题
目要求的。
阅读下列材料,完成1~3题。
我国提出争取在2030年前实现碳达峰,2060年前实现碳中和,这对于改善环境,实现绿色发展至关重
要。“碳中和”指 的排放与吸收总量相当。回答下列问题:
1.下列做法有利于实现“碳中和”的是( )
A.多乘坐燃油车出行 B.焚烧农田秸秆
C.积极参加植树造林 D.推广使用一次性餐具
【答案】C
【解析】多乘坐燃油车出行,增大CO 的排放,不利于实现“碳中和”,A不合题意;焚烧农田作物秸
2
秆,产生大量二氧化碳,不利于实现“碳中和”,B不合题意;植树造林增加绿色植被,增大CO 的消
2
耗,有利于实现“碳中和”,C符合题意;推广使用一次性餐具,增大森林树木的砍伐,减小CO 的消
2
耗,不利于实现“碳中和”,D不合题意。
2. 属于( )
A.电解质 B.碱性氧化物 C.酸性氧化物 D.酸
【答案】C
【解析】CO 属于非电解质,A错误;CO 不能和酸反应生成盐和水,不属于碱性氧化物,B错误;
2 2
CO 能和碱反应生成盐和水,属于酸性氧化物,C正确;CO 属于氧化物,不属于酸,D错误。
2 2
3.标准状况下,11.2L CO 气体的物质的量约为( )
2
A.22g B.0.5mol C. D.
【答案】B
【解析】标准状况下,11.2L CO 气体的物质的量为 ,选B。
2
4.下列各选项不能满足如图一系列关系的选项是( )
A.X为铜、Y为氧化铜、Z为硫酸铜 B.X为二氧化碳、Y为碳酸钠、Z为碳酸钙
C.X为碳酸钙、Y为氧化钙、Z为氢氧化钙 D.X为氢氧化钠、Y为氯化钠、Z为碳酸钠
【答案】D
【解析】Cu可以与O 反应生成CuO,CuO可以与硫酸反应生成CuSO 和水,铁可以与CuSO 反应生
2 4 4
成Cu和FeSO ,A项正确;CO 可以和NaOH反应生成NaCO ,NaCO 和Ca(OH) 反应生成CaCO 和
4 2 2 3 2 3 2 3
学科网(北京)股份有限公司 学科网(北京)股份有限公司NaOH,CaCO 和稀盐酸反应生成CaCl 、水和CO ,B项正确;CaCO 受热分解生成CaO,CaO与水反
3 2 2 3
应生成Ca(OH) ,CO 通入Ca(OH) 溶液中生成CaCO ,C项正确;NaOH与盐酸反应生成NaCl,NaCl
2 2 2 3
不能直接转化生成NaCO,D项错误。
2 3
5.一种火力发电厂烟气中 的捕捉和转化过程如图所示。下列说法错误的是( )
A.捕捉室中发生了化合反应
B.上图中出现的氧化物有4种
C.固态二氧化碳俗称干冰,广泛用于冷藏奶制品和人工降雨
D.煅烧室中发生反应的化学方程式为
【答案】B
【解析】捕捉室中CaO和CO 生成CaCO ,发生了化合反应,A项正确;上图中出现的氧化物有
2 3
CO、CaO、CO三种,B项错误;干冰升华吸热导致温度降低,广泛用于冷藏奶制品和人工降雨,C项
2
正确;CaCO 高温煅烧生成CaO和CO,D项正确。
3 2
6.下列实验方法或操作正确的是( )
图1 图2 图3 图4
A.图1:蒸发NaCl溶液 B.图2:浓硫酸稀释
C.图3:过滤Ca(OH) 悬浊液 D.图4:蒸馏乙醇
2
【答案】A
【解析】蒸发NaCl溶液用蒸发皿,装置正确,A正确; 量筒不能用于稀释浓硫酸,只能量取液体体
积,B错误;过滤应该使用玻璃棒引流,C错误;蒸馏乙醇装置中,温度计的水银球的位置和冷凝管中
冷凝水的水流方向都是错误的,D错误。
7.科学家第一次让18个碳原子连成环,其合成过程如图所示。下列说法正确的是( )
学科网(北京)股份有限公司 学科网(北京)股份有限公司( )
用N 表示阿伏加德罗常数的值
A
A.C 的摩尔质量为216 B.C 与石墨都是碳的同素异形体
18 18
C.216gC 含有的原子总数是1N D.1molC O 转化为C 过程中反应生成44.8LCO
18 A 20 2 18
【答案】B
【解析】C 的摩尔质量为216 g∙mol−1,A错误;C 与石墨都是碳元素形成的不同单质,二者互
18 18
为同素异形体,B正确;216gC 的物质的量为1mol,其中含有的原子总数是18N ,C错误;
18 A
C O→C +2CO,1mol C O 转化为C 过程中生成2molCO,即标准状况下生成44.8LCO,但
20 2 18 20 2 18
题中没有说明标准状况,D错误。
8.下列物质:①盐酸,②氨水,③二氧化碳,④纯硫酸,⑤氯化钠固体,⑥酒精,⑦铜,⑧熔融氯化
钠,⑨氢氧化铁胶体,⑩五水硫酸铜,以下叙述不正确的是
A.能导电的有4种 B.属于纯净物的有7种
C.属于非电解质的有2种 D.属于电解质的有4种
【答案】A
【解析】能导电的有盐酸、氨水、铜、熔融氯化钠、氢氧化铁胶体,共5种,A项错误;属于纯净物的
有二氧化碳、纯硫酸、氯化钠固体、酒精、铜、熔融氯化钠、五水硫酸铜,共 7种,B项正确;属于非
电解质的有二氧化碳、酒精,共2种,C项正确;属于电解质的有纯硫酸、氯化钠固体、熔融氯化钠、
五水硫酸铜,共4种,D项正确。
9.下列实验所采取的分离方法与对应原理都正确的是( )
选
目的 分离方法 原理
项
A 由海水(含 )获得蒸馏水 蒸馏 加热时 难挥发
B 分离汽油和水 萃取 汽油和水的密度不同
C 除去 固体中混杂的 蒸发结晶 在水中的溶解度随温度变化不大
D 分离溶于水的碘 乙醇萃取 碘在乙醇中的溶解度较大
【答案】A
【解析】用蒸馏法从海水中获得蒸馏水,主要是利用水的沸点较NaCl低,加热时 难挥发,A正
确;用分液的方法分离汽油和水主要是因为汽油与水不相混溶,B错误;用重结晶的方法除去硝酸钾中
的氯化钾杂质,利用的原理是两者的溶解度随温度变化差异较大,C错误;乙醇能与水互溶,不可用作
分离溶于水的碘的萃取剂,D错误。
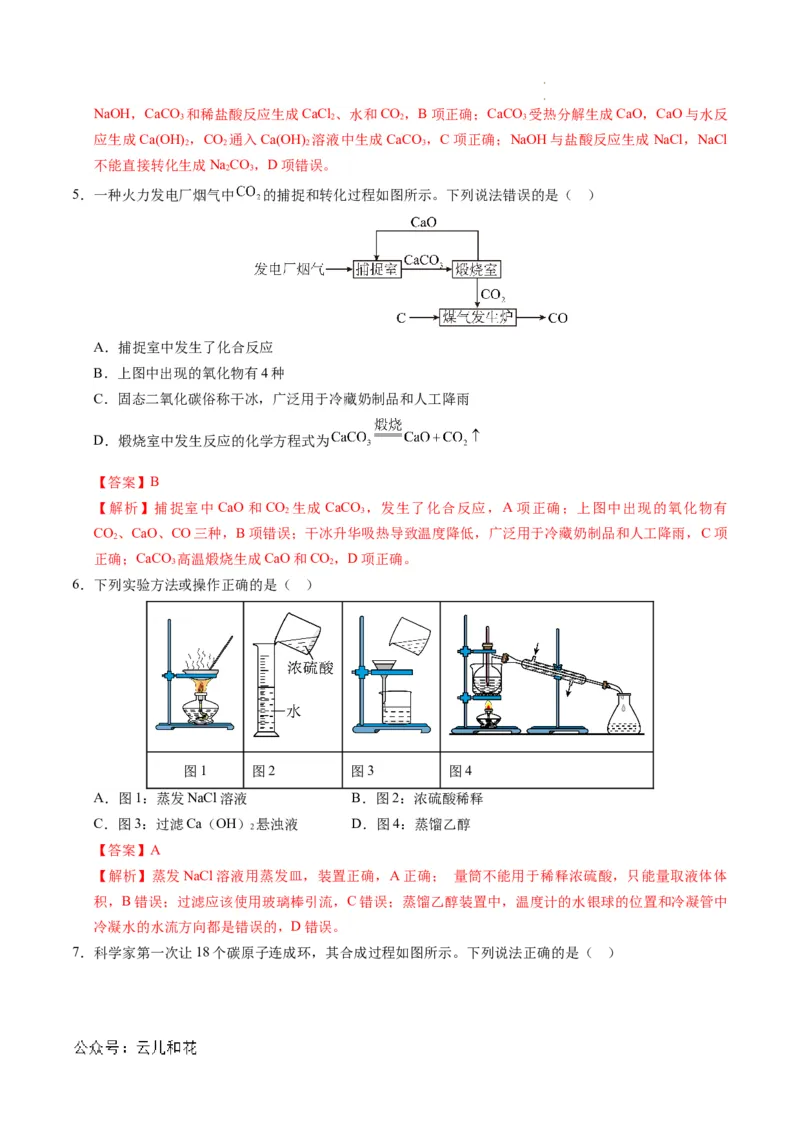
10.配制一定体积一定物质的量浓度的 溶液的操作过程示意图如下:
学科网(北京)股份有限公司 学科网(北京)股份有限公司下列说法中不正确的是( )
A.“操作1”将 在烧杯中溶解并冷却至室温
B.“操作2”中玻璃棒起引流作用
C.“操作4”定容时若俯视刻度线会造成所配溶液浓度偏低
D.所配制的 溶液中 为
【答案】C
【解析】溶解需要在烧杯中进行,冷却至室温后在转移到容量瓶中,A项正确;向容量瓶中转
移溶液时用玻璃棒引流,B项正确;定容时若俯视刻度线,水的量不足,溶液体积减小,造成
所配溶液浓度偏大,C项错误;碳酸钠的质量为 10.6g,物质的量为0.1mol,容量瓶规格为
100mL,溶液的物质的量浓度为 0.1mol÷0.1L=1mol/L,则钠离子浓度为1mol/L×2=2mol/L,D
项正确。
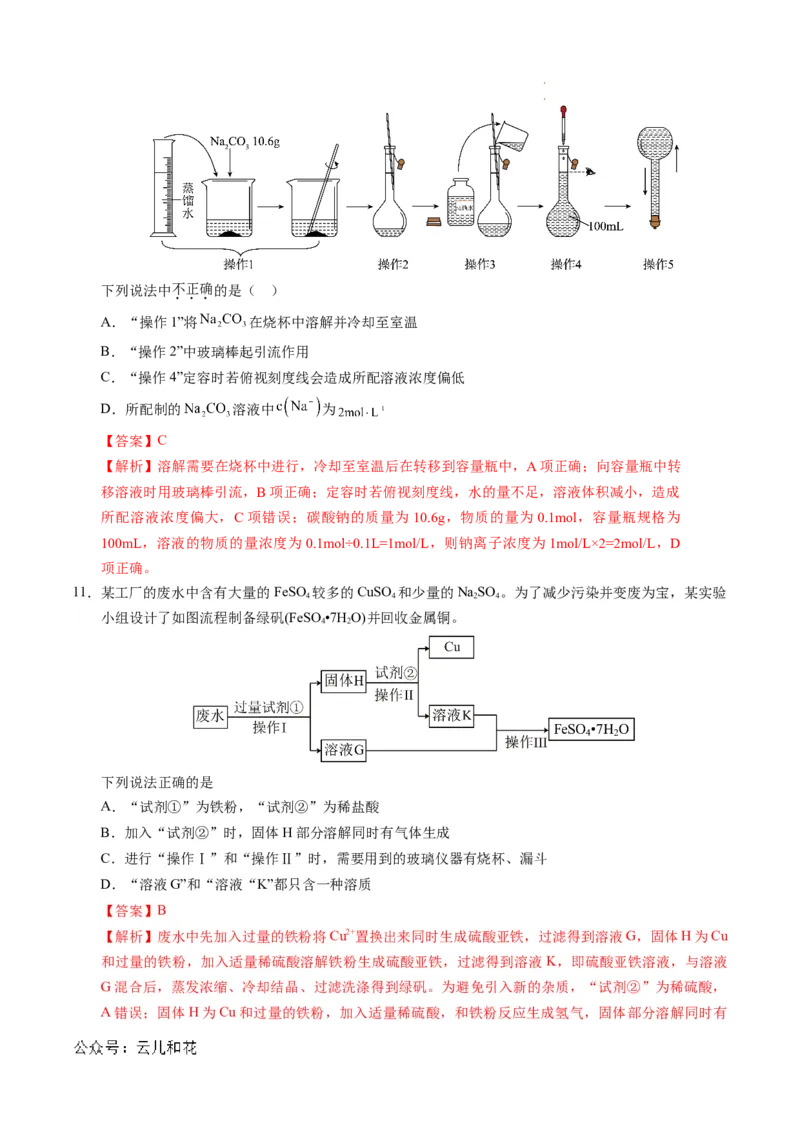
11.某工厂的废水中含有大量的FeSO 较多的CuSO 和少量的NaSO 。为了减少污染并变废为宝,某实验
4 4 2 4
小组设计了如图流程制备绿矾(FeSO •7H O)并回收金属铜。
4 2
下列说法正确的是
A.“试剂①”为铁粉,“试剂②”为稀盐酸
B.加入“试剂②”时,固体H部分溶解同时有气体生成
C.进行“操作Ⅰ”和“操作Ⅱ”时,需要用到的玻璃仪器有烧杯、漏斗
D.“溶液G”和“溶液“K”都只含一种溶质
【答案】B
【解析】废水中先加入过量的铁粉将Cu2+置换出来同时生成硫酸亚铁,过滤得到溶液G,固体H为Cu
和过量的铁粉,加入适量稀硫酸溶解铁粉生成硫酸亚铁,过滤得到溶液 K,即硫酸亚铁溶液,与溶液
G混合后,蒸发浓缩、冷却结晶、过滤洗涤得到绿矾。为避免引入新的杂质,“试剂②”为稀硫酸,
A错误;固体H为Cu和过量的铁粉,加入适量稀硫酸,和铁粉反应生成氢气,固体部分溶解同时有
学科网(北京)股份有限公司 学科网(北京)股份有限公司气体生成,B正确;“操作I”和“操作Ⅱ”均为过滤,所需玻璃仪器为烧杯、漏斗、玻璃棒,C错
误;溶液G中含硫酸亚铁和未除去的硫酸钠,溶液K中含硫酸亚铁和可能剩余的硫酸,D错误。
12.在0.4L由NaCl、 、 组成的混合溶液中,部分离子浓度大小如图所示。下列说法错误的是
( )
A.NaCl的物质的量为0.4mol
B. 的质量为19g
C.该混合溶液加水稀释至体积为1L,稀释后溶液中 的物质的量浓度为0.2
D.向该稀释后的溶液中加入足量硝酸酸化的 溶液,可得到沉淀0.4mol
【答案】D
【解析】c(Na+)=1.0mol/L,该混合液中,NaCl的物质的量为0.4L×1.0mol/L=0.4mol,A正确;该混合
液中,c(Mg2+)=0.5mol/L,含溶质MgCl 的质量为0.4L×0.5mol/L×95g/mol=19.0g,B正确;由电荷守恒
2
可以计算出溶液中Ca2+的物质的量浓度为0.5mol/L,该混合液加水稀释至体积为1L,稀释过程中溶质
的物质的量不变,则稀释后溶液中Ca2+的物质的量浓度为:c= =0.2mol/L,C正确;加
入足量硝酸酸化的硝酸银溶液,氯离子转化为AgCl沉淀,n(AgCl)=n(Cl−)=3mol/L×0.4L=1.2mol,D错
误。
13.相对分子质量为Mr的气态化合物V L(标准状况)溶于m g水中,得到溶液的质量分数为w%,物质的
量浓度为c mol·L-1,密度为ρ g·cm-3,则下列说法正确的是( )
A.溶液密度ρ可表示为 B.物质的量浓度c可表示为
C.溶液的质量分数w%可表示为 D.相对分子质量Mr可表示为
【答案】D
【解析】根据c= 可得ρ= ,A错误;V L标准状况下的该气体的物质的量
为 ,该气体的质量为 ,溶液的质量为m g+ ,形成溶液的
学科网(北京)股份有限公司 学科网(北京)股份有限公司体积为 ,该溶液的物质的量浓度为 ,B错误;由B项
的分析可知,溶液中溶质的质量分数w%= ,C错误;由溶质
的 质 量 分 数 w%= 整 理 得 该 气 体 的 相 对 分 子 质 量 为
,D正确。
二、非选择题:本题共4小题,共61分。
14.(8分)现有甲、乙、丙三名同学分别进行Fe(OH) 胶体的制备实验。
3
甲同学:向饱和氯化铁溶液中加入少量的NaOH溶液。
乙同学:直接加热饱和FeCl 溶液。
3
丙同学:向25mL沸水中逐滴加入5~6滴FeCl 饱和溶液;继续煮沸至溶液呈红褐色,停止加热。
3
试回答下列问题:
(1)其中操作正确的同学是 (填“甲”“乙”或“丙”)。该同学想证明Fe(OH) 胶体已经
3
制备成功,他可以利用 (最简单的方法)进行鉴别。
(2)制备氢氧化铁胶体的化学方程式为 。
(3)已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯Fe(OH) 胶体
3
的装置是可用下列中的 (填选项)。
A. B. C.
【答案】(1)丙(2分) 丁达尔效应(2分)
(2) (2分)
(3)C(2分)
【解析】(1)Fe(OH) 胶体制备的方法为:向25mL沸水中逐滴加入5~6滴FeCl 饱和溶液;继续煮沸
3 3
至溶液呈红褐色,停止加热;可用丁达尔效应鉴别胶体已制备成功。(2)制备氢氧化铁胶体为FeCl
3
与HO反应生成Fe(OH) 胶体和HCl,化学方程式为 。(3)胶体
2 3
学科网(北京)股份有限公司 学科网(北京)股份有限公司的分散质可以透过滤纸,不可以透过半透膜,提纯 Fe(OH) 胶体可以用半透膜装置,让杂质小分子透
3
过半透膜,胶体分散质留下来,起到提纯作用。
15.(22分)I.根根据所学知识,回答下列问题:
(1)在同温同压下,NO和SO 两种气体,密度比为 ,若两者质量相等,其体积比为
2
。
(2)30gRO 中,核外电子总数比质子总数多6.02×1023,则R的摩尔质量为 。
(3)实验室利用反应2KClO 2KCl+3O ↑制取氧气,现有12.25gKClO 参加反应,计算得到标准状况
3 2 3
下的氧气的体积是 L。
(4)某元素G的一种含氧酸化学式为HGO ,属于二元酸,则HGO 与过量氢氧化钠溶液反应生成
3 3 3 3
的产物NaHGO 为 (填“酸式盐”或“正盐”)。
2 3
(5)某密闭容器,中间有一可自由滑动的隔板(厚度忽略不计)将容器分成两部分,装置如图所示
(左、右两侧温度相同)。左边充入 1mol 氦气,右边充入 CO 和 NO 的混合气体,原子总数为共
1.6mol,则左右两室体积比为 。
(6)2.76gCaO ·8H O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线,140°C时完全脱水,杂
2 2
质受热不分解)如图所示。试确定60°C时CaO·xHO中x= 。
2 2
II.新型冠状病毒肺炎爆发以来,各类杀菌消毒剂逐渐被人们所认识和使用。下列是我们常见的几种
消毒剂:①“84”消毒液;② HO ;③ ClO ;④ O ;⑤碘酒;⑥ 75%酒精;⑦过氧乙酸
2 2 2 3
(CHCOOOH);⑧高铁酸钠(Na FeO)。回答下列问题:
3 2 4
(7)上述杀菌消毒剂属于电解质的是 (填序号):属于非电解质的是 (填序号)。
【答案】(1)15:32(2分) 32:15(2分)
(2)12g/mol(2分)
(3)3.36(2分)
(4)正盐(2分)
(5)5:4(3分)
(6)2(3分)
学科网(北京)股份有限公司 学科网(北京)股份有限公司(7)②⑦⑧(3分) ③(3分)
【解析】(1)同温同压下,气体密度之比等于摩尔质量之比,NO和SO 的密度之比为30:64=15:
2
32。若两者质量相等,体积之比为密度的反比,为32:15。(2)1mol 核外电子数比质子总数多
2mol,当核外电子总数比质子总数多6.02×1023,则 的物质的量为0.5mol, 的摩尔质量为
60g/mol,R的摩尔质量为12g/mol。(3) 的物质的量为0.1mol,反应产生氧气的物质的
量为0.15mol,标准状况下的体积为 =3.36L。(4)HGO ,属于二元酸,则HGO 与过量氢
3 3 3 3
氧化钠溶液反应生成的产物NaHGO 为正盐,因为氢氧化钠过量,若为酸式盐则还会与氢氧化钠反
2 3
应。(5)两室的压强和温度相等,体积之比等与气体物质的量之比,右边充入 CO和NO的混合气
体,原子总数为共1.6mol,CO和NO都是双原子分子,则气体的物质的量为0.8mol,左右两室体积之
比为1:0.8=5:4。(6)60℃时固体质量减少了2.76-1.68=1.08g,减少水的物质的量为1.08g÷18g/
mol=0.06mol,140℃时样品中结晶水完全失去,质量减少了 2.76-1.32=1.44g,减少水的物质的量为
1.44g÷18g/mol=0.08mol,CaO·8H O 中有 8 个结晶水,则 CaO·8H O 的物质的量为 0.01mol,那么
2 2 2 2
60℃时失去了0.06mol水,60℃时CaO·xHO的分子式为CaO·2H O,故x=2。
2 2 2 2
(7)①“84”消毒液是混合物,不是电解质也不是非电解质;② HO 在水中部分电离,属于电解质,
2 2
③ClO 自身不能电离,属于非电解质;④O 为单质,既不是电解质也不是非电解质;⑤碘酒是混合
2 3
物,既不是电解质也不是非电解质;⑥75%酒精是混合物,既不是电解液也不是非电解质;⑦过氧乙
酸的水溶液能导电,属于电解质;⑧高铁酸钠的水溶液能导电,高铁酸钠是电解质。上述物质中属于
电解质的是②⑦⑧,属于非电解质的是③。
16.(14分)HSO 和NaOH是实验室里常用的试剂。已知浓硫酸应密封保存,否则吸水而使浓度降低。
2 4
名称 硫酸
化学式 HSO
2 4
体积 500mL
质量分数 98%
密度 1.8g/mL
I.HSO 溶液的配制
2 4
(1)某次实验中五组同学每组都要用250mL1mol/LH SO 的溶液,现有浓硫酸一瓶,瓶上标签如图,
2 4
请帮助他们计算该浓硫酸的物质的量浓度为 mol/L。配制250mL1mol/LH SO 溶液时需此浓硫
2 4
酸的体积为 mL。(保留一位小数)
II.NaOH溶液的配制
实验室需配制490mL0.5mol/L的NaOH溶液
(2)配制过程中用到的玻璃仪器有量筒、烧杯、玻璃棒、 和胶头滴管,配制前要称量NaOH
固体 g。
III.某同学认为上述浓硫酸可能因保存不当而使浓度降低,甲小组同学重新测定配制的 HSO 溶液的
2 4
物质的量浓度。
(3)甲组同学用配制的标准NaOH溶液来测定20mLH SO 溶液的浓度,消耗0.5mol/L的NaOH溶液
2 4
学科网(北京)股份有限公司 学科网(北京)股份有限公司76.00mL。则HSO 的实际物质的量浓度为 mol/L。
2 4
IV.乙丙丁戊四组同学也模仿甲同学进行实验,他们测定时所消耗的NaOH溶液的体积如下表
组别 乙 丙 丁 戊
消耗NaOH溶液的体积 76.10ml 79.50ml 76.00ml 75.95ml
(4)甲、乙、丁、戊四组同学一致认为丙组同学在配制HSO 溶液时出现了问题,请你帮助分析一下
2 4
可能的原因_______。
A.未冷却就转移定容 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
【答案】(1)18(2分) 13.9(2分)
(2)500mL容量瓶 (2分) 10.0(2分)
(3)0.95mol/L(3分)
(4)AC(3分)
【解析】(1)该浓硫酸物质的量浓度c= = mol/L=18mol/L,溶液稀释过程中硫
酸的物质的量不变,即18mol/L×V=1mol/L×0.25L,解得V=0.0139L,即13.9mL;
(2)配制溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀、装瓶,则需要的玻
璃仪器为 500mL 容量瓶、胶头滴管、量筒、烧杯、玻璃棒;500mL0.5mol/L 的 NaOH 溶液中
n(NaOH)=cV=0.5mol/L×0.5L=0.25mol,m(NaOH)=nM=40g/mol×0.25mol=10.0g。(3)NaOH与HSO
2 4
的 反 应 为 2NaOH+H SO =Na SO +2H O , 则 n(NaOH)=2n(H SO ) , 0.5mol/
2 4 2 4 2 2 4
L×0.076L=2×0.02L×c(H SO ),c(HSO )=0.95mol/L。(4)甲、乙、丁、戊四组同学一致认为丙组同学
2 4 2 4
在滴定时所消耗的NaOH溶液的体积偏大,则所配制HSO 溶液浓度c(HSO )偏大。未冷却就转移定
2 4 2 4
容,导致溶液总体积偏小,由c= 分析可知所配制HSO 溶液浓度c(HSO )偏大,A选;配制溶液
2 4 2 4
时,未洗涤烧杯,溶质没有完全转入容量瓶中,所配制HSO 溶液浓度c(HSO )偏小,B不选;配制
2 4 2 4
溶液时,俯视容量瓶刻度线,导致溶液总体积偏小,所配制HSO 溶液浓度c(HSO )偏大,C选;加
2 4 2 4
水时超过刻度线,用胶头滴管吸出,导致溶质的量偏小,所配制HSO 溶液浓度c(HSO )偏小,D不
2 4 2 4
选。
17.(17分)我国科学家屠呦呦因成功提取青蒿素而获得2015年诺贝尔医学奖。青蒿素是一种无色针状
晶体,其相对分子质量为 282,在乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为
156~157℃,热稳定性差。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法是乙醚浸取法,主要
工艺流程为:
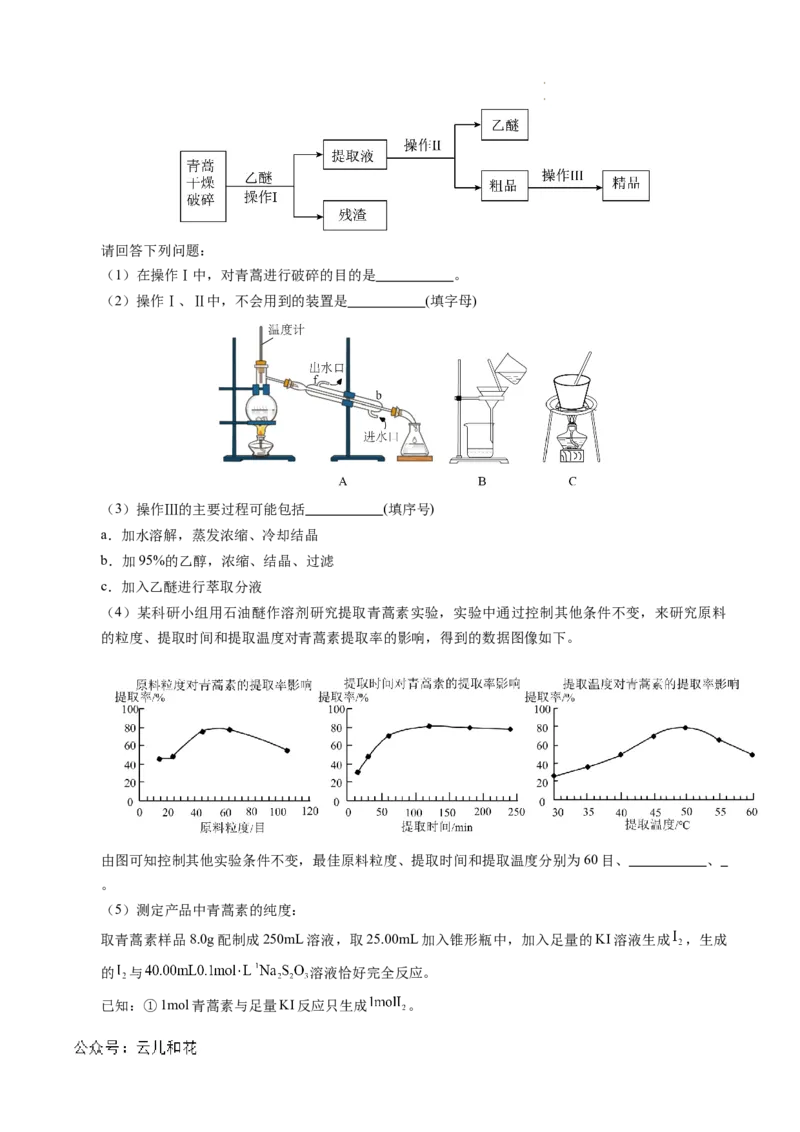
学科网(北京)股份有限公司 学科网(北京)股份有限公司请回答下列问题:
(1)在操作Ⅰ中,对青蒿进行破碎的目的是 。
(2)操作Ⅰ、Ⅱ中,不会用到的装置是 (填字母)
(3)操作Ⅲ的主要过程可能包括 (填序号)
a.加水溶解,蒸发浓缩、冷却结晶
b.加95%的乙醇,浓缩、结晶、过滤
c.加入乙醚进行萃取分液
(4)某科研小组用石油醚作溶剂研究提取青蒿素实验,实验中通过控制其他条件不变,来研究原料
的粒度、提取时间和提取温度对青蒿素提取率的影响,得到的数据图像如下。
由图可知控制其他实验条件不变,最佳原料粒度、提取时间和提取温度分别为60目、 、
。
(5)测定产品中青蒿素的纯度:
取青蒿素样品8.0g配制成250mL溶液,取25.00mL加入锥形瓶中,加入足量的KI溶液生成 ,生成
的 与 溶液恰好完全反应。
已知:①1mol青蒿素与足量KI反应只生成 。
学科网(北京)股份有限公司 学科网(北京)股份有限公司② 。
则青蒿素的纯度为 (写出计算过程)。
【答案】(1)增大青蒿与乙醚的接触面积,提高青蒿素的浸取率(3分)
(2)C(3分)
(3)b(3分)
(4)120min(2分) 50oC(2分)
( 5 ) 根 据 题 意 可 找 出 关 系 式 : , 青 蒿 素 的 纯 度 为 :
(4分)
【解析】青蒿进行破碎后加入乙醚萃取,过滤得到提取液和滤渣,滤液经过蒸馏分离得到乙醚和粗
品,粗品加入乙醇溶解后结晶得到精品。(1)青蒿进行破碎的目的是:增大青蒿与乙醚的接触面
积,提高青蒿素的浸取率。(2)根据分析,操作I为过滤,操作Ⅱ为蒸馏,故选C。(3)青蒿素可
溶于乙醇、乙醚、石油醚等有机溶剂,几乎不溶于水中,操作Ⅲ为溶解结晶提纯精品青蒿素的过程,
故主要过程可能是b:加95%的乙醇,浓缩、结晶、过滤。(4)由图可知:最佳原料粒度、提取时间
和提取温度分别为60目、120min、50oC。(5)根据题意可找出关系式: ,青
蒿素的纯度为: 。
学科网(北京)股份有限公司 学科网(北京)股份有限公司