文档内容
江苏省扬州市 2021 年中考化学试题(解析版)
单项选择题:本题包括15小题,每小题2分,共计30分。每小题只有一个选项符合题意。
1. 人体中含有多种元素。下列属于人体必需微量元素的是
A. 铁 B. 碳 C. 氢 D. 氧
【答案】A
【解析】
【详解】 碳、氧、氢、氮、磷、钾等都属于人体中的常量元素,铁、钴、铜、锌等属于人体内的微量元
素。故选A。
2. 下列过程中只发生物理变化的是
A. 高炉炼铁 B. 冰雪融化 C. 食物变质 D. 木材燃烧
【答案】B
【解析】
【分析】物理变化:没有生成新物质的变化;化学变化:生成新物质的变化;
【详解】A、高炉炼铁过程中,铁矿石转化为铁,有新物质生成属于化学变化,不符合题意,故选项错误;
B、冰雪融化过程是水的状态发生改变,没有新物质生成属于物理变化,符合题意,故选项正确;
C、食物变质过程中,物质发生缓慢氧化,有新物质生成,属于化学变化,不符合题意,故选项错误;
D、木材燃烧过程中,有二氧化碳生成,是化学变化,不符合题意,故选项错误。
故选择B;
3. 下列物质由分子构成的是
A. 氢氧化钾 B. 铝 C. 金刚石 D. 水
【答案】D
【解析】
【详解】A、氢氧化钾是由钾离子和氢氧根离子构成的,不符合题意;
B、铝是由铝原子构成的,不符合题意;
C、金刚石由碳原子构成的,不符合题意;
D、水由水分子构成的,符合题意;
故选D。
4. 自然界中的物质大多数是化合物。下列化合物属于酸的是
A. KCl B. NaOH C. CuO D. HNO
3
【答案】D
【解析】
【分析】酸:电离时产生的阳离子全部是H+的化合物为酸。碱:电离时产生的阴离子全部是OH-的化合物为碱。
盐在化学中是指一类金属离子或铵根离子与酸根离子结合的化合物
【详解】A、根据定义氯化钾是盐,不符合题意;
B、根据定义NaOH是碱,不符合题意;
C、CuO是金属氧化物,不符合题意;
D、根据定义HNO 是酸,符合题意;
3
故选D。
5. 金可制成金箔,拉成金丝,说明金具有良好的
A. 导电性 B. 延展性 C. 导热性 D. 抗腐蚀性
【答案】B
【解析】
【分析】
【详解】金子被压成薄薄的金箔、被拉成几十上百倍长度的金丝,这些都表明金具有良好的延展性。故选
B。
6. “安全重于泰山”。以下应张贴在“防火”场所的标志是
A. B. C. D.
【答案】A
【解析】
【详解】A、 是防火标识,符合题意;
B、 是循环利用标识,不符合题意;
C、 是节能标识,不符合题意;D、 是节约用水标识,不符合题意;
故选A。
7. FeCl 溶液用于制作印刷电路板,反应为 。X的化学式是
3
A. Fe B. FeCl C. Fe(OH) D. Fe(OH)
2 2 3
【答案】B
【解析】
【详解】根据质量守恒定律,反应前后原子的种类数目不发生变化,反应前原子种类数目为Fe:2,Cl:
6,Cu:1,反应后不包括X原子的种类数目为Cu:1,Cl:2,因此X中原子的种类数目为Fe:2,
Cl:4,因此X为FeCl 。
2
故选B。
8. 下列物质对应组成不正确的是
A. 干冰:CO B. 小苏打:NaHCO C. 纯碱:NaCO D. 熟石灰:CaO
2 3 2 3
【答案】D
【解析】
【详解】A、干冰是固态CO 的俗称,正确;
2
B、小苏打是NaHCO 的俗称,正确;
3
C、纯碱是Na CO 的俗称,正确;
2 3
D、熟石灰是Ca(OH) 的俗称,错误;
2
故选D。
9. 测得一些物质的pH如下,其中酸性最强的是
A. 肥皂水:pH=10.2 B. 唾液:pH=6.8 C. 柠檬汁:pH=2.5 D. 洗涤剂:pH=12.2
【答案】C
【解析】
【分析】
【详解】pH>7,溶液显碱性,pH越大,碱性越强;pH<7,溶液显酸性,pH越小,酸性越强,pH=7,溶
液显中性;
答案:C。
10. 下列属于化合反应的是A. B.
C. D.
【答案】A
【解析】
【分析】
【详解】A、该反应符合“多变一”的特点,属于化合反应,符合题意;
B、该反应符合“一变多”的特点,属于分解反应,不符合题意;
C、该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,属于复分解反应,不符合题意;
D、该反应符合“一种单质与一种化合物反应生成另一种单质和另一种化合物”的反应,属于置换反应,
不符合题意。
故选A。
11. 蔗糖的分子式为C H O ,下列关于蔗糖的说法正确的是
12 22 11
A. H、O原子个数比为2:1 B. 相对分子质量为(12+1+16)
C. 蔗糖中含45种元素 D. 氧元素的质量分数最小
【答案】A
【解析】
【详解】A、H、O原子个数比为22:11,即2:1,符合题意;
B、相对分子质量为(12×12+22×1+11×16)=342,不符合题意;
C、蔗糖中含有C、H、O三种元素,不符合题意;
D、氧元素的质量分数最大,氢元素的质量分数最小,不符合题意。
故选A。
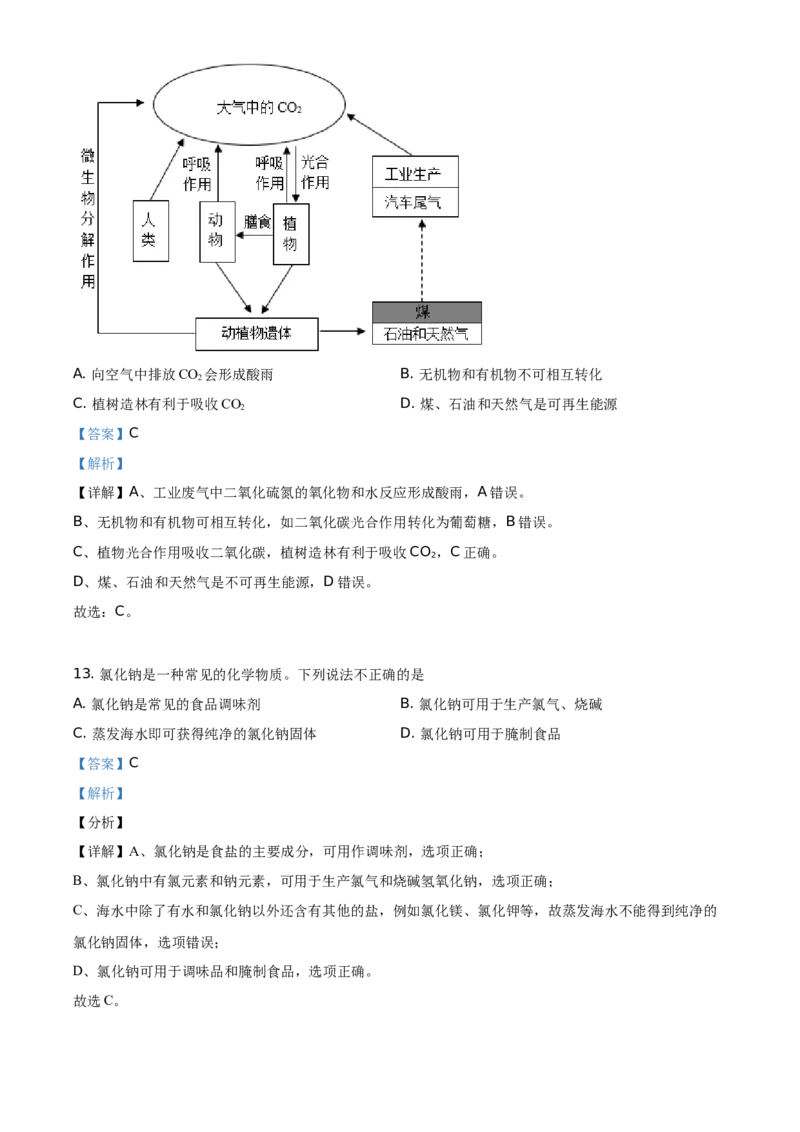
12. 自然界碳循环如图所示。下列说法正确的是A. 向空气中排放CO 会形成酸雨 B. 无机物和有机物不可相互转化
2
C. 植树造林有利于吸收CO D. 煤、石油和天然气是可再生能源
2
【答案】C
【解析】
【详解】A、工业废气中二氧化硫氮的氧化物和水反应形成酸雨,A错误。
B、无机物和有机物可相互转化,如二氧化碳光合作用转化为葡萄糖,B错误。
C、植物光合作用吸收二氧化碳,植树造林有利于吸收CO ,C正确。
2
D、煤、石油和天然气是不可再生能源,D错误。
故选:C。
13. 氯化钠是一种常见的化学物质。下列说法不正确的是
A. 氯化钠是常见的食品调味剂 B. 氯化钠可用于生产氯气、烧碱
C. 蒸发海水即可获得纯净的氯化钠固体 D. 氯化钠可用于腌制食品
【答案】C
【解析】
【分析】
【详解】A、氯化钠是食盐的主要成分,可用作调味剂,选项正确;
B、氯化钠中有氯元素和钠元素,可用于生产氯气和烧碱氢氧化钠,选项正确;
C、海水中除了有水和氯化钠以外还含有其他的盐,例如氯化镁、氯化钾等,故蒸发海水不能得到纯净的
氯化钠固体,选项错误;
D、氯化钠可用于调味品和腌制食品,选项正确。
故选C。【点睛】工业盐不能用于调味和腌制食品。
14. 某反应前后分子变化的微观示意图如下、下列说法正确的是
A. 反应有单质生成 B. 反应前后原子种类、数目不变
C. 反应物和生成物共有8种物质 D. 该反应为置换反应
【答案】B
【解析】
【分析】
【详解】A、新生成的产物中没有新生成的单质,两个白球是为完全反应的反应物,不是产物,不符合题
意;
B、根据质量守恒定律可知,化学反应前后物质的总质量不变、原子的种类不变、原子的数目不变,符合
题意;
C、反应物有两种,产物有两种,共4种,不符合题意;
D、该反应产物中没有新的单质生成,不符合置换反应的定义,不符合题意。
。
故选B
15. 为测定某石灰石样品中碳酸钙的质量分数,取2.0g石灰石样品于烧杯中,将20g稀盐酸分4次加入样
品中,充分反应后经过滤、干燥、称重,得实验数据如下:
第一次 第二次 第三次 第四次
.
稀盐酸的用量/g 50 5.0 5.0 5.0
剩余固体的质量/g 1.5 1.0 0.5 0.3
已知石灰石中的杂质既不与盐酸反应,也不溶解于水。下列说法正确的是
A. 第三次实验后碳酸钙无剩余 B. 第四次实验后盐酸无剩余
C. 盐酸中HC1的质量分数是3.65% D. 样品中碳酸钙的质量分数是85%
【答案】D
【解析】
【详解】A、根据表格可知每次加入5g稀盐酸反应0.5g碳酸钙,而第四次反应加入5g稀盐酸反应0.2g
碳酸钙,因此第三次实验后碳酸钙有剩余,错误;
B、结合选项A,第四次实验后加入5g稀盐酸反应0.2g碳酸钙,因此碳酸钙无剩余盐酸有剩余,错误;C、设盐酸的溶质质量分数为x
x=7.3%,不符合题意;
D、2.0g石灰石样品中碳酸钙质量为1.7g,样品中碳酸钙的质量分数是 ,符合题意。
故选D。
不定项选择题:本题包括5小题,每小题2分,共计10分。每小题只有一个或两个选项符合
题意。若正确答案只有一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选
一个且正确的得1分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
16. 下列有关物质的性质与用途具有对应关系的是
A. 生石灰具有吸水性,可用作干燥剂 B. 氮气性质稳定,可用作保护气
C. 金属铁具有导电性,可用于制炊具 D. 盐酸易挥发,可用于除铁锈
【答案】A
【解析】
【详解】A、生石灰能与水反应生成氢氧化钙,可作食品干燥剂,正确;
B、氮气化学性质稳定,可作保护气,错误;
C、金属铁具有导热性,可用于制炊具,错误;
D、盐酸和氧化铁反应,可用于除铁锈,错误;
故选A。
17. 用浓硫酸配制一定质量分数的稀硫酸并进行相关实验。下列操作正确的是
A. 量取浓硫酸 B. 测稀硫酸pHC. 制取氢气 D. 收集氢气
【答案】C
【解析】
【分析】
【详解】A、量筒读数时视线应与凹液面的最低处相平,选项操作错误;
B、测pH时,pH试纸不能湿润,会对待测液产生稀释的效果,选项操作错误;
C、实验室制取氢气采用稀硫酸和锌作为反应物,将锌放在多孔隔板上,稀硫酸从长颈漏斗中加入,使用
该装置可使反应随时发生随时停止,选项操作正确;
D、氢气密度比空气小,应采用向下排空气法收集,选项操作错误。
故选C。
【点睛】量筒仰视读数会使读数比实际液体体积要小。
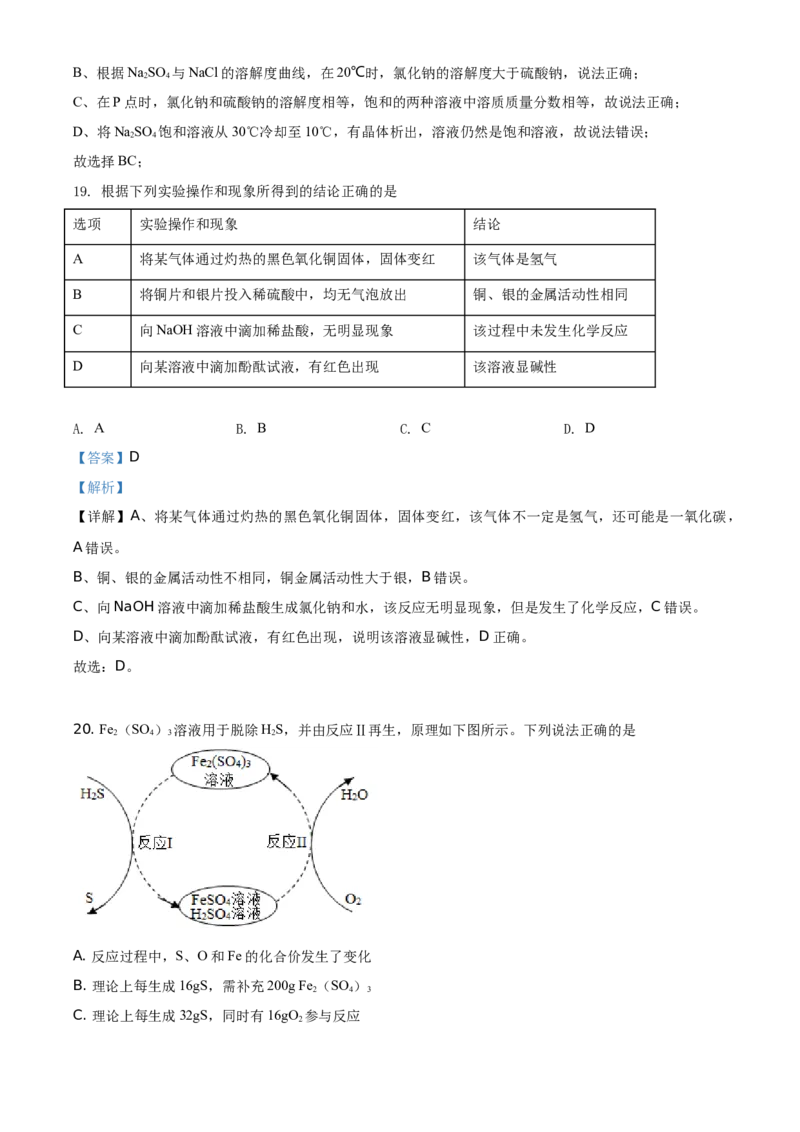
18. NaSO 与NaCl的溶解度曲线如图所示。下列说法正确的是
2 4
A. 加水能使NaCl溶液从不饱和变为饱和
B. 20℃时,NaCl的溶解度比NaSO 大
2 4
C. P点时,NaC1与NaSO 的饱和溶液质量分数相等
2 4
D. 将NaSO 饱和溶液从30℃冷却至10℃,有晶体析出,溶液变为不饱和
2 4
【答案】BC
【解析】
【详解】A、不饱和溶液转化为饱和溶液常用的方法有:加入同种溶质,恒温蒸发溶剂,降温(大多数溶
液),故加水能使NaCl溶液从不饱和变为饱和说法错误;B、根据NaSO 与NaCl的溶解度曲线,在20℃时,氯化钠的溶解度大于硫酸钠,说法正确;
2 4
C、在P点时,氯化钠和硫酸钠的溶解度相等,饱和的两种溶液中溶质质量分数相等,故说法正确;
D、将NaSO 饱和溶液从30℃冷却至10℃,有晶体析出,溶液仍然是饱和溶液,故说法错误;
2 4
故选择BC;
19. 根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 结论
A 将某气体通过灼热的黑色氧化铜固体,固体变红 该气体是氢气
B 将铜片和银片投入稀硫酸中,均无气泡放出 铜、银的金属活动性相同
C 向NaOH溶液中滴加稀盐酸,无明显现象 该过程中未发生化学反应
D 向某溶液中滴加酚酞试液,有红色出现 该溶液显碱性
A. A B. B C. C D. D
【答案】D
【解析】
【详解】A、将某气体通过灼热的黑色氧化铜固体,固体变红,该气体不一定是氢气,还可能是一氧化碳,
A错误。
B、铜、银的金属活动性不相同,铜金属活动性大于银,B错误。
C、向NaOH溶液中滴加稀盐酸生成氯化钠和水,该反应无明显现象,但是发生了化学反应,C错误。
D、向某溶液中滴加酚酞试液,有红色出现,说明该溶液显碱性,D正确。
故选:D。
20. Fe (SO ) 溶液用于脱除HS,并由反应Ⅱ再生,原理如下图所示。下列说法正确的是
2 4 3 2
A. 反应过程中,S、O和Fe的化合价发生了变化
B. 理论上每生成16gS,需补充200g Fe (SO )
2 4 3
C. 理论上每生成32gS,同时有16gO 参与反应
2D. 理论上反应Ⅱ中每生成18gHO,同时消耗152 g FeSO
2 4
【答案】AC
【解析】
【分析】
【详解】A、反应过程中,反生I的化学方程式: ,硫化氢中氢
元素显+1价,硫元素显-2价,硫酸铁中铁元素显+3价,硫元素显+6价,氧元素显-2价,单质硫中硫元素
的化合价为0,硫酸亚铁中铁元素显+2价,硫元素显+6价,氧元素显-2价,硫酸中氢元素显+1价,硫元
素显+6价,氧元素显-2价, ,硫酸中氢元素显+1价,硫元
素显+6价,氧元素显-2价,硫酸亚铁中铁元素显+2价,硫元素显+6价,氧元素显-2价,氧气中氧元素化
合价为0,水中氢元素显+1价,氧元素显-2价,硫酸铁中铁元素显+3价,硫元素显+6价,氧元素显-2价,
S、O和Fe的化合价发生了变化,说法正确;
B、硫酸铁溶液用于脱除硫化氢,并由反应Ⅱ再生,可以循环利用,无需补充硫酸铁,说法正确;
C、由化学方程式: ,
可知,该反应的总化学方程式为:
,由反应可得:每有32份质量的硫生成,就有16g氧气参与反应,说法正确;
D、由 可知:每有36份质量的水生成,需要消耗608g硫酸
亚铁,理论上反应Ⅱ中每生成18gHO,同时消耗304g硫酸亚铁,说法错误;
2
答案:AC。
非选择题
21. 扬州被称为运河之都、文化之都和美食之都,自古人文荟萃。
(1)故人西辞黄鹤楼,烟花三月下扬州。一唐·李白①孟浩然“下扬州”的交通工具是木船。现代游船常用玻璃钢制造船体,玻璃钢属于______(填“复合材
料”或“金属材料”)。
②现代人远行可乘坐飞机。铝锂合金材料大量运用于国产C919大飞机的制造,下列不属于铝锂合金性质
的是______(填字母)。
A.密度大 B.硬度大 C.抗腐蚀
③汽车是重要的陆路交通工具。燃油车辆须加装尾气催化净化装置,该装置将尾气中的CO和NO转化成
CO 和一种无污染的气体,发生反应的化学方程式是______。
2
(2)天下三分明月夜,二分无赖是扬州。一唐·徐凝
①空气质量影响人们观赏明月。空气属于______(填“混合物”或“纯净物”)。
②下列做法不利于改善空气质量的是______(填字母)。
A.风力发电 B.徒步出行 C.垃圾露天焚烧
③煤的气化和液化可实现能源清洁化,改善空气质量。水煤气中CO和H 在高温、高压和催化剂条件下合
2
成甲醇(CHO),该反应的化学方程式是______。
4
(3)前日扬州去,酒熟美蟹蜊。一宋·梅尧臣
①蟹肉鲜美,富含蛋白质。蛋白质水溶液在加热时会生成沉淀,此沉淀______(填“能”或“不能”)重
新溶解于水中。
②各种酒中都含有乙醇(C HO)。在酿酒过程中,粮食中的______(填糖类名称)先转化为葡萄糖,再
2 6
经发酵生成乙醇。
③下列食品中富含维生素C的是______(填字母)。
A.盐水鹅 B.西红柿 C.大虾
【答案】 (1). 复合材料 (2). A (3). (4). 混合物 (5). C
(6). (7). 不能 (8). 淀粉 (9). B
【解析】【分析】
【详解】(1) ①玻璃钢是强化纤维塑料,故不属于金属材料,是复合材料;
②飞机制造使用铝锂合金材料,只要是利用铝锂合金硬度大、抗腐蚀,故不属于铝锂合金材料的性质是密
度大;
③由质量守恒定律可知,化学反应前后元素的种类不变可知,反应后还有氮气生成,故反应的方程式为:
(2) ①空气中含有多种物质,故空气属于混合物;
②露天焚烧垃圾会产生多种有害气体,污染空气,故不利于改善空气质量;
③根据题意:该反应的反应物为CO和H,生成物为甲醇(CHO),反应条件为高温、高压和催化剂,故
2 4
反应方程式为:
(3) ①蛋白质水溶液在加热时会生成沉淀,此过程会使蛋白质发生变性,故不能重新溶解在水中;
②粮食中富含大量的淀粉,故酿酒时淀粉会转化为葡萄糖,葡萄糖再转化为酒精;
③富含维生素的主要原料是水果、蔬菜,故西红柿中富含大量的维生素C;
22. 水是一种常见的溶剂,也是重要的资源。
(1)实验室用NaC1固体配制50g15%NaCl溶液。
①使用托盘天平称取______gNaC1固体。
②溶解过程中需要用到的玻璃仪器有烧杯、量筒、胶头滴管和______(填仪器名称)。
。
(2)大多数天然淡水需要经过处理方可直接饮用
①工厂锅炉长期使用会形成水垢,可用盐酸去除。写出水垢中Mg(OH)CO 溶于盐酸时发生反应的化学
2 2 3
方程式______。
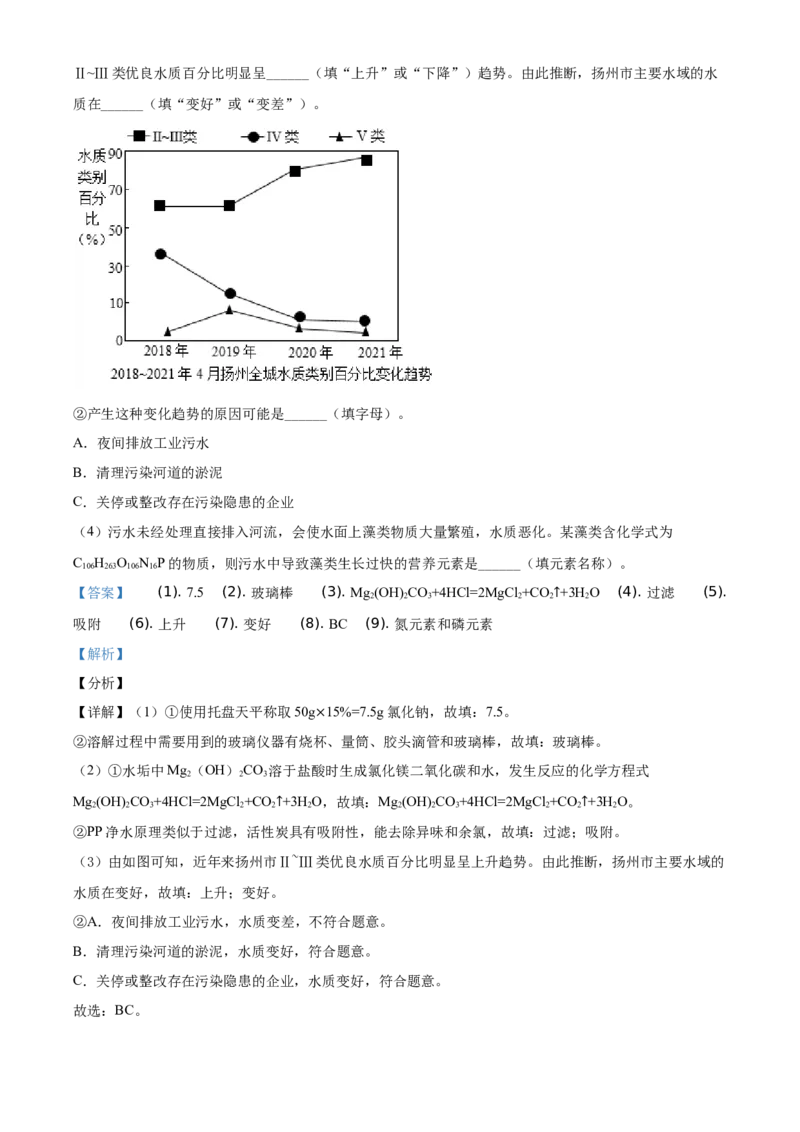
②某家用净水机工作原理如下图所示:
净水机中,PP棉净水原理是______(填“过滤”或“蒸馏”),颗粒活性炭可去除异味和余氯,是因为活
性炭具有良好 的______性。
(3)扬州积极推进水环境整治,建设“秀美瘦西湖,文明新扬州”。
①环保部门对水质进行长期监测,将水质从“优”到 “劣”分为Ⅰ~V类。由如图可知,近年来扬州市Ⅱ~Ⅲ类优良水质百分比明显呈______(填“上升”或“下降”)趋势。由此推断,扬州市主要水域的水
质在______(填“变好”或“变差”)。
②产生这种变化趋势的原因可能是______(填字母)。
A.夜间排放工业污水
B.清理污染河道的淤泥
C.关停或整改存在污染隐患的企业
(4)污水未经处理直接排入河流,会使水面上藻类物质大量繁殖,水质恶化。某藻类含化学式为
C H O N P的物质,则污水中导致藻类生长过快的营养元素是______(填元素名称)。
106 263 106 16
【答案】 (1). 7.5 (2). 玻璃棒 (3). Mg(OH) CO+4HCl=2MgCl +CO +3H O (4). 过滤 (5).
2 2 3 2 2 2
吸附 (6). 上升 (7). 变好 (8). BC (9). 氮元素和磷元素 ↑
【解析】
【分析】
【详解】(1)①使用托盘天平称取50g 15%=7.5g氯化钠,故填:7.5。
②溶解过程中需要用到的玻璃仪器有烧杯×、量筒、胶头滴管和玻璃棒,故填:玻璃棒。
(2)①水垢中Mg(OH)CO 溶于盐酸时生成氯化镁二氧化碳和水,发生反应的化学方程式
2 2 3
Mg(OH) CO+4HCl=2MgCl +CO +3H O,故填:Mg(OH) CO+4HCl=2MgCl +CO +3H O。
2 2 3 2 2 2 2 2 3 2 2 2
②PP净水原理类似于过滤,活性炭↑ 具有吸附性,能去除异味和余氯,故填:过滤;↑吸附。
(3)由如图可知,近年来扬州市Ⅱ~Ⅲ类优良水质百分比明显呈上升趋势。由此推断,扬州市主要水域的
水质在变好,故填:上升;变好。
②A.夜间排放工业污水,水质变差,不符合题意。
B.清理污染河道的淤泥,水质变好,符合题意。
C.关停或整改存在污染隐患的企业,水质变好,符合题意。
故选:BC。(3)藻类含化学式为 C H O N P的物质,则污水中导致藻类生长过快的营养元素是氮元素和磷元素,
106 263 106 16
故填:氮元素和磷元素。
23. 氧气支持生命活动,也是一种重要的化工原料。
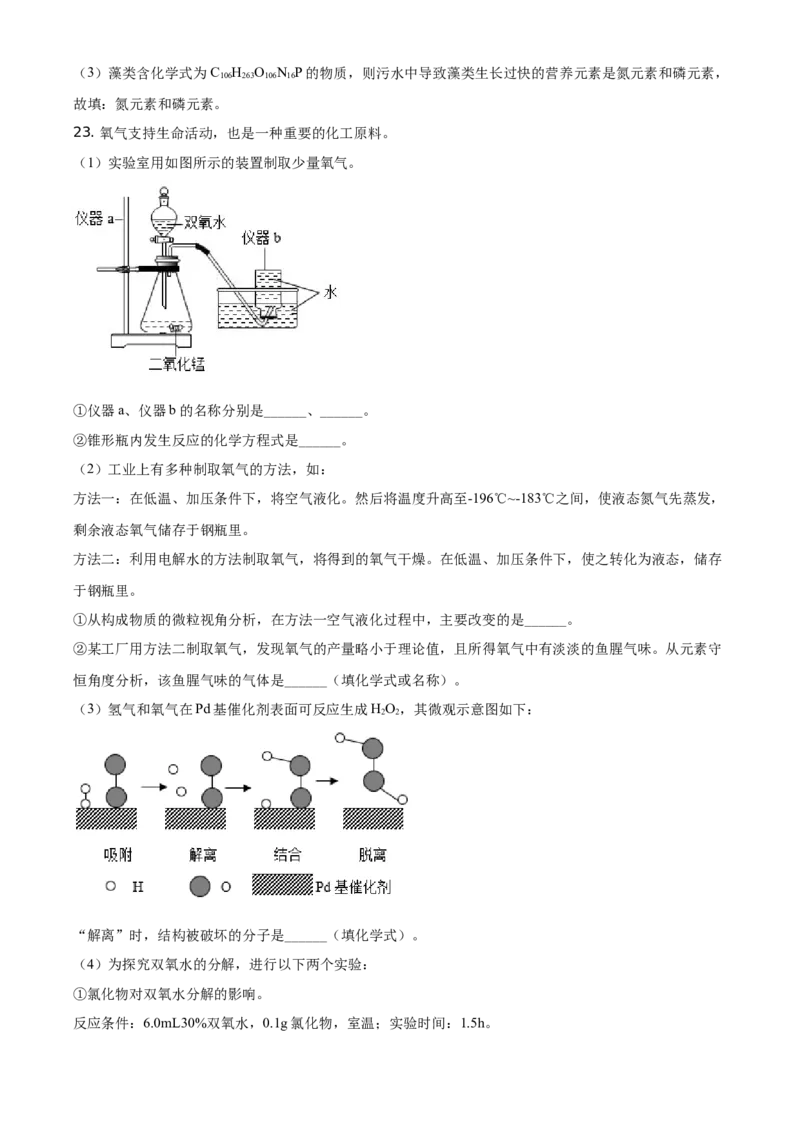
(1)实验室用如图所示的装置制取少量氧气。
①仪器a、仪器b的名称分别是______、______。
②锥形瓶内发生反应的化学方程式是______。
(2)工业上有多种制取氧气的方法,如:
方法一:在低温、加压条件下,将空气液化。然后将温度升高至-196℃~-183℃之间,使液态氮气先蒸发,
剩余液态氧气储存于钢瓶里。
方法二:利用电解水的方法制取氧气,将得到的氧气干燥。在低温、加压条件下,使之转化为液态,储存
于钢瓶里。
①从构成物质的微粒视角分析,在方法一空气液化过程中,主要改变的是______。
②某工厂用方法二制取氧气,发现氧气的产量略小于理论值,且所得氧气中有淡淡的鱼腥气味。从元素守
恒角度分析,该鱼腥气味的气体是______(填化学式或名称)。
(3)氢气和氧气在Pd基催化剂表面可反应生成HO,其微观示意图如下:
2 2
“解离”时,结构被破坏的分子是______(填化学式)。
(4)为探究双氧水的分解,进行以下两个实验:
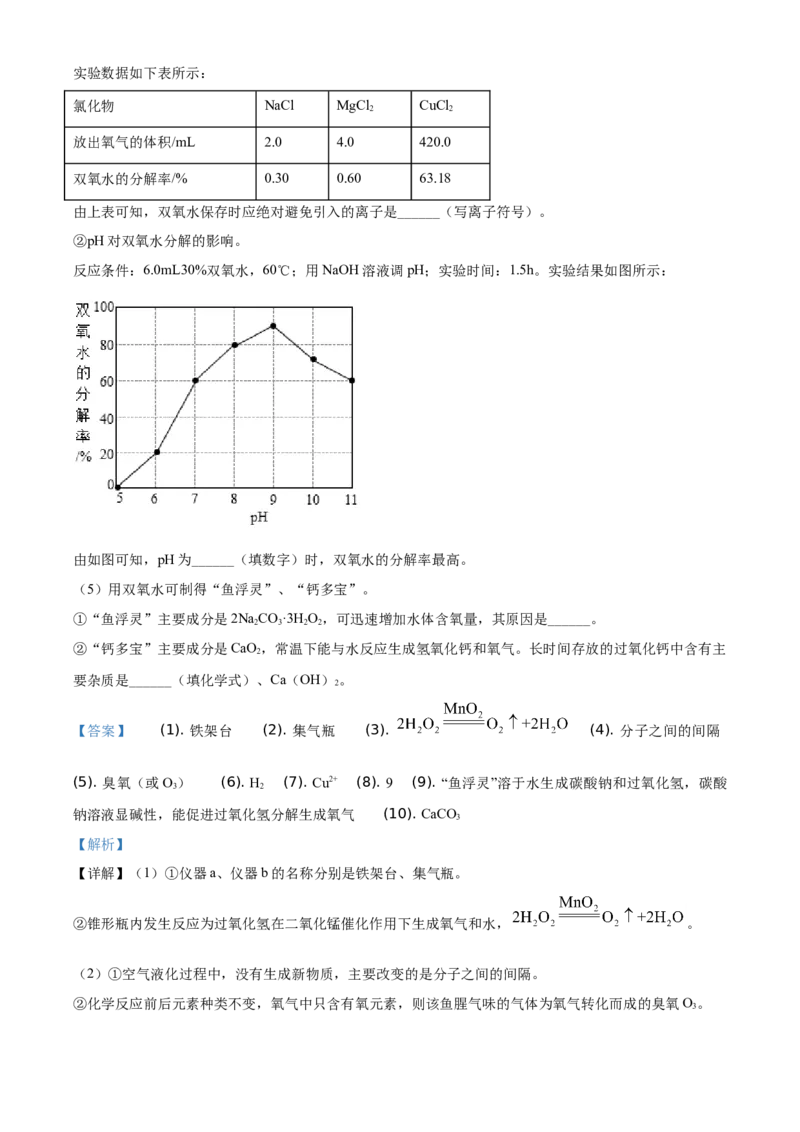
①氯化物对双氧水分解的影响。
反应条件:6.0mL30%双氧水,0.1g氯化物,室温;实验时间:1.5h。实验数据如下表所示:
氯化物 NaCl MgCl CuCl
2 2
放出氧气的体积/mL 2.0 4.0 420.0
双氧水的分解率/% 0.30 0.60 63.18
由上表可知,双氧水保存时应绝对避免引入的离子是______(写离子符号)。
②pH对双氧水分解的影响。
反应条件:6.0mL30%双氧水,60℃;用NaOH溶液调pH;实验时间:1.5h。实验结果如图所示:
由如图可知,pH为______(填数字)时,双氧水的分解率最高。
(5)用双氧水可制得“鱼浮灵”、“钙多宝”。
①“鱼浮灵”主要成分是2NaCO·3H O,可迅速增加水体含氧量,其原因是______。
2 3 2 2
②“钙多宝”主要成分是CaO,常温下能与水反应生成氢氧化钙和氧气。长时间存放的过氧化钙中含有主
2
要杂质是______(填化学式)、Ca(OH)。
2
【答案】 (1). 铁架台 (2). 集气瓶 (3). (4). 分子之间的间隔
(5). 臭氧(或O ) (6). H (7). Cu2+ (8). 9 (9). “鱼浮灵”溶于水生成碳酸钠和过氧化氢,碳酸
3 2
钠溶液显碱性,能促进过氧化氢分解生成氧气 (10). CaCO
3
【解析】
【详解】(1)①仪器a、仪器b的名称分别是铁架台、集气瓶。
②锥形瓶内发生反应为过氧化氢在二氧化锰催化作用下生成氧气和水, 。
(2)①空气液化过程中,没有生成新物质,主要改变的是分子之间的间隔。
②化学反应前后元素种类不变,氧气中只含有氧元素,则该鱼腥气味的气体为氧气转化而成的臭氧O。
3(3)由图可知,“解离”时,结构被破坏的分子是氢分子H。
2
(4)①由表可知,加入氯化铜以后,双氧水分解率特别大,比较加入氯化钠、氯化镁分解率可知,双氧
水分解率特别大的原因是引入了铜离子,故双氧水保存时应绝对避免引入的离子是铜离子Cu2+。
②由图可知,pH为9时,双氧水的分解率最高。
(5)①“鱼浮灵”主要成分是2NaCO·3H O,可迅速增加水体含氧量,其原因是“鱼浮灵”溶于水生成碳酸
2 3 2 2
钠和过氧化氢,碳酸钠溶液显碱性,能促进过氧化氢分解生成氧气。
②“钙多宝”主要成分是CaO,常温下能与水反应生成氢氧化钙和氧气,氢氧化钙能吸收二氧化碳生成碳酸
2
钙,故长时间存放的过氧化钙中含有主要杂质是生成的碳酸钙CaCO 、氢氧化钙Ca(OH)。
3 2
24. 天然气(主要成分为CH)作为清洁能源,正逐步走进城乡居民生活。
4
(1)“西气东输”工程利于国家能源和产业结构调整,极大改善了沿线居民生活质量。
①为防止传输天然气的钢管被腐蚀,可采取的措施有______(写出一种)。
②CH 完全燃烧的化学方程式是______,该过程______(填“释放”或“吸收”)能量。
4
③天然气的使用可有效减少酸雨形成。下列现象与酸雨有关的是______。
A.石刻文物被腐蚀 B.全球海平面上升
(2)工业上以CH 为原料生产H,制取原理如下图所示:
4 2
已知变换塔、洗涤塔发生的主要反应依次是:
,
①“转化炉”中有H 产生,参加反应的CH 与HO的质量比 ______。
2 4 2
②“洗涤塔”中气体从塔底通入,水从塔顶喷淋。这样操作的优点是______。
③若有32gCH 参与反应(假设各步反应都完全转化),理论上可制得______gH。
4 2
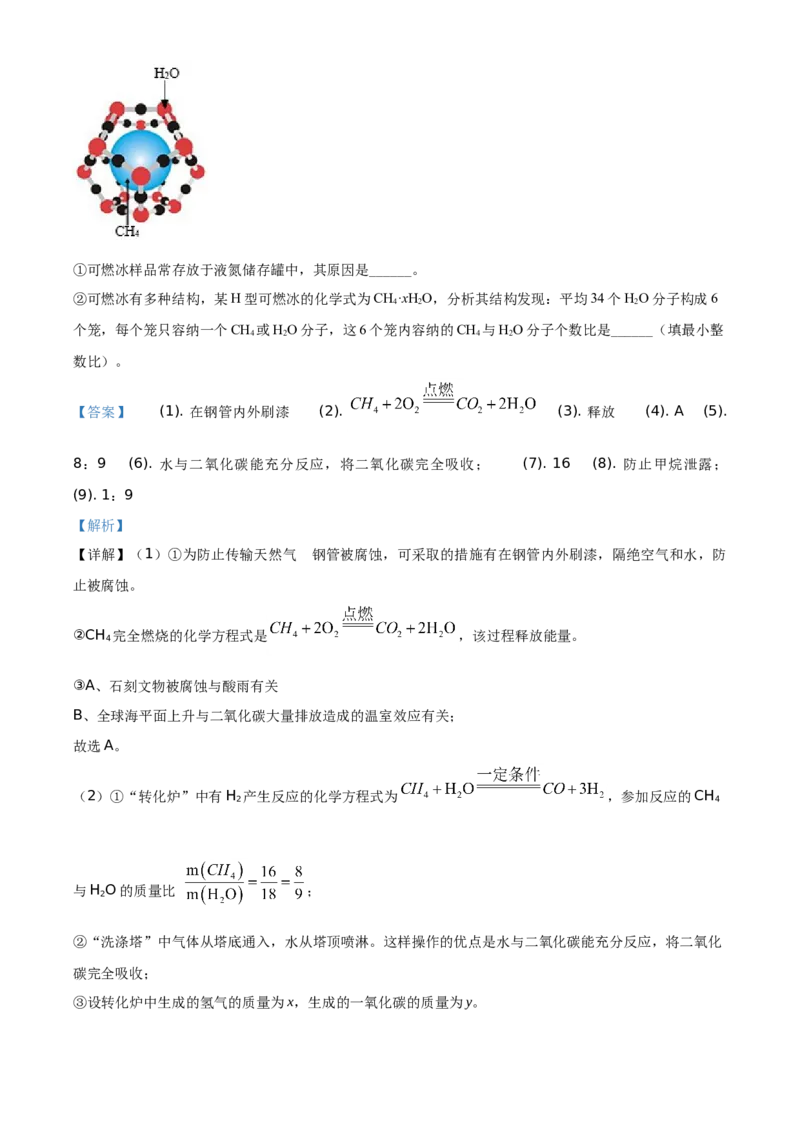
(3)我国是世界上首个成功试采海域可燃冰的国家。可燃冰是CH 被HO分子形成的笼包裹,在海底低
4 2
温和高压作用下形成的结晶物质。①可燃冰样品常存放于液氮储存罐中,其原因是______。
②可燃冰有多种结构,某H型可燃冰的化学式为CH·xHO,分析其结构发现:平均34个HO分子构成6
4 2 2
个笼,每个笼只容纳一个CH 或HO分子,这6个笼内容纳的CH 与HO分子个数比是______(填最小整
4 2 4 2
数比)。
【答案】 (1). 在钢管内外刷漆 (2). (3). 释放 (4). A (5).
8:9 (6). 水与二氧化碳能充分反应,将二氧化碳完全吸收; (7). 16 (8). 防止甲烷泄露;
(9). 1:9
【解析】
【详解】(1)①为防止传输天然气 的钢管被腐蚀,可采取的措施有在钢管内外刷漆,隔绝空气和水,防
止被腐蚀。
②CH 完全燃烧的化学方程式是 ,该过程释放能量。
4
③A、石刻文物被腐蚀与酸雨有关
B、全球海平面上升与二氧化碳大量排放造成的温室效应有关;
故选A。
(2)①“转化炉”中有H 产生反应的化学方程式为 ,参加反应的CH
2 4
与H O的质量比 ;
2
②“洗涤塔”中气体从塔底通入,水从塔顶喷淋。这样操作的优点是水与二氧化碳能充分反应,将二氧化
碳完全吸收;
③设转化炉中生成的氢气的质量为x,生成的一氧化碳的质量为y。设变换炉中生成的氢气的质量为z。
z=4g
因此理论上可制得12g+4g=16gH 。
2
(3)①由题干可知,可燃冰是CH 被H O分子形成的笼包裹,在液氮的作用下水分子能够牢牢包裹甲烷
4 2
分子,因此可燃冰样品常存放于液氮储存罐中,其原因是防止甲烷泄露;
②平均34个H O分子构成6个笼,每个笼只容纳一个CH 或H O分子,同时根据H型可燃冰的化学式,
2 4 2
则说明有2个笼被游离H O分子填充,因此水分子的个数为34+2=36,甲烷分子个数=6-2=4,因此这
2
6个笼内容纳的CH 与H O分子个数比是4:36=1:9;
4 2
25. 以某菱镁矿石(主要成分是MgCO ,含少量MnCO 、SiO)制取MgSO ·7H O,流程如下:
3 3 2 4 2
(1)“酸浸”时,为了提高浸取率,除了搅拌、提高硫酸浓度外,还可采取的措施有______(写出一
种)。此时,MnCO 发生反应的化学方程式是______。
3(2)“转化”时主要反应是 ,氯元素反应前后化合价
变化情况是______(填“升高”或“降低”)。
(3)硫酸镁溶液在不同温度下进行浓缩结晶,可得到不同的晶体:
温度/℃ -3.9-1.8 1.8-48.1 48.1-67.5 67.5-200
析出晶体 MgSO ·12H O MgSO ·7H O MgSO ·6H O MgSO ·H O等
4 2 4 2 4 2 4 2
①“操作1”的具体操作是:蒸发浓缩滤液至表面有晶膜出现(此时MgSO 溶液已饱和)、______、过滤、
4
洗涤、低温干燥。
②“操作1”所得滤液中能分离出一种可循环使用的物质,该物质是______(填化学式)。循环使用的目
的是______。
(4)已知:MgSO ·7HO中镁元素质量分数为9.76%,采用热分析法测定所得MgSO ·7H O样品中镁元
4 2 4 2
素质量分数:
①未加热前,测得样品中镁元素质量分数略大于9.76%,可能的原因是______。
②高于900℃后,测得剩余固体中镁元素质量分数大于20%,可能的原因是______。
(5)若用100t菱镁矿石可制得246 t MgSO ·7H O产品,忽略反应过程中镁元素损失,求该菱镁矿石中
4 2
MgCO 的质量分数。(写出计算过程)______。
3
【答案】 (1). 粉碎菱镁矿石 (2). MnCO +H SO =MnSO +H O+CO↑ (3). 降低 (4). 降温至
3 2 4 4 2 2
1.8-48.1℃结晶 (5). HSO (6). 提高原料利用率,节约资源和成本,减少污染 (7). 已经失去部分
2 4
结晶水 (8). 硫酸镁部分分解(合理即可) (9). 设参与反应的MgCO 的质量为x
3
根据镁元素守恒可得
解得x=84t
所以岭煤矿中碳酸镁质量分数为
【解析】
【分析】矿石中主要成分是MgCO ,含少量MnCO 、SiO,加入硫酸进行酸浸,二氧化硅和硫酸不反应,
3 3 2
依据流程图中信息,MgCO 和MnCO 与硫酸分别反应生成MgSO 和MnSO 溶液,经过过滤操作将固液分
3 3 4 4
离。向溶液中加入NaClO溶液,由图可以看出将MnSO 转化为MnO 沉淀,MgSO 和NaClO不反应,经
4 2 4过过滤操作将固液分离,得到MgSO 溶液,可通过浓缩结晶的方式得到MgSO ·7H O。
4 4 2
【详解】(1)酸浸时为了提高浸出率,可采用的操作有将矿石研磨成粉末、搅拌、提高硫酸浓度等。根
据 上 述 分 析 , MnCO 与 硫 酸 反 应 生 成 MnSO 、 水 和 二 氧 化 碳 , 反 应 方 程 式 为
3 4
MnCO +H SO =MnSO +H O+CO↑。
3 2 4 4 2 2
(2)反应前是NaClO中氯为+1价,反应后是氯化钠中氯为-1价,故化合价降低。
(3)①由表中可知,MgSO ·7H O在1.8-48.1℃析出,故在蒸发浓缩后的冷却结晶中应控制温度为1.8-
4 2
48.1℃,故填降温至1.8-48.1℃结晶。
②操作Ⅰ得到的滤液中溶质为HSO 和NaCl,其中硫酸可至酸浸步骤进行循环利用,循环使用的目的是提
2 4
高原料利用率,节约资源和成本,减少污染。
(4)①未加热前,镁元素的质量分数偏大,有可能是结晶过程中已经失去部分结晶水所导致。
②由计算可得,MgSO 中镁元素的质量分数为 ,高于900℃,镁元素的质量
4
分数大于硫酸镁中镁元素的质量分数,可能原因为硫酸镁部分分解。
(5)见答案
【点睛】当不考虑过程中镁元素的损失时,整个流程镁元素守恒,即菱镁矿碳酸镁中镁元素与生成结晶中
镁元素质量相等,据此计算。