文档内容
专题10 化学计算
1.【2022年上海卷】冰层表面摩擦力小,原因可能是其表面有一层液态水,现有一冰面面积为200m2,
液态水厚度为 m,水的密度为1g·cm⁻³,求液态水分子数
A. B. C. D.
2.【2022年1月浙江卷】某同学设计实验确定Al(NO )·xH O的结晶水数目。称取样品7.50g,经热分解
3 3 2
测得气体产物中有NO 、O、HNO、HO,其中HO的质量为3.06g;残留的固体产物是Al O,质量
2 2 3 2 2 2 3
为1.02g。计算:
(1)x=_______(写出计算过程)。
(2)气体产物中n(O )_______mol。
2
3.【2022年6月浙江卷】联合生产是化学综合利用资源的有效方法。煅烧石灰石反应:
,石灰石分解需要的能量由焦炭燃烧提供。将石灰石
与焦炭按一定比例混合于石灰窑中,连续鼓入空气,使焦炭完全燃烧生成 ,其热量有效利用率为
50%。石灰窑中产生的富含 的窑气通入氨的氯化钠饱和溶液中,40%的 最终转化为纯碱。已
知:焦炭的热值为 (假设焦炭不含杂质)。请回答:
(1)每完全分解 石灰石(含 ,杂质不参与反应),需要投料_______kg焦炭。
(2)每生产106kg纯碱,同时可获得_______ (列式计算)。
4.(2021.6·浙江真题)将3.00g某有机物(仅含C.H、O元素,相对分子质量为150)样品置于燃烧器中充
分燃烧,依次通过吸水剂、CO 吸收剂,燃烧产物被完全吸收。实验数据如下表:
2
吸水
CO 吸收剂
2
剂
实验前质量/g 20.00 26.48
实验后质量/g 21.08 30.00
请回答:
(1)燃烧产物中水的物质的量为_______mol。
(2)该有机物的分子式为_______(写出计算过程)。
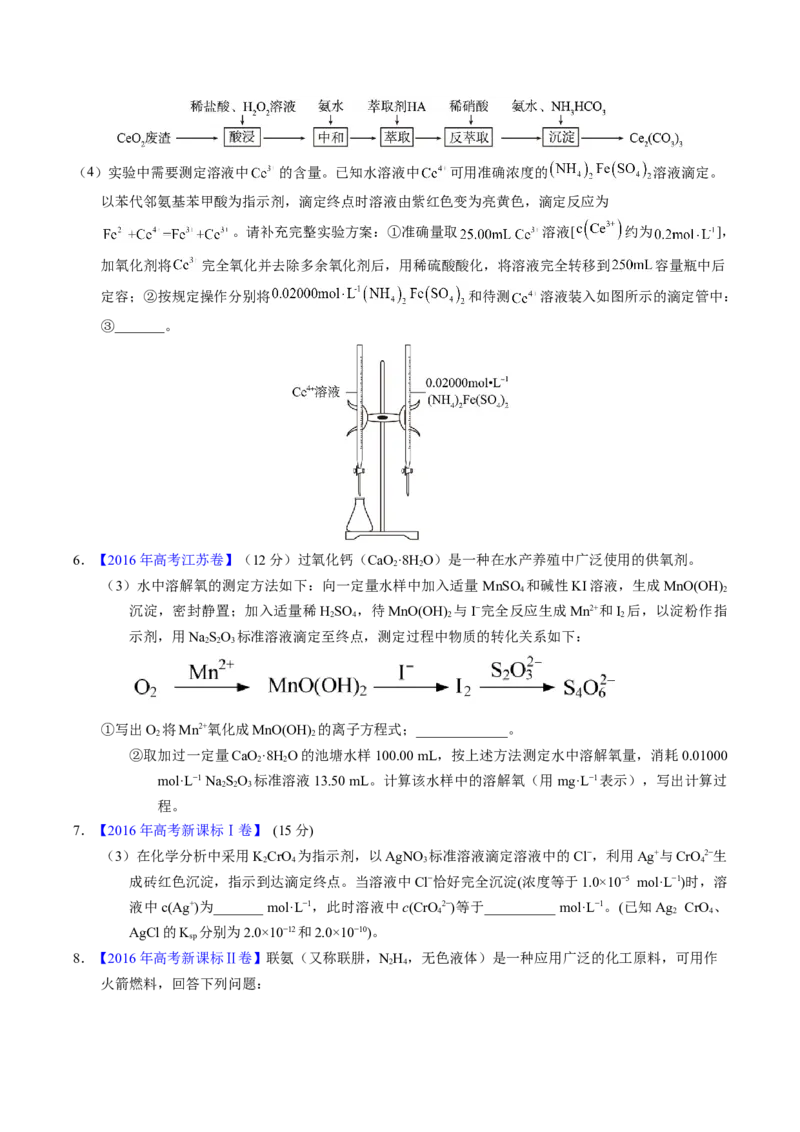
5.【2022年江苏卷】实验室以二氧化铈( )废渣为原料制备 含量少的 ,其部分实验过程
如下:(4)实验中需要测定溶液中 的含量。已知水溶液中 可用准确浓度的 溶液滴定。
以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为
。请补充完整实验方案:①准确量取 溶液[ 约为 ],
加氧化剂将 完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到 容量瓶中后
定容;②按规定操作分别将 和待测 溶液装入如图所示的滴定管中:
③_______。
6.【2016年高考江苏卷】(12分)过氧化钙(CaO·8H O)是一种在水产养殖中广泛使用的供氧剂。
2 2
(3)水中溶解氧的测定方法如下:向一定量水样中加入适量 MnSO 和碱性KI溶液,生成MnO(OH)
4 2
沉淀,密封静置;加入适量稀HSO ,待MnO(OH) 与I−完全反应生成Mn2+和I 后,以淀粉作指
2 4 2 2
示剂,用NaSO 标准溶液滴定至终点,测定过程中物质的转化关系如下:
2 2 3
①写出O 将Mn2+氧化成MnO(OH) 的离子方程式;_____________。
2 2
②取加过一定量CaO·8H O的池塘水样100.00 mL,按上述方法测定水中溶解氧量,消耗0.01000
2 2
mol·L−1 NaSO 标准溶液13.50 mL。计算该水样中的溶解氧(用mg·L−1表示),写出计算过
2 2 3
程。
7.【2016年高考新课标Ⅰ卷】 (15分)
(3)在化学分析中采用KCrO 为指示剂,以AgNO 标准溶液滴定溶液中的Cl−,利用Ag+与CrO2−生
2 4 3 4
成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好完全沉淀(浓度等于1.0×10−5 mol·L−1)时,溶
液中c(Ag+)为_______ mol·L−1,此时溶液中c(CrO 2−)等于__________ mol·L−1。(已知Ag CrO 、
4 2 4
AgCl的K 分别为2.0×10−12和2.0×10−10)。
sp
8.【2016年高考新课标Ⅱ卷】联氨(又称联肼,NH,无色液体)是一种应用广泛的化工原料,可用作
2 4
火箭燃料,回答下列问题:(5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是 。联氨
可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O kg;与
2
使用NaSO 处理水中溶解的O 相比,联氨的优点是 。
2 3 2
9.【2016年高考上海卷】(本题共14分)
CO 是重要的化工原料,也是应用广发的化工产品。CO 与过氧化钠或超氧化钾反应可产生氧气。
2 2
完成下列计算:
(1)CO 通入氨水生成NH HCO ,NH HCO 很容易分解。2.00 mol NH HCO 完全分解,分解产物经
2 4 3 4 3 4 3
干燥后的体积为_________L(标准状况)。
(2)某H 中含有2.40 molCO ,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH
2 2
完全反应,该NaOH溶液的浓度为_______。
(3)CO 和KO 有下列反应:
2 2
4KO +2CO →2KCO+3O
2 2 2 3 2
4KO +4CO +2H O→4KHCO+3O
2 2 2 3 2
若9 mol CO 在密封舱内和KO 反应后生成9 mol O ,则反应前密封舱内HO的量应该是多少?列
2 2 2 2
式计算。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH+H O CO+3H
4 2 2
已知:CO+2H CHOH CO +3H CHOH+H O
2 3 2 2 3 2
300 mol CH 完全反应后的产物中,加入100 mol CO 后合成甲醇。若获得甲醇350 mol,残留氢气
4 2
120 mol,计算CO 的转化率。
2
10.【2014年高考上海卷第十(52~55)题】(本题共14分)
硫有多种含氧酸,亚硫酸(HSO )、硫酸(HSO )、焦硫酸(HSO ·SO )、硫代硫酸(HSO )等等,
2 3 2 4 2 4 3 2 2 3
其中硫酸最为重要,在工业上有广泛的应用。在实验室,浓硫酸是常用的干燥剂。
完成下列计算:
(1)焦硫酸(HSO ·SO )溶于水,其中的SO 都转化为硫酸。若将445g焦硫酸溶于水配成4.00L硫
2 4 3 3
酸,该硫酸的物质的量浓度为________mol/。
(2)若以浓硫酸吸水后生成的HSO ·H O计算,250g质量分数为98%的硫酸能吸收多少g水?
2 4 2
(3)硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:
3FeS+8O→Fe O+6SO 4FeS +11 O →2Fe O+8SO
2 2 3 4 2 2 2 2 3 2
若48mol FeS 完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe O 与Fe O 物质的量之比。
2 3 4 2 3
(4)用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法。
硫化氢体积分数为0.84的混合气体(HS、HO、N )在空气中完全燃烧,若空气过量77%,计
2 2 2
算产物气体中SO 体积分数(水是气体)。(已知空气组成:N 体积分数0.79、O 体积分数
2 2 2
0.21)
11.【2015上海化学】(本题共14分)
氨碱法制纯碱包括石灰石分解、粗盐水精制、氨盐水碳酸化等基本步骤。完成下列计算:
(1)CaCO 质量分数为0.90的石灰石100 kg完成分解产生CO
3 2
L(标准状况)。
石灰窑中,该石灰石100 kg与焦炭混合焙烧,产生CO 29120 L(标准状况),
2
如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的物质的量为
mol。
(2)已知粗盐水含MgCl 6.80 mol/m3,含CaCl 3.00mol/m3。
2 2
向粗盐水中加入Ca(OH) 除镁离子:MgCl + Ca(OH) → Mg(OH) ↓ + CaCl
2 2 2 2 2
然后加入NaCO 除钙离子。
2 3
处理上述粗盐水10 m3,至少需要加NaCO
2 3
g。
如果用碳酸化尾气(含NH 体积分数为0.100、CO 体积分数0.040)代替碳酸钠,发生如下反应:
3 2
Ca2+ + 2NH + CO + H O → CaCO ↓ + 2NH+
3 2 2 3 4
处理上述10 m3粗盐水至少需要通入多少L(标准状况)碳酸化尾气?列式计算。
(3)某氨盐水含氯化钠1521 kg,通入二氧化碳后析出碳酸氢钠晶体,过滤后溶液中含氯化铵1070
kg。列式计算:
①过滤后溶液中氯化钠的质量。
②析出的碳酸氢钠晶体的质量。
12.【2014年高考江苏卷第18题】(12分)碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·x HO]常用作塑料阻燃剂
2
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和 。
(2)MgaAlb(OH)c(CO3)d·x HO中a、b、c、d的代数关系式为 。
2
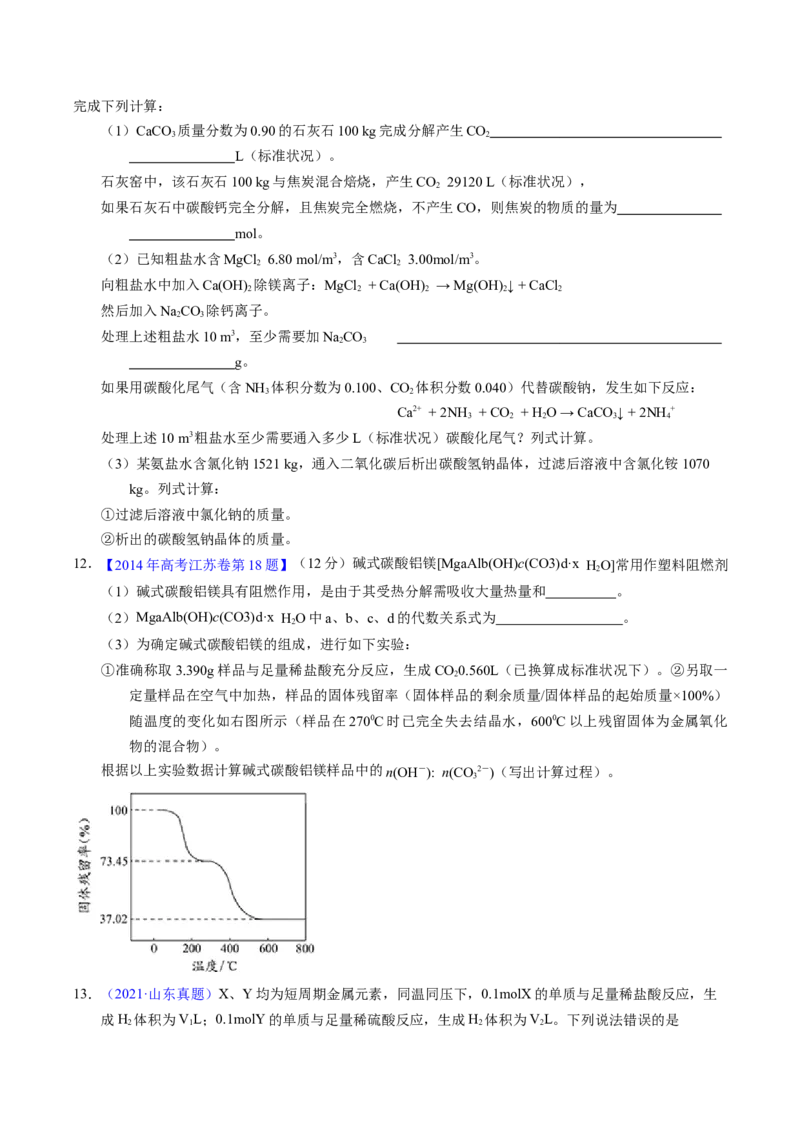
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390g样品与足量稀盐酸充分反应,生成CO0.560L(已换算成标准状况下)。②另取一
2
定量样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)
随温度的变化如右图所示(样品在2700C时已完全失去结晶水,6000C以上残留固体为金属氧化
物的混合物)。
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-): n(CO2-)(写出计算过程)。
3
13.(2021·山东真题)X、Y均为短周期金属元素,同温同压下,0.1molX的单质与足量稀盐酸反应,生
成H 体积为VL;0.1molY的单质与足量稀硫酸反应,生成H 体积为VL。下列说法错误的是
2 1 2 2A.X、Y生成H 的物质的量之比一定为
2
B.X、Y消耗酸的物质的量之比一定为
C.产物中X、Y化合价之比一定为
D.由 一定能确定产物中X、Y的化合价
14.【2016年高考上海卷】某铁的氧化物(Fe O)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下
x
112mlCl ,恰好将Fe2+完全氧化。x值为( )
2
A.0.80 B.0.85 C.0.90 D.0.93
15.【2016年高考上海卷】称取(NH )SO 和NH HSO 混合物样品7.24g,加入含0.1molNaOH的溶液,完
4 2 4 4 4
全反应,生成NH 1792ml(标准状况),则(NH )SO 和NH HSO 的物质的量比为( )
3 4 2 4 4 4
A.1:1 B.1:2 C.1.87:1 D.3.65:1
16.【2015上海化学】将O 和NH 的混合气体448mL通过加热的三氧化二铬,充分反应后,再通过足量
2 3
的水,最终收集到44.8mL气体。原混合气体中O 的体积可能是(假设氨全部被氧化;气体体积均已
2
换算成标准状况)( )
A.231.5mL B.268.8mL C.287.5mL D.313.6mL
17.【2013年高考上海卷第22题】一定量的CuS和Cu S的混合物投入足量的HNO 中,收集到气体VL
2 3
(标准状况),向反应后的溶液中(存在Cu2+和SO 2-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,
4
灼烧,得到CuO12.0g,若上述气体为NO和NO 的混合物,且体积比为1﹕1,则V可能为( )
2
A.9.0L B.13.5L C.15.7L D.16.8L
18.【2013年高考上海卷第15题】N 代表阿伏伽德罗常数。已知C H 和C H 的混合物的质量为ag,则
A 2 4 3 6
该混合物( )
A.所含共用电子对数目为(a/7+1)N B.所含碳氢键数目为aN /7
A A
C.燃烧时消耗的O 一定是33.6a/14L D.所含原子总数为aN /14
2 A
19.(2009·海南高考真题)用足量的CO还原13.7 g某铅氧化物,把生成的CO 全部通入到过量的澄清
2
石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式是:
A.PbO B.Pb O C.Pb O D.PbO
2 3 3 4 2
20.(2012·全国高考真题)在常压和500℃条件下,等物质的量的Ag O、Fe(OH)、NH HCO 、
2 3 4 3
NaHCO 完全分解,所得气体体积依次为V、V、V、V,体积大小顺序正确的是( )
3 1 2 3 4
A.V>V>V>V B.V>V>V>V C.V>V>V>V D.V>V>V>V
3 2 4 1 3 4 2 1 3 2 1 4 2 3 1 4