文档内容
2024 年普通高中学业水平选择性考试(广东卷)
化学
本卷满分100分,考试用时75分钟。
可能用到的相对原子质量:
一、选择题:本大题共16小题,共44分。第1-题,每小题2分;第11-16小题,每小题4分。
在每小题列出的四个选项中,只有一项符合题目要求。
1. 龙是中华民族重要的精神象征和文化符号。下列与龙有关的历史文物中,主要材质为有机高分子的是
A B C D
鎏金铁芯铜 云龙纹瓷
红山玉龙 云龙纹丝绸
龙 瓶
A. A B. B C. C D. D
2. “极地破冰”“太空养鱼”等彰显了我国科技发展的巨大成就。下列说法正确的是
A. “雪龙2”号破冰船极地科考:破冰过程中水发生了化学变化
B. 大型液化天然气运输船成功建造:天然气液化过程中形成了新的化学键
C. 嫦娥六号的运载火箭助推器采用液氧煤油发动机:燃烧时存在化学能转化为热能
D. 神舟十八号乘组带着水和斑马鱼进入空间站进行科学实验:水的电子式为
3. 嘀嗒嘀嗒,时间都去哪儿了!计时器的发展史铭刻着化学的贡献。下列说法不正确的是
A. 制作日晷圆盘的石材,属于无机非金属材料
B. 机械表中由钼钴镍铬等元素组成的发条,其材质属于合金
C. 基于石英晶体振荡特性计时的石英表,其中石英的成分为SiC
D. 目前“北京时间”授时以铯原子钟为基准, 的质子数为55
的
4. 我国饮食注重营养均衡,讲究“色香味形”。下列说法不正确 是
A. 烹饪糖醋排骨用蔗糖炒出焦糖色,蔗糖属于二糖B. 新鲜榨得的花生油具有独特油香,油脂属于芳香烃
C. 凉拌黄瓜加醋使其具有可口酸味,食醋中含有极性分子
D. 端午时节用棕叶将糯米包裹成形,糯米中的淀粉可水解
5. 我国自主设计建造的浮式生产储御油装置“海葵一号”将在珠江口盆地海域使用,其钢铁外壳镶嵌了锌块,
以利用电化学原理延缓外壳的腐蚀。下列有关说法正确的是
A. 钢铁外壳为负极 B. 镶嵌的锌块可永久使用
C. 该法为外加电流法 D. 锌发生反应:
6. 提纯 苯甲酸粗品(含少量 和泥沙)的过程如下。其中,操作X为
A. 加热蒸馏 B. 加水稀释 C. 冷却结晶 D. 萃取分液
7. “光荣属于劳动者,幸福属于劳动者。”下列劳动项目与所述化学知识没有关联的是
选项 劳动项目 化学知识
水质检验员:用滴定法测水中
A
含量
化学实验员:检验 是否失
B
效
C 化工工程师:进行顺丁橡胶硫化 碳碳双键可打开与硫形成二硫键
考古研究员:通过 测定化石年
D 与石墨烯互为同素异形体
代
A. A B. B C. C D. D
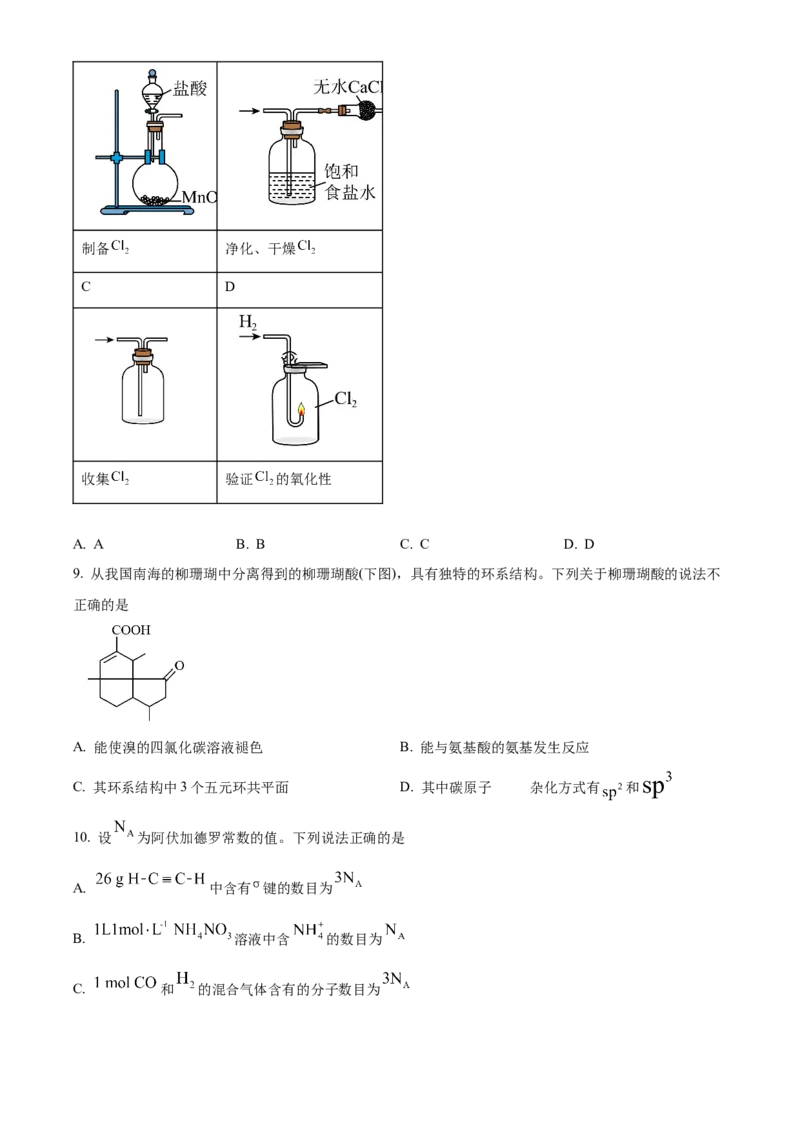
8. 1810年,化学家戴维首次确认“氯气”是一种新元素组成的单质。兴趣小组利用以下装置进行实验。
其中,难以达到预期目的的是
A B制备 净化、干燥
C D
收集 验证 的氧化性
A. A B. B C. C D. D
9. 从我国南海的柳珊瑚中分离得到的柳珊瑚酸(下图),具有独特的环系结构。下列关于柳珊瑚酸的说法不
正确的是
A. 能使溴的四氯化碳溶液褪色 B. 能与氨基酸的氨基发生反应
C. 其环系结构中3个五元环共平面 D. 其中碳原子 杂化方式有 和
的
10. 设 为阿伏加德罗常数的值。下列说法正确的是
A. 中含有 键的数目为
B. 溶液中含 的数目为
C. 和 的混合气体含有的分子数目为D. 与 反应生成 ,转移电子数目为
11. 按下图装置进行实验。搅拌一段时间后,滴加浓盐酸。不同反应阶段的预期现象及其相应推理均合理
的是
A. 烧瓶壁会变冷,说明存在 的反应
B. 试纸会变蓝,说明有 生成,产氨过程熵增
C. 滴加浓盐酸后,有白烟产生,说明有 升华
D. 实验过程中,气球会一直变大,说明体系压强增大
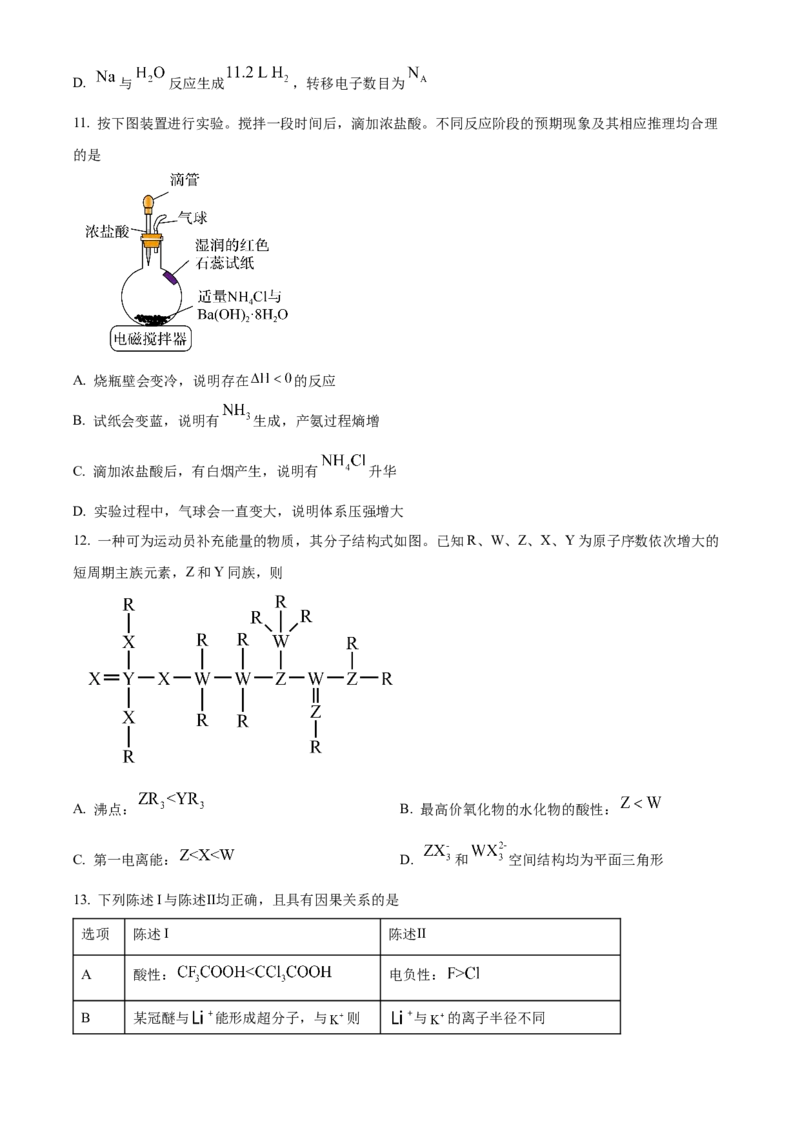
12. 一种可为运动员补充能量的物质,其分子结构式如图。已知R、W、Z、X、Y为原子序数依次增大的
短周期主族元素,Z和Y同族,则
A. 沸点: B. 最高价氧化物的水化物的酸性:
C. 第一电离能: D. 和 空间结构均为平面三角形
13. 下列陈述I与陈述Ⅱ均正确,且具有因果关系的是
选项 陈述I 陈述Ⅱ
A 酸性: 电负性:
B 某冠醚与 能形成超分子,与 则 与 的离子半径不同不能
由氨制硝酸:
C 和 均具有氧化性
D 苯酚与甲醛反应,可合成酚醛树脂 合成酚醛树脂的反应是加聚反应
A. A B. B C. C D. D
14. 部分含 或 或 物质的分类与相应化合价关系如图。下列推断合理的是
A. 若a在沸水中可生成e,则a→f的反应一定是化合反应
B. 在g→f→e→d转化过程中,一定存在物质颜色的变化
C. 加热c的饱和溶液,一定会形成能产生丁达尔效应的红棕色分散系
D. 若b和d均能与同一物质反应生成c,则组成a的元素一定位于周期表p区
15. 对反应 (I为中间产物),相同条件下:①加入催化剂,反应达到平衡所需时间大幅缩短;
②提高反应温度, 增大, 减小
。基于以上事实,可能的反应历程示意图(——为无催化剂,------为有催化剂)为
A. B. C.
D.16. 一种基于氯碱工艺的新型电解池(下图),可用于湿法冶铁的研究。电解过程中,下列说法不正确的是
A. 阳极反应:
B. 阴极区溶液中 浓度逐渐升高
C. 理论上每消耗 ,阳极室溶液减少
D. 理论上每消耗 ,阴极室物质最多增加
二、非选择题:本大题共4小题,共56分。考生根据要求作答。
17. 含硫物质种类繁多,在一定条件下可相互转化。
(1)实验室中,浓硫酸与铜丝反应,所产生的尾气可用_______(填化学式)溶液吸收。
(2)工业上,烟气中的 可在通空气条件下用石灰石的浆液吸收,生成石膏。该过程中,_______(填
元素符号)被氧化。
(3)工业锅炉需定期除水垢,其中的硫酸钙用纯碱溶液处理时,发生反应:
(Ⅰ)。兴趣小组在实验室探究 溶液的浓度对反应(Ⅰ)
的反应速率的影响。
①用 固体配制溶液,以滴定法测定其浓度。
i.该过程中用到的仪器有_______。
ii.滴定数据及处理: 溶液 ,消耗 盐酸 (滴定终点时, 转化为),则 _______ 。
②实验探究:取①中的 溶液,按下表配制总体积相同的系列溶液,分别加入 硫酸钙固体,反
应 后,过滤,取 滤液,用 盐酸参照①进行滴定。记录的部分数据如下表(忽略
水解的影响)。
序号
a 100.0 0
b 80.0 x
则 _______,测得的平均反应速率之比 _______。
(4)兴趣小组继续探究反应(Ⅰ)平衡的建立,进行实验。
①初步实验 将 硫酸钙( )加入 溶液中,在 和搅
拌条件下,利用 计测得体系的 随时间的变化曲线如图。
②分析讨论 甲同学根据 后 不改变,认为反应(Ⅰ)已达到平衡;乙同学认为证据不足,并提出如
下假设:
假设1 硫酸钙固体已完全消耗;
假设2 硫酸钙固体有剩余,但被碳酸钙沉淀包裹。
③验证假设,乙同学设计如下方案,进行实验。
步骤 现象
ⅰ.将①实验中的反应混合物进行固液分离 /
ⅱ.取少量分离出的沉淀置于试管中,滴加_______ _______,沉淀完全溶解
ⅲ.继续向ⅱ的试管中滴加_______ 无白色沉淀生成④实验小结 假设1成立,假设2不成立 。①实验中反应(Ⅰ)平衡未建立。
⑤优化方案、建立平衡 写出优化的实验方案,并给出反应(Ⅰ)平衡已建立的判断依据:_______。
18. 镓(Ga)在半导体、记忆合金等高精尖材料领域有重要应用。一种从电解铝的副产品炭渣(含
和少量的 等元素)中提取镓及循环利用铝的工艺如下。
工艺中, 是一种新型阴离子交换膜,允许带负电荷的配离子从高浓度区扩散至低浓度区。用
提取金属离子 的原理如图。已知:
① 。
② (冰晶石)的 为 。
③浸取液中, 和 以 微粒形式存在, 最多可与2个 配位,其他
金属离子与 的配位可忽略。
(1)“电解”中,反应的化学方程式为_______。
(2)“浸取”中,由 形成 的离子方程式为_______。
(3)“还原”的目的:避免_______元素以_______(填化学式)微粒的形式通过 ,从而有利于Ga的
分离。(4)“ 提取”中,原料液的 浓度越_______,越有利于Ga的提取;研究表明,原料液酸度过
高,会降低Ga的提取率。因此,在不提高原料液酸度的前提下,可向I室中加入_______(填化学式),以进
一步提高Ga的提取率。
(5)“调 ”中, 至少应大于_______,使溶液中 ,有利于 配离子及
晶体的生成。若“结晶”后溶液中 ,则 浓度为_______ 。
(6)一种含Ga、 、 元素的记忆合金的晶体结构可描述为Ga与 交替填充在 构成的立方体体
心,形成如图所示的结构单元。该合金的晶胞中,粒子个数最简比 _______,其立方晶胞的体
积为_______ 。
的
19. 酸在多种反应中具有广泛应用,其性能通常与酸 强度密切相关。
(1)酸催化下 与 混合溶液的反应(反应a),可用于石油开采中油路解堵。
①基态N原子价层电子的轨道表示式为_______。
②反应a:
已知:
则反应a的 _______。
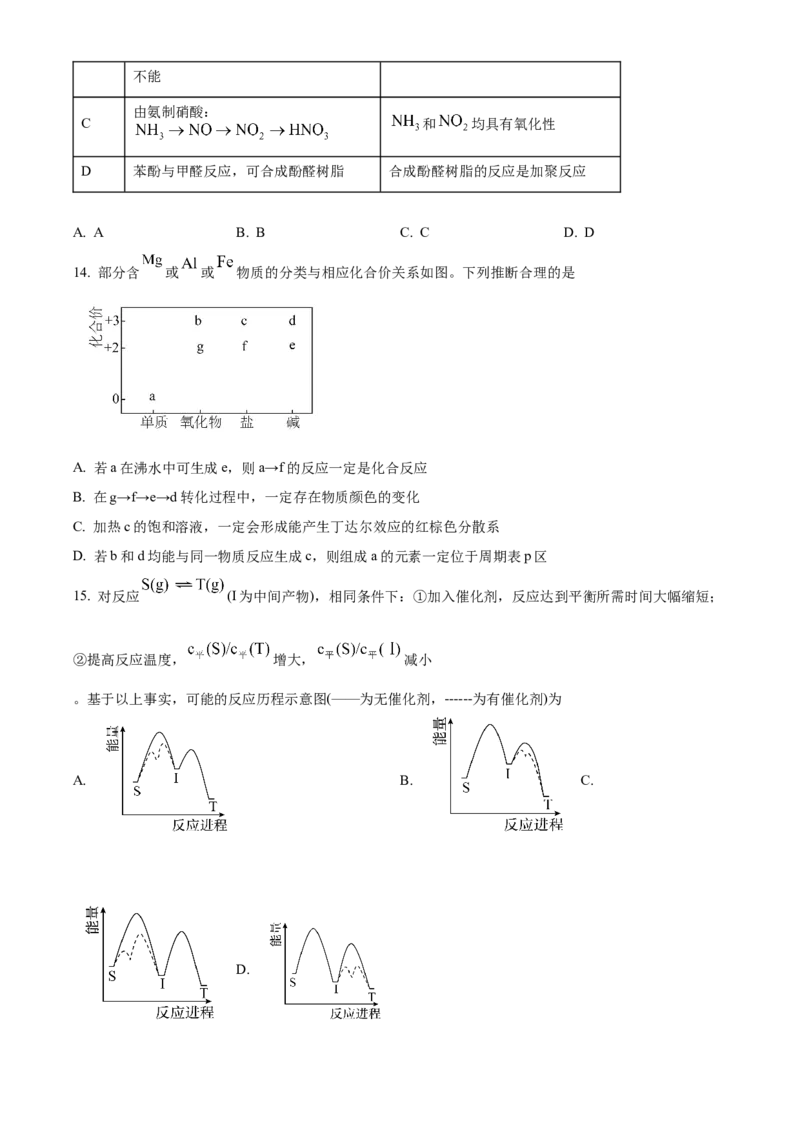
③某小组研究了3种酸对反应a的催化作用。在相同条件下,向反应体系中滴加等物质的量的少量酸,测
得体系的温度T随时间t的变化如图。据图可知,在该过程中_______。
A.催化剂酸性增强,可增大反应焓变
B.催化剂酸性增强,有利于提高反应速率
C.催化剂分子中含H越多,越有利于加速反应
D.反应速率并不始终随着反应物浓度下降而减小
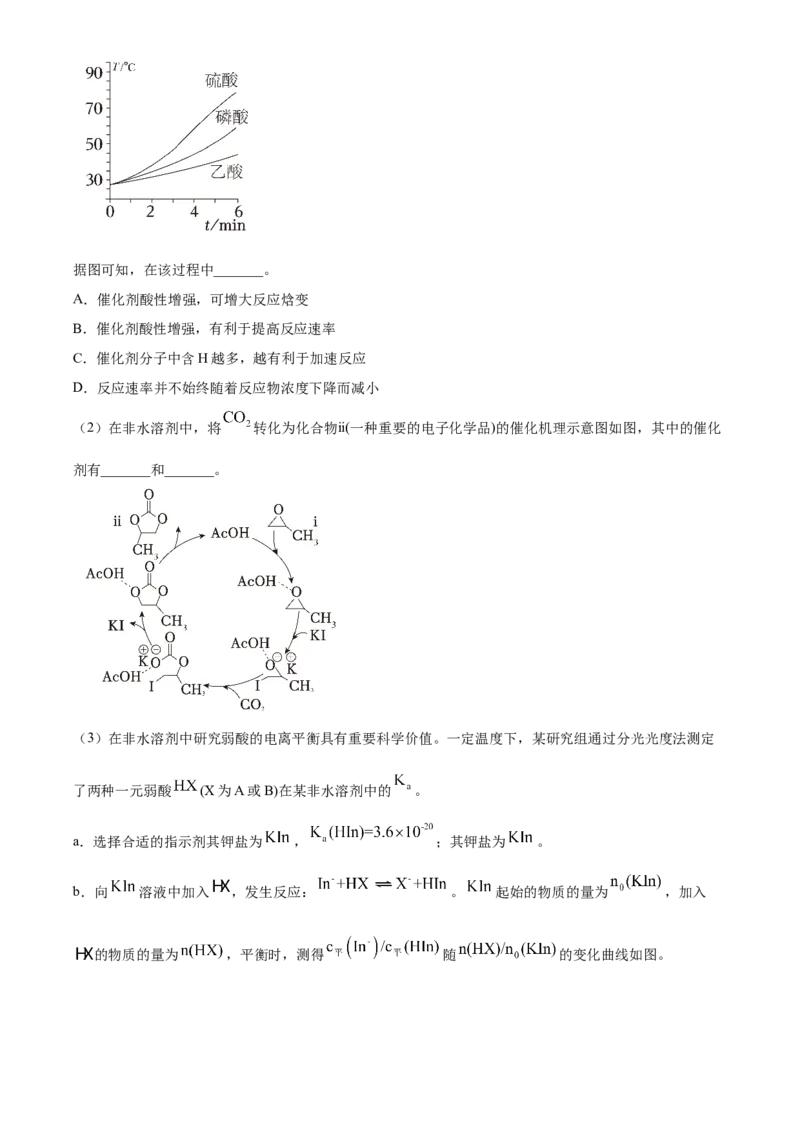
(2)在非水溶剂中,将 转化为化合物ⅱ(一种重要的电子化学品)的催化机理示意图如图,其中的催化
剂有_______和_______。
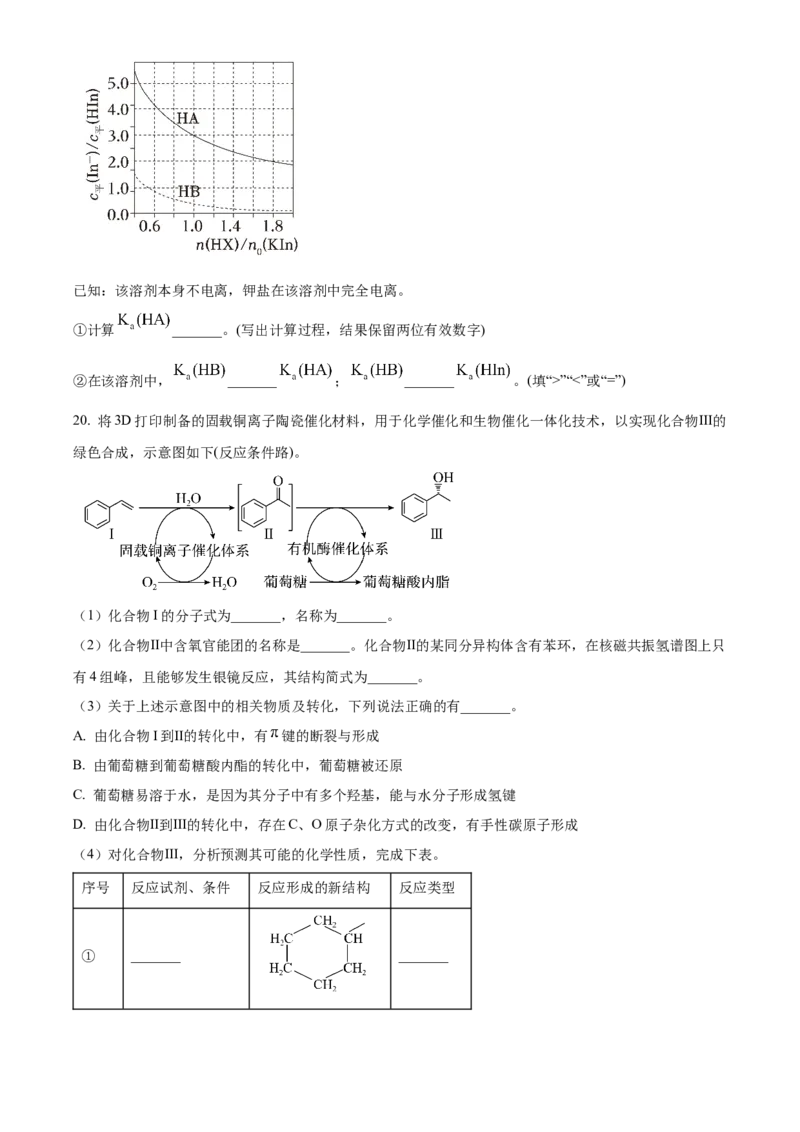
(3)在非水溶剂中研究弱酸的电离平衡具有重要科学价值。一定温度下,某研究组通过分光光度法测定
了两种一元弱酸 (X为A或B)在某非水溶剂中的 。
a.选择合适的指示剂其钾盐为 , ;其钾盐为 。
b.向 溶液中加入 ,发生反应: 。 起始的物质的量为 ,加入
的物质的量为 ,平衡时,测得 随 的变化曲线如图。已知:该溶剂本身不电离,钾盐在该溶剂中完全电离。
①计算 _______。(写出计算过程,结果保留两位有效数字)
②在该溶剂中, _______ ; _______ 。(填“>”“<”或“=”)
20. 将3D打印制备的固载铜离子陶瓷催化材料,用于化学催化和生物催化一体化技术,以实现化合物Ⅲ的
绿色合成,示意图如下(反应条件路)。
(1)化合物I的分子式为_______,名称为_______。
(2)化合物Ⅱ中含氧官能团的名称是_______。化合物Ⅱ的某同分异构体含有苯环,在核磁共振氢谱图上只
有4组峰,且能够发生银镜反应,其结构简式为_______。
(3)关于上述示意图中的相关物质及转化,下列说法正确的有_______。
A. 由化合物I到Ⅱ的转化中,有 键的断裂与形成
B. 由葡萄糖到葡萄糖酸内酯的转化中,葡萄糖被还原
C. 葡萄糖易溶于水,是因为其分子中有多个羟基,能与水分子形成氢键
D. 由化合物Ⅱ到Ⅲ的转化中,存在C、O原子杂化方式的改变,有手性碳原子形成
(4)对化合物Ⅲ,分析预测其可能的化学性质,完成下表。
序号 反应试剂、条件 反应形成的新结构 反应类型
① _______ _______② _______ _______ 取代反应
(5)在一定条件下,以原子利用率 的反应制备 。该反应中:
①若反应物之一为非极性分子,则另一反应物为_______(写结构简式)。
②若反应物之一为V形结构分子,则另一反应物为_______(写结构简式)。
(6)以2-溴丙烷为唯一有机原料,合成 。基于你设计 的合成路线,回答下列问
题:
①最后一步反应的化学方程式为_______(注明反应条件)。
②第一步反应的化学方程式为_______(写一个即可,注明反应条件)。