文档内容
专题 14 化学反应原理综合题
考点 命题趋势
化学反应原理综合题,通常以速率、平衡知识为中心,还常涉及化学反应与能量变
化电解质溶液等内容。主要的命题方向有根据已知热化学方程式书写待求热化学方
程式或直接计算其反应热,电极反应式的书写,化学反应速率的定量计算,外界条
件对化学反应速率与平衡的影响,新情境下平衡状态的判定,平衡常数的表达式及
平衡常数与转化率的计算,速率平衡图像与数据表格分析,电离平衡、水解平衡、
溶解平衡的理解, K(K )及K 的理解与计算等。主要考查考生的信息处理能力、
a b sp
考点1 化学反
学科内综合分析能力、解决生产实际中的具体问题能力。
应原理综合题
原理综合题特别注重对考生图表分析能力的考查。该类试题考查的是高中化学主干
知识,试题难度一般较大,特别是原理综合题型将多个知识点组合在一起,客观上
增加了思维容量。随着新高考卷的实行,一些知识点如离子反应与平衡等可以更多
地设置在选择题中,所以今后的化学反应原理综合题主要知识点还是会以化学反应
的热效应、化学反应速率和化学平衡为主,因此考生一定要重视对这方面知识的复
习。
1. (2024·广东卷)酸在多种反应中具有广泛应用,其性能通常与酸的强度密切相关。
(1)酸催化下 与 混合溶液的反应(反应a),可用于石油开采中油路解堵。
①基态N原子价层电子的轨道表示式为_______。
②反应a:
已知:
则反应a的 _______。
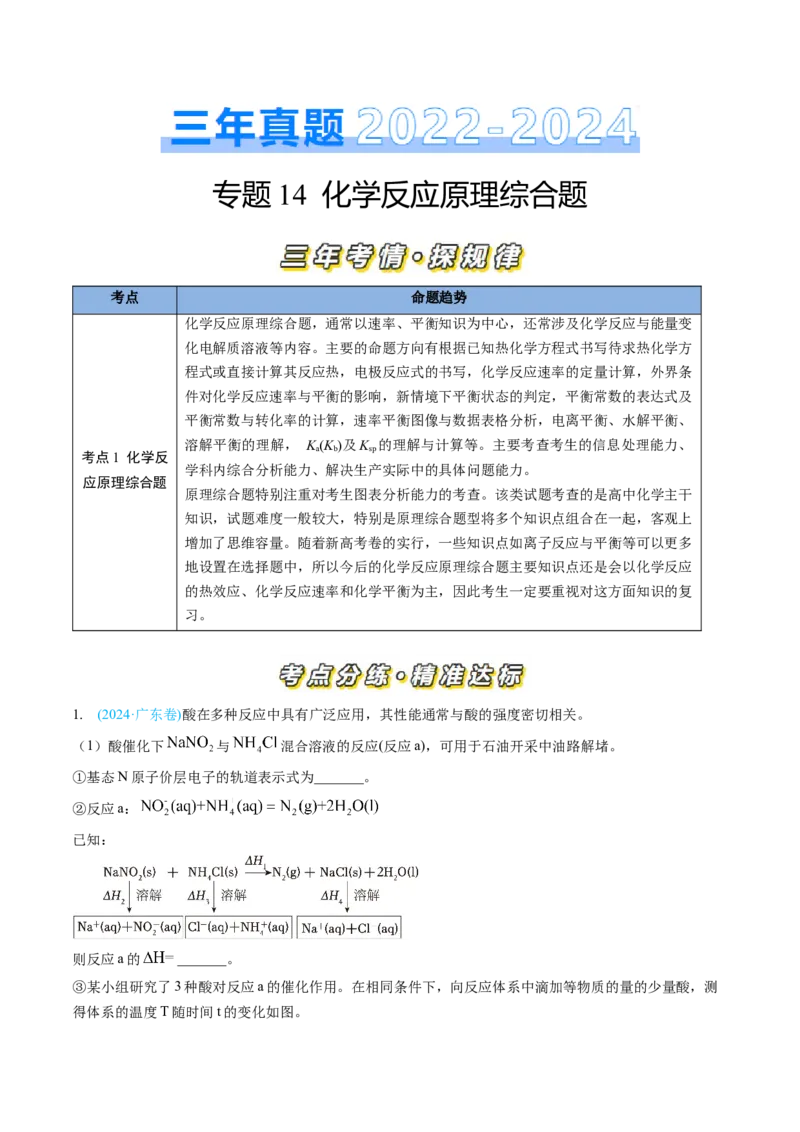
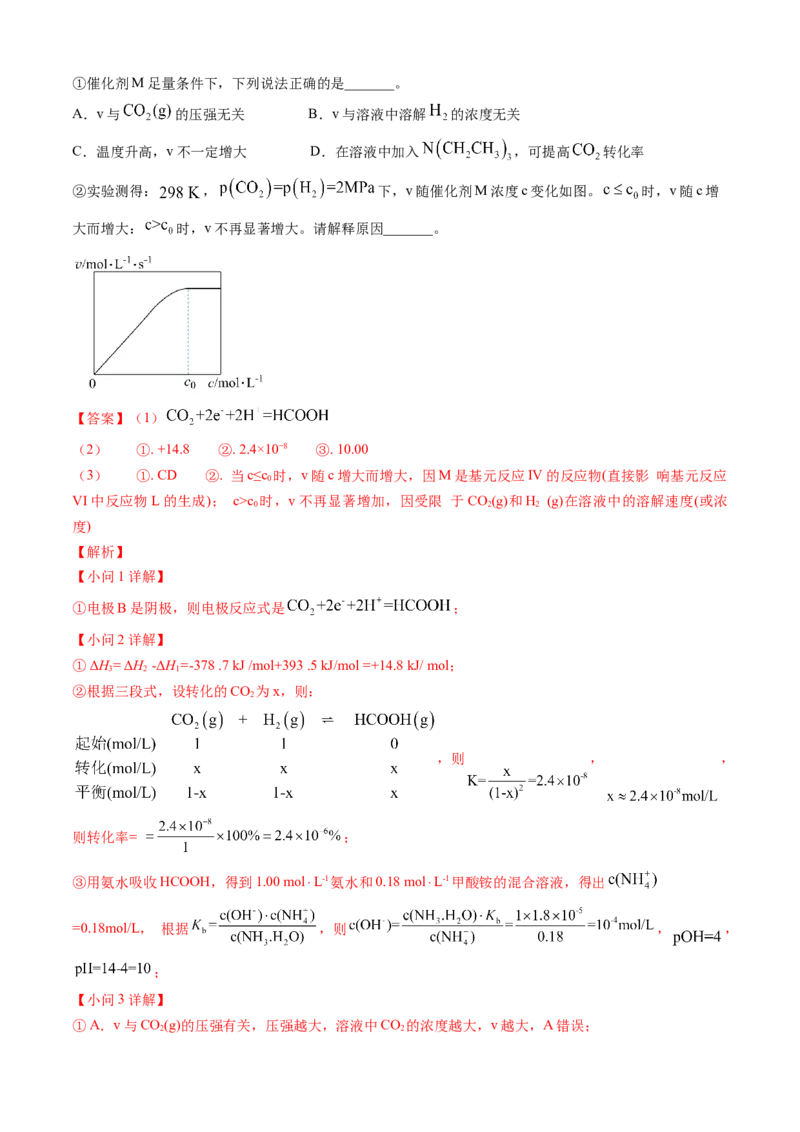
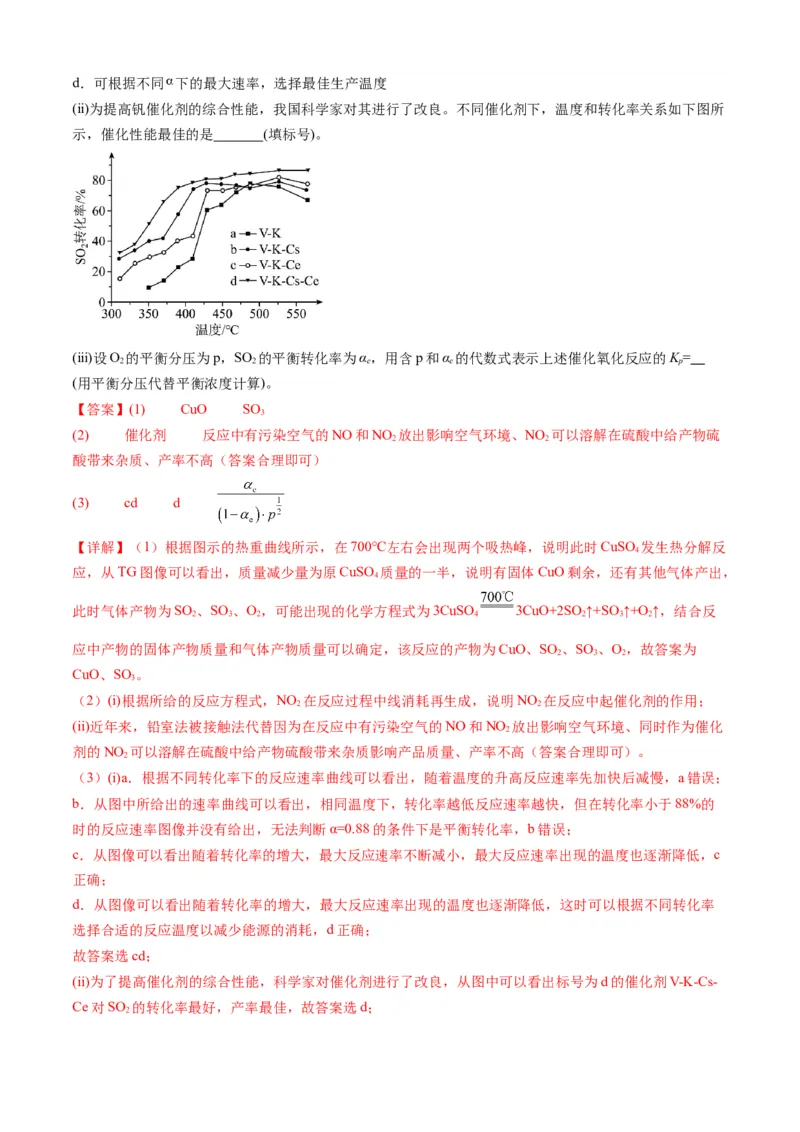
③某小组研究了3种酸对反应a的催化作用。在相同条件下,向反应体系中滴加等物质的量的少量酸,测
得体系的温度T随时间t的变化如图。据图可知,在该过程中_______。
A.催化剂酸性增强,可增大反应焓变
B.催化剂酸性增强,有利于提高反应速率
C.催化剂分子中含H越多,越有利于加速反应
D.反应速率并不始终随着反应物浓度下降而减小
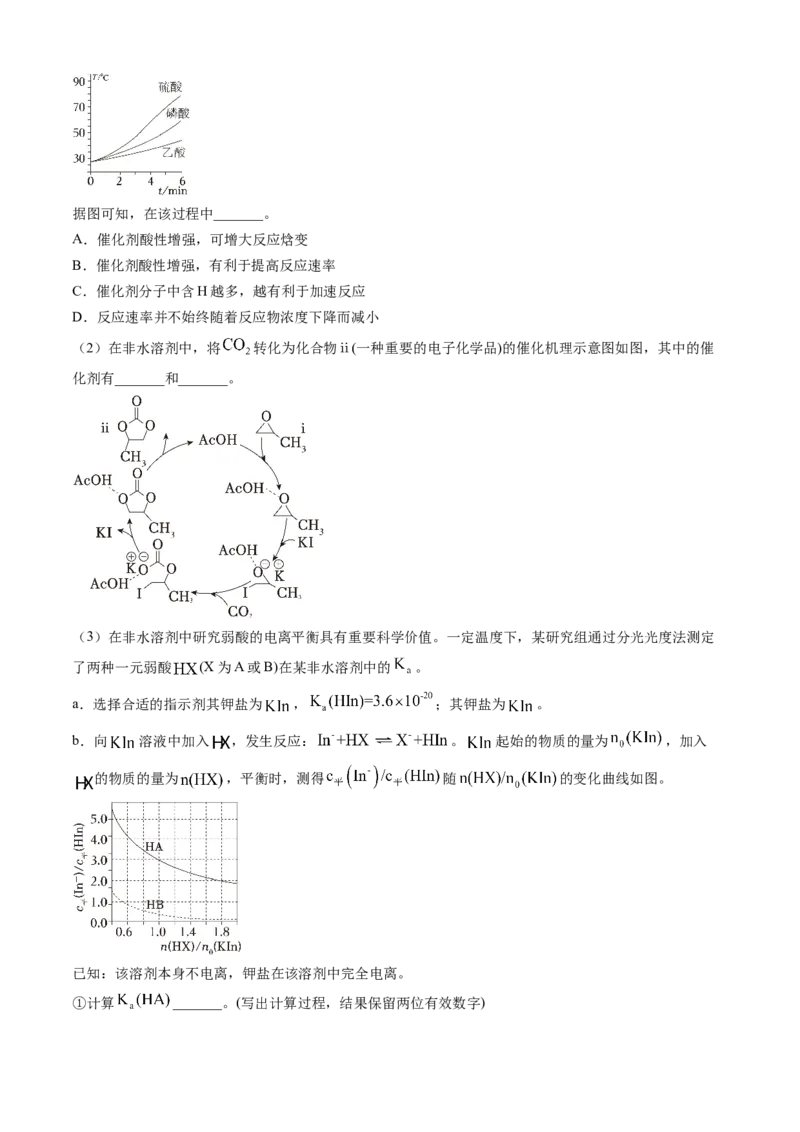
(2)在非水溶剂中,将 转化为化合物ⅱ(一种重要的电子化学品)的催化机理示意图如图,其中的催
化剂有_______和_______。
(3)在非水溶剂中研究弱酸的电离平衡具有重要科学价值。一定温度下,某研究组通过分光光度法测定
了两种一元弱酸 (X为A或B)在某非水溶剂中的 。
a.选择合适的指示剂其钾盐为 , ;其钾盐为 。
b.向 溶液中加入 ,发生反应: 。 起始的物质的量为 ,加入
的物质的量为 ,平衡时,测得 随 的变化曲线如图。
已知:该溶剂本身不电离,钾盐在该溶剂中完全电离。
①计算 _______。(写出计算过程,结果保留两位有效数字)②在该溶剂中, _______ ; _______ 。(填“>”“<”或“=”)
【答案】(1) ①. ②. ③. BD
(2) ①. AcOH ②. KI
(3) ①. ②. > ③. >
【解析】
【小问1详解】
①N的原子序数为7,位于第二周期第ⅤA族,基态N原子价层电子的轨道表示式为 ;
②由已知可得:
Ⅰ. , ;
Ⅱ. , ;
Ⅲ. , ;
Ⅳ. , ;
由盖斯定律可知,目标方程式 可由方程式Ⅰ-Ⅱ-Ⅲ+Ⅳ得到,故反
应 ;
③A.催化剂不能改变反应的焓变,A项错误;
B.由图示可知,酸性:硫酸>磷酸>乙酸,催化剂酸性增强,反应速率提高,B项正确;
C.一个硫酸分子中含有2个H,一个磷酸分子中含有3个H,一个乙酸分子中含有4个H,但含H最少的
硫酸催化时,最有利于加速反应,C项错误;
D.由图示可知,反应开始一段时间,反应物浓度减小,但反应速率加快,反应速率并不始终随着反应物
浓度下降而减小,D项正确;
故选BD。
【小问2详解】
催化剂参与化学反应,但反应前后质量和化学性质并未改变,由催化机理示意图可知,催化剂有AcOH和
KI;
【小问3详解】
由变化曲线图可知,当 时, ,设初始 ,则初始
,转化的物质的量浓度为 ,可列出三段式如下:由 ,即 ,解得 ,则该反应的平衡常数为
解得 ;
②根据图像可知,当 时,设此时转化的物质的量浓度为 ,可列出三段式如下:
此时 ,即 ,则 ,则平衡常数 ,则
;
由于 ,则 , 。
2.(2024·北京卷) 是一种重要的工业原料。可采用不同的氮源制备 。
(1)方法一:早期以硝石(含 )为氮源制备 ,反应的化学方程式为:
。该反应利用了浓硫酸的性质是酸性和_________。
(2)方法二:以 为氮源催化氧化制备 ,反应原理分三步进行。
①第I步反应的化学方程式为___________________________。
②针对第Ⅱ步反应进行研究:在容积可变的密闭容器中,充入 和 进行反应。在不同
压强下( 、 ),反应达到平衡时,测得 转化率随温度的变化如图所示。解释y点的容器容积小
于x点的容器容积的原因_________________________________________________________。(3)方法三:研究表明可以用电解法以 为氨源直接制备 ,其原理示意图如下。
①电极a表面生成 的电极反应式:__________________。
②研究发现: 转化可能的途径为 。电极a表面还发生iii. 。iii的
存在,有利于途径ii,原因是________________________________________________。
(4)人工固氮是高能耗的过程,结合 分子结构解释原因___________________________。方法三为
的直接利用提供了一种新的思路。
【答案】(1)难挥发性
(2)①
② ,该反应正向气体分子总数减小,同温时, 条件下 转化率高于 ,故
,x、y点转化率相同,此时压强对容积的影响大于温度对容积的影响
(3)①
②反应iii生成 , 将 氧化成 , 更易转化成
(4) 中存在氨氮三键,键能高,断键时需要较大的能量,故人工固氮是高能耗的过程
【解析】(1)(浓)难挥发,产物 为气体,有利于复分解反应进行,体现了 (浓)的难挥
发性和酸性。(2)①第I步反应为氨气的催化氧化,化学方程式为 。
(3)①由电极a上的物质转化可知,电极a为阳极,电极反应式为 。
3. (2024·甘肃卷) 是制备半导体材料硅的重要原料,可由不同途径制备。
(1)由 制备 :
已知
时,由 制备 硅_______(填“吸”或“放”)热_______ 。升高温度有利于制备硅的原因是_______。
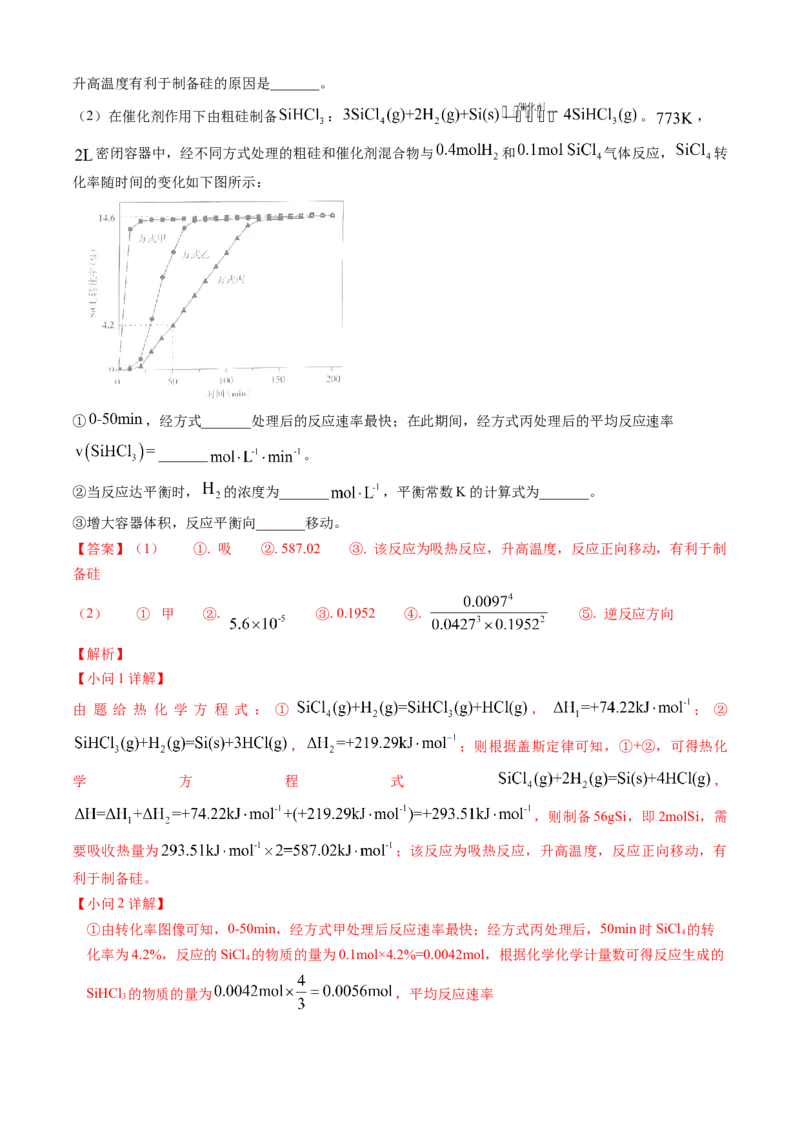
(2)在催化剂作用下由粗硅制备 : 。 ,
密闭容器中,经不同方式处理的粗硅和催化剂混合物与 和 气体反应, 转
化率随时间的变化如下图所示:
① ,经方式_______处理后的反应速率最快;在此期间,经方式丙处理后的平均反应速率
_______ 。
②当反应达平衡时, 的浓度为_______ ,平衡常数K的计算式为_______。
③增大容器体积,反应平衡向_______移动。
【答案】(1) ①. 吸 ②. 587.02 ③. 该反应为吸热反应,升高温度,反应正向移动,有利于制
备硅
(2) ①. 甲 ②. ③. 0.1952 ④. ⑤. 逆反应方向
【解析】
【小问1详解】
由 题 给 热 化 学 方 程 式 : ① , ; ②
, ;则根据盖斯定律可知,①+②,可得热化
学 方 程 式 ,
,则制备56gSi,即2molSi,需
要吸收热量为 ;该反应为吸热反应,升高温度,反应正向移动,有
利于制备硅。
【小问2详解】
①由转化率图像可知,0-50min,经方式甲处理后反应速率最快;经方式丙处理后,50min时SiCl 的转
4
化率为4.2%,反应的SiCl 的物质的量为0.1mol×4.2%=0.0042mol,根据化学化学计量数可得反应生成的
4
SiHCl 的物质的量为 ,平均反应速率
3;
②反应达到平衡时,SiCl 的转化率为14.6%,列出三段式为:
4
当反应达平衡时,H 的浓度为 ,平衡常数K的计算式为 ;
2
③增大容器体积,压强减小,平衡向气体体积增大的方向移动,即反应平衡向逆反应方向移动。
4. (2024·湖南卷)丙烯腈( )是一种重要的化工原料。工业上以 为载气,用 作催化剂
生产 的流程如下:
已知:①进料混合气进入两釜的流量恒定,两釜中反应温度恒定:
②反应釜Ⅰ中发生的反应:
ⅰ:
③反应釜Ⅱ中发生的反应:
ⅱ:
ⅲ:
④在此生产条件下,酯类物质可能发生水解。
回答下列问题:
(1)总反应
_______(用含 、 、和 的代数式表示);
(2)进料混合气中 ,出料中四种物质(
、 、 、 )的流量,(单位时间内出料口流出的物质的
量)随时间变化关系如图:①表示 的曲线是_______(填“a”“b”或“c”);
②反应釜Ⅰ中加入 的作用是_______。
③出料中没有检测到 的原因是_______。
④反应 后,a、b、c曲线对应物质的流量逐渐降低的原因是_______。
(3)催化剂 再生时会释放 ,可用氨水吸收获得 。现将一定量的 固体(含
水)置于密闭真空容器中,充入 和 ,其中 的分压为 ,在 ℃下进行干燥。为
保证 不分解, 的分压应不低于_______ (已知
分解的平衡常数 );
(4)以 为原料,稀硫酸为电解液,Sn作阴极,用电解的方法可制得 ,
其阴极反应式_______。
【答案】(1)ΔH+ΔH +ΔH
1 2 3
(2) ①. c ②. 降低分压有利于反应i平衡正向移动且提高醇的浓度可以使酯的水解程度降低从而
提高产率 ③. CH =CHCONH 在反应釜Ⅱ的温度下发生分解 ④. 反应时间过长,催化剂中毒活性降
2 2
低,反应速率降低,故产物减少 (3)40
(4)Sn+4CH=CHCN+4e-+4H+=Sn(CHCHCN)
2 2 2 4
【解析】
【分析】工业上以N 为载气,用TiO 作催化剂,由HOCH CHCOOC H 和C HOH为进料气体生产
2 2 2 2 2 5 2 5
CH=CHCN,在反应釜I中发生反应i:HOCH CHCOOC H(g)→CH =CHCOOC H(g)+HO(g),加入NH
2 2 2 2 5 2 2 5 2 3
后,在反应釜Ⅱ中发生反应ii:CH=CHCOOC H(g)+NH (g)→CH =CHCONH (g)+C HOH(g),反应iii:
2 2 5 3 2 2 2 5
CH=CHCONH (g)→CH =CHCN(g)+H O(g),故产物的混合气体中有CH=CHCN、未反应完的C HOH、
2 2 2 2 2 2 5
CH=CHCOOC H(g)和水;
2 2 5
【小问1详解】
根据盖斯定律,总反应HOCH CHCOOC H(g)+NH (g)→CH =CHCN(g)+C HOH(g)+2H O(g)可以由反应
2 2 2 5 3 2 2 5 2
i+反应ii+反应iii得到,故ΔH=ΔH+ΔH +ΔH ;
1 2 3
【小问2详解】
①根据总反应HOCH CHCOOC H(g)+NH (g)→CH =CHCN(g)+C HOH(g)+2H O(g),设进料混合气中
2 2 2 5 3 2 2 5 2
n(HOCHCHCOOC H)=1mol,n(C HOH)=2mol,出料气中CH=CHCOOC H 含量很少,则生成
2 2 2 5 2 5 2 2 5CH=CHCN(g)、C HOH(g)物质的量约为1mol,生成HO(g)的物质的量约为2mol,故出料气中C HOH(g)
2 2 5 2 2 5
物质的量共约3mol,故出料气中CH=CHCN、C HOH、HO物质的量之比约为1:3:2,故曲线c表示
2 2 5 2
CH=CHCN的曲线;
2
②反应釜Ⅰ中发生反应i是气体体积增大的反应,故加入C HOH降低分压有利于反应i平衡正向移动且提
2 5
高醇的浓度可以使酯的水解程度降低从而提高产率;
③丙烯酰胺(CH=CHCONH )的分解温度约为160°C至170°C,出料中没有检测到CH=CHCONH 的原因是
2 2 2 2
CH=CHCONH 在反应釜Ⅱ的温度下发生分解;
2 2
④反应11h后,a、b、c曲线对应物质的流量逐渐降低的原因是反应时间过长,催化剂中毒活性降低,反
应速率降低,故产物减少;
【小问3详解】
0.72g水的物质的量为0.04mol,故p(H
2
O)=2.5×102kPa⋅mol−1×n(H
2
O)=10kPa,NH
4
HCO
3
分解的反应式为
NH HCO =NH↑+CO ↑+H O↑,故NH HCO 分解的平衡常数K=p(NH)p(CO )p(H O)=4×104(kPa)3,解得
4 3 3 2 2 4 3 p 3 2 2
p(NH )=40kPa,故为保证NH HCO 不分解,NH 的分压应不低于40kPa;
3 4 3 3
【小问4详解】
Sn(CH CHCN) 是有机化合物,与水不溶,水中不电离,以CH=CHCN为原料在Sn做的阴极得电子制得
2 2 4 2
Sn(CH CHCN) ,故阴极的电极反应式为Sn+4CH=CHCN+4e-+4H+=Sn(CHCHCN) 。
2 2 4 2 2 2 4
5. (2024·浙江卷6月)氢是清洁能源,硼氢化钠( )是一种环境友好的固体储氢材料,其水解生氢反
应方程式如下:(除非特别说明,本题中反应条件均为 , )
请回答:
(1)该反应能自发进行的条件是_______。
A. 高温 B. 低温 C. 任意温度 D. 无法判断
(2)该反应比较缓慢。忽略体积变化的影响,下列措施中可加快反应速率的是_______。
A. 升高溶液温度 B. 加入少量异丙胺
C. 加入少量固体硼酸 D. 增大体系压强
(3)为加速 水解,某研究小组开发了一种水溶性催化剂,当该催化剂足量、浓度一定且活性不变
时,测得反应开始时生氢速率v与投料比 之间的关系,结果如图1所示。请解释
ab段变化的原因_______。(4)氢能的高效利用途径之一是在燃料电池中产生电能。某研究小组的自制熔融碳酸盐燃料电池工作原
理如图2所示,正极上的电极反应式是_______。该电池以 恒定电流工作14分钟,消耗 体积为
,故可测得该电池将化学能转化为电能的转化率为_______。[已知:该条件下 的摩尔体积为
;电荷量 电流 时间 ; ; 。]
(5)资源的再利用和再循环有利于人类的可持续发展。选用如下方程式,可以设计能自发进行的多种制
备方法,将反应副产物偏硼酸钠( )再生为 。(已知: 是反应的自由能变化量,其计算方
法也遵循盖斯定律,可类比 计算方法;当 时,反应能自发进行。)
I.
II.
III.
请书写一个方程式表示 再生为 的一种制备方法,并注明 _______。(要求:反应物不超
过三种物质;氢原子利用率为 。)
【答案】(1)C (2)A
(3)随着投料比 增大,NaBH 的水解转化率降低
4
(4) ①. O+4e-+2CO =2 ②. 70%
2 2
(5)
【解析】【小问1详解】
反应 , ,由 可知,任意温度下,
该反应均能自发进行,故答案选C;
【小问2详解】
A.升高温度,活化分子数增多,有效碰撞几率增大,反应速率加快,A符合题意;
B.加入少量异丙胺 ,HO的量减少,化学反应速率降低,B不符合题意;
2
C. 加入少量固体硼酸 ,HO的量减少,化学反应速率降低,C不符合题意;
2
D.增大体系压强,忽略体积变化,则气体浓度不变,化学反应速率不变,D不符合题意;
答案选A。
【小问3详解】
随着投料比 增大,NaBH 的水解转化率降低,因此生成氢气的速率不断减小。
4
【小问4详解】
根据题干信息,该燃料电池中H 为负极,O 为正极,熔融碳酸盐为电解质溶液,故正极的电极反应式为:
2 2
O+4e-+2CO =2 , 该条件下,0.49L H 的物质的量为 ,工作时,H 失
2 2 2 2
去电子:H-2e-=2H+,所带电荷量为:2×0.02mol×6.0×1023mol-1×1.60×10-19= 3840C,工作电荷量为:
2
3.2×14×60=2688C,则该电池将化学能转化为电能的转化率为: ;
【小问5详解】
结合题干信息,要使得氢原子利用率为100%,可由(2×反应3)-(2×反应Ⅱ+反应Ⅰ)得
,
。
6. (2024·江苏卷)氢能是理想清洁能源,氢能产业链由制氢、储氢和用氢组成。
(1)利用铁及其氧化物循环制氢,原理如图所示。反应器Ⅰ中化合价发生改变的元素有_______;含CO
和 各1mol的混合气体通过该方法制氢,理论上可获得_______ 。
(2)一定条件下,将氮气和氢气按 混合匀速通入合成塔,发生反应
。海绵状的 作催化剂,多孔 作为 的“骨架”和气体吸
附剂。① 中含有CO会使催化剂中毒。 和氨水的混合溶液能吸收CO生成
溶液,该反应的化学方程式为_______。
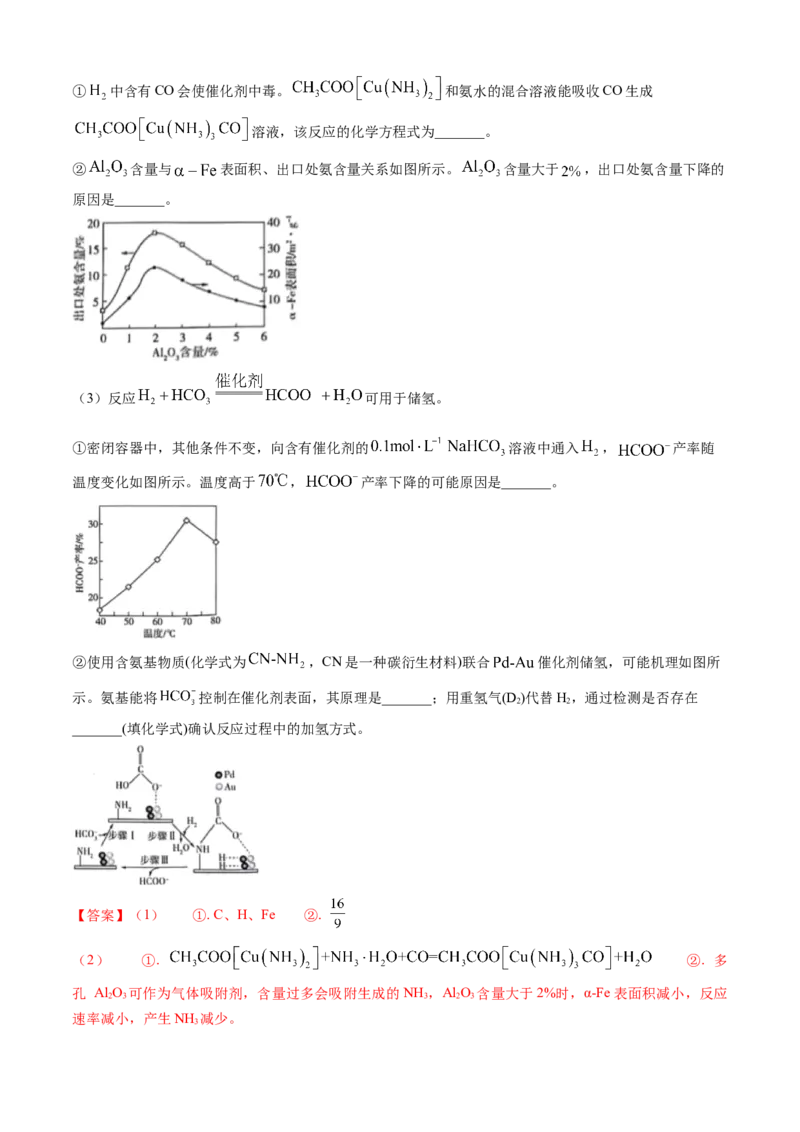
② 含量与 表面积、出口处氨含量关系如图所示。 含量大于 ,出口处氨含量下降的
原因是_______。
(3)反应 可用于储氢。
①密闭容器中,其他条件不变,向含有催化剂的 溶液中通入 , 产率随
温度变化如图所示。温度高于 , 产率下降的可能原因是_______。
②使用含氨基物质(化学式为 ,CN是一种碳衍生材料)联合 催化剂储氢,可能机理如图所
示。氨基能将 控制在催化剂表面,其原理是_______;用重氢气(D )代替H,通过检测是否存在
2 2
_______(填化学式)确认反应过程中的加氢方式。
【答案】(1) ①. C、H、Fe ②.
(2) ①. ②. 多
孔 Al O 可作为气体吸附剂,含量过多会吸附生成的NH ,Al O 含量大于2%时,α-Fe表面积减小,反应
2 3 3 2 3
速率减小,产生NH 减少。
3(3) ①. NaHCO 受热分解,导致HCOO-产率下降 ②. -NH 可以与 形成氢键 ③. HDO
3 2
【解析】
【小问1详解】
①反应器I中参与反应的物质有CO、H、Fe O,产物有 CO、HO、Fe,发生反应
2 2 3 2 2
、 化合价发生改变的元素有 C、H、Fe。
②CO、H 各1 mol参与上述反应,各生成 mol Fe,共生成 molFe, molFe在反应器Ⅱ中发生反应
2
,列比例计算 ,共生成 mol
H₂。
【小问2详解】
①根据题给反应物及生成物书写即可。②多孔 Al O 可作为气体吸附剂,含量过多会吸附生成的NH ,
2 3 3
Al O 含量大于2%时,α-Fe表面积减小,反应速率减小,这也会导致产生的NH 减少。
2 3 3
【小问3详解】
①NaHCO 受热易分解,导致HCOO-产率下降。②氨基中的H原子连在电负性较大的N原子上,
3
中的H原子连在电负性较大的O原子上,二者之间可以形成氢键 ③总反应为
,用D 代替H,若生成 HDO,则可确认反应过程中的加氢方式。
2 2
7. (2024·河北卷)氯气是一种重要的基础化工原料,广泛应用于含氯化工产品的生产。硫酰氯及1,4-二
(氯甲基)苯等可通过氯化反应制备。
(1)硫酰氯常用作氯化剂和氯磺化剂,工业上制备原理如下:
。
①若正反应 的活化能为 ,则逆反应的活化能 _______ (用含 正的代数式表
示)。
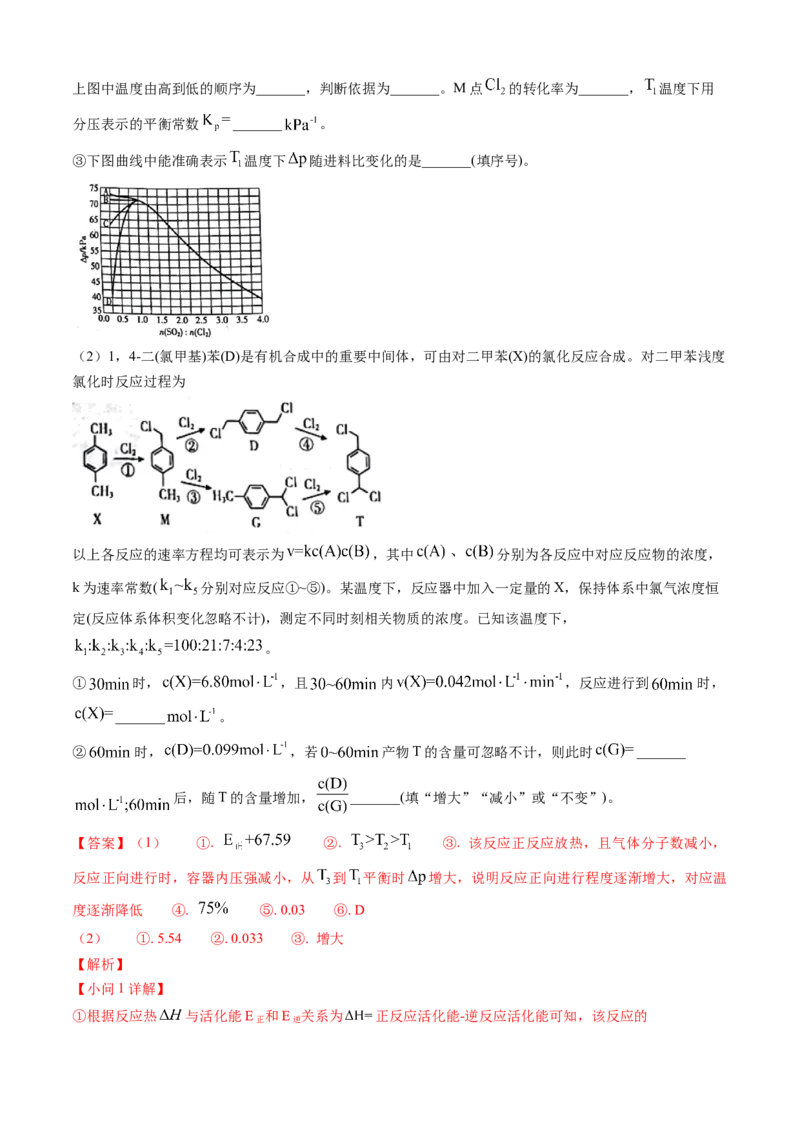
②恒容密闭容器中按不同进料比充入 和其 ,测定 温度下体系达平衡时的 (
为体系初始压强, ,P为体系平衡压强),结果如图。上图中温度由高到低的顺序为_______,判断依据为_______。M点 的转化率为_______, 温度下用
分压表示的平衡常数 _______ 。
③下图曲线中能准确表示 温度下 随进料比变化的是_______(填序号)。
(2)1,4-二(氯甲基)苯(D)是有机合成中的重要中间体,可由对二甲苯(X)的氯化反应合成。对二甲苯浅度
氯化时反应过程为
以上各反应的速率方程均可表示为 ,其中 分别为各反应中对应反应物的浓度,
k为速率常数( 分别对应反应①~⑤)。某温度下,反应器中加入一定量的X,保持体系中氯气浓度恒
定(反应体系体积变化忽略不计),测定不同时刻相关物质的浓度。已知该温度下,
。
① 时, ,且 内 ,反应进行到 时,
_______ 。
② 时, ,若 产物T的含量可忽略不计,则此时 _______
后,随T的含量增加, _______(填“增大”“减小”或“不变”)。
【答案】(1) ①. ②. ③. 该反应正反应放热,且气体分子数减小,
反应正向进行时,容器内压强减小,从 到 平衡时 增大,说明反应正向进行程度逐渐增大,对应温
度逐渐降低 ④. ⑤. 0.03 ⑥. D
(2) ①. 5.54 ②. 0.033 ③. 增大
【解析】
【小问1详解】
①根据反应热 与活化能E 和E 关系为 正反应活化能-逆反应活化能可知,该反应的
正 逆。
②该反应的正反应为气体体积减小的反应,因此反应正向进行程度越大,平衡时容器内压强越小, 即
越大。从 到 , 增大,说明反应正向进行程度逐渐增大,已知正反应为放热反应,则温度由 到
逐渐降低,即 。由题图甲中M点可知,进料比为 ,平衡时 ,已
知恒温恒容情况下,容器内气体物质的量之比等于压强之比,可据此列出“三段式”。
可计算得 , 。
③由题图甲中M点可知,进料比为2时, ,结合“三段式”,以及 时化学平衡常数可知,
进料比为0.5时, 也为 ,曲线D上存在(0.5,60)。本题也可以快解:根据“等效平衡”原理,
该反应中 和 的化学计量数之比为 ,则 和 的进料比互为倒数(如2与0.5)时, 相等。
【小问2详解】
①根据化学反应速率的计算公式时, , 时,
。
②已知 ,又由题给反应速率方程推知, ,则
,即 后 。 后,D和G转化为T的速
率比为 ,G消耗得更快,则 增大。
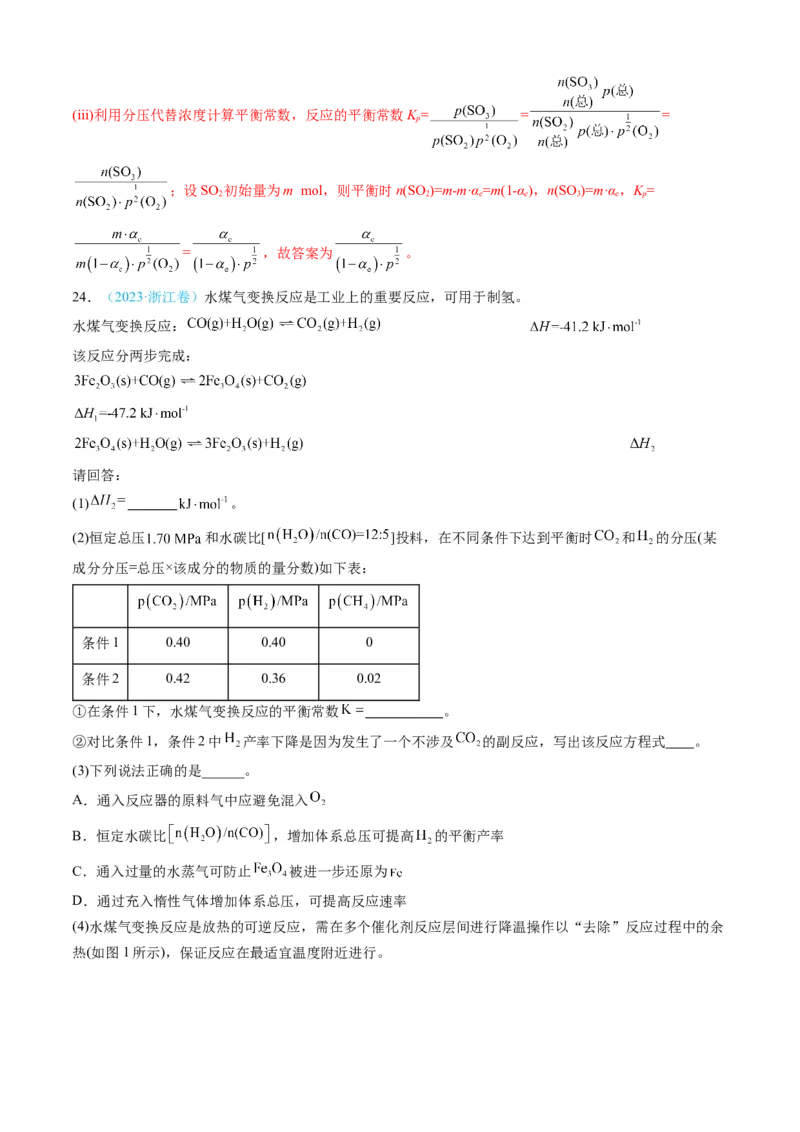
8. (2024·山东卷)水煤气是 的主要来源,研究 对 体系制 的影响,涉及主要反应如下:
回答列问题:
(1) 的焓变 _______(用代数式表示)。(2)压力p下, 体系达平衡后,图示温度范围内 已完全反应, 在 温度时
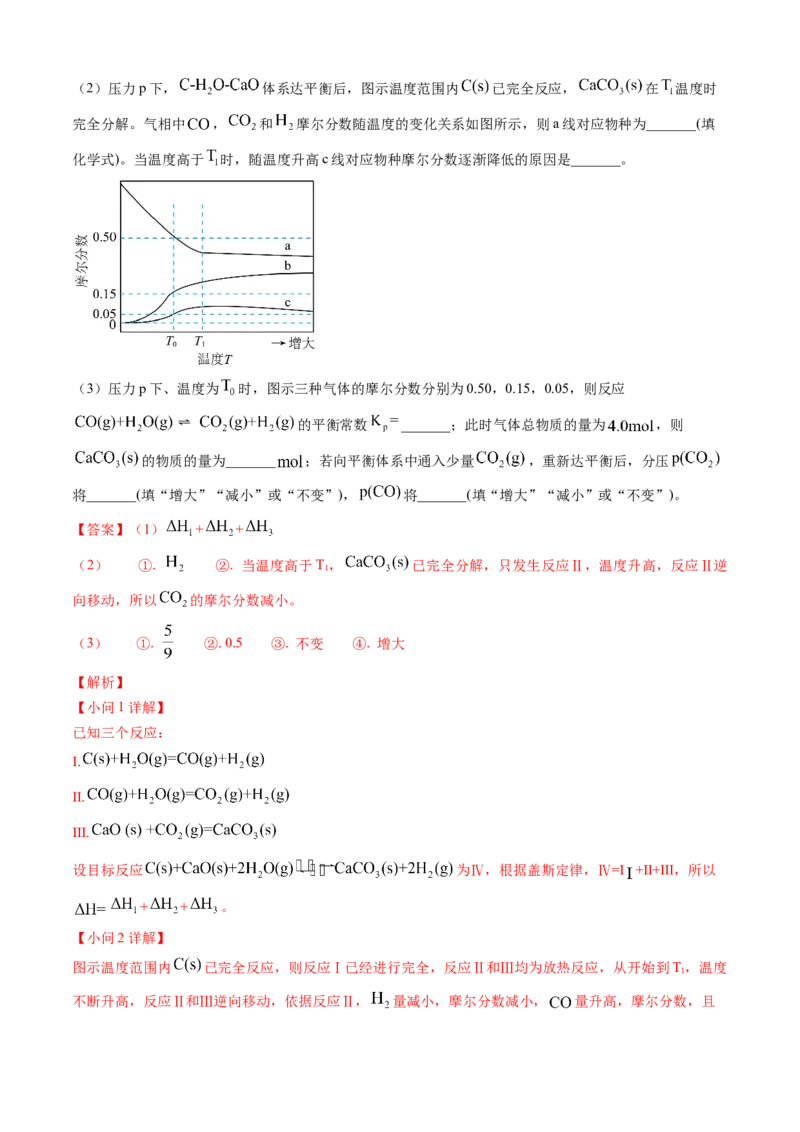
完全分解。气相中 , 和 摩尔分数随温度的变化关系如图所示,则a线对应物种为_______(填
化学式)。当温度高于 时,随温度升高c线对应物种摩尔分数逐渐降低的原因是_______。
(3)压力p下、温度为 时,图示三种气体的摩尔分数分别为0.50,0.15,0.05,则反应
的平衡常数 _______;此时气体总物质的量为 ,则
的物质的量为_______ ;若向平衡体系中通入少量 ,重新达平衡后,分压
将_______(填“增大”“减小”或“不变”), 将_______(填“增大”“减小”或“不变”)。
【答案】(1) + +
(2) ①. ②. 当温度高于T , 已完全分解,只发生反应Ⅱ,温度升高,反应Ⅱ逆
1
向移动,所以 的摩尔分数减小。
(3) ①. ②. 0.5 ③. 不变 ④. 增大
【解析】
【小问1详解】
已知三个反应:
Ⅰ.
Ⅱ.
Ⅲ.
设目标反应 为Ⅳ,根据盖斯定律,Ⅳ=Ⅰ +Ⅱ+Ⅲ,所以
+ + 。
【小问2详解】
图示温度范围内 已完全反应,则反应Ⅰ已经进行完全,反应Ⅱ和Ⅲ均为放热反应,从开始到T,温度
1
不断升高,反应Ⅱ和Ⅲ逆向移动,依据反应Ⅱ, 量减小,摩尔分数减小, 量升高,摩尔分数,且二者摩尔分数变化斜率相同,所以a曲线代表 的摩尔分数的变化,则c曲线代表 的摩尔分数随温
度的变化,开始到T, 的摩尔分数升高,说明在这段温度范围内,反应Ⅲ占主导,当温度高于T,
1 1
已完全分解,只发生反应Ⅱ,所以 的摩尔分数减小。
【小问3详解】
①压力p下、温度为 时, 、 、 和摩尔分数分别为0.50、0.15、0.05,则HO(g)的摩尔分数
2
为: ,则反应 的平衡常数
;
②设起始状态1molC(s),xmolH O(g),反应Ⅰ 进行完全。
2
则依据三段式:
根据平衡时 、 、 和摩尔分数分别为0.50、0.15、0.05,则有 、 、
,解出 , , 则 ,而由于平衡时
n(总)=4mol,则 y=4,y= ,则n(CaCO3)= = =0.5。
③若向平衡体系中通入少量 ,重新达平衡后,反应 的Kp=
,温度不变,Kp不变,则分压 不变,但体系中增加了 ,反应Ⅱ逆向移动,所以 增
大。
9. (2024·新课标卷)Ni(CO) (四羰合镍,沸点43℃)可用于制备高纯镍,也是有机化合物羰基化反应的催化
4
剂。回答下列问题:
(1)Ni基态原子价电子的轨道表示式为_______。镍的晶胞结构类型与铜的相同,晶胞体积为 ,镍原
子半径为_______。
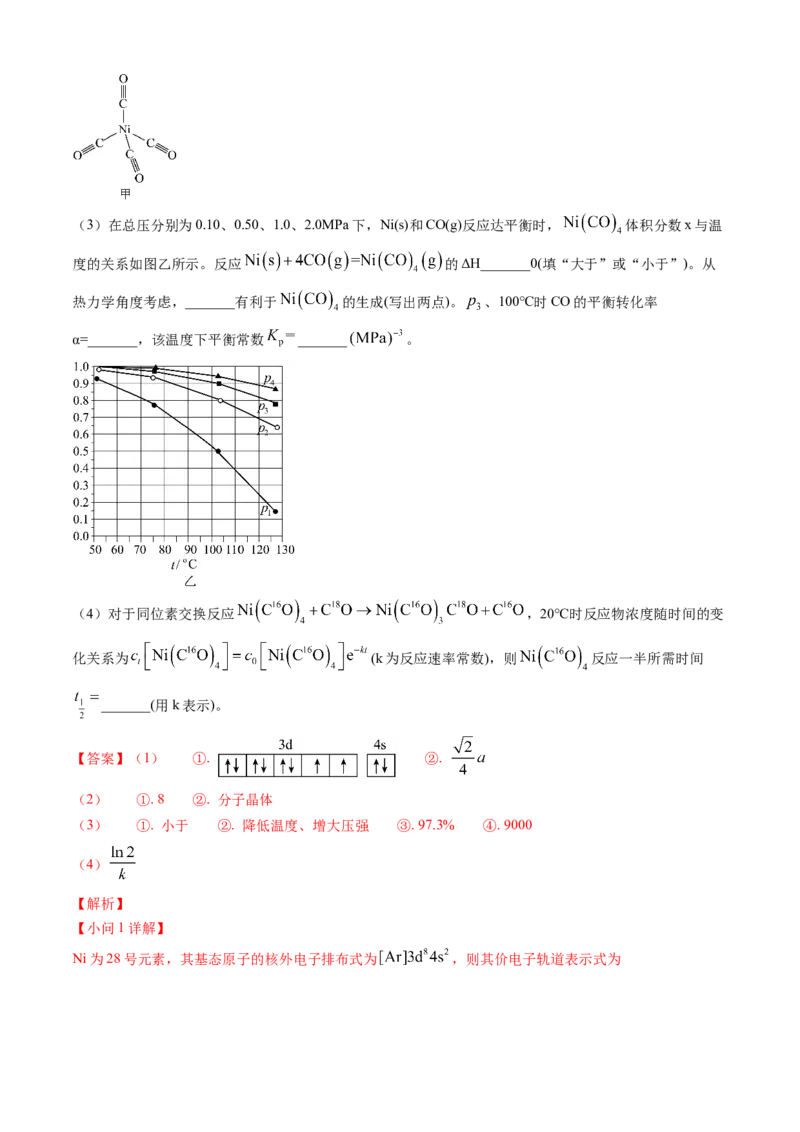
(2) 结构如图甲所示,其中含有σ键 的数目为_______, 晶体的类型为_______。(3)在总压分别为0.10、0.50、1.0、2.0MPa下,Ni(s)和CO(g)反应达平衡时, 体积分数x与温
度的关系如图乙所示。反应 的ΔH_______0(填“大于”或“小于”)。从
热力学角度考虑,_______有利于 的生成(写出两点)。 、100℃时CO的平衡转化率
α=_______,该温度下平衡常数 _______ 。
(4)对于同位素交换反应 ,20℃时反应物浓度随时间的变
化关系为 (k为反应速率常数),则 反应一半所需时间
_______(用k表示)。
【答案】(1) ①. ②.
(2) ①. 8 ②. 分子晶体
(3) ①. 小于 ②. 降低温度、增大压强 ③. 97.3% ④. 9000
(4)
【解析】
【小问1详解】
Ni为28号元素,其基态原子的核外电子排布式为 ,则其价电子轨道表示式为;铜晶胞示意图为 ,镍的晶胞结构类型与铜的相同,则镍原
子半径为晶胞面对角线长度的 ,因为晶胞体积为 ,所以晶胞棱长为a,面对角线长度为 ,则镍
原子半径为 。
【小问2详解】
单键均为σ键,双键含有1个σ键和1个π键,三键含有1个σ键2个π键,由 的结构可知,4
个配体CO与中心原子Ni形成的4个配位键均为σ键,而每个配体CO中含有1个σ键2个π键,因此1个
分子中含有8个σ键。 的沸点很低,结合其结构可知该物质由分子构成,因此其晶体
类型为分子晶体。
【小问3详解】
随着温度升高,平衡时 的体积分数减小,说明温度升高平衡逆移,因此该反应的 ;该反
应的正反应是气体总分子数减小的放热反应,因此降低温度和增大压强均有利于 的生成;由上
述分析知,温度相同时,增大压强平衡正向移动,对应的平衡体系中 的体积分数增大,则压强:
,即 对应的压强是1.0MPa.由题图乙可知, 、100℃条件下达到平衡时,CO和
的物质的量分数分别为0.1、0.9,设初始投入的CO为4mol,反应生成的 为xmol,可
得三段式:
,反应后总物质的量为:(4-3x)mol,根据阿伏加德罗定律,其他条件相同时,气体的体积分数即为其物
质的量分数,因此有 ,解得 ,因此达到平衡时 ,CO的平衡转
化率 ;气体的分压=总压强×该气体的物质的量分数,则该温度下的压强
平衡常数 。
【小问4详解】由题给关系式可得 ,当 反应一半时 ,即 ,
, ,则 。
10. (2024·全国甲卷)甲烷转化为多碳化合物具有重要意义。一种将甲烷溴化再偶联为丙烯( )的研究
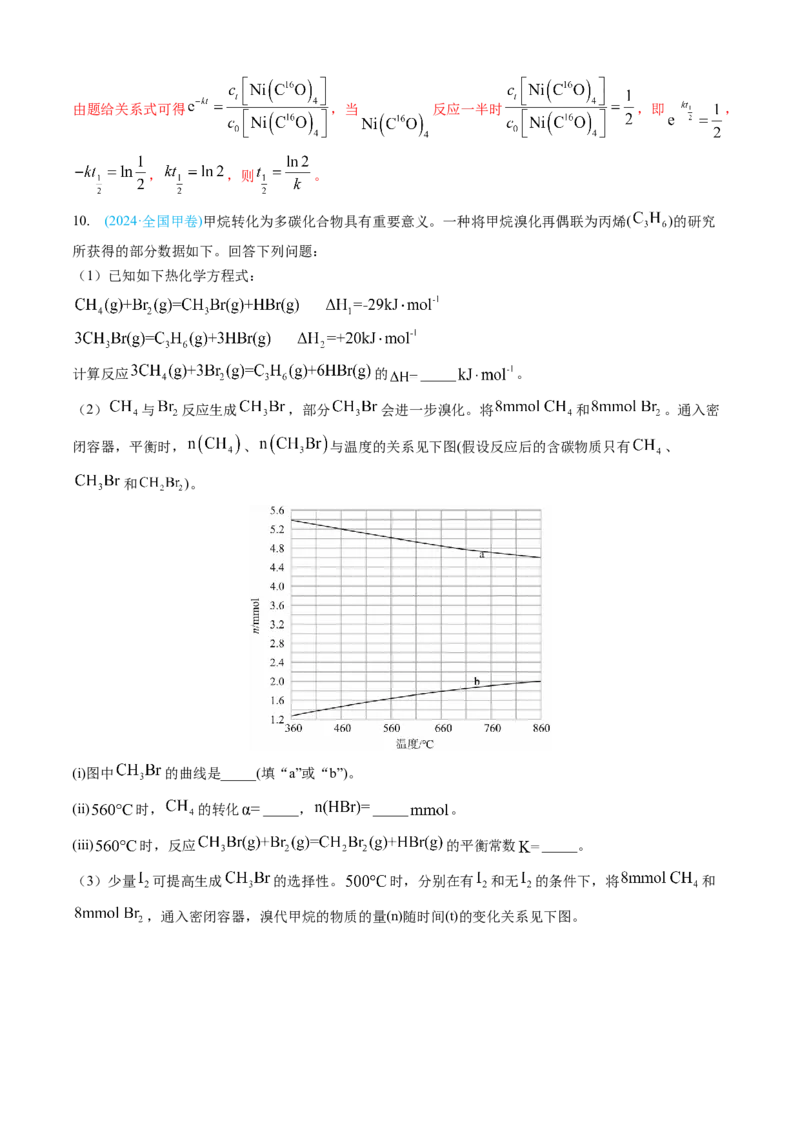
所获得的部分数据如下。回答下列问题:
(1)已知如下热化学方程式:
计算反应 的 _____ 。
(2) 与 反应生成 ,部分 会进一步溴化。将 和 。通入密
闭容器,平衡时, 、 与温度的关系见下图(假设反应后的含碳物质只有 、
和 )。
(i)图中 的曲线是_____(填“a”或“b”)。
(ii) 时, 的转化 _____, _____ 。
(iii) 时,反应 的平衡常数 _____。
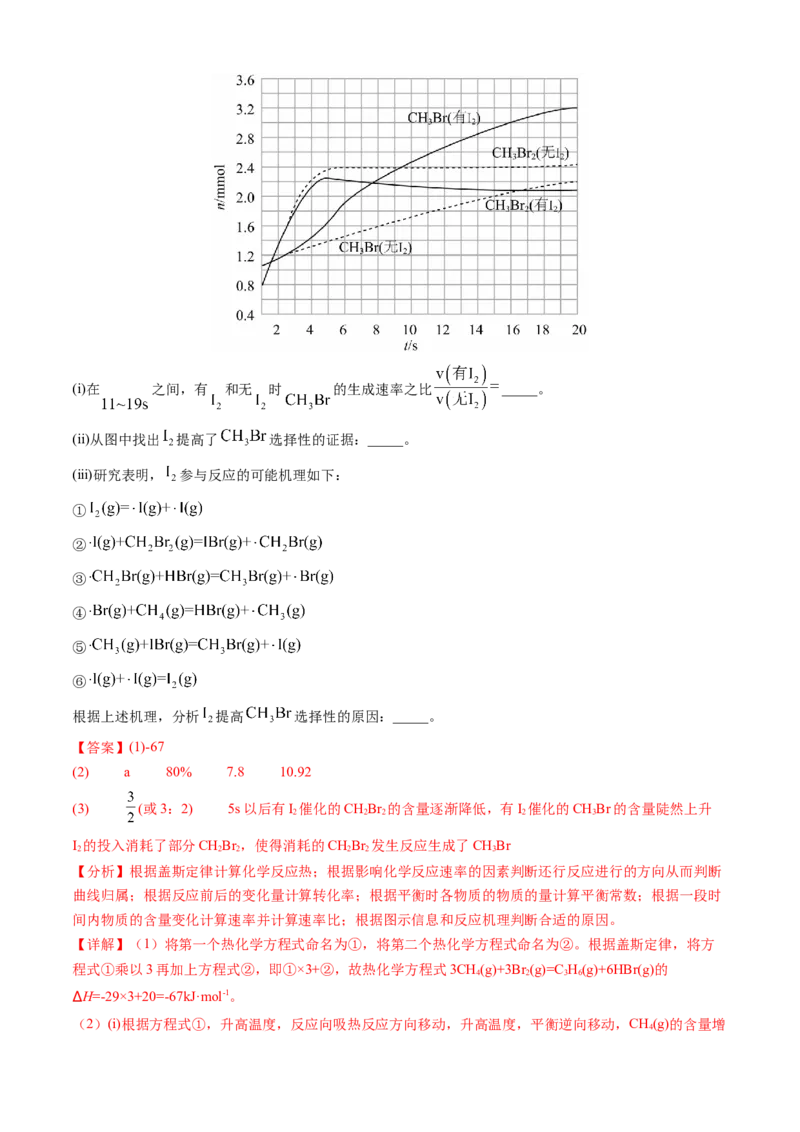
(3)少量 可提高生成 的选择性。 时,分别在有 和无 的条件下,将 和
,通入密闭容器,溴代甲烷的物质的量(n)随时间(t)的变化关系见下图。(i)在 之间,有 和无 时 的生成速率之比 _____。
(ii)从图中找出 提高了 选择性的证据:_____。
(ⅲ)研究表明, 参与反应的可能机理如下:
①
②
③
④
⑤
⑥
根据上述机理,分析 提高 选择性的原因:_____。
【答案】(1)-67
(2) a 80% 7.8 10.92
(3) (或3:2) 5s以后有I 催化的CHBr 的含量逐渐降低,有I 催化的CHBr的含量陡然上升
2 2 2 2 3
I 的投入消耗了部分CHBr ,使得消耗的CHBr 发生反应生成了CHBr
2 2 2 2 2 3
【分析】根据盖斯定律计算化学反应热;根据影响化学反应速率的因素判断还行反应进行的方向从而判断
曲线归属;根据反应前后的变化量计算转化率;根据平衡时各物质的物质的量计算平衡常数;根据一段时
间内物质的含量变化计算速率并计算速率比;根据图示信息和反应机理判断合适的原因。
【详解】(1)将第一个热化学方程式命名为①,将第二个热化学方程式命名为②。根据盖斯定律,将方
程式①乘以3再加上方程式②,即①×3+②,故热化学方程式3CH(g)+3Br (g)=C H(g)+6HBr(g)的
4 2 3 6
∆H=-29×3+20=-67kJ·mol-1。
(2)(i)根据方程式①,升高温度,反应向吸热反应方向移动,升高温度,平衡逆向移动,CH(g)的含量增
4多,CHBr(g)的含量减少,故CHBr的曲线为a;
3 3
(ii)560℃时反应达平衡,剩余的CH(g)的物质的量为1.6mmol,其转化率α=
4
×100%=80%;若只发生一步反应,则生成6.4mmol CH Br,但此时剩余CHBr的物质的量为5.0mmol,说
3 3
明还有1.4mmol CH Br发生反应生成CHBr ,则此时生成的HBr的物质的量n=6.4+1.4=7.8mmol;
3 2 2
(iii)平衡时,反应中各组分的物质的量分别为n(CHBr)=5.0mmol、n(Br)=0.2mmol、n(CHBr )=1.4mmol、
3 2 2 2
n(HBr)=7.8mmol,故该反应的平衡常数K= = =10.92。
(3)(i)11~19s时,有I 的生成速率v= = mmol·(L·s)-1,无I 的生成速率v= =
2 2
mmol·(L·s)-1。生成速率比 = = ;
(ii)从图中可以看出,大约4.5s以后有I 催化的CHBr 的含量逐渐降低,有I 催化的CHBr的含量陡然上
2 2 2 2 3
升,因此,可以利用此变化判断I 提高了CHBr的选择性;
2 3
(iii)根据反应机理,I 的投入消耗了部分CHBr ,同时也消耗了部分HBr,使得消耗的CHBr 发生反应生
2 2 2 2 2
成了CHBr,提高了CHBr的选择性。
3 3
11. (2024·湖北卷)用 和焦炭为原料,经反应I、Ⅱ得到 ,再制备乙炔是我国科研人员提出的
绿色环保新路线。
反应I:
反应Ⅱ:
回答下列问题:
(1)写出 与水反应的化学方程式_______。
(2)已知 、 (n是 的化学计量系数)。反应、Ⅱ的 与温度的关系曲线见
图1。①反应 在 的 _______ 。
②保持 不变,假定恒容容器中只发生反应I,达到平衡时 _______ ,若将容器体积压缩到
原来的 ,重新建立平衡后 _______ 。
(3)恒压容器中,焦炭与 的物质的量之比为 , 为载气。 和 下, 产率随
时间的关系曲线依实验数据拟合得到图2(不考虑接触面积的影响)。
①初始温度为 ,缓慢加热至 时,实验表明 已全部消耗,此时反应体系中含 物种为
_______。
② 下,反应速率的变化特点为_______,其原因是_______。
【答案】(1)BaC +2H O→Ba(OH) +HC≡CH↑
2 2 2
(2) ①. 1016 ②. 105 ③. 105
(3) ①. BaO ②. 速率不变至BaC 产率接近100% ③. 容器中只有反应Ⅱ:BaO(s)+3C(s)
2BaC (s)+CO(g),反应条件恒温1823K、恒压,且该反应只有CO为气态,据 可知,CO的压强
2
为定值,所以化学反应速率不变
【解析】
【小问1详解】
Ba、Ca元素同主族,所以BaC 与水的反应和CaC 与水的反应相似,其反应的化学方程式为
2 2
BaC +2H O→Ba(OH) +HC≡CH↑;
2 2 2
【小问2详解】
①反应I+反应Ⅱ得BaCO (s)+4C(s) BaC (s)+3CO(g),所以其平衡常数K=K×K = ,由图1可
3 2 I Ⅱ
知,1585K时K=102.5,K =10-1.5,即 =102.5×10-1.5=10,所以p3 =10×(105pa)3=1016p3,则K=
I Ⅱ CO a p
p3 =1016p3;
CO a
②由图1可知,1320K时反应I的K=100=1,即K= =1,所以p2 =(105pa)2,即p =105pa;
I I CO CO
③若将容器体积压缩到原来的 ,由于温度不变、平衡常数不变,重新建立平衡后p 应不变,即
CO
p =105pa;
CO
【小问3详解】
①由图2可知,1400K时,BaC 的产率为0,即没有BaC ,又实验表明BaBO 已全部消耗,所以此时反应
2 2 3
体系中含Ba物种为BaO;
②图像显示,1823K时BaC 的产率随时间由0开始呈直线增加到接近100%,说明该反应速率为一个定值,
2
即速率保持不变;1400K时碳酸钡已全部消耗,此时反应体系的含钡物种只有氧化钡,即只有反应Ⅱ:
BaO(s)+3C(s) BaC (s)+CO(g),反应条件恒温1823K、恒压,且该反应只有CO为气态,据
2
可知,CO的压强为定值,所以化学反应速率不变。
12. (2024·黑吉辽卷)为实现氯资源循环利用,工业上采用 催化氧化法处理 废气:
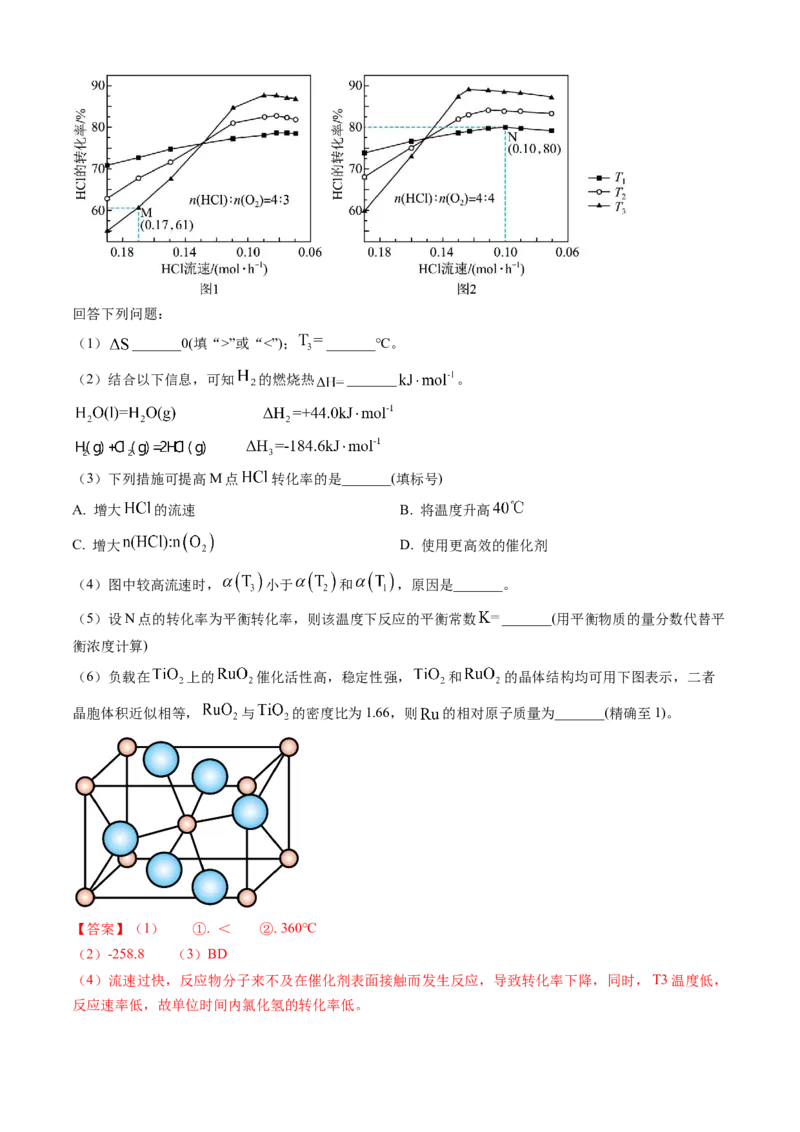
。将 和 分别以不同起
始流速通入反应器中,在 和 下反应,通过检测流出气成分绘制 转化率( )曲线,
如下图所示(较低流速下转化率可近似为平衡转化率)。回答下列问题:
(1) _______0(填“>”或“<”); _______℃。
(2)结合以下信息,可知 的燃烧热 _______ 。
(3)下列措施可提高M点 转化率的是_______(填标号)
A. 增大 的流速 B. 将温度升高
C. 增大 D. 使用更高效的催化剂
(4)图中较高流速时, 小于 和 ,原因是_______。
(5)设N点的转化率为平衡转化率,则该温度下反应的平衡常数 _______(用平衡物质的量分数代替平
衡浓度计算)
(6)负载在 上的 催化活性高,稳定性强, 和 的晶体结构均可用下图表示,二者
晶胞体积近似相等, 与 的密度比为1.66,则 的相对原子质量为_______(精确至1)。
【答案】(1) ①. < ②. 360℃
(2)-258.8 (3)BD
(4)流速过快,反应物分子来不及在催化剂表面接触而发生反应,导致转化率下降,同时,T3温度低,
反应速率低,故单位时间内氯化氢的转化率低。(5)6 (6)101
【解析】
【小问1详解】
反应 前后的气体分子数目在减小,所以该反应 <0,该反应为
放热反应,由于在流速较低时的转化率视为平衡转化率,所以在流速低的时候,温度越高,HCl的转化率
越小,故T 代表的温度为440℃,T 为360℃。
1 3
【小问2详解】
表 示 氢 气 燃 烧 热 热 化 学 方 程 式 为 ④ , 设 ①
的
, ② , ③ , 则
,因此氢气的燃烧热 -57.2kJ/mol-184.6kJ/mol-44kJ/mol=-258.8
【小问3详解】
A.增大HCl的流速,由图像可知,HCl的转化率在减小,不符合题意;
B.M对应温度为360℃,由图像可知,升高温度,HCl的转化率增大,符合题意;
C.增大n(HCl):n(O),HCl的转化率减小,不符合题意;
2
D.使用高效催化剂,可以增加该温度下的反应速率,使单位时间内HCl的转化率增加,符合题意;
故选BD。
【小问4详解】
图中在较高流速下,T 温度下的转化率低于温度较高的T 和T,主要是流速过快,反应物分子来不及在催
3 1 2
化剂表面接触而发生反应,导致转化率下降,同时,T 温度低,反应速率低,故单位时间内氯化氢的转化
3
率低。
【小问5详解】
由图像可知,N点HCl的平衡转化率为80%,设起始n(HCl)=n(O)=4mol,可列出三段式
2
则 。
【小问6详解】
由于二者的晶体结构相似,体积近似相等,则其密度之比等于摩尔质量之比。故 ,则Ru的相对原子质量为101。
13. (2024·浙江卷1月)通过电化学、热化学等方法,将 转化为 等化学品,是实现“双碳”
目标的途径之一。请回答:
(1)某研究小组采用电化学方法将 转化为 ,装置如图。电极B上的电极反应式是_______。
(2)该研究小组改用热化学方法,相关热化学方程式如下:
:
Ⅱ:
Ⅲ:
① _______ 。
②反应Ⅲ在恒温、恒容的密闭容器中进行, 和 的投料浓度均为 ,平衡常数
,则 的平衡转化率为_______。
③用氨水吸收 ,得到 氨水和 甲酸铵的混合溶液, 时该混合溶
液的 _______。[已知: 时,电离常数 、 ]
(3)为提高效率,该研究小组参考文献优化热化学方法,在如图密闭装置中充分搅拌催化剂M的
(有机溶剂)溶液, 和 在溶液中反应制备 ,反应过程中保持 和 的
压强不变,总反应 的反应速率为v,反应机理如下列三个基元反应,各反应的活
化能 (不考虑催化剂活性降低或丧失)。
Ⅳ:
V:
VI:①催化剂M足量条件下,下列说法正确的是_______。
A.v与 的压强无关 B.v与溶液中溶解 的浓度无关
C.温度升高,v不一定增大 D.在溶液中加入 ,可提高 转化率
②实验测得: , 下,v随催化剂M浓度c变化如图。 时,v随c增
大而增大: 时,v不再显著增大。请解释原因_______。
【答案】(1)
(2) ①. +14.8 ②. 2.4×10−8 ③. 10.00
(3) ①. CD ②. 当c≤c 时,v随c增大而增大,因M是基元反应IV的反应物(直接影 响基元反应
0
VI中反应物L的生成); c>c 时,v不再显著增加,因受限 于CO(g)和H (g)在溶液中的溶解速度(或浓
0 2 2
度)
【解析】
【小问1详解】
①电极B是阴极,则电极反应式是 ;
【小问2详解】
①ΔH= ΔH -ΔH=-378 .7 kJ /mol+393 .5 kJ/mol =+14.8 kJ/ mol;
3 2 1
②根据三段式,设转化的CO 为x,则:
2
,则 , ,
则转化率= ;
③用氨水吸收HCOOH,得到1.00 mol⋅L-1氨水和0.18 mol⋅L-1甲酸铵的混合溶液,得出
=0.18mol/L, 根据 ,则 , ,
;
【小问3详解】
①A.v与CO(g)的压强有关,压强越大,溶液中CO 的浓度越大,v越大,A错误;
2 2B.v与溶液中溶解H 的浓度有关,氢气浓度越大,速率越快,B错误;
2
C.温度升高,v不一定增大,反应Ⅳ和Ⅴ是快反应,而Ⅵ是慢反应(决速步骤),若Ⅳ和Ⅴ是放热反应且
可以快速建立平衡状态,则随着温度升高L的浓度减小,若L的浓度减小对反应速率的影响大于温度升高
对总反应速率的影响,则总反应速率减小 ,故总反应的速率不一定增大,C错误;
D.在溶液中加入的N(CH CH) 会与HCOOH反应,使得三个平衡正向移动,可提高CO 转化率,D正确;
2 3 3 2
故选CD。
②当c≤c 时,v随c增大而增大,因M是基元反应IV的反应物(直接影 响基元反应VI中反应物L的生成);
0
c>c 时,v不再显著增加,因受限 于CO(g)和H (g)在溶液中的溶解速度(或浓度)。
0 2 2
14. (2024·安徽卷)乙烯是一种用途广泛的有机化工原料。由乙烷制乙烯的研究备受关注。回答下列问题:
【乙烷制乙烯】
(1) 氧化脱氢反应:
计算: _______
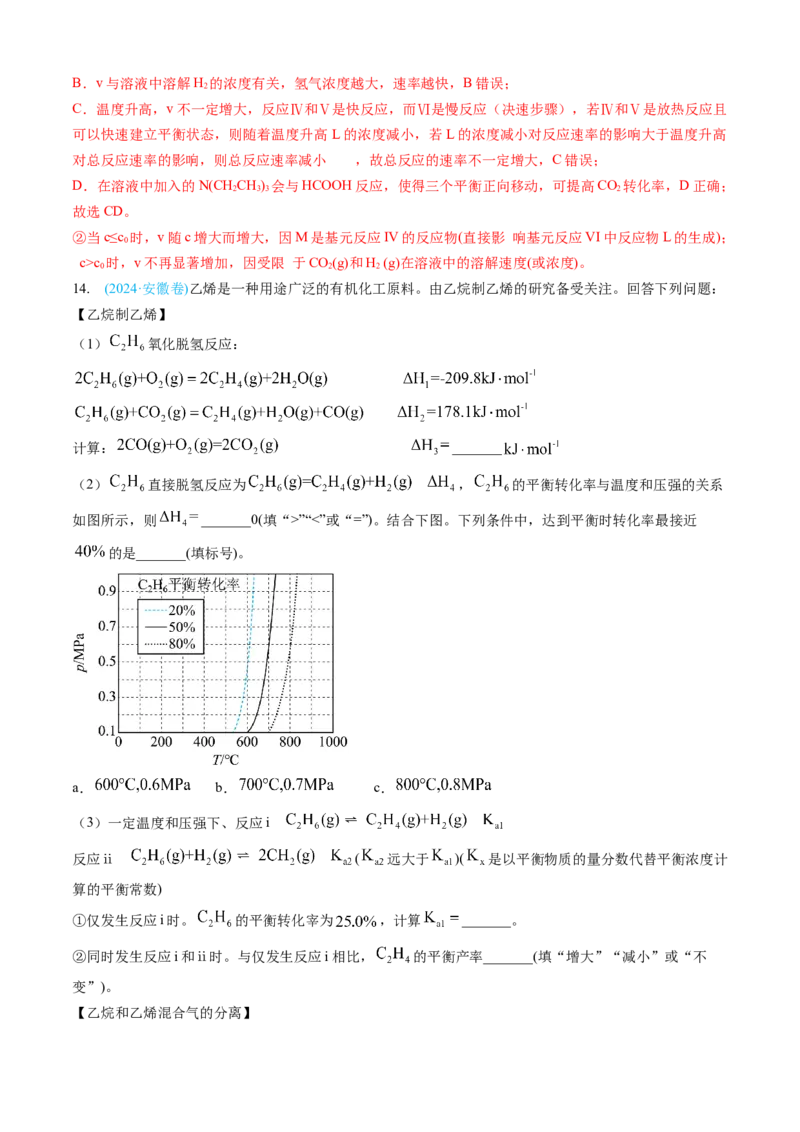
(2) 直接脱氢反应为 , 的平衡转化率与温度和压强的关系
如图所示,则 _______0(填“>”“<”或“=”)。结合下图。下列条件中,达到平衡时转化率最接近
的是_______(填标号)。
a. b. c.
(3)一定温度和压强下、反应i
反应ⅱ ( 远大于 )( 是以平衡物质的量分数代替平衡浓度计
算的平衡常数)
①仅发生反应i时。 的平衡转化宰为 ,计算 _______。
②同时发生反应i和ⅱ时。与仅发生反应i相比, 的平衡产率_______(填“增大”“减小”或“不
变”)。
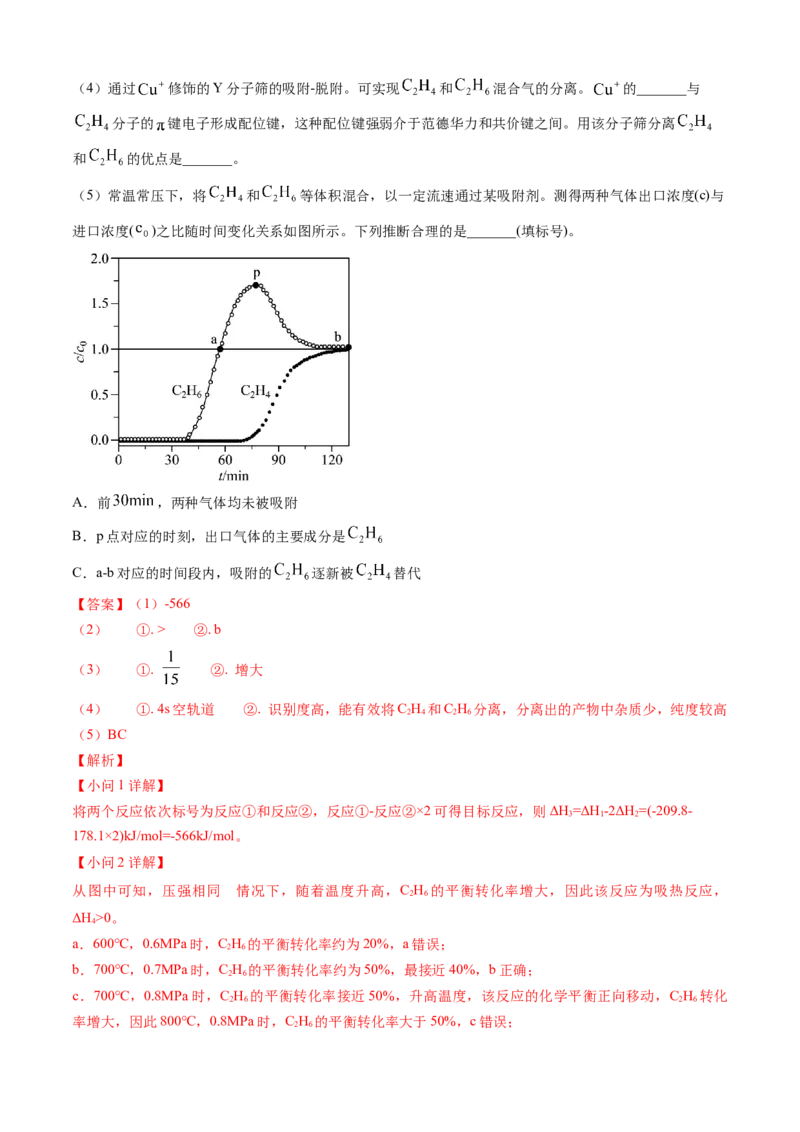
【乙烷和乙烯混合气的分离】(4)通过 修饰的Y分子筛的吸附-脱附。可实现 和 混合气的分离。 的_______与
分子的 键电子形成配位键,这种配位键强弱介于范德华力和共价键之间。用该分子筛分离
和 的优点是_______。
(5)常温常压下,将 和 等体积混合,以一定流速通过某吸附剂。测得两种气体出口浓度(c)与
进口浓度( )之比随时间变化关系如图所示。下列推断合理的是_______(填标号)。
A.前 ,两种气体均未被吸附
B.p点对应的时刻,出口气体的主要成分是
C.a-b对应的时间段内,吸附的 逐新被 替代
【答案】(1)-566
(2) ①. > ②. b
(3) ①. ②. 增大
(4) ①. 4s空轨道 ②. 识别度高,能有效将C H 和C H 分离,分离出的产物中杂质少,纯度较高
2 4 2 6
(5)BC
【解析】
【小问1详解】
将两个反应依次标号为反应①和反应②,反应①-反应②×2可得目标反应,则ΔH=ΔH -2ΔH =(-209.8-
3 1 2
178.1×2)kJ/mol=-566kJ/mol。
【小问2详解】
从图中可知,压强相同 情的况下,随着温度升高,C H 的平衡转化率增大,因此该反应为吸热反应,
2 6
ΔH>0。
4
a.600℃,0.6MPa时,C H 的平衡转化率约为20%,a错误;
2 6
b.700℃,0.7MPa时,C H 的平衡转化率约为50%,最接近40%,b正确;
2 6
c.700℃,0.8MPa时,C H 的平衡转化率接近50%,升高温度,该反应的化学平衡正向移动,C H 转化
2 6 2 6
率增大,因此800℃,0.8MPa时,C H 的平衡转化率大于50%,c错误;
2 6故答案选b。
【小问3详解】
①仅发生反应i,设初始时C H 物质的量为1mol,平衡时C H 转化率为25%,则消耗C H0.25mol,生成
2 6 2 6 2 6
C H0.25mol,生成H0.25mol,K = = 。
2 4 2 a1
②只发生反应i时,随着反应进行,气体总物质的量增大,压强增大促使化学平衡逆向移动,同时发生反
应i和反应ii,且从题干可知K 远大于K ,反应ii为等体积反应,因为反应ii的发生相当于在单独发生反
a2 a1
应i的基础上减小了压强,则反应i化学平衡正向移动,C H 平衡产率增大。
2 4
【小问4详解】
配合物中,金属离子通常提供空轨道,配体提供孤电子对,则Cu+的4s空轨道与C H 分子的π键电子形成
2 4
配位键。C H 能与Cu+形成配合物而吸附在Y分子筛上,C H 中无孤电子对不能与Cu+形成配合物而无法
2 4 2 6
吸附,通过这种分子筛分离C H 和C H,优点是识别度高,能有效将C H 和C H 分离,分离出的产物中
2 4 2 6 2 4 2 6
杂质少,纯度较高。
【小问5详解】
A.前30min, 等于0,出口浓度c为0,说明两种气体均被吸附,A错误;
B.p点时,C H 对应的 约为1.75,出口处C H 浓度较大,而C H 对应的 较小,出口处C H 浓度较
2 6 2 6 2 4 2 4
小,说明此时出口处气体的主要成分为C H,B正确;
2 6
C.a点处C H 的 =1,说明此时C H 不再吸附在吸附剂上,而a点后C H 的 >1,说明原来吸附在吸
2 6 2 6 2 6
附剂上的C H 也开始脱落,同时从图中可知,a点后一段时间,C H 的 仍为0,说明是吸附的C H 逐
2 6 2 4 2 6
渐被C H 替代,p点到b点之间,吸附的C H 仍在被C H 替代,但是速率相对之前有所减小,同时吸附剂
2 4 2 6 2 4
可能因吸附量有限等原因无法一直吸附C H ,因此p点后C H 的 也逐步增大,直至等于1,此时吸附
2 4 2 4
剂不能再吸附两种物质,C正确;
故答案选BC。
15.(2023·全国甲卷)甲烷选择性氧化制备甲醇是一种原子利用率高的方法。回答下列问题:
(1)已知下列反应的热化学方程式:
①
②
反应③ 的 _______ ,平衡常数 _______(用 表
示)。
(2)电喷雾电离等方法得到的 ( 等)与 反应可得 。 与 反应能高选择性地生成甲醇。分别在 和 下(其他反应条件相同)进行反应 ,结果如下图所
示。图中 的曲线是_______(填“a”或“b”。 、 时 的转化率为_______(列出算式)。
(3) 分别与 反应,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以 示
例)。
(ⅰ)步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是_______(填“Ⅰ”或“Ⅱ”)。
(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则 与 反应的能量变
化应为图中曲线_______(填“c”或“d”)。
(ⅲ) 与 反应,氘代甲醇的产量 _______ (填“>”“<”或“=”)。若 与
反应,生成的氘代甲醇有_______种。
【答案】(1) 或
(2) b
(3)Ⅰ c < 2
【详解】(1)根据盖斯定律可知,反应③= (反应②-①),所以对应
;根据平衡常数表达式与热化学方程式之间的关系可知,对应化学平衡常数 或 ,故答案为: ; 或 ;
(2)根据图示信息可知,纵坐标表示-lg( ),即与MO+的微粒分布系数成反比,与M+的微
粒分布系数成正比。则同一时间内,b曲线生成M+的物质的量浓度比a曲线的小,证明化学反应速率慢,
又因同一条件下降低温度化学反应速率减慢,所以曲线b表示的是300 K条件下的反应;
根据上述分析结合图像可知, 、 时-lg( )=0.1,则 =10-0.1,利用数
学关系式可求出 ,根据反应 可知,生成的M+即为转
化的 ,则 的转化率为 ;故答案为:b;
;
(3)(ⅰ)步骤Ⅰ涉及的是碳氢键的断裂和氢氧键的形成,步骤Ⅱ中涉及碳氧键形成,所以符合题意的是步
骤Ⅰ;
(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则此时正反应活化能会增大,
根据图示可知, 与 反应的能量变化应为图中曲线c;
(ⅲ) 与 反应时,因直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则
单位时间内产量会下降,则氘代甲醇的产量 < ;根据反应机理可知,若 与
反应,生成的氘代甲醇可能为 或 共2种,故答案为:<;2。
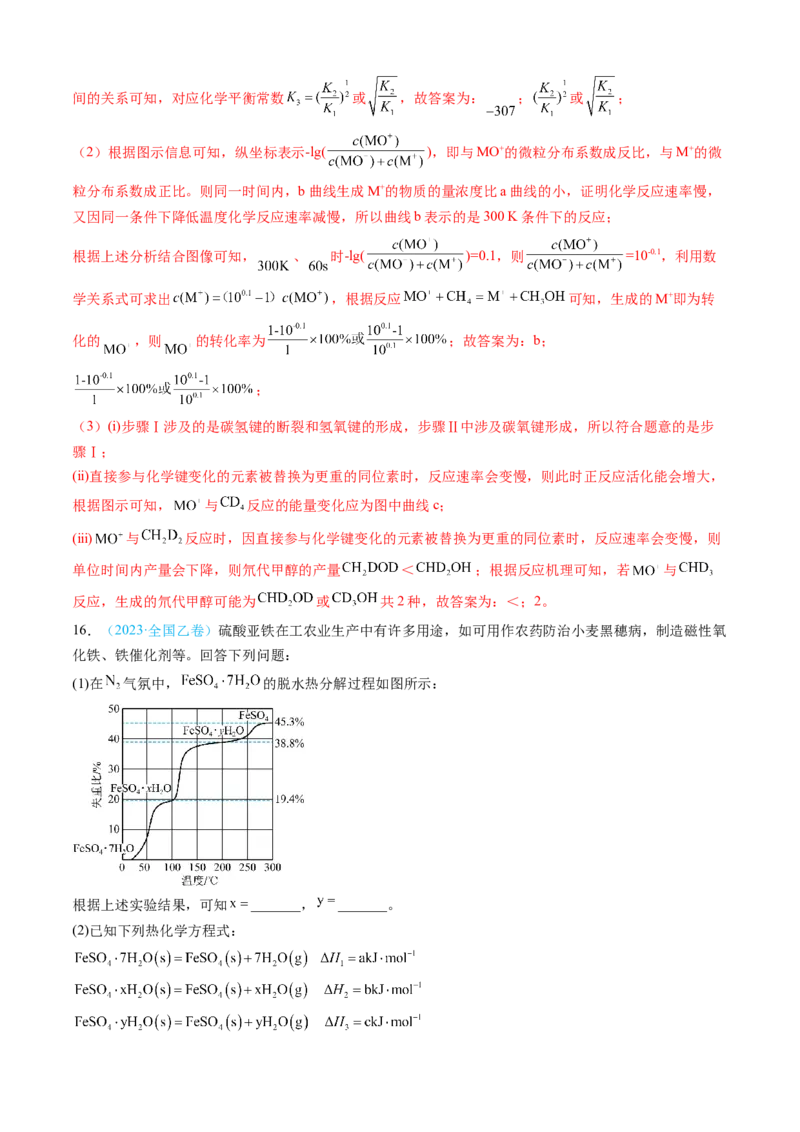
16.(2023·全国乙卷)硫酸亚铁在工农业生产中有许多用途,如可用作农药防治小麦黑穗病,制造磁性氧
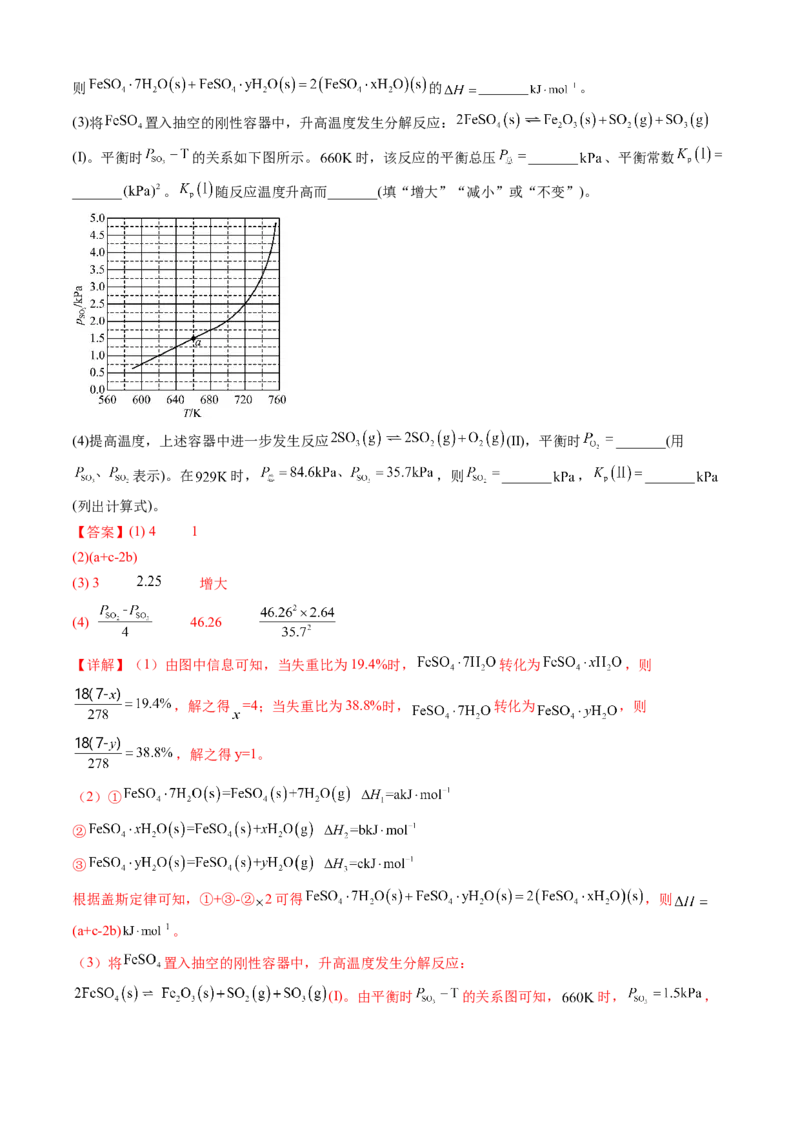
化铁、铁催化剂等。回答下列问题:
(1)在 气氛中, 的脱水热分解过程如图所示:
根据上述实验结果,可知 _______, _______。
(2)已知下列热化学方程式:则 的 _______ 。
(3)将 置入抽空的刚性容器中,升高温度发生分解反应:
(Ⅰ)。平衡时 的关系如下图所示。 时,该反应的平衡总压 _______ 、平衡常数
_______ 。 随反应温度升高而_______(填“增大”“减小”或“不变”)。
(4)提高温度,上述容器中进一步发生反应 (Ⅱ),平衡时 _______(用
表示)。在 时, ,则 _______ , _______
(列出计算式)。
【答案】(1) 4 1
(2)(a+c-2b)
(3) 3 增大
(4) 46.26
【详解】(1)由图中信息可知,当失重比为19.4%时, 转化为 ,则
,解之得 =4;当失重比为38.8%时, 转化为 ,则
,解之得y=1。
(2)①
②
③
根据盖斯定律可知,①+③-② 2可得 ,则
(a+c-2b) 。
(3)将 置入抽空的刚性容器中,升高温度发生分解反应:
(Ⅰ)。由平衡时 的关系图可知, 时, ,则 ,因此,该反应的平衡总压 3 、平衡常数 。由
图中信息可知, 随着温度升高而增大,因此, 随反应温度升高而增大。
(4)提高温度,上述容器中进一步发生反应 (Ⅱ),在同温同压下,不同气体的
物质的量之比等于其分压之比,由于仅发生反应(Ⅰ)时 ,则 ,因此,平衡时
。在 时, ,则 、 ,
联立方程组消去 ,可得 ,代入相关数据可求出 46.26 ,则
, 。
17.(2023·新课标卷)氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
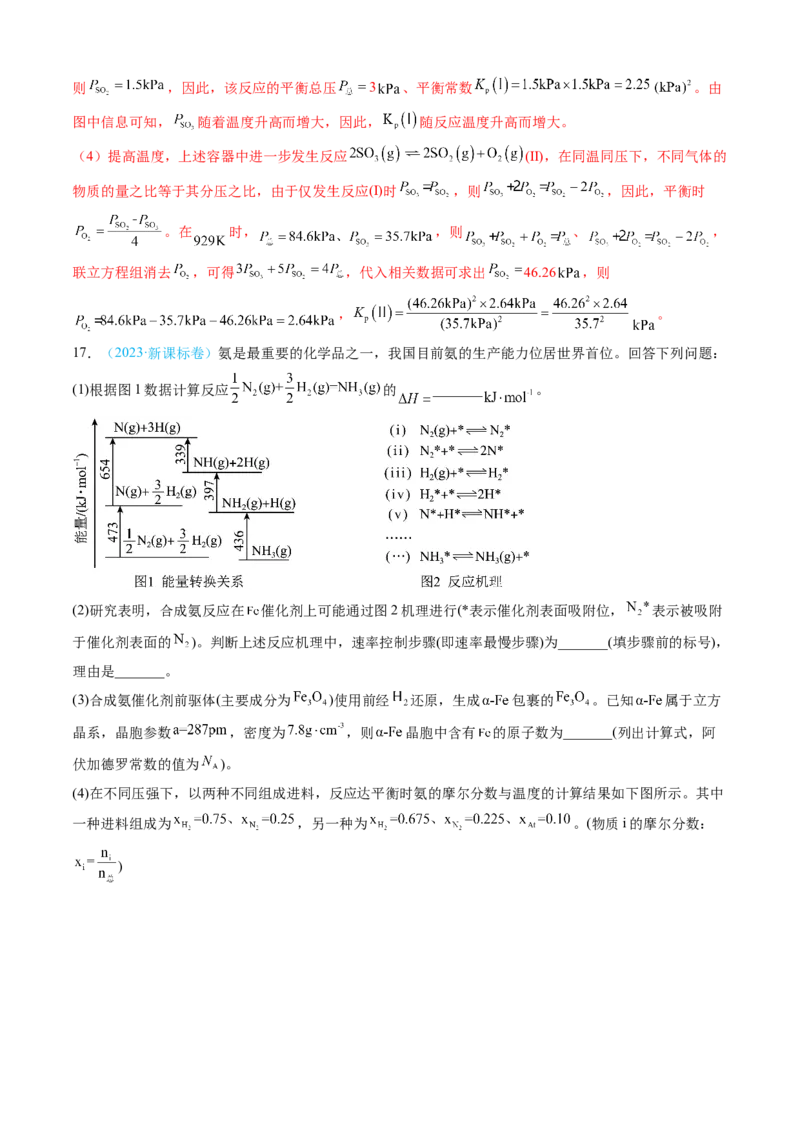
(1)根据图1数据计算反应 的 _______ 。
(2)研究表明,合成氨反应在 催化剂上可能通过图2机理进行(*表示催化剂表面吸附位, 表示被吸附
于催化剂表面的 )。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为_______(填步骤前的标号),
理由是_______。
(3)合成氨催化剂前驱体(主要成分为 )使用前经 还原,生成 包裹的 。已知 属于立方
晶系,晶胞参数 ,密度为 ,则 晶胞中含有 的原子数为_______(列出计算式,阿
伏加德罗常数的值为 )。
(4)在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中
一种进料组成为 ,另一种为 。(物质i的摩尔分数:
)①图中压强由小到大的顺序为_______,判断的依据是_______。
②进料组成中含有惰性气体 的图是_______。
③图3中,当 、 时,氮气的转化率 _______。该温度时,反应
的平衡常数 _______ (化为最简式)。
【答案】(1)
(2) (ⅱ) 在化学反应中,最大的能垒为速率控制步骤,而断开化学键的步骤都属于能垒,由于 的
键能比H-H键的大很多,因此,在上述反应机理中,速率控制步骤为(ⅱ)
(3)
(4) 合成氨的反应为气体分子数减少的反应,压强越大平衡时氨的摩尔分数越大 图4
【详解】(1)在化学反应中,断开化学键要消耗能量,形成化学键要释放能量,反应的焓变等于反应物
的键能总和与生成物的键能总和的差,因此,由图1数据可知,反应 的
。
(2)由图1中信息可知, 的 ,则 的键能为 ;
的 ,则H-H键的键能为 。在化学反应中,最大的能垒为速率
控制步骤,而断开化学键的步骤都属于能垒,由于 的键能比H-H键的大很多,因此,在上述反应机
理中,速率控制步骤为(ⅱ)。
(3)已知 属于立方晶系,晶胞参数 ,密度为 ,设其晶胞中含有 的原子数为 ,
则 晶体密度 ,解之得 ,即 晶胞中含有 的原子
数为 。(4)①合成氨的反应中,压强越大越有利于氨的合成,因此,压强越大平衡时氨的摩尔分数越大。由图
中信息可知,在相同温度下,反应达平衡时氨的摩尔分数 ,因此,图中压强由小到大的顺序为
,判断的依据是:合成氨的反应为气体分子数减少的反应,压强越大平衡时氨的摩尔分数越大。
②对比图3和图4中的信息可知,在相同温度和相同压强下,图4中平衡时氨的摩尔分数较小。在恒压下
充入情性气体 ,反应混合物中各组分的浓度减小,各组分的分压也减小,化学平衡要朝气体分子数增大
的方向移动,因此,充入情性气体 不利于合成氨,进料组成中含有情性气体 的图是图4。
③图3中,进料组成为 两者物质的量之比为3:1。假设进料中氢气和氮气的物质的量分
别为3mol和1mol,达到平衡时氮气的变化量为x mol,则有:
当 、 时, ,解之得 ,则氮气的转化率 ,平衡时
、 、 的物质的量分别为 、2 、 ,其物质的量分数分别为 、 、 ,则该温度下
因此,该温度时,反应 的平衡常数
。
18.(2023·广东卷)配合物广泛存在于自然界,且在生产和生活中都发挥着重要作用。
(1)某有机物 能与 形成橙红色的配离子 ,该配离子可被 氧化成淡蓝色的配离子
。
①基态 的 电子轨道表示式为 。
②完成反应的离子方程式:
(2)某研究小组对(1)中②的反应进行了研究。
用浓度分别为 的 溶液进行了三组实验,得到 随时间t的
变化曲线如图。① 时,在 内, 的平均消耗速率= 。
②下列有关说法中,正确的有 。
A.平衡后加水稀释, 增大
B. 平衡转化率:
C.三组实验中,反应速率都随反应进程一直减小
D.体系由橙红色转变为淡蓝色所需时间:
(3)R的衍生物L可用于分离稀土。溶液中某稀土离子(用M表示)与L存在平衡:
研究组配制了L起始浓度 与L起始浓度比 不同的系列溶液,反应平衡后
测定其核磁共振氢谱。配体L上的某个特征H在三个物种 中的化学位移不同,该特征H对
应吸收峰的相对峰面积S(体系中所有特征H的总峰面积计为1)如下表。
0 1.00 0 0
a x 0.64
b 0.40 0.60
【注】核磁共振氢谱中相对峰面积S之比等于吸收峰对应H的原子数目之比;“ ”表示未检测到。
① 时, 。
② 时,平衡浓度比 。
(4)研究组用吸收光谱法研究了(3)中M与L反应体系。当 时,测得平衡时各物种
随 的变化曲线如图。 时,计算M的平衡转化率 (写出计
算过程,结果保留两位有效数字)。【答案】(1) HNO
2
(2) A、B
(3) 0.36 3:4或0.75
(4)98%
【详解】(1)①基态 的 电子轨道表示式为 ;
②根据原子守恒可知离子方程式中需要增加HNO。
2
(2)①浓度分别为 的 溶液,反应物浓度增加,反应速率增大,据此
可知三者对应的曲线分别为Ⅰ、Ⅱ、Ⅲ; 时,在 内,观察图像可知
的平均消耗速率为 ;
②A.对于反应 HNO ,加水稀释,平衡往粒子数增加的方向移
2
动, 含量增加, 含量减小, 增大,A正确;
B. 浓度增加, 转化率增加,故 ,B正确;
C.观察图像可知,三组实验反应速率都是前期速率增加,后期速率减小,C错误;
D.硝酸浓度越高,反应速率越快,体系由橙红色转变为淡蓝色所需时间越短,故 ,D错误;
故选AB。
(3)① 时, ,且 =0.64, 得x=0.36;
② 相比于 含有两个配体,则 与 的浓度比应为 相对峰面积S的一半与
的相对峰面积S之比,即 。
(4) ; ,由L守恒可知,则
;则M的转化率为 。
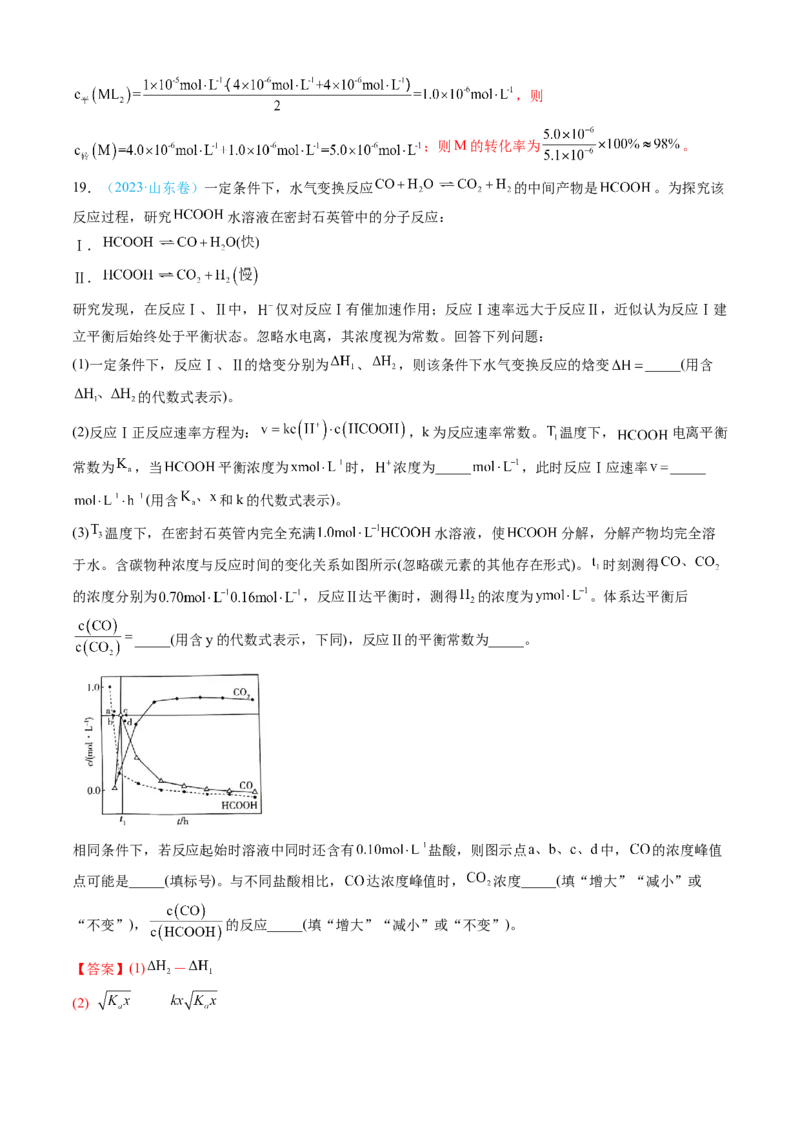
19.(2023·山东卷)一定条件下,水气变换反应 的中间产物是 。为探究该
反应过程,研究 水溶液在密封石英管中的分子反应:
Ⅰ.
Ⅱ.
研究发现,在反应Ⅰ、Ⅱ中, 仅对反应Ⅰ有催加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建
立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
(1)一定条件下,反应Ⅰ、Ⅱ的焓变分别为 、 ,则该条件下水气变换反应的焓变 _____(用含
的代数式表示)。
(2)反应Ⅰ正反应速率方程为: ,k为反应速率常数。 温度下, 电离平衡
常数为 ,当 平衡浓度为 时, 浓度为_____ ,此时反应Ⅰ应速率 _____
(用含 和k的代数式表示)。
(3) 温度下,在密封石英管内完全充满 水溶液,使 分解,分解产物均完全溶
于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。 时刻测得
的浓度分别为 ,反应Ⅱ达平衡时,测得 的浓度为 。体系达平衡后
_____(用含y的代数式表示,下同),反应Ⅱ的平衡常数为_____。
相同条件下,若反应起始时溶液中同时还含有 盐酸,则图示点 中, 的浓度峰值
点可能是_____(填标号)。与不同盐酸相比, 达浓度峰值时, 浓度_____(填“增大”“减小”或
“不变”), 的反应_____(填“增大”“减小”或“不变”)。
【答案】(1) -
(2)(3) a 减小 不变
【详解】(1)根据盖斯定律,反应II-反应I=水气变换反应,故水气变换反应的焓变 = - ;
(2)T 温度时,HCOOH建立电离平衡:
1
,c(HCOO-)=c(H+),故c(H+)= 。
。
(3)t 时刻时,c(CO)达到最大值,说明此时反应I达平衡状态。此时
1
故t 时刻c(HCOOH)=1.0-0.70-0.16=0.14 mol·L-1,K(I)= 。t 时刻→反应II达平
1 1
衡过程,
则c(H )=b+0.16=y,b=(y-0.16)mol·L-1,c(HCOOH)=0.14-a-b=0.3-a-y,c(CO)=a+0.7,K(I)=
2
,a= 。故 = ,K(II)=
。
加入0.1 mol·L-1盐酸后,H+对反应I起催化作用,加快反应I的反应速率,缩短到达平衡所需时间,故
CO浓度峰值提前,由于时间缩短,反应Ⅱ消耗的HCOOH减小,体系中HCOOH浓度增大,导致CO浓度
大于t 时刻的峰值,故c(CO)最有可能在a处达到峰值。此时c(CO)会小于不含盐酸的浓度,
1 2
=K(I),温度不变,平衡常数不变,则 的值不变。
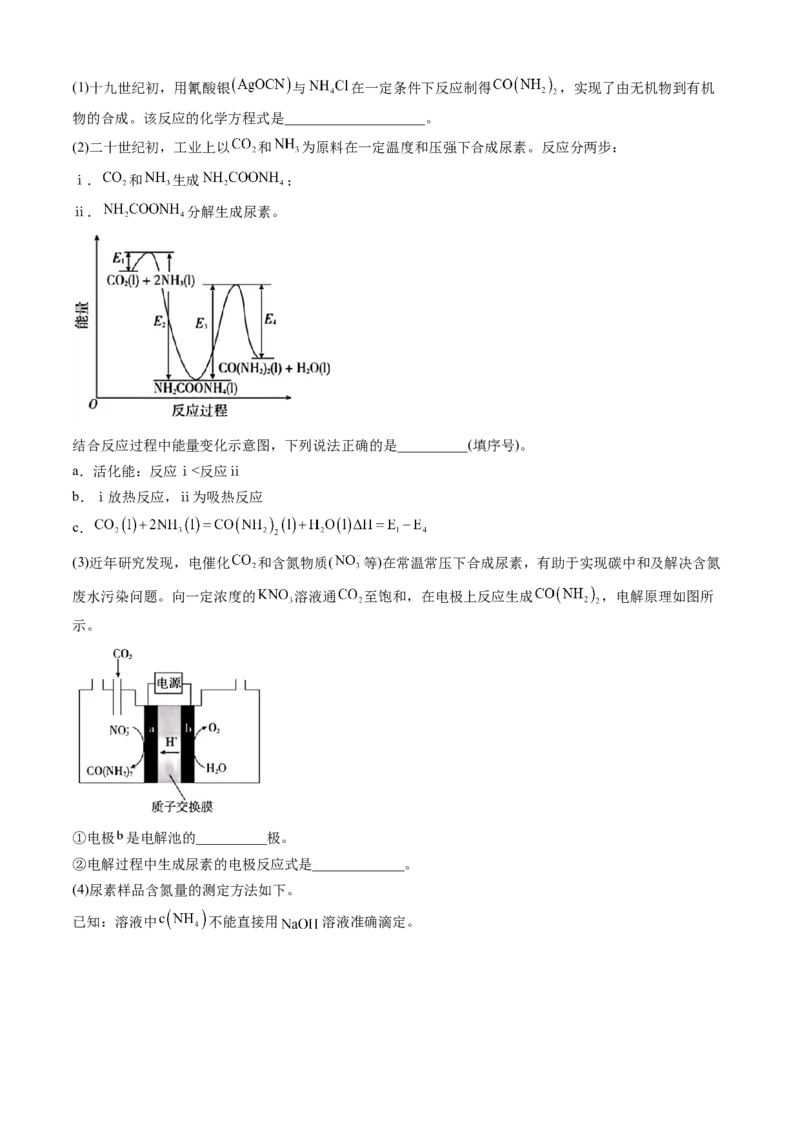
20.(2023·北京卷)尿素 合成的发展体现了化学科学与技术的不断进步。(1)十九世纪初,用氰酸银 与 在一定条件下反应制得 ,实现了由无机物到有机
物的合成。该反应的化学方程式是____________________。
(2)二十世纪初,工业上以 和 为原料在一定温度和压强下合成尿素。反应分两步:
ⅰ. 和 生成 ;
ⅱ. 分解生成尿素。
结合反应过程中能量变化示意图,下列说法正确的是__________(填序号)。
a.活化能:反应ⅰ<反应ⅱ
b.ⅰ放热反应,ⅱ为吸热反应
c.
(3)近年研究发现,电催化 和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮
废水污染问题。向一定浓度的 溶液通 至饱和,在电极上反应生成 ,电解原理如图所
示。
①电极 是电解池的__________极。
②电解过程中生成尿素的电极反应式是_____________。
(4)尿素样品含氮量的测定方法如下。
已知:溶液中 不能直接用 溶液准确滴定。①消化液中的含氮粒子是__________。
②步骤ⅳ中标准 溶液的浓度和消耗的体积分别为 和 ,计算样品含氮量还需要的实验数据有
__________。
【答案】(1)
(2)ab
(3) 阳
(4) 样品的质量、步骤Ⅲ所加入 溶液的体积和浓度
【详解】(1)根据原子守恒分析,二者反应生成尿素和氯化银,化学方程式是
。答案为 ;
(2)a.反应ⅰ的活化能是 ,反应ⅱ活化能是 , ,a项正确;
b.从图中反应物和生成物能量的相对大小可看出反应ⅰ放热,反应ⅱ吸热,b项正确;
c.总反应的: ,c项错误;
故选ab。
(3)①电极b上发生 失电子生成 的氧化反应,是电解池的阳极。②a极硝酸根离子得电子转化为
尿素,再结合酸性环境可分析出电极反应式为 。答案为阳极;
;
(4)①尿素消化分解生成 和 ,由于反应中存在浓 ,则消化液中含氮粒子为 。②除了
已知数据外,还需要的是样品的质量、步骤ⅲ所加入 溶液的体积和浓度。答案为 ;样品的质量、
步骤Ⅲ所加入HSO 溶液的体积和浓度。
2 4
21.(2023·湖北卷)纳米碗 是一种奇特的碗状共轭体系。高温条件下, 可以由 分子经
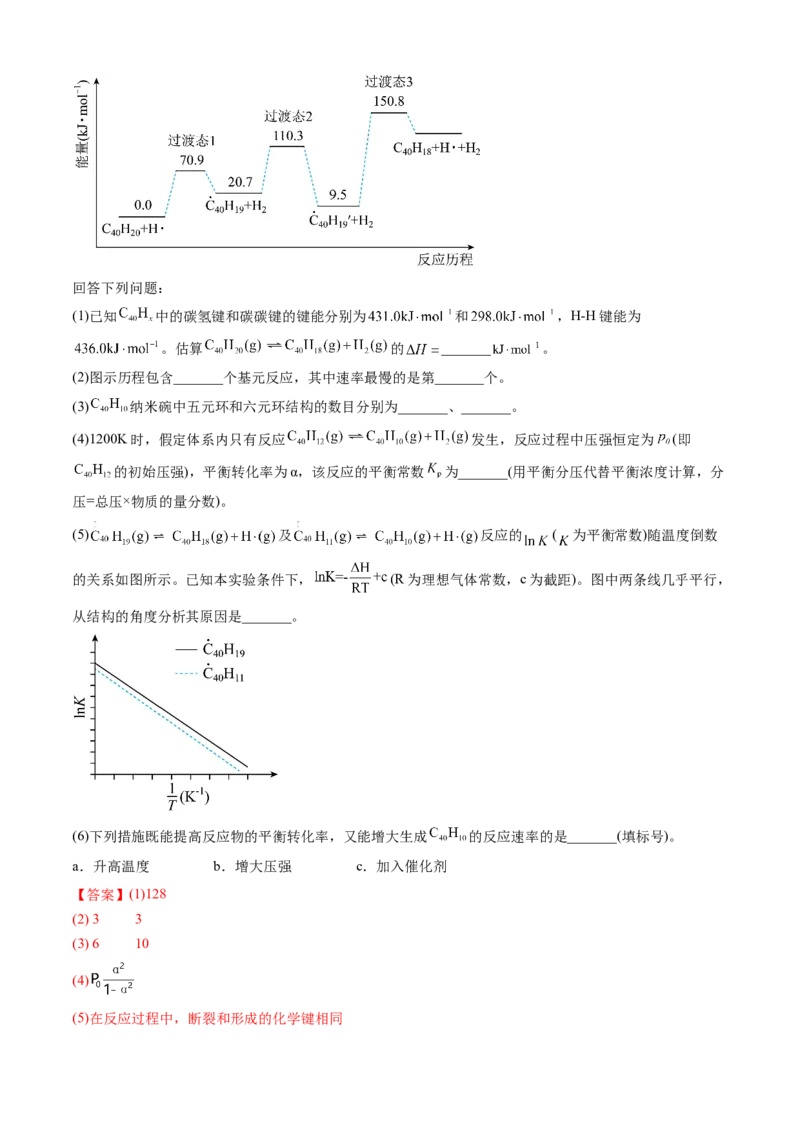
过连续5步氢抽提和闭环脱氢反应生成。 的反应机理和能量变化如下:回答下列问题:
(1)已知 中的碳氢键和碳碳键的键能分别为 和 ,H-H键能为
。估算 的 _______ 。
(2)图示历程包含_______个基元反应,其中速率最慢的是第_______个。
(3) 纳米碗中五元环和六元环结构的数目分别为_______、_______。
(4)1200K时,假定体系内只有反应 发生,反应过程中压强恒定为 (即
的初始压强),平衡转化率为α,该反应的平衡常数 为_______(用平衡分压代替平衡浓度计算,分
压=总压×物质的量分数)。
(5) 及 反应的 ( 为平衡常数)随温度倒数
的关系如图所示。已知本实验条件下, (R为理想气体常数,c为截距)。图中两条线几乎平行,
从结构的角度分析其原因是_______。
(6)下列措施既能提高反应物的平衡转化率,又能增大生成 的反应速率的是_______(填标号)。
a.升高温度 b.增大压强 c.加入催化剂
【答案】(1)128
(2) 3 3
(3) 6 10
(4)
(5)在反应过程中,断裂和形成的化学键相同(6)a
【详解】(1)由 和 的结构式和反应历程可以看出, 中断裂了2根碳氢键, 形成
了1根碳碳键,所以 的 = ,故答
案为:128;
(2)由反应历程可知,包含3个基元反应,分别为: ,
, ,其中第三个的活化能最大,反应速率最慢,
故答案为:3;3;
(3)由 的结构分析,可知其中含有1个五元环,10个六元环,每脱两个氢形成一个五元环,则
总共含有6个五元环,10个六元环,故答案为:6;10;
(4)1200K时,假定体系内只有反应 发生,反应过程中压强恒定为 (即
的初始压强),平衡转化率为α,设起始量为1mol,则根据信息列出三段式为:
则 , , ,该反应的平衡常数 =
,故答案为: ;
(5) 及 反应的 ( 为平衡常数)随温度倒
数的关系如图。图中两条线几乎平行,说明斜率几乎相等,根据 (R为理想气体常数,c为截
距)可知,斜率相等,则说明焓变相等,因为在反应过程中,断裂和形成的化学键相同,故答案为:在反应
过程中,断裂和形成的化学键相同;
(6)a.由反应历程可知,该反应为吸热反应,升温,反应正向进行,提高了平衡转化率反应速率也加快,
a符合题意;
b.由化学方程式可知,该反应为正向体积增大的反应,加压,反应逆向进行,降低了平衡转化率,b不符
合题意;
c.加入催化剂,平衡不移动,不能提高平衡转化率,c不符合题意;
故答案为:a。
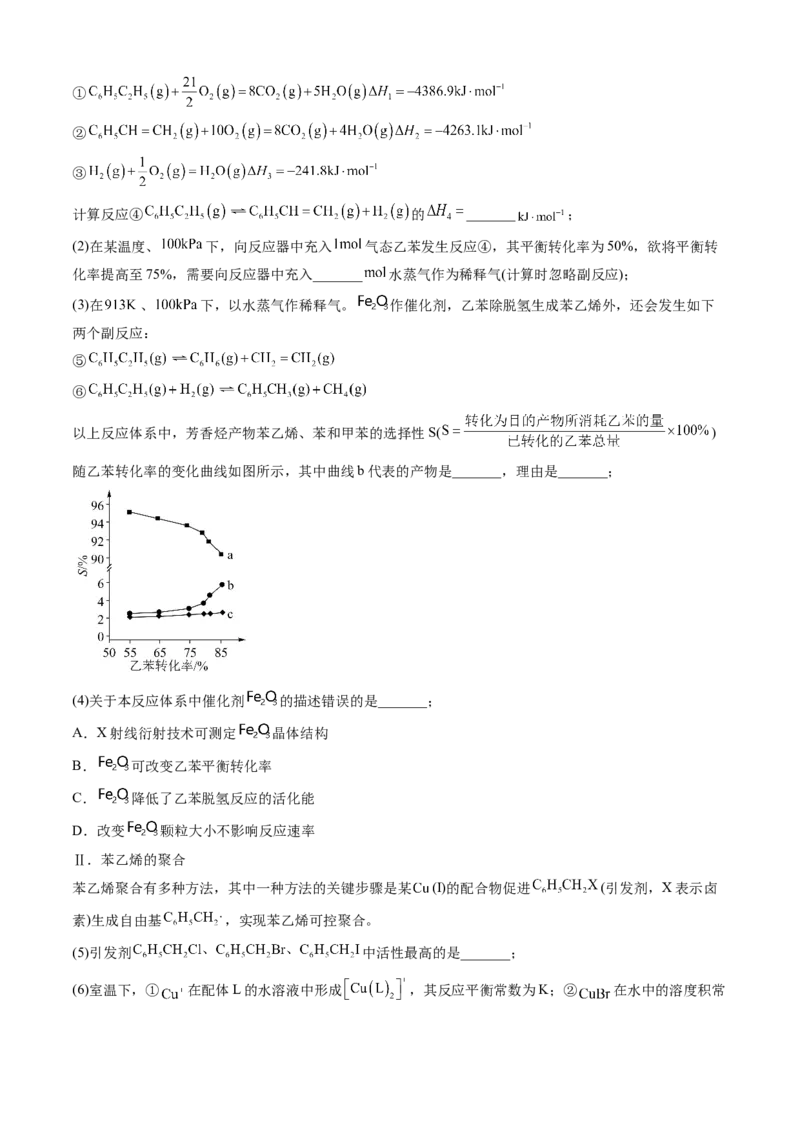
22.(2023·湖南卷)聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。
Ⅰ.苯乙烯的制备
(1)已知下列反应的热化学方程式:①
②
③
计算反应④ 的 _______ ;
(2)在某温度、 下,向反应器中充入 气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转
化率提高至75%,需要向反应器中充入_______ 水蒸气作为稀释气(计算时忽略副反应);
(3)在 、 下,以水蒸气作稀释气。 作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下
两个副反应:
⑤
⑥
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S( )
随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是_______,理由是_______;
(4)关于本反应体系中催化剂 的描述错误的是_______;
A.X射线衍射技术可测定 晶体结构
B. 可改变乙苯平衡转化率
C. 降低了乙苯脱氢反应的活化能
D.改变 颗粒大小不影响反应速率
Ⅱ.苯乙烯的聚合
苯乙烯聚合有多种方法,其中一种方法的关键步骤是某 (Ⅰ)的配合物促进 (引发剂,X表示卤
素)生成自由基 ,实现苯乙烯可控聚合。
(5)引发剂 中活性最高的是_______;
(6)室温下,① 在配体L的水溶液中形成 ,其反应平衡常数为K;② 在水中的溶度积常数为 。由此可知, 在配体L的水溶液中溶解反应的平衡常数为_______(所有方程式中计量系数关
系均为最简整数比)。
【答案】(1)+118
(2)5
(3) 苯 反应④为主反应,反应⑤⑥为副反应,苯乙烯的选择性最大;在恒温恒压下,随乙苯转化率
的增大,反应⑤正向移动,反应⑥不移动,则曲线b代表产物苯
(4)BD
(5)C HCHCl
6 5 2
(6)K∙K
sp
【详解】(1)根据盖斯定律,将①-②-③可得C
6
H
5
C
2
H
5
(g)⇌C
6
H
5
CH=CH
2
(g)+H
2
(g) ∆H
4
=-4386.9kJ/mol-
(-4263.1kJ/mol)-(-241.8kJ/mol)=+118kJ/mol;答案为:+118;
(2)设充入HO(g)物质的量为xmol;在某温度、100kPa下,向反应器中充入1mol气态乙苯发生反应④。
2
乙苯的平衡转化率为50%,可列三段式 ,此时平衡时
混合气体总物质的量为1.5mol,此时容器的体积为V;当乙苯的平衡转化率为75%,可列三段式
,此时乙苯、苯乙烯、H 物质的量之和为1.75mol,
2
混合气的总物质的量为(1.75+x)mol,在恒温、恒压时,体积之比等于物质的量之比,此时容器的体积为
;两次平衡温度相同,则平衡常数相等,则 = ,解得x=5;答案为:5;
(3)曲线a芳香烃产物的选择性大于曲线b、c芳香烃产物的选择性,反应④为主反应,反应⑤⑥为副反
应,则曲线a代表产物苯乙烯的选择性;反应④⑤的正反应为气体分子数增大的反应,反应⑥的正反应是
气体分子数不变的反应;在913K、100kPa(即恒温恒压)下以水蒸气作稀释气,乙苯的转化率增大,即减
小压强,反应④⑤都向正反应方向移动,反应⑥平衡不移动,故曲线b代表的产物是苯;答案为:苯;反
应④为主反应,反应⑤⑥为副反应,苯乙烯的选择性最大;在恒温恒压下,随乙苯转化率的增大,反应⑤
正向移动,反应⑥不移动,则曲线b代表产物苯;
(4)A.测定晶体结构最常用的仪器是X射线衍射仪,即用X射线衍射技术可测定Fe O 晶体结构,A项
2 3
正确;
B.催化剂不能使平衡发生移动,不能改变乙苯的平衡转化率,B项错误;
C.催化剂能降低反应的活化能,加快反应速率,故Fe O 可降低乙苯脱氢反应的活化能,C项正确;
2 3
D.催化剂颗粒大小会影响接触面积,会影响反应速率,D项错误;答案选BD。
(5)电负性Cl>Br>I,则极性C—Cl键>C—Br键>C—I键,则C HCHCl更易生成自由基,即活性最
6 5 2
高的是C HCHCl;答案为:C HCHCl;
6 5 2 6 5 2
(6)Cu+在配体L的水溶液中形成[Cu(L)
2
]+,则Cu++2L⇌[Cu(L)
2
]+的平衡常数K= ;CuBr在
水中的溶度积常数K
sp
=c(Cu+)∙c(Br-);CuBr在配体L的水溶液中溶解反应为CuBr+2L⇌[Cu(L)
2
]++Br-,该反
应的平衡常数为 = =K∙K ;答案为:K∙K 。
sp sp
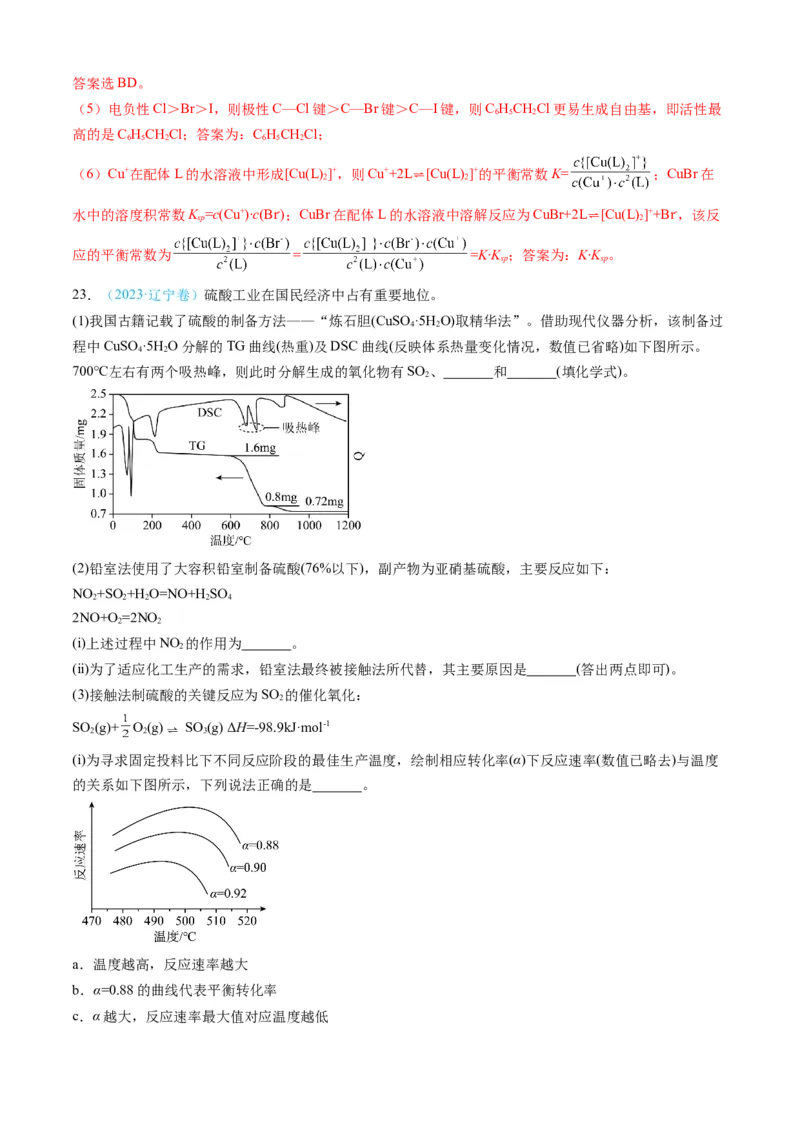
23.(2023·辽宁卷)硫酸工业在国民经济中占有重要地位。
(1)我国古籍记载了硫酸的制备方法——“炼石胆(CuSO ·5H O)取精华法”。借助现代仪器分析,该制备过
4 2
程中CuSO ·5H O分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如下图所示。
4 2
700℃左右有两个吸热峰,则此时分解生成的氧化物有SO 、 和 (填化学式)。
2
(2)铅室法使用了大容积铅室制备硫酸(76%以下),副产物为亚硝基硫酸,主要反应如下:
NO +SO+H O=NO+H SO
2 2 2 2 4
2NO+O =2NO
2 2
(ⅰ)上述过程中NO 的作用为 。
2
(ⅱ)为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是 (答出两点即可)。
(3)接触法制硫酸的关键反应为SO 的催化氧化:
2
SO (g)+ O(g) SO (g) ΔH=-98.9kJ·mol-1
2 2 3
(ⅰ)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度
的关系如下图所示,下列说法正确的是 。
a.温度越高,反应速率越大
b.α=0.88的曲线代表平衡转化率
c.α越大,反应速率最大值对应温度越低d.可根据不同 下的最大速率,选择最佳生产温度
(ⅱ)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如下图所
示,催化性能最佳的是 (填标号)。
(ⅲ)设O 的平衡分压为p,SO 的平衡转化率为α,用含p和α 的代数式表示上述催化氧化反应的K =
2 2 e e p
(用平衡分压代替平衡浓度计算)。
【答案】(1) CuO SO
3
(2) 催化剂 反应中有污染空气的NO和NO 放出影响空气环境、NO 可以溶解在硫酸中给产物硫
2 2
酸带来杂质、产率不高(答案合理即可)
(3) cd d
【详解】(1)根据图示的热重曲线所示,在700℃左右会出现两个吸热峰,说明此时CuSO 发生热分解反
4
应,从TG图像可以看出,质量减少量为原CuSO 质量的一半,说明有固体CuO剩余,还有其他气体产出,
4
此时气体产物为SO 、SO 、O,可能出现的化学方程式为3CuSO 3CuO+2SO ↑+SO↑+O ↑,结合反
2 3 2 4 2 3 2
应中产物的固体产物质量和气体产物质量可以确定,该反应的产物为CuO、SO 、SO 、O,故答案为
2 3 2
CuO、SO 。
3
(2)(i)根据所给的反应方程式,NO 在反应过程中线消耗再生成,说明NO 在反应中起催化剂的作用;
2 2
(ii)近年来,铅室法被接触法代替因为在反应中有污染空气的NO和NO 放出影响空气环境、同时作为催化
2
剂的NO 可以溶解在硫酸中给产物硫酸带来杂质影响产品质量、产率不高(答案合理即可)。
2
(3)(i)a.根据不同转化率下的反应速率曲线可以看出,随着温度的升高反应速率先加快后减慢,a错误;
b.从图中所给出的速率曲线可以看出,相同温度下,转化率越低反应速率越快,但在转化率小于88%的
时的反应速率图像并没有给出,无法判断α=0.88的条件下是平衡转化率,b错误;
c.从图像可以看出随着转化率的增大,最大反应速率不断减小,最大反应速率出现的温度也逐渐降低,c
正确;
d.从图像可以看出随着转化率的增大,最大反应速率出现的温度也逐渐降低,这时可以根据不同转化率
选择合适的反应温度以减少能源的消耗,d正确;
故答案选cd;
(ii)为了提高催化剂的综合性能,科学家对催化剂进行了改良,从图中可以看出标号为d的催化剂V-K-Cs-
Ce对SO 的转化率最好,产率最佳,故答案选d;
2(iii)利用分压代替浓度计算平衡常数,反应的平衡常数K = = =
p
;设SO 初始量为m mol,则平衡时n(SO )=m-m·α=m(1-α),n(SO )=m·α,K =
2 2 e e 3 e p
= ,故答案为 。
24.(2023·浙江卷)水煤气变换反应是工业上的重要反应,可用于制氢。
水煤气变换反应:
该反应分两步完成:
请回答:
(1) 。
(2)恒定总压 和水碳比[ ]投料,在不同条件下达到平衡时 和 的分压(某
成分分压=总压×该成分的物质的量分数)如下表:
条件1 0.40 0.40 0
条件2 0.42 0.36 0.02
①在条件1下,水煤气变换反应的平衡常数 。
②对比条件1,条件2中 产率下降是因为发生了一个不涉及 的副反应,写出该反应方程式 。
(3)下列说法正确的是______。
A.通入反应器的原料气中应避免混入
B.恒定水碳比 ,增加体系总压可提高 的平衡产率
C.通入过量的水蒸气可防止 被进一步还原为
D.通过充入惰性气体增加体系总压,可提高反应速率
(4)水煤气变换反应是放热的可逆反应,需在多个催化剂反应层间进行降温操作以“去除”反应过程中的余
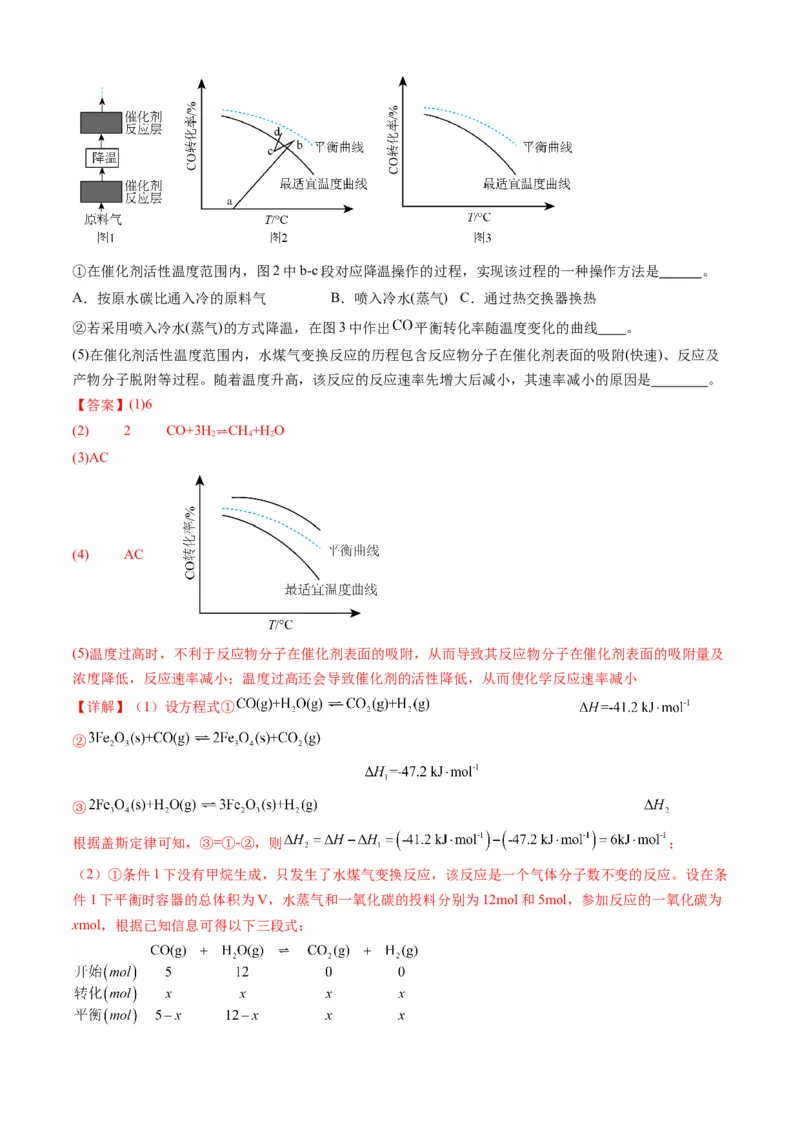
热(如图1所示),保证反应在最适宜温度附近进行。①在催化剂活性温度范围内,图2中b-c段对应降温操作的过程,实现该过程的一种操作方法是 。
A.按原水碳比通入冷的原料气 B.喷入冷水(蒸气) C.通过热交换器换热
②若采用喷入冷水(蒸气)的方式降温,在图3中作出 平衡转化率随温度变化的曲线 。
(5)在催化剂活性温度范围内,水煤气变换反应的历程包含反应物分子在催化剂表面的吸附(快速)、反应及
产物分子脱附等过程。随着温度升高,该反应的反应速率先增大后减小,其速率减小的原因是 。
【答案】(1)6
(2) 2 CO+3H 2⇌CH
4
+H
2
O
(3)AC
(4) AC
(5)温度过高时,不利于反应物分子在催化剂表面的吸附,从而导致其反应物分子在催化剂表面的吸附量及
浓度降低,反应速率减小;温度过高还会导致催化剂的活性降低,从而使化学反应速率减小
【详解】(1)设方程式①
②
③
根据盖斯定律可知,③=①-②,则 ;
(2)①条件1下没有甲烷生成,只发生了水煤气变换反应,该反应是一个气体分子数不变的反应。设在条
件1下平衡时容器的总体积为V,水蒸气和一氧化碳的投料分别为12mol和5mol,参加反应的一氧化碳为
xmol,根据已知信息可得以下三段式:,解得x=4;
则平衡常数 ;
②根据表格中的数据可知,有甲烷生成,且该副反应没有二氧化碳参与,且氢气的产率降低,则该方程式
为:CO+3H 2⇌CH
4
+H
2
O;
(3)A.一氧化碳和氢气都可以和氧气反应,则通入反应器的原料气中应避免混入 ,A正确;
B.该反应前后气体计量系数相同,则增加体系总压平衡不移动,不能提高平衡产率,B错误;
C.通入过量的水蒸气可以促进四氧化三铁被氧化为氧化铁,水蒸气不能将铁的氧化物还原为单质铁,但
过量的水蒸气可以降低体系中CO和H 的浓度,从而防止铁的氧化物被还原为单质铁,C正确;
2
D.若保持容器的体积不变,通过充入惰性气体增加体系总压,反应物浓度不变,反应速率不变,D错误;
故选AC;
(4)①A.按原水碳比通入冷的原料气,可以降低温度,同时化学反应速率稍减小,导致CO的转化率稍
减小,与图中变化相符,A正确;
B.喷入冷水(蒸气),可以降低温度,但是同时水蒸气的浓度增大,会导致CO的转化率增大,与图中变化
不符,B错误;
C.通过热交换器换热,可以降低温度,且不改变投料比,同时化学反应速率稍减小,导致CO的转化率
稍减小,与图中变化相符,C正确;
故选AC;
②增大水蒸气的浓度,平衡正向移动,则一氧化碳的的平衡转化率增大,会高于原平衡线,故图像为:
;
(5)反应物分子在催化剂表面的吸附是一个放热的快速过程,温度过高时,不利于反应物分子在催化剂
表面的吸附,从而导致其反应物分子在催化剂表面的吸附量及浓度降低,反应速率减小;温度过高还会导
致催化剂的活性降低,从而使化学反应速率减小。
25.(2023·浙江卷)“碳达峰·碳中和”是我国社会发展重大战略之一, 还原 是实现“双碳”经
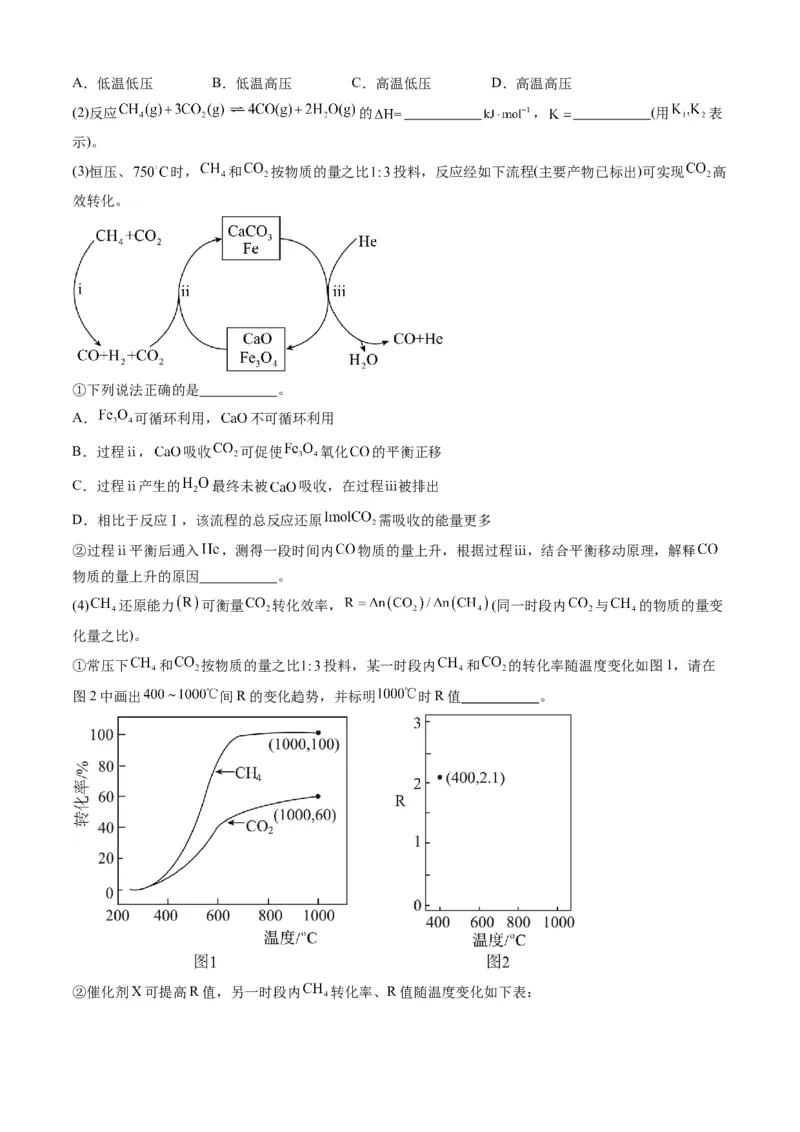
济的有效途径之一,相关的主要反应有:
Ⅰ:
Ⅱ:
请回答:
(1)有利于提高 平衡转化率的条件是___________。A.低温低压 B.低温高压 C.高温低压 D.高温高压
(2)反应 的 , (用 表
示)。
(3)恒压、 时, 和 按物质的量之比 投料,反应经如下流程(主要产物已标出)可实现 高
效转化。
①下列说法正确的是 。
A. 可循环利用, 不可循环利用
B.过程ⅱ, 吸收 可促使 氧化 的平衡正移
C.过程ⅱ产生的 最终未被 吸收,在过程ⅲ被排出
D.相比于反应Ⅰ,该流程的总反应还原 需吸收的能量更多
②过程ⅱ平衡后通入 ,测得一段时间内 物质的量上升,根据过程ⅲ,结合平衡移动原理,解释
物质的量上升的原因 。
(4) 还原能力 可衡量 转化效率, (同一时段内 与 的物质的量变
化量之比)。
①常压下 和 按物质的量之比 投料,某一时段内 和 的转化率随温度变化如图1,请在
图2中画出 间R的变化趋势,并标明 时R值 。
②催化剂X可提高R值,另一时段内 转化率、R值随温度变化如下表:48
温度/℃ 500 520 550
0
转化率/% 7.9 11.5 20.2 34.8
R 2.6 2.4 2.1 1.8
下列说法不正确的是
A.R值提高是由于催化剂X选择性地提高反应Ⅱ的速率
B.温度越低,含氢产物中 占比越高
C.温度升高, 转化率增加, 转化率降低,R值减小
D.改变催化剂提高 转化率,R值不一定增大
【答案】(1)C
(2)
(3) BC 通入 分解平衡正移,导致 增大,促进 还原 平衡正移
(4) C
【详解】(1)反应Ⅰ为气体体积增大的吸热反应,反应Ⅱ为气体体积不变的吸热反应,△H>0,升高温度,
平衡右移,CH 平衡转化率增大;降低压强,平衡右移,CH 平衡转化率增大,故有利于提高 平衡转
4 4
化率的条件是高温低压;答案选C;
(2)已知:Ⅰ:
Ⅱ:
根据盖斯定律,由Ⅰ+Ⅱ 2得反应 ;
故 △H+2△H=+329 , ;
1 2
(3)①A.根据流程可知, 转化为Fe,Fe又转化为 , 可循环利用;CaCO 受热分解生
3
成 和CO, 又与CO 反应生成CaCO , 也可循环利用,选项A错误;
2 2 3
B.过程ⅱ, 吸收 使 浓度降低,促进 氧化 的平衡正移,选项B正确;
C.过程ⅱ 吸收 而产生的 最终未被 吸收,在过程ⅲ被排出,选项C正确;D.焓变只与起始物质的量有关,与过程无关,故相比于反应Ⅰ,该流程的总反应还原 需吸收的
能量一样多,选项D错误;
答案选BC;
②通入 分解平衡正移,导致 增大,促进 还原 平衡正移,故过程ⅱ平衡后通入 ,
测得一段时间内 物质的量上升;
(4)①600℃以下,甲烷转化率随温度升高增大程度大于二氧化碳转化率,该阶段R减小,600℃以上,
二氧化碳转化率随温度升高增大程度大于甲烷转化率,该阶段R增大,根据图1可知 时, 转化
率为100%,即 =1mol, 转化率为60%,即 =3mol 60%=1.8mol,故
= =1.8,故 间R的变化趋势如图:
②A.R值提高是由于催化剂X选择性地提高反应Ⅱ的速率,使单位时间内反应Ⅱ中CO 的转化率增大,
2
增大的倍数比 大,则R提高,选项A正确;
B.根据表中数据可知,温度越低, 转化率越小,而R越大, 增大的倍数比 大,含
氢产物中 占比越高,选项B正确;
C.温度升高, 转化率增加, 转化率也增大,且两个反应中的 转化率均增大,增大倍数多,
故R值增大,选项C不正确;
D.改变催化剂使反应有选择性按反应Ⅰ而提高 转化率,若 转化率减小,则R值不一定增大,选
项D正确;
答案选C。
26.(2022·全国甲卷)金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之
一是将金红石 TiO 转化为TiCl ,再进一步还原得到钛。回答下列问题:
2 4
(1)TiO 转化为TiCl 有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:
2 4
(ⅰ)直接氯化:TiO (s)+2Cl (g)=TiCl (g)+O (g) ΔH =172kJmol-1,K =1.010-2
2 2 4 2 1 p1
(ⅱ)碳氯化:TiO (s)+2Cl (g)+2C(s)=TiCl (g)+2CO(g) ΔH =-51kJmol-1, K =1.21012Pa
2 2 4 2 p2
①反应2C(s)+O
2
(g)=2CO(g)的ΔH为_______kJmol-1,K
p
=_______Pa。
②碳氯化的反应趋势远大于直接氯化,其原因是_______。
③对于碳氯化反应:增大压强,平衡_______移动(填“向左”“向右”或“不”);温度升高,平衡转化率
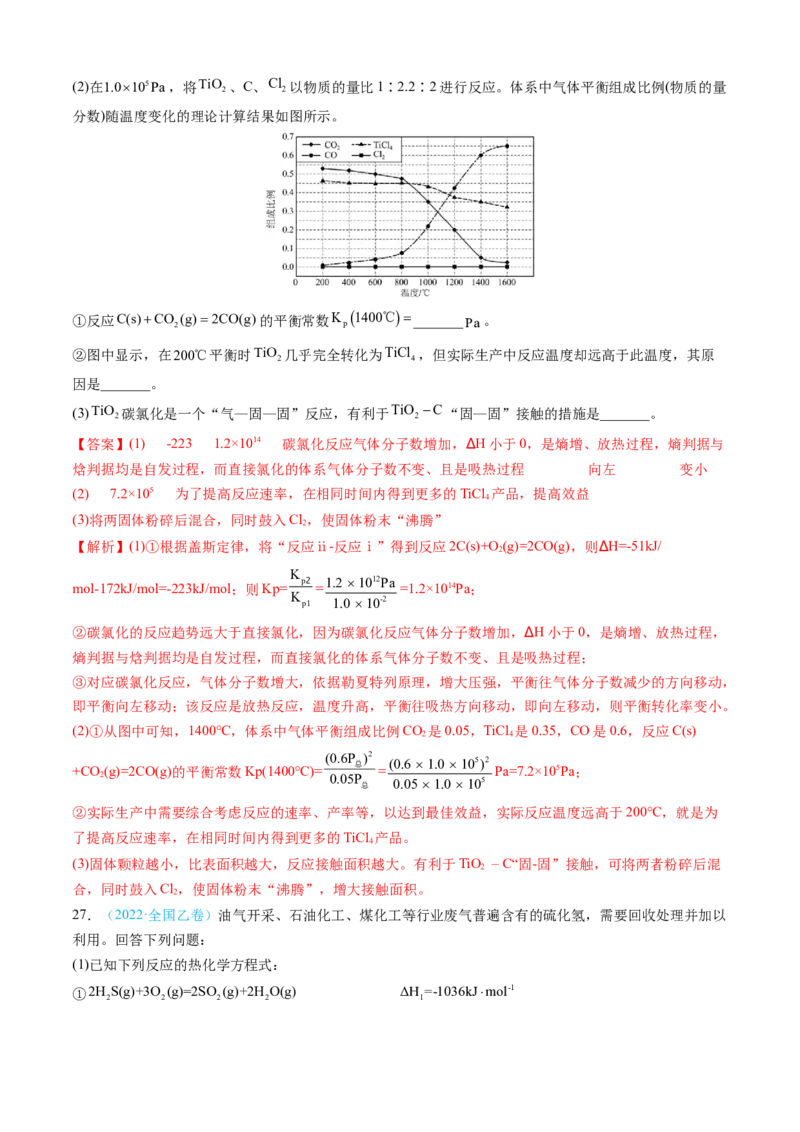
_______(填“变大”“变小”或“不变”)。(2)在1.0105Pa,将TiO 、C、Cl 以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量
2 2
分数)随温度变化的理论计算结果如图所示。
①反应C(s)CO
2
(g)2CO(g)的平衡常数K
p
1400℃_______Pa。
②图中显示,在200℃平衡时TiO 几乎完全转化为TiCl ,但实际生产中反应温度却远高于此温度,其原
2 4
因是_______。
(3)TiO 碳氯化是一个“气—固—固”反应,有利于TiO C“固—固”接触的措施是_______。
2 2
【答案】(1) -223 1.2×1014 碳氯化反应气体分子数增加,∆H小于0,是熵增、放热过程,熵判据与
焓判据均是自发过程,而直接氯化的体系气体分子数不变、且是吸热过程 向左 变小
(2) 7.2×105 为了提高反应速率,在相同时间内得到更多的TiCl 产品,提高效益
4
(3)将两固体粉碎后混合,同时鼓入Cl,使固体粉末“沸腾”
2
【解析】(1)①根据盖斯定律,将“反应ⅱ-反应ⅰ”得到反应2C(s)+O(g)=2CO(g),则∆H=-51kJ/
2
K
p2 1.2 1012Pa
mol-172kJ/mol=-223kJ/mol;则Kp= = =1.2×1014Pa;
K
p1 1.0 10-2
②碳氯化的反应趋势远大于直接氯化,因为碳氯化反应气体分子数增加,∆H小于0,是熵增、放热过程,
熵判据与焓判据均是自发过程,而直接氯化的体系气体分子数不变、且是吸热过程;
③对应碳氯化反应,气体分子数增大,依据勒夏特列原理,增大压强,平衡往气体分子数减少的方向移动,
即平衡向左移动;该反应是放热反应,温度升高,平衡往吸热方向移动,即向左移动,则平衡转化率变小。
(2)①从图中可知,1400℃,体系中气体平衡组成比例CO 是0.05,TiCl 是0.35,CO是0.6,反应C(s)
2 4
+CO (g)=2CO(g)的平衡常数Kp(1400℃)= (0.6P 总 )2 = (0.6 1.0 105)2 Pa=7.2×105Pa;
2 0.05P 总 0.05 1.0 105
②实际生产中需要综合考虑反应的速率、产率等,以达到最佳效益,实际反应温度远高于200℃,就是为
了提高反应速率,在相同时间内得到更多的TiCl 产品。
4
(3)固体颗粒越小,比表面积越大,反应接触面积越大。有利于TiO – C“固-固”接触,可将两者粉碎后混
2
合,同时鼓入Cl,使固体粉末“沸腾”,增大接触面积。
2
27.(2022·全国乙卷)油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以
利用。回答下列问题:
(1)已知下列反应的热化学方程式:
①2H S(g)+3O (g)=2SO (g)+2H O(g) ΔH =-1036kJmol-1
2 2 2 2 1②4H S(g)+2SO (g)=3S (g)+4H O(g) ΔH =94kJmol-1
2 2 2 2 2
③2H (g)+O (g)=2H O(g) ΔH =-484kJmol-1
2 2 2 3
计算H S热分解反应④2H S(g)=S (g)+2H (g)的ΔH =________kJmol-1。
2 2 2 2 4
(2)较普遍采用的H S处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④
2
高温热分解H S。相比克劳斯工艺,高温热分解方法的优点是________,缺点是________。
2
(3)在1470K、100kPa反应条件下,将n(H S):n(Ar)=1:4的混合气进行H S热分解反应。平衡时混合气中
2 2
H
2
S与H
2
的分压相等,H
2
S平衡转化率为________,平衡常数K
p
=________kPa。
(4)在1373K、100kPa反应条件下,对于n(H
2
S):n(Ar)分别为4:1、1:1、1:4、1:9、1:19的H
2
S-Ar混合气,
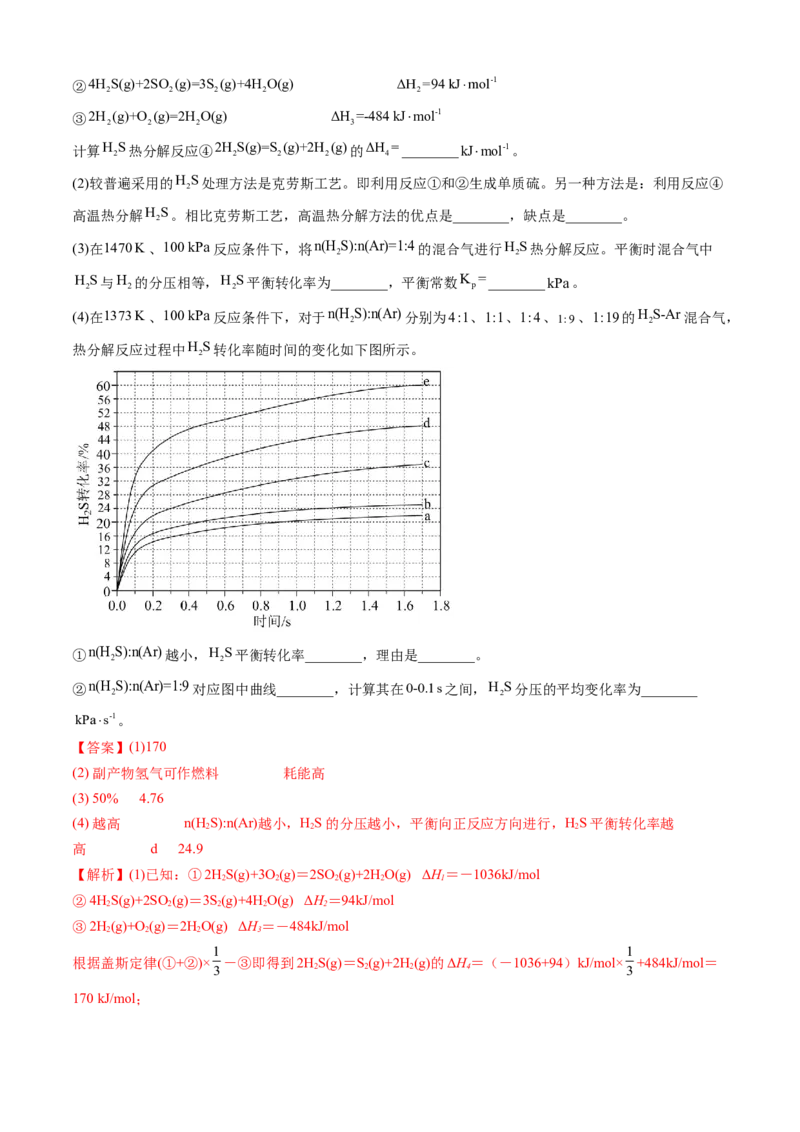
热分解反应过程中H S转化率随时间的变化如下图所示。
2
①n(H S):n(Ar)越小,H S平衡转化率________,理由是________。
2 2
②n(H S):n(Ar)=1:9对应图中曲线________,计算其在0-0.1s之间,H S分压的平均变化率为________
2 2
kPas-1。
【答案】(1)170
(2) 副产物氢气可作燃料 耗能高
(3) 50% 4.76
(4) 越高 n(H S):n(Ar)越小,HS的分压越小,平衡向正反应方向进行,HS平衡转化率越
2 2 2
高 d 24.9
【解析】(1)已知:①2HS(g)+3O(g)=2SO (g)+2HO(g) ΔH=-1036kJ/mol
2 2 2 2 1
②4HS(g)+2SO (g)=3S(g)+4HO(g) ΔH=94kJ/mol
2 2 2 2 2
③2H(g)+O(g)=2HO(g) ΔH=-484kJ/mol
2 2 2 3
1 1
根据盖斯定律(①+②)× -③即得到2HS(g)=S(g)+2H(g)的ΔH=(-1036+94)kJ/mol× +484kJ/mol=
3 2 2 2 4 3
170 kJ/mol;1 1
(2)根据盖斯定律(①+②)× 可得2HS(g)+O(g)=S(g)+2HO(g) ΔH=(-1036+94)kJ/mol× =-314kJ/mol,
3 2 2 2 2 3
因此,克劳斯工艺的总反应是放热反应;根据硫化氢分解的化学方程式可知,高温热分解方法在生成单质
硫的同时还有氢气生成。因此,高温热分解方法的优点是:可以获得氢气作燃料;但由于高温分解HS会
2
消耗大量能量,所以其缺点是耗能高;
(3)假设在该条件下,硫化氢和氩的起始投料的物质的量分别为1mol和4mol,根据三段式可知:
2H S(g) ⇌ S (g) + 2H (g)
2 2 2
始/mol 1 0 0
变/mol x 0.5x x
平/mol 1x 0.5x x
平衡时HS和H 的分压相等,则二者的物质的量相等,即1-x=x,解得x=0.5,所以HS的平衡转化率
2 2 2
0.25 0.5
100kPa( 100kPa)2
5.25 5.25
为 0.5 ,所以平衡常数K p = p(S )p2(H ) = 0.5 ≈4.76kPa;
100%50% 2 2 ( 100kPa)2
1 p2(H S) 5.25
2
(4)①由于正反应是体积增大的可逆反应,n(H S):n(Ar)越小,HS的分压越小,相当于降低压强,平衡向正
2 2
反应方向移动,因此HS平衡转化率越高;
2
②n(H S):n(Ar)越小,HS平衡转化率越高,所以n(H S):n(Ar)=1:9对应的曲线是d;根据图像可知
2 2 2
n(H S):n(Ar)=1:9反应进行到0.1s时HS转化率为0.24。假设在该条件下,硫化氢和氩的起始投料的物质
2 2
的量分别为1mol和9mol,则根据三段式可知
2H S(g) ⇌ S (g) + 2H (g)
2 2 2
始/mol 1 0 0
变/mol 0.24 0.12 0.24
平/mol 0.76 0.12 0.24
0.76
此时HS的压强为 100kPa≈7.51kPa,HS的起始压强为10kPa,所以HS分压的平均
2 0.760.120.249 2 2
10kPa7.51kPa
变化率为 =24.9kPa·s-1。
0.1s
28.(2022·广东卷)铬及其化合物在催化、金属防腐等方面具有重要应用。
(1)催化剂CrO 可由 NH CrO 加热分解制备,反应同时生成无污染气体。
2 3 4 2 2 7
①完成化学方程式: NH
4
2
Cr
2
O
7
Cr
2
O
3
______________。
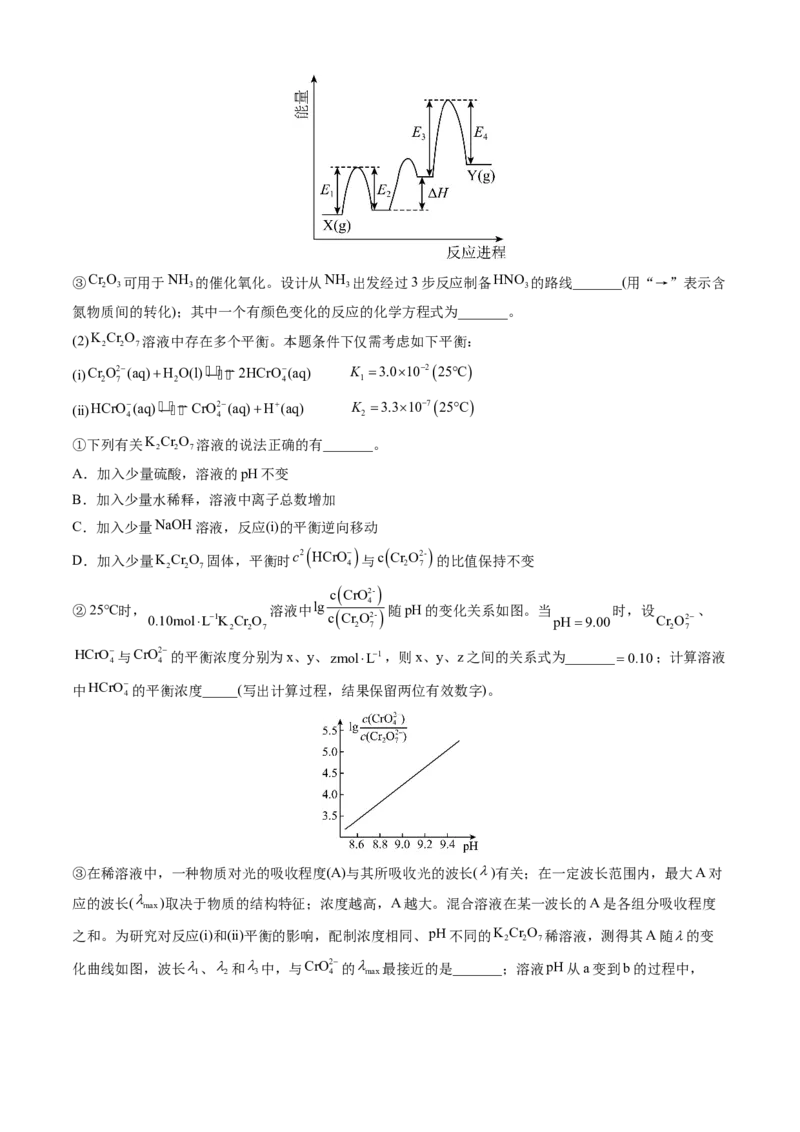
②CrO 催化丙烷脱氢过程中,部分反应历程如图,X(g)Y(g)过程的焓变为_______(列式表示)。
2 3③CrO 可用于NH 的催化氧化。设计从NH 出发经过3步反应制备HNO 的路线_______(用“→”表示含
2 3 3 3 3
氮物质间的转化);其中一个有颜色变化的反应的化学方程式为_______。
(2)K CrO 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
2 2 7
(ⅰ)Cr
2
O
7
2(aq)H
2
O(l)
2HCrO
4
(aq) K
1
3.010225C
(ⅱ)HCrO
4
(aq)
CrO2
4
(aq)H(aq) K
2
3.310725C
①下列有关K CrO 溶液的说法正确的有_______。
2 2 7
A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K CrO
固体,平衡时c2 HCrO
与c
CrO2-
的比值保持不变
2 2 7 4 2 7
c
CrO2-
②25℃时, 溶液中lg 4 随pH的变化关系如图。当 时,设 、
0.10molL1K CrO c
CrO2-
pH9.00 CrO2
2 2 7 2 7 2 7
HCrO与CrO2 的平衡浓度分别为x、y、zmolL1,则x、y、z之间的关系式为_______0.10;计算溶液
4 4
中HCrO的平衡浓度_____(写出计算过程,结果保留两位有效数字)。
4
③在稀溶液中,一种物质对光的吸收程度(A)与其所吸收光的波长()有关;在一定波长范围内,最大A对
应的波长( )取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度
max
之和。为研究对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、pH不同的K CrO 稀溶液,测得其A随的变
2 2 7
化曲线如图,波长、和中,与CrO2 的 最接近的是_______;溶液pH从a变到b的过程中,
1 2 3 4 maxc
H c2 CrO2
4
的值_______(填“增大”“减小”或“不变”)。
c
CrO2
2 7
【答案】(1) N↑ 4HO (E-E)+ΔH+(E-E)
2 2 1 2 3 4
NH Cr 2 O3NOO2NO O 2HNO 2NO+O =2NO
3 O 2 2 H 2 O 3 2 2
c
CrO2
(2) BD x
1
2
y
1
2
z 当溶液pH=9时,
c
Cr 2 O
4
7
2
104
,因此可忽略溶液中
Cr 2 O 7 2
即c
HCrO
c
CrO2
=0.20
4 4
c H c CrO2 109c CrO2
4 4
反应(ii)的平衡常数K = = =3.3×10-7
2 c HCrO c HCrO
4 4
联立两个方程可得c
HCrO
=6.0×10-4mol/L λ 增大
4 3
【解析】(1)① NH CrO 分解过程中,生成Cr O 和无污染气体,根据元素守恒可知,其余生成物为
4 2 2 7 2 3
N、HO,根据原子守恒可知反应方程式为 NH CrO CrO N 4H O。
2 2 4 2 2 7 2 3 2 2
②设反应过程中第一步的产物为M,第二步的产物为N,则X→M ΔH=(E-E),M→N ΔH=ΔH,N→Y
1 1 2 2
ΔH=(E-E),根据盖斯定律可知,X(g)→Y(g)的焓变为ΔH+ΔH+ΔH=(E-E)+ΔH+(E-E)。
3 3 4 1 1 2 3 1 2 3 4
③NH 在Cr O 作催化剂条件下,能与O 反应生成NO,NO与O 反应生成红棕色气体NO ,NO 与HO
3 2 3 2 2 2 2 2
反应生成HNO 和NO,若同时通入O,可将氮元素全部氧化为HNO,因此从NH 出发经过3步反应制备
3 2 3 3
HNO 的路线为 NH Cr 2 O3NOO2NO O 2HNO ;其中NO反应生成NO 过程中,气体颜色发生
3 3 O 2 2 H 2 O 3 2
变化,其反应方程式为2NO+O =2NO。
2 2
(2)①KCr O
溶液中存在平衡:(i)CrO2aqH Ol
⇌
2HCrOaq
、(ii)
2 2 7 2 7 2 4
HCrOaq
⇌
CrO2aqHaq
。
4 4
A.向溶液中加入少量硫酸,溶液中c(H+)增大,(ii)平衡逆向移动,根据勒夏特列原理可知,平衡移动只是
减弱改变量,平衡后,溶液中c(H+)依然增大,因此溶液的pH将减小,故A错误;
B.加水稀释过程中,根据“越稀越水解”、“越稀越电离”可知,(i)和(ii)的平衡都正向移动,两个平衡
正向都是离子数增大的反应,因此稀释后,溶液中离子总数将增大,故B正确;
C.加入少量NaOH溶液,(ii)正向移动,溶液中c
HCrO
将减小,(i)将正向移动,故C错误;
4c2 HCrO
4
D.平衡(i)的平衡常数K = ,平衡常数只与温度和反应本身有关,因此加入少量KCr O 溶液,
1 c CrO2 2 2 7
2 7
c2 HCrO
4
不变,故D正确;
c
CrO2
2 7
综上所述,答案为:BD。
②0.10mol/L K Cr O 溶液中,Cr原子的总浓度为0.20mol/L,当溶液pH=9.00时,溶液中Cr原子总浓度为
2 2 7
2c Cr
2
O
7
2 c HCrO
4
c CrO
4
2 =0.20mol/L,Cr
2
O
7
2、HCrO
4
与CrO2
4
的平衡浓度分别为x、y、z
c
CrO2
mol/L,因此x
1
2
y
1
2
z=0.10;由图8可知,当溶液pH=9时,
c
Cr 2 O
4
7
2
104
,因此可忽略溶液中
Cr 2 O 7 2
,
c H c CrO2 109c CrO2
4 4
即 c HCrO c CrO2=0.20,反应(ii)的平衡常数K 2 = c HCrO = c HCrO =3.3×10-7,联立
4 4 4 4
两个方程可得c
HCrO
=6.0×10-4mol/L。
4
③根据反应(i)、(ii)是离子浓度增大的平衡可知,溶液pH越大,溶液中c
CrO2
c
HCrO
c
CrO2
越
2 7 4 4
大,混合溶液在某一波长的A越大,溶液的pH越大,溶液中c CrO2
4
越大,因此与CrO2
4
的λ
max
最接近的
c2 HCrO
c
H
c
CrO2
4 4
是λ;反应(i)的平衡常数K = ,反应(ii)的平衡常数K = , =
3 1 c CrO2 2 c HCrO K 2K
2 7 4 2 1
c2 H c2 CrO2 c2 HCrO c2 H c2 CrO2 c H c2 CrO2 K 2K
4 4 = 4 ,因此 4 = 2 1 ,由上述分
c2 HCrO
c
CrO2
c
CrO2
c
CrO2
c
H
4 2 7 2 7 2 7
c
H c2 CrO2
4
析逆推可知,b>a,即溶液pH从a变到b的过程中,溶液中c(H+)减小,所以 的值将增大。
c
CrO2
2 7
29.(2022·福建卷)异丙醇 可由生物质转化得到,催化异丙醇脱水制取高值化学品丙烯 的
工业化技术已引起人们的关注,其主要反应如下:
Ⅰ.
Ⅱ.
回答下列问题:
(1)已知 ,则 燃烧生成 和
的热化学方程式为_______。
(2)在 下,刚性密闭容器中的反应体系内水蒸气浓度与反应时间关系如下表:
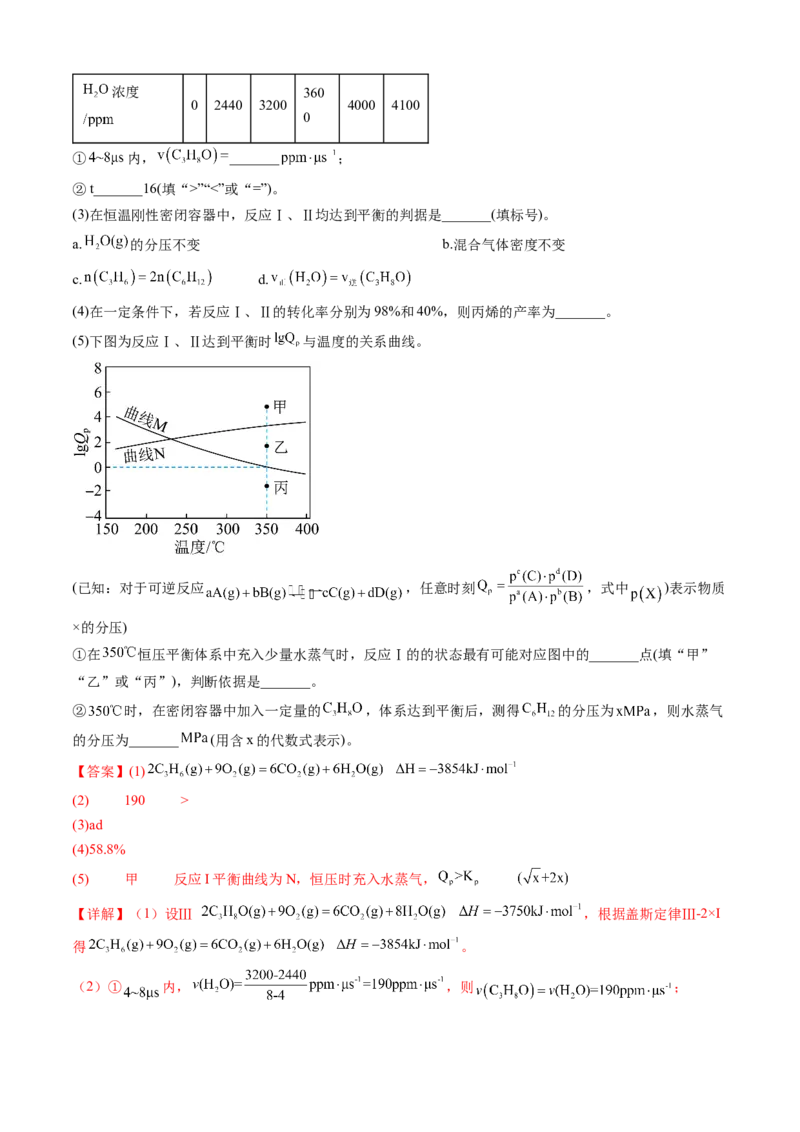
反应时间 0 4 8 12 t 20浓度 360
0 2440 3200 4000 4100
0
① 内, _______ ;
②t_______16(填“>”“<”或“=”)。
(3)在恒温刚性密闭容器中,反应Ⅰ、Ⅱ均达到平衡的判据是_______(填标号)。
a. 的分压不变 b.混合气体密度不变
c. d.
(4)在一定条件下,若反应Ⅰ、Ⅱ的转化率分别为98%和40%,则丙烯的产率为_______。
(5)下图为反应Ⅰ、Ⅱ达到平衡时 与温度的关系曲线。
(已知:对于可逆反应 ,任意时刻 ,式中 )表示物质
×的分压)
①在 恒压平衡体系中充入少量水蒸气时,反应Ⅰ的的状态最有可能对应图中的_______点(填“甲”
“乙”或“丙”),判断依据是_______。
② 时,在密闭容器中加入一定量的 ,体系达到平衡后,测得 的分压为 ,则水蒸气
的分压为_______ (用含x的代数式表示)。
【答案】(1)
(2) 190 >
(3)ad
(4)58.8%
(5) 甲 反应I平衡曲线为N,恒压时充入水蒸气,
【详解】(1)设Ⅲ ,根据盖斯定律Ⅲ-2×Ⅰ
得 。
(2)① 内, ,则 ;② 、 、 ,△c(H2O)逐渐减小,说明反应速率减小, 内,Δc(H2O)=400ppm,
内,Δc(H2O)=400ppm,则t-12>4,即t>16。
(3)a.H2O的分压不变,则C3H6的分压也不变,反应1、Ⅱ各组分分压不变,反应1、Ⅱ均达到平衡,
a正确;
b.反应物和生成物均为气体,混合气体的总质量不变,刚性密闭容器体积不变,则混合气体密度不变,
不能作为反应I、Ⅱ均达到平衡的判据,b错误;
c.当 时,反应不一定达到平衡,不能作为反应1、Ⅱ均达到平衡的判据,c错误;
d. ,说明正逆反应速率相等,反应I达平衡,各组分分压不变,C3H6的分压不变,
说明反应Ⅱ也达平衡,d正确;
故选ad。
(4)设C3H8O的物质的量为1mol,若lmol C3H8O完全反应,理论上生成1mol C3H6,因为反应Ⅰ、Ⅱ
的转化率分别为98%和40%,反应I生成1mol×98%=0.98mol C3H6,反应Ⅱ消耗了40% C3H6,则达平衡
时C3H6的物质的量为0.98mol×(1-40%)=0.588mol,所以丙烯的产率为 =58.8%。
(5)①反应I为气体体积增大的吸热反应,反应Ⅱ为气体体积减小的放热反应,则升高温度,反应I正向
移动, 逐渐增大,反应Ⅱ逆向移动, 逐渐减小,即反应I为平衡曲线为N,反应Ⅱ平衡曲线为M;在
350℃恒压平衡体系中充入少量水蒸气时,对于反应I而言,相当于增大生成物浓度,使得 > ,即lg
增大,反应I的状态最有可能对应图中的甲;
②由图可知,350°C时达平衡后, =0,则350℃时 = =1,设水蒸气的平衡分压为a MPa,则反应
II的C3H6起始分压为 a MPa,对反应Ⅱ列三段式有
,解得a= MPa。
30.(2022·湖北卷)自发热材料在生活中的应用日益广泛。某实验小组为探究“CaOAlH O”体系的
2
发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值(T)随时间(t)的变化
曲线,如图所示。
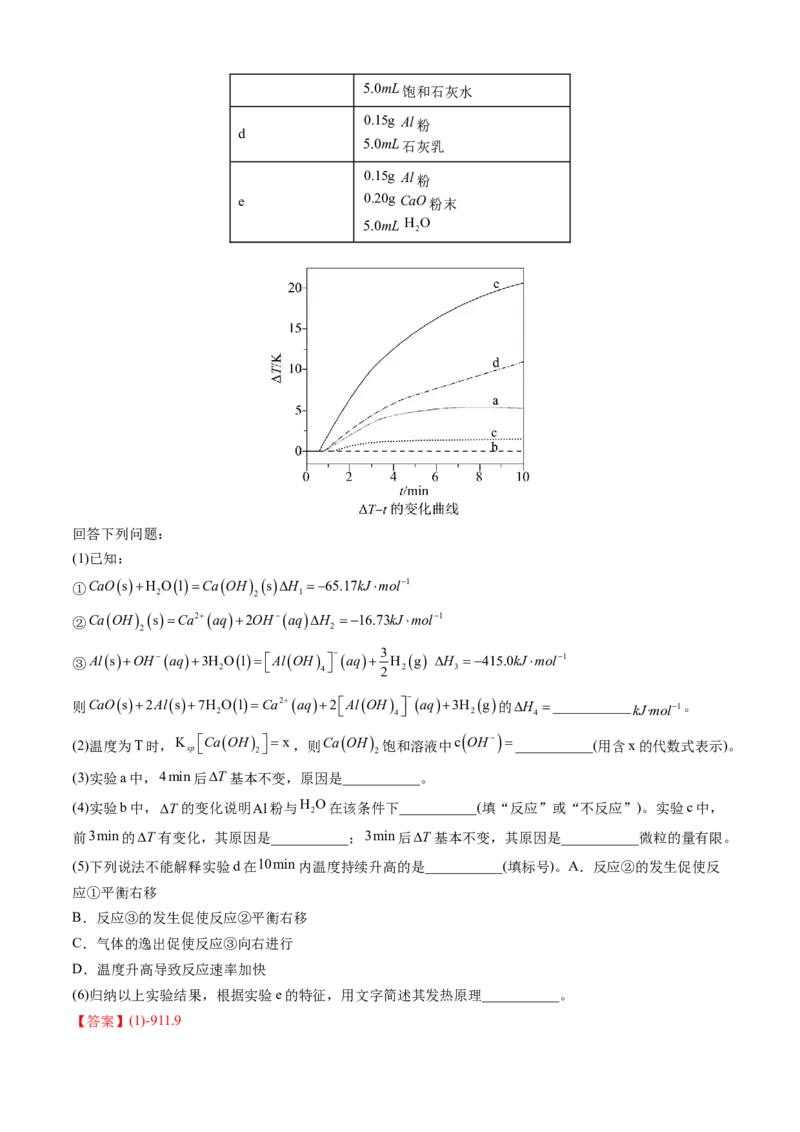
实验编号 反应物组成
0.20g CaO粉末
a
5.0mL H O
2
0.15g Al粉
b
5.0mL H O
2
c 0.15g Al粉5.0mL饱和石灰水
0.15g Al粉
d
5.0mL石灰乳
0.15g Al粉
e 0.20g CaO粉末
5.0mL H O
2
回答下列问题:
(1)已知:
①CaOsH OlCaOH sH 65.17kJmol1
2 2 1
②CaOH sCa2aq2OHaqH 16.73kJmol1
2 2
③AlsOHaq3H
2
Ol
AlOH
4
aq 3
2
H
2
g H
3
415.0kJmol1
则CaOs2Als7H
2
OlCa2aq2
AlOH
4
aq3H
2
g的H
4
___________ kJ·mol1。
(2)温度为T时,K
sp
CaOH
2
x,则CaOH
2
饱和溶液中c OH ___________(用含x的代数式表示)。
(3)实验a中,4min后T基本不变,原因是___________。
(4)实验b中,T的变化说明Al粉与H
2
O在该条件下___________(填“反应”或“不反应”)。实验c中,
前3min的T有变化,其原因是___________;3min后T基本不变,其原因是___________微粒的量有限。
(5)下列说法不能解释实验d在10min内温度持续升高的是___________(填标号)。A.反应②的发生促使反
应①平衡右移
B.反应③的发生促使反应②平衡右移
C.气体的逸出促使反应③向右进行
D.温度升高导致反应速率加快
(6)归纳以上实验结果,根据实验e的特征,用文字简述其发热原理___________。
【答案】(1)-911.9(2)3 2xmol⋅L-1
(3)Ca(OH) 在水中的溶解度小,反应①达到了平衡状态
2
(4) 不反应 Al和溶液中的OH-发生了反应 OH-
(5)A
(6)实验e中,发生反应①、②和③,反应③中有气体生成,气体的逸出促使反应③向右进行,反应③的发
生使得溶液中OH-的浓度减小,促使反应②平衡右移,反应②的发生促使反应①平衡右移,这三步反应都
是放热反应,温度升高导致反应速率加快。
【解析】(1)根据盖斯定律可得,①+②+2③可得反应CaO(s)+2Al(s)+7H2O(l)=Ca2+(aq)+2[Al(OH) ]-(aq)
4
+3H
2
(g),则ΔH
4
=ΔH
1
+ΔH
2
+2ΔH
3
=(-65.17kJ⋅mol-1)+(-16.73kJ⋅mol-1)+2(-415.0kJ⋅mol-1)=-911.9kJ⋅mol-1。
(2)温度为T时,Ca(OH) 饱和溶液中,Ca(OH) (s) Ca2+(aq)+2OH-(aq), c(OH-)=2c(Ca2+)∙,
2 2
K
sp
[Ca(OH)
2
]=c(Ca2+)∙c2(OH-)=x,则c(OH-)=3 2xmol⋅L-1。
(3)实验a中,CaO和HO反应①生成Ca(OH) ,4min后ΔT基本不变,是因为Ca(OH) 在水中的溶解度小,
2 2 2
反应①达到了平衡状态。
(4)实验b中,ΔT几乎不变,说明Al粉与HO在该条件下不反应;实验c中,前3min的ΔT有变化,是因
2
为Al和溶液中的OH-发生了反应,3min后ΔT基本不变,是因为饱和石灰水中OH-的浓度较低,OH-的量
有限。
(5)实验d中,发生反应②和③,反应③中有气体生成,气体的逸出促使反应③向右进行,反应③的发生使
得溶液中OH-的浓度减小,促使反应②平衡右移,这两步反应都是放热反应,温度升高导致反应速率加快;
综上所述,实验d在10min内温度持续升高与反应①无关,故选A。
(6)实验e中,发生反应①、②和③,反应③中有气体生成,气体的逸出促使反应③向右进行,反应③的发
生使得溶液中OH-的浓度减小,促使反应②平衡右移,反应②的发生促使反应①平衡右移,这三步反应都
是放热反应,温度升高导致反应速率加快。
31.(2022·重庆卷)反应 在工业上有重要应用。
(1)该反应在不同温度下的平衡常数如表所示。
温度/℃ 700 800 830 1000
平衡常
1.67 1.11 1.00 0.59
数
①反应的△H_____0(填“>”“<”或“=”)。
②反应常在较高温度下进行,该措施的优缺点是_____。
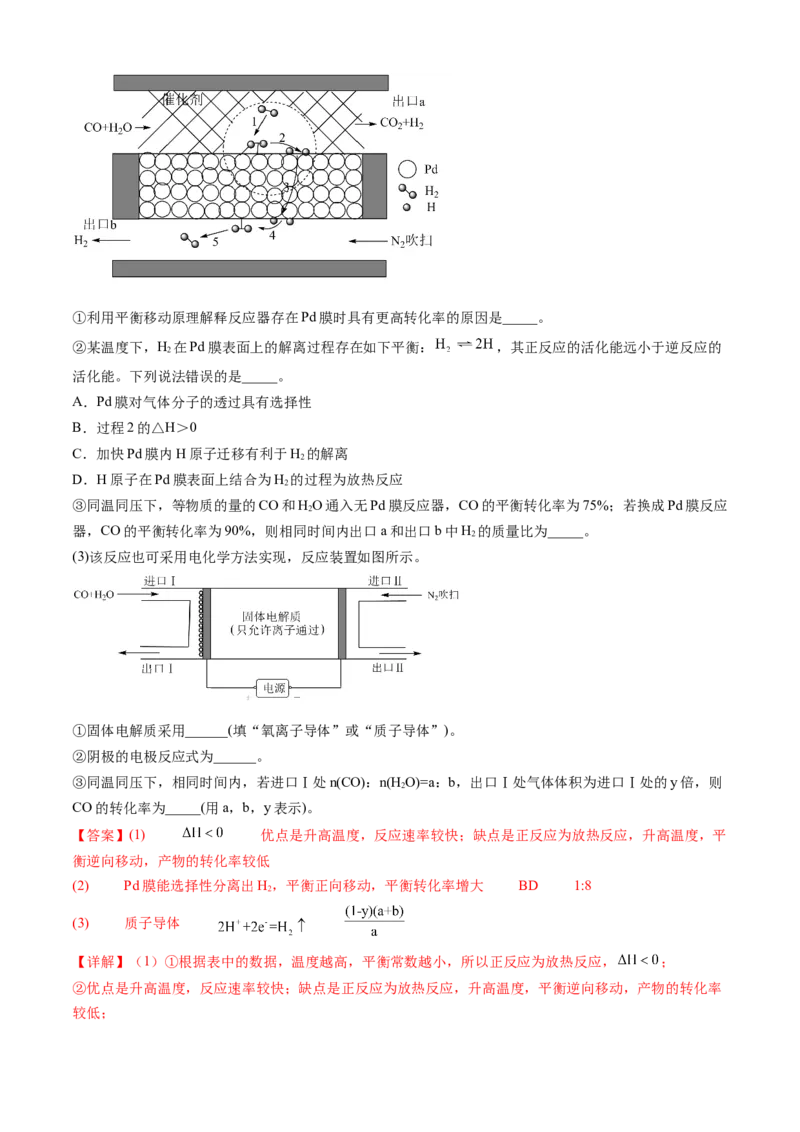
(2)该反应常在Pd膜反应器中进行,其工作原理如图所示。①利用平衡移动原理解释反应器存在Pd膜时具有更高转化率的原因是_____。
②某温度下,H 在Pd膜表面上的解离过程存在如下平衡: ,其正反应的活化能远小于逆反应的
2
活化能。下列说法错误的是_____。
A.Pd膜对气体分子的透过具有选择性
B.过程2的△H>0
C.加快Pd膜内H原子迁移有利于H 的解离
2
D.H原子在Pd膜表面上结合为H 的过程为放热反应
2
③同温同压下,等物质的量的CO和HO通入无Pd膜反应器,CO的平衡转化率为75%;若换成Pd膜反应
2
器,CO的平衡转化率为90%,则相同时间内出口a和出口b中H 的质量比为_____。
2
(3)该反应也可采用电化学方法实现,反应装置如图所示。
①固体电解质采用______(填“氧离子导体”或“质子导体”)。
②阴极的电极反应式为______。
③同温同压下,相同时间内,若进口Ⅰ处n(CO):n(H O)=a:b,出口Ⅰ处气体体积为进口Ⅰ处的y倍,则
2
CO的转化率为_____(用a,b,y表示)。
【答案】(1) 优点是升高温度,反应速率较快;缺点是正反应为放热反应,升高温度,平
衡逆向移动,产物的转化率较低
(2) Pd膜能选择性分离出H,平衡正向移动,平衡转化率增大 BD 1:8
2
(3) 质子导体
【详解】(1)①根据表中的数据,温度越高,平衡常数越小,所以正反应为放热反应, ;
②优点是升高温度,反应速率较快;缺点是正反应为放热反应,升高温度,平衡逆向移动,产物的转化率
较低;(2)①Pd膜能选择性分离出H,平衡正向移动,平衡转化率增大;
2
②A.Pd膜只允许 通过,不允许 通过,对气体分子的透过具有选择性,A正确;
B.过程正反应的活化能远小于逆反应的活化能, ,B错误;
C.加快Pd膜内H原子迁移,平衡 正向移动,有利于 的解离,C正确;
D. 为放热过程,H原子在Pd膜表面上结合为 的过程为吸热反应,D错误;
故选BD;
③根据反应 ,设通入的 为1mol,无膜情况下一氧化碳的平衡
转化率为75%,则平衡时CO、HO(g)、CO、H 的平衡物质的量分别为0.25mol、0.25mol、0.75mol、
2 2 2
0.75mol,可计算出此温度下平衡常数K=3;有膜情况下一氧化碳的平衡转化率为90%,则平衡时CO、
HO(g)、CO、H 的平衡物质的量分别为0.1mol、0.1mol、0.9mol、0.9mol(a口和b口总量,其中只有a口
2 2 2
的处于平衡体系),设a口产生的H 的物质的量为xmol,则 ,解得x=0.1,则出口a产生的
2
为0.1mol,出口b的 为0.9mol-0.1mol=0.8mol,质量比为1:8;
(3)①电解时,一氧化碳和水从均从阳极口进入,阳极一氧化碳转化为二氧化碳,则氢气要在阴极产生,
故阳极产生二氧化碳的同时产生氢离子,氢离子通过固体电解质进入阴极附近得电子产生氢气,故固体电
解质应采用质子导体;
②电解时,阴极发生还原反应,电极反应式为: ;
③根据三段式:
,出口Ⅰ处气体为 体积为x,进口Ⅰ处的气体体积为
,则 ,CO的转化率为: 。
32.(2022·湖南卷)2021年我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。回答下列问题:
(1)在一定温度下,向体积固定的密闭容器中加入足量的C(s)和1molH O(g),起始压强为0.2MPa时,发生
2
下列反应生成水煤气:
Ⅰ.C(s)+H O(g)⇌ CO(g)+H (g) ΔH =+131.4kJmol-1
2 2 1
Ⅱ.CO(g)+H O(g)⇌ CO (g)+H (g) ΔH =-41.1kJmol-1
2 2 2 2
①下列说法正确的是_______;
A.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
2
C.平衡时H 的体积分数可能大于
2 3D.将炭块粉碎,可加快反应速率
②反应平衡时,H O(g)的转化率为50%,CO的物质的量为0.1mol。此时,整个体系_______(填“吸收”
2
或“放出”)热量_______kJ,反应Ⅰ的平衡常数K =_______(以分压表示,分压=总压×物质的量分数)。
p
(2)一种脱除和利用水煤气中CO 方法的示意图如下:
2
①某温度下,吸收塔中K CO 溶液吸收一定量的CO 后,c
CO2-
:c
HCO-
=1:2,则该溶液的pH=
2 3 2 3 3
_______(该温度下H CO 的K =4.6107,K 5.01011 );
2 3 al a2
②再生塔中产生CO 的离子方程式为_______;
2
③利用电化学原理,将CO 电催化还原为C H ,阴极反应式为_______。
2 2 4
【答案】(1) BD 吸收 31.2 0.02MPa
Δ
(2) 10 2 CO↑+ +H O 2CO+12e-+12H+=C H+4H O、AgCl+e-=Ag+Cl-
HCO- 2 CO2- 2 2 2 4 2
3 3
【解析】(1)①A.在恒温恒容条件下,平衡时向容器中充入情性气体不能改变反应混合物的浓度,因此反
应Ⅰ的平衡不移动,A说法不正确;
B.在反应中有固体C转化为气体,气体的质量增加,而容器的体积不变,因此气体的密度在反应过程中
不断增大,当混合气体的密度保持不变时,说明反应体系已达到平衡,B说法正确;
C.若C(s)和HO(g)完全反应全部转化为CO(g)和H(g),由C(s)+ 2H O(g) = CO (g)+ 2H (g)可知,H 的体
2 2 2 2 2 2 2
2
积分数的极值为 ,由于可逆反应只有一定的限度,反应物不可能全部转化为生成物,因此,平衡时H 的
3 2
2
体积分数不可能大于 ,C说法不正确;
3
D.将炭块粉碎可以增大其与HO(g)的接触面积,因此可加快反应速率,D说法正确;
2
综上所述,相关说法正确的是BD。
②反应平衡时,HO(g)的转化率为50%,则水的变化量为0.5mol,水的平衡量也是0.5mol,由于CO的物
2
质的量为0.1mol,则根据O原子守恒可知CO 的物质的量为0.2mol,生成0.2mol CO 时消耗了0.2mol
2 2
CO,故在反应Ⅰ实际生成了0.3molCO。根据相关反应的热化学方程式可知,生成0.3mol CO要吸收热量
39.42kJ ,生成0.2mol CO 要放出热量8.22kJ此时,因此整个体系吸收热量39.42kJ-8.22kJ=31.2kJ;由H原
2
子守恒可知,平衡时H 的物质的量为0.5mol,CO的物质的量为0.1mol,CO 的物质的量为0.2mol,水的
2 2
物质的量为0.5mol,则平衡时气体的总物质的量为0.5mol+0.1mol+0.2mol+0.5mol=1.3mol,在同温同体积条件下,气体的总压之比等于气体的总物质的量之比,则平衡体系的总压为0.2MPa1.3=0.26MPa,反应I
0.1 0.5
1.3 1.3 0.1
(C(s)+HO(g) CO(g)+H(g))的平衡常数K = P 0.26MPa0.02MPa。
2 2 p 0.5 总 1.3
噲垐�� 1.3
c(CO2)c(H)
(2)①某温度下,吸收塔中KCO 溶液吸收一定量的CO 后,c( ):c( )=1:2,由K 3
2 3 2 CO2 HCO a2 c(HCO)
3 3 3
c(HCO-)
可知, = 3 K 25.010-11molL-1 1.010-10molL-1 ,则该溶液的pH=10;
c(H) c(CO2-) a2
3
Δ
②再生塔中KHCO 受热分解生成KCO、HO和CO,该反应的离子方程式为2 CO↑+
3 2 3 2 2 HCO- 2 CO2-
3 3
+H O;
2
③利用电化学原理,将CO 电催化还原为C H,阴极上发生还原反应,阳极上水放电生成氧气和H+,H+通
2 2 4
过质子交换膜迁移到阴极区参与反应生成乙烯,铂电极和Ag/AgCl电极均为阴极,在电解过程中AgCl可
以转化为Ag,则阴极的电极反应式为2CO+12e-+12H+=C H+4H O、AgCl+e-=Ag+Cl-。
2 2 4 2
33.(2022·山东卷)利用 丁内酯(BL)制备1, 丁二醇(BD),反应过程中伴有生成四氢呋喃(THF)和
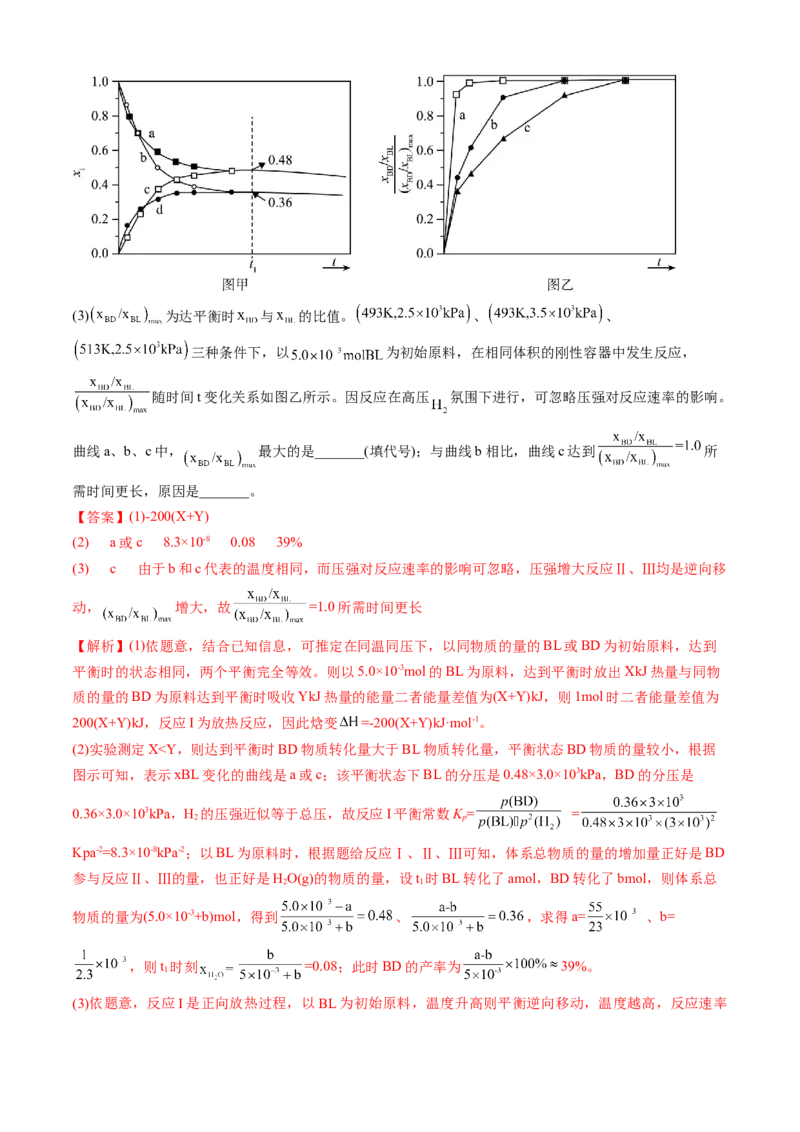
丁醇(BuOH)的副反应,涉及反应如下:
已知:①反应Ⅰ为快速平衡,可认为不受慢反应Ⅱ、Ⅲ的影响;②因反应Ⅰ在高压 氛围下进行,故
压强近似等于总压。回答下列问题:
(1)以 或BD为初始原料,在 、 的高压 氛围下,分别在恒压容器中进行
反应。达平衡时,以BL为原料,体系向环境放热 ;以BD为原料,体系从环境吸热 。忽略副反应
热效应,反应Ⅰ焓变 _______ 。
(2)初始条件同上。 表示某物种i的物质的量与除 外其它各物种总物质的量之比, 和 随时间t
变化关系如图甲所示。实验测得 ,则图中表示 变化的曲线是_______;反应Ⅰ平衡常数
_______ (保留两位有效数字)。以BL为原料时, 时刻 _______,BD产率=_______(保留两位
有效数字)。(3) 为达平衡时 与 的比值。 、 、
三种条件下,以 为初始原料,在相同体积的刚性容器中发生反应,
随时间t变化关系如图乙所示。因反应在高压 氛围下进行,可忽略压强对反应速率的影响。
曲线a、b、c中, 最大的是_______(填代号);与曲线b相比,曲线c达到 所
需时间更长,原因是_______。
【答案】(1)-200(X+Y)
(2) a或c 8.3×10-8 0.08 39%
(3) c 由于b和c代表的温度相同,而压强对反应速率的影响可忽略,压强增大反应Ⅱ、Ⅲ均是逆向移
动, 增大,故 =1.0所需时间更长
【解析】(1)依题意,结合已知信息,可推定在同温同压下,以同物质的量的BL或BD为初始原料,达到
平衡时的状态相同,两个平衡完全等效。则以5.0×10-3mol的BL为原料,达到平衡时放出XkJ热量与同物
质的量的BD为原料达到平衡时吸收YkJ热量的能量二者能量差值为(X+Y)kJ,则1mol时二者能量差值为
200(X+Y)kJ,反应I为放热反应,因此焓变 =-200(X+Y)kJ·mol-1。
(2)实验测定X”“<”或“=”)。
②反应常在较高温度下进行,该措施的优缺点是 。
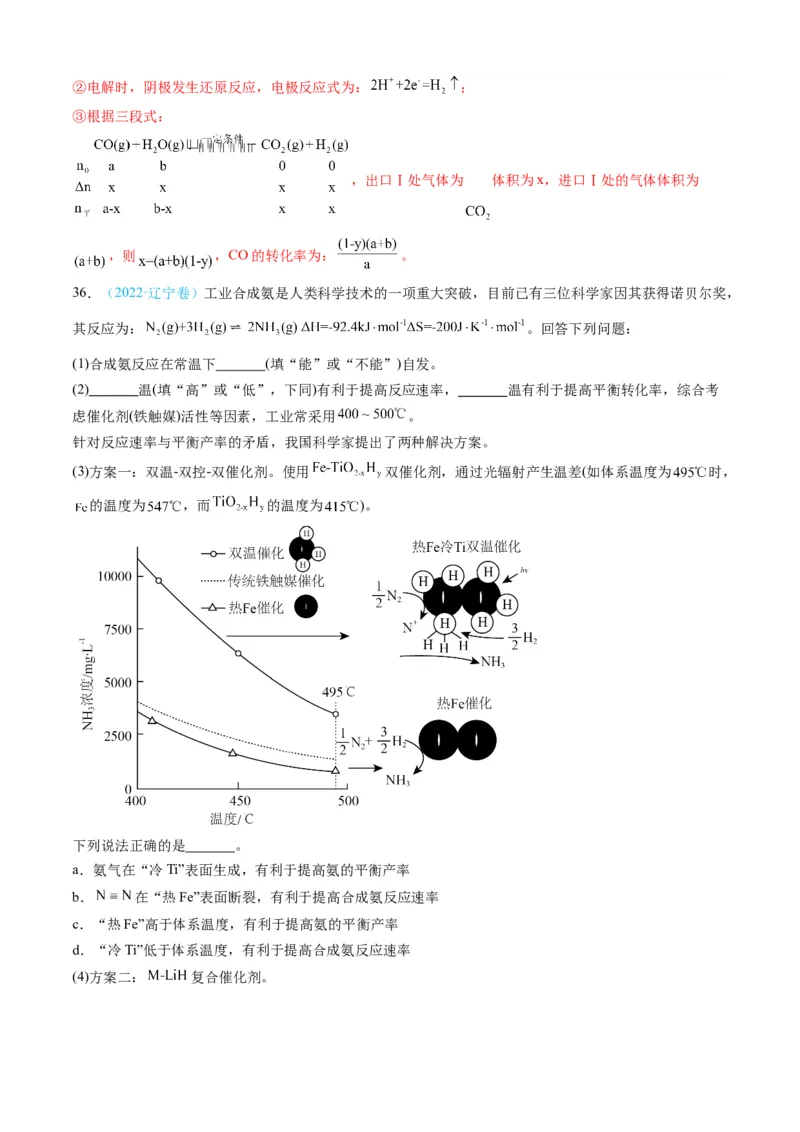
(2)该反应常在Pd膜反应器中进行,其工作原理如图所示。
①利用平衡移动原理解释反应器存在Pd膜时具有更高转化率的原因是 。
②某温度下,H 在Pd膜表面上的解离过程存在如下平衡: ,其正反应的活化能远小于逆反应的
2
活化能。下列说法错误的是 。
A.Pd膜对气体分子的透过具有选择性
B.过程2的△H>0
C.加快Pd膜内H原子迁移有利于H 的解离
2
D.H原子在Pd膜表面上结合为H 的过程为放热反应
2
③同温同压下,等物质的量的CO和HO通入无Pd膜反应器,CO的平衡转化率为75%;若换成Pd膜反应
2
器,CO的平衡转化率为90%,则相同时间内出口a和出口b中H 的质量比为 。
2
(3)该反应也可采用电化学方法实现,反应装置如图所示。①固体电解质采用 (填“氧离子导体”或“质子导体”)。
②阴极的电极反应式为 。
③同温同压下,相同时间内,若进口Ⅰ处n(CO):n(H O)=a:b,出口Ⅰ处气体体积为进口Ⅰ处的y倍,则
2
CO的转化率为 (用a,b,y表示)。
【答案】(1) 优点是升高温度,反应速率较快;缺点是正反应为放热反应,升高温度,平
衡逆向移动,产物的转化率较低
(2) Pd膜能选择性分离出H,平衡正向移动,平衡转化率增大 BD 1:8
2
(3) 质子导体
【详解】(1)①根据表中的数据,温度越高,平衡常数越小,所以正反应为放热反应, ;
②优点是升高温度,反应速率较快;缺点是正反应为放热反应,升高温度,平衡逆向移动,产物的转化率
较低;
(2)①Pd膜能选择性分离出H,平衡正向移动,平衡转化率增大;
2
②A.Pd膜只允许 通过,不允许 通过,对气体分子的透过具有选择性,A正确;
B.过程正反应的活化能远小于逆反应的活化能, ,B错误;
C.加快Pd膜内H原子迁移,平衡 正向移动,有利于 的解离,C正确;
D. 为放热过程,H原子在Pd膜表面上结合为 的过程为吸热反应,D错误;
故选BD;
③根据反应 ,设通入的 为1mol,无膜情况下一氧化碳的平衡
转化率为75%,则平衡时CO、HO(g)、CO、H 的平衡物质的量分别为0.25mol、0.25mol、0.75mol、
2 2 2
0.75mol,可计算出此温度下平衡常数K=9;有膜情况下一氧化碳的平衡转化率为90%,则平衡时CO、
HO(g)、CO、H 的平衡物质的量分别为0.1mol、0.1mol、0.9mol、0.9mol(a口和b口总量,其中只有a口
2 2 2
的处于平衡体系),设a口产生的H 的物质的量为xmol,则 ,解得x=0.1,则出口a产生的
2
为0.1mol,出口b的 为0.9mol-0.1mol=0.8mol,质量比为1:8;
(3)①电解时,一氧化碳和水从均从阳极口进入,阳极一氧化碳转化为二氧化碳,则氢气要在阴极产生,
故阳极产生二氧化碳的同时产生氢离子,氢离子通过固体电解质进入阴极附近得电子产生氢气,故固体电
解质应采用质子导体;②电解时,阴极发生还原反应,电极反应式为: ;
③根据三段式:
,出口Ⅰ处气体为 体积为x,进口Ⅰ处的气体体积为
,则 ,CO的转化率为: 。
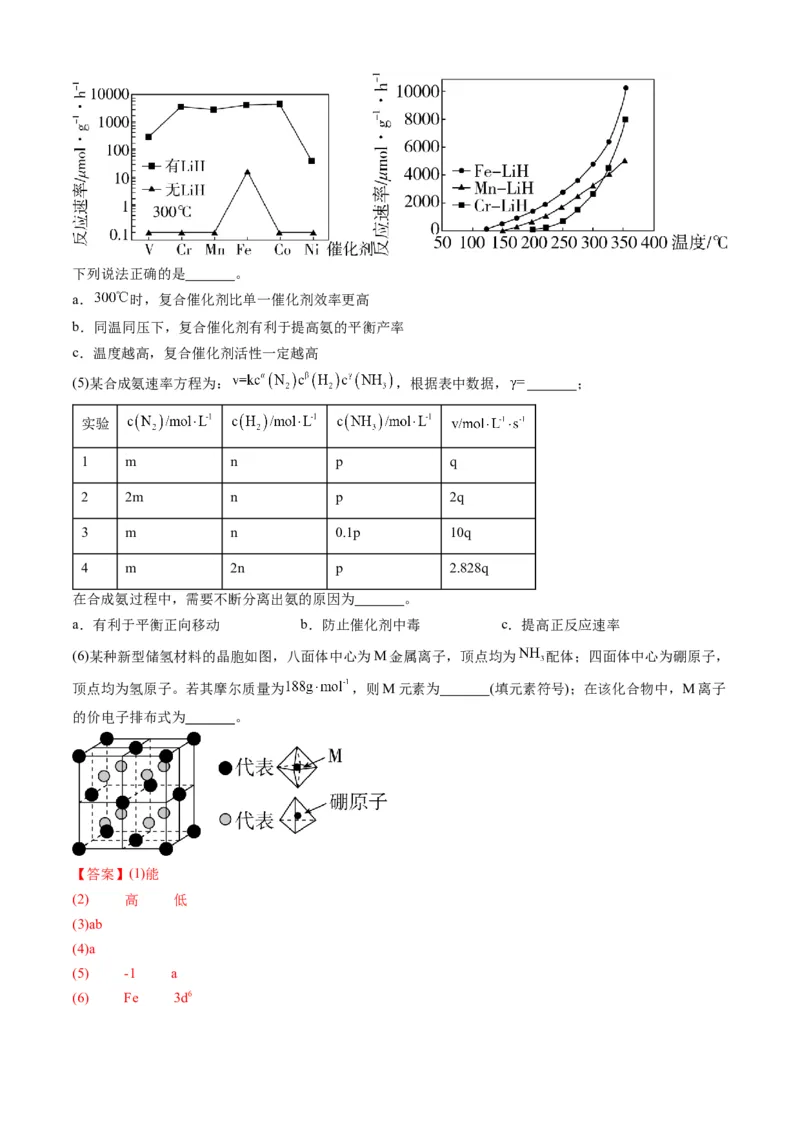
36.(2022·辽宁卷)工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,
其反应为: 。回答下列问题:
(1)合成氨反应在常温下 (填“能”或“不能”)自发。
(2) 温(填“高”或“低”,下同)有利于提高反应速率, 温有利于提高平衡转化率,综合考
虑催化剂(铁触媒)活性等因素,工业常采用 。
针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
(3)方案一:双温-双控-双催化剂。使用 双催化剂,通过光辐射产生温差(如体系温度为 时,
的温度为 ,而 的温度为 )。
下列说法正确的是 。
a.氨气在“冷Ti”表面生成,有利于提高氨的平衡产率
b. 在“热Fe”表面断裂,有利于提高合成氨反应速率
c.“热Fe”高于体系温度,有利于提高氨的平衡产率
d.“冷Ti”低于体系温度,有利于提高合成氨反应速率
(4)方案二: 复合催化剂。下列说法正确的是 。
a. 时,复合催化剂比单一催化剂效率更高
b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
(5)某合成氨速率方程为: ,根据表中数据, ;
实验
1 m n p q
2 2m n p 2q
3 m n 0.1p 10q
4 m 2n p 2.828q
在合成氨过程中,需要不断分离出氨的原因为 。
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
(6)某种新型储氢材料的晶胞如图,八面体中心为M金属离子,顶点均为 配体;四面体中心为硼原子,
顶点均为氢原子。若其摩尔质量为 ,则M元素为 (填元素符号);在该化合物中,M离子
的价电子排布式为 。
【答案】(1)能
(2) 高 低
(3)ab
(4)a
(5) -1 a
(6) Fe 3d6【详解】(1) ,则∆G=∆H-
T∆S=(-92.4+0.2×298) kJ∙mol-1=-32.4 kJ∙mol-1<0,所以合成氨反应在常温下能自发进行。答案为:能;
(2)温度越高,反应速率越快,所以高温有利于提高反应速率;因为正反应为放热反应,所以低温有利
于提高平衡转化率。答案为:高;低;
(3)a.因为正反应为放热反应,所以低温有利于平衡正向移动,氨气在“冷Ti”表面生成,有利于提高氨
的平衡产率,a正确;
b.温度升高,反应速率加快,所以 在“热Fe”表面断裂,有利于提高合成氨反应速率,b正确;
c.合成氨反应的正反应为放热反应,“热Fe”高于体系温度,不利于提高氨的平衡产率,c不正确;
d.温度升高,可提高合成氨反应的速率,所以“冷Ti”低于体系温度,不利于提高合成氨反应速率,d不
正确;
故选ab。答案为:ab;
(4)a.从图中可以看出, 时,复合催化剂比单一催化剂的反应速率快,催化效率更高,a正确;
b.催化剂只能改变反应速率,不能改变平衡产率,所以同温同压下,复合催化剂不能提高氨的平衡产率,
b不正确;
c.虽然图中显示温度高反应速率快,但温度高到一定程度后,复合催化剂活性就可能不变或变低,c不正
确;
故选a。答案为:a;
(5)选择实验1和3进行分析,此时 ,则γ=-1;
a.在合成氨过程中,需要不断分离出氨,有利于平衡正向移动,a正确;
b.氨是在该催化剂的催化作用下生成,不会使催化剂中毒,b不正确;
c.分离出氨,并没有增大反应物的浓度,所以不会提高正反应速率,c不正确;
故选a。答案为:-1;a;
(6)从图中信息可以进行以下计算:含黑球的数目为 =4,含白球的数目为8,则黑球与白球的
个数比为1:2。黑球的化学式为 ,白球的化学式为 。从而得出M+17×6+15×2=188,
M=56,则M元素为Fe;在该化合物中,Fe2+的价电子排布式为3d6。答案为:Fe;3d6。
【点睛】计算晶胞中所含微粒数目时,可采用均摊法。
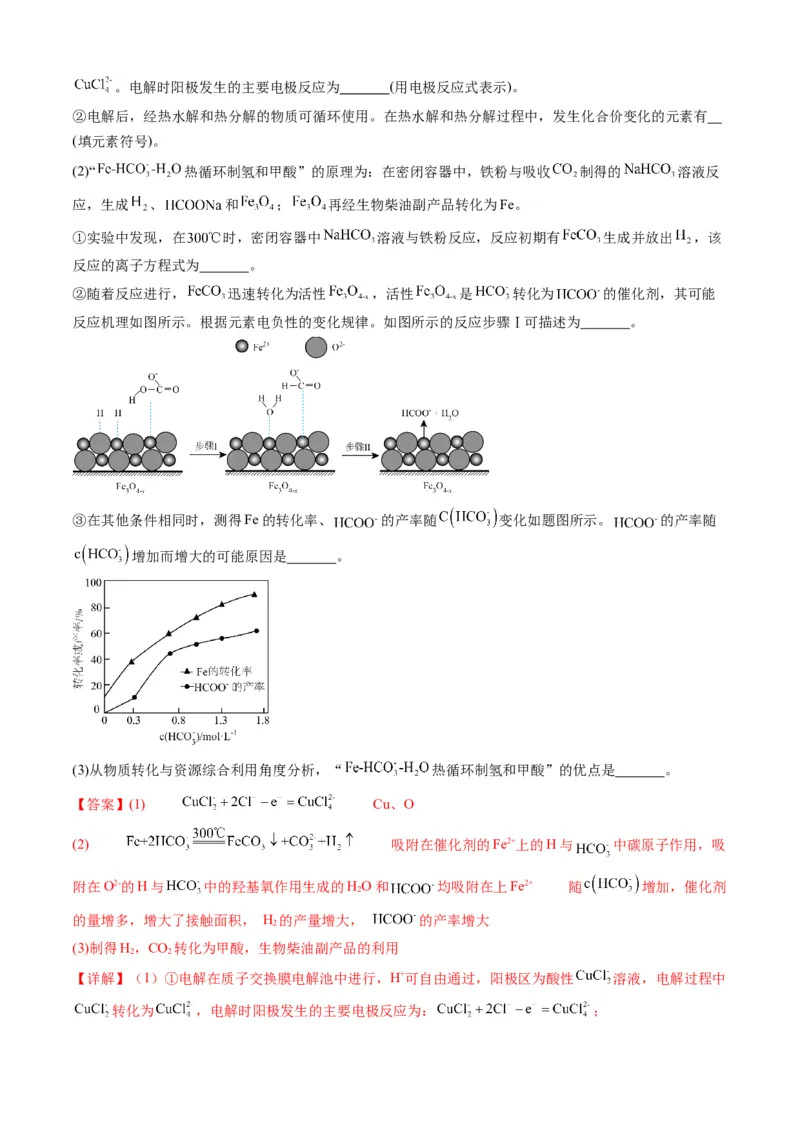
37.(2022·江苏卷)氢气是一种清洁能源,绿色环保制氢技术研究具有重要意义。
(1)“ 热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
①电解在质子交换膜电解池中进行。阳极区为酸性 溶液,阴极区为盐酸,电解过程中 转化为。电解时阳极发生的主要电极反应为 (用电极反应式表示)。
②电解后,经热水解和热分解的物质可循环使用。在热水解和热分解过程中,发生化合价变化的元素有
(填元素符号)。
(2)“ 热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收 制得的 溶液反
应,生成 、 和 ; 再经生物柴油副产品转化为Fe。
①实验中发现,在 时,密闭容器中 溶液与铁粉反应,反应初期有 生成并放出 ,该
反应的离子方程式为 。
②随着反应进行, 迅速转化为活性 ,活性 是 转化为 的催化剂,其可能
反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为 。
③在其他条件相同时,测得Fe的转化率、 的产率随 变化如题图所示。 的产率随
增加而增大的可能原因是 。
(3)从物质转化与资源综合利用角度分析,“ 热循环制氢和甲酸”的优点是 。
【答案】(1) Cu、O
(2) 吸附在催化剂的Fe2+上的H与 中碳原子作用,吸
附在O2-的H与 中的羟基氧作用生成的HO和 均吸附在上Fe2+ 随 增加,催化剂
2
的量增多,增大了接触面积, H 的产量增大, 的产率增大
2
(3)制得H,CO 转化为甲酸,生物柴油副产品的利用
2 2
【详解】(1)①电解在质子交换膜电解池中进行,H+可自由通过,阳极区为酸性 溶液,电解过程中
转化为 ,电解时阳极发生的主要电极反应为: ;②电解后,经热水解得到的HCl和热分解得到的CuCl等物质可循环使用,从图中可知,热分解产物还有
O,从详解①中得知,进入热水解的物质有 ,故发生化合价变化的元素有Cu、O。
2
(2)①在 时,密闭容器中 溶液与铁粉反应,反应初期有 生成并放出 ,离子方程
式为: ;
②H的电负性大于Fe,小于O,在活性 表面,部分H吸附在催化剂的亚铁离子上,略带负电;另
一部分H吸附在催化剂的氧离子上,略带正电;前者与 中略带正电的碳结合,后者与 中略带
负电的羟基氧结合生成HO, 转化为 ;故答案为:吸附在催化剂的Fe2+上的H与 中碳
2
原子作用,吸附在O2-的H与 中的羟基氧作用生成的HO和 均吸附在上Fe2+;
2
③在其他条件相同时,随 增加,其与铁粉反应加快,从图中得知Fe的转化率也增大,即生成
和H 的速率更快,量更大,则得到活性 的速度更快,量也更多,生成 的速率更快,
2
产率也更大。故答案为:随 增加,催化剂的量增多,增大了接触面积, H 的产量增大,
2
的产率增大;
(3)“ 热循环制氢和甲酸”系统将 转化为 和生成H 的速率快,原子利用率高,
2
不产生污染物,Fe初期生成 后迅速转化为活性 , 氧化为 再经生物柴油副产品转
化为Fe,得到循环利用,故该原理的优点是:制得H,CO 转化为甲酸,生物柴油副产品的利用。
2 2
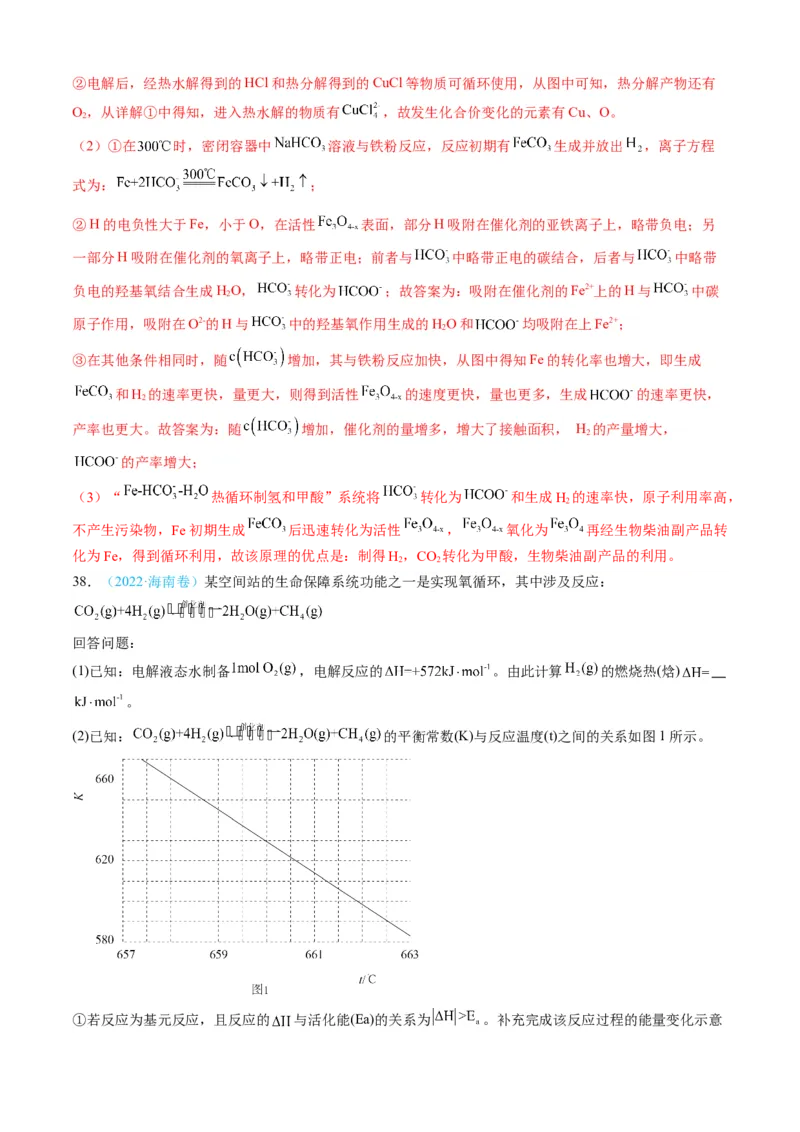
38.(2022·海南卷)某空间站的生命保障系统功能之一是实现氧循环,其中涉及反应:
回答问题:
(1)已知:电解液态水制备 ,电解反应的 。由此计算 的燃烧热(焓)
。
(2)已知: 的平衡常数(K)与反应温度(t)之间的关系如图1所示。
①若反应为基元反应,且反应的 与活化能(Ea)的关系为 。补充完成该反应过程的能量变化示意图(图2) 。
②某研究小组模拟该反应,温度t下,向容积为10L的抽空的密闭容器中通入 和 ,反
应平衡后测得容器中 。则 的转化率为 ,反应温度t约为 ℃。
(3)在相同条件下, 与 还会发生不利于氧循环的副反应:
,在反应器中按 通入反应物,在不同温度、
不同催化剂条件下,反应进行到2min时,测得反应器中 、 浓度( )如下表所示。
t=350℃ t=400℃
催化剂
催化剂
10.8 12722 345.2 42780
Ⅰ
催化剂
9.2 10775 34 38932
Ⅱ
在选择使用催化剂Ⅰ和350℃条件下反应, 生成 的平均反应速率为 ;
若某空间站的生命保障系统实际选择使用催化剂Ⅱ和400℃的反应条件,原因是 。
【答案】(1)-286
(2) 50%或0.5 660.2(或660.1或660.3,其他答案酌情给分)
(3) 5.4 相同催化剂,400℃的反应速率更快,相同温度,催化剂Ⅱ副产物浓度低,甲烷与甲醇比
例高
【详解】(1)电解液态水制备 ,电解反应的 ,由此可以判断,2mol 完
全燃烧消耗 ,生成液态水的同时放出的热量为572kJ ,故1mol 完全燃烧生成液态水放出的热量为286kJ,因此, 的燃烧热(焓) -286 。
(2)①由 的平衡常数(K)与反应温度(t)之间的关系图可知,K随
着温度升高而减小,故该反应为放热反应。若反应为基元反应,则反应为一步完成,由于反应的 与活
化能(Ea)的关系为 ,由图2信息可知 =a ,则 a ,该反应为放热反应,
生成物的总能量小于反应物的,因此该反应过程的能量变化示意图为: 。
②温度t下,向容积为10L的抽空的密闭容器中通入 和 ,反应平衡后测得容器中
,则 的转化率为 ,根据C元素守恒可知, 的平衡量为 ,
和 是按化学计量数之比投料的,则 的平衡量为 , 的平衡量是 的2倍,则
, 的平衡浓度分别为 、 、
、 ,则该反应的平衡常数K= ,根据图1中的信息可知,反应
温度t约为660.2℃。
(3)在选择使用催化剂Ⅰ和350℃条件下反应,由表中信息可知, 的浓度由0增加到
10.8 ,因此, 生成 的平均反应速率为 ;由表中信
息可知,在选择使用催化剂Ⅰ和350℃条件下反应, 的浓度由0增加到10.8
,, : =12722:10.8 1178;在选择使用催化剂Ⅱ和350℃的反应条件下,
的浓度由0增加到9.2 , : =10775:9.2 1171;在选择使用催化剂Ⅰ和
400℃条件下反应, 的浓度由0增加到345.2 , : =42780:345.2
124;在选择使用催化剂Ⅱ和400℃的反应条件下, 的浓度由0增加到34 ,
: =38932:34 1145。因此,若某空间站的生命保障系统实际选择使用催化剂Ⅱ和400℃
的反应条件的原因是:相同催化剂,400℃的反应速率更快,相同温度,催化剂Ⅱ副产物浓度低,甲烷与
甲醇比例高。
39.(2022·河北卷)氢能是极具发展潜力的清洁能源,以氢燃料为代表的燃料电池有良好的应用前景。
(1) 时, 燃烧生成 )放热 , 蒸发吸热 ,表示 燃烧热的热化学方程
式为 。
(2)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应。Ⅰ.
Ⅱ.
①下列操作中,能提高 平衡转化率的是 (填标号)。
A.增加 用量 B.恒温恒压下通入惰性气体
C.移除 D.加入催化剂
②恒温恒压条件下,1molCH (g)和1molH O(g)反应达平衡时, 的转化率为 , 的物质的量
4 2
为 ,则反应Ⅰ的平衡常数 (写出含有α、b的计算式;对于反应
, ,x为物质的量分数)。其他条件不变, 起始量
增加到 ,达平衡时, ,平衡体系中 的物质的量分数为 (结果保留两位有效
数字)。
(3)氢氧燃料电池中氢气在 (填“正”或“负”)极发生反应。
(4)在允许 自由迁移的固体电解质燃料电池中, 放电的电极反应式为 。
(5)甲醇燃料电池中,吸附在催化剂表面的甲醇分子逐步脱氢得到CO,四步可能脱氢产物及其相对能量如
图,则最可行途径为a→ (用 等代号表示)。
【答案】(1)H (g)+ O (g)=HO(1) H= -286 kJ•mol-1
2 2 2
(2) BC 43%
(3)负
(4)C H -(6n+2)e-+ (3n+1) O2-=n CO+(n+1) HO
n 2n+2 2 2
(5)a b e h j【详解】(1)298K时,1gH 燃烧生成HO(g)放热121 kJ,则1molH 燃烧生成HO(g)放热 =242kJ,
2 2 2 2
用热化学方程式表示为:H(g)+ O(g)=HO(g) H= -242 kJ•mol-1①,又因为1 mol H O(1)蒸发吸热
2 2 2 1 2
44kJ,则HO(g)= H O(l) H= -44 kJ•mol-1②,根据盖斯定律可知,表示H 燃烧热的反应热为 H= H+
2 2 2 2 1
H= -286 kJ•mol-1,故答案为:H(g)+ O (g)=HO(1) H= -286 kJ•mol-1;
2 2 2 2
(2)①A.增加CH (g)用量可以提高HO(g)的转化率,但是CH(g)平衡转化率减小,A不符合题意;
4 2 4
B.恒温恒压下通入惰性气体,相当于减小体系压强,反应混合物中各组分的浓度减小,反应Ⅰ的化学平
衡正向移动,能提高CH(g)平衡转化率,B符合题意;
4
C.移除CO(g),减小了反应混合物中CO(g)的浓度,反应Ⅰ的化学平衡正向移动,能提高CH(g)平衡转化
4
率,C符合题意;
D.加入催化剂不能改变平衡状态,故不能提高CH(g)平衡转化率,D不符合题意;
4
综上所述,上述操作中,能提高CH(g)平衡转化率的是BC;
4
②恒温恒压条件下,1 mol CH (g)和1 mol H O(g)反应达平衡时,CH (g)的转化率为α,CO (g)的物质的
4 2 4 2
量为b mol,则转化的CH (g)为α mol,剩余的CH (g)为(1-α)mol,根据C元素守恒可知,CO(g)的物质的
4 4
量为(α-b)mol,根据H和O守恒可知,HO(g)的物质的量为(1-α-b)mol,H(g)的物质的量为(3α+b)mol,则
2 2
反应混合物的总物质的量为(2α+2)mol,平衡混合物中,CH(g)、HO(g)、 CO(g) 、H(g)的物质的量分数
4 2 2
分别为 、 、 、 ,因此,反应I的平衡常数K=
x
;其他条件不变,HO(g)起始量增加到5mol,达平衡时,
2
α=0.90,b =0.65,则平衡时,CH (g)为0.1mol,根据C元素守恒可知,CO(g)的物质的量为0.25mol,,根
4
据H和O守恒可知,HO(g)的物质的量为(5-0.90-0.65 )mol=3.45mol,H(g)的物质的量为
2 2
(3α+b )mol=3.35mol,平衡混合物的总物质的量为(2α+6 )mol=7.8mol,平衡体系中H(g)的物质的量分数为
2
;
(3)燃料电池中的燃料在负极发生氧化反应,因此,氢氧燃料电池中氢气在负极发生反应;
(4)在允许O2-自由迁移的固体电解质燃料电池中,C H 在负极发生氧化反应生成CO 和HO,电极反
n 2n+2 2 2
应式为C H -(6n+2)e-+ (3n+1) O2-=nCO +(n+1) HO;
n 2n+2 2 2
(5)由图示可知,吸附在催化剂表面的甲醇分子逐步脱氢得到CO,且能垒越低,活化能越小,越容易进
行,根据图示可知,其可行的途径为:a b e h j。
40.(2022·浙江卷)主要成分为 的工业废气的回收利用有重要意义。
(1)回收单质硫。将三分之一的 燃烧,产生的 与其余 混合后反应:
。在某温度下达到平衡,测得密闭系统中各组分浓度分别为、 、 ,计算该温度下的平衡常数
。
(2)热解 制 。根据文献,将 和 的混合气体导入石英管反应器热解(一边进料,另一边出料),
发生如下反应:
Ⅰ
Ⅱ
总反应:
Ⅲ
投料按体积之比 ,并用 稀释;常压,不同温度下反应相同时间后,测得 和
体积分数如下表:
105
温度/ 950 1000 1100 1150
0
0.5 1.5 3.6 5.5 8.5
0.0 0.0 0.1 0.4 1.8
请回答:
①反应Ⅲ能自发进行的条件是 。
②下列说法正确的是 。
A.其他条件不变时,用Ar替代 作稀释气体,对实验结果几乎无影响
B.其他条件不变时,温度越高, 的转化率越高
C.由实验数据推出 中的 键强于 中的 键
D.恒温恒压下,增加 的体积分数, 的浓度升高
③若将反应Ⅲ看成由反应Ⅰ和反应Ⅱ两步进行,画出由反应原料经两步生成产物的反应过程能量示意图
。
④在 ,常压下,保持通入的 体积分数不变,提高投料比 , 的转化率不变,
原因是 。
⑤在 范围内(其他条件不变), 的体积分数随温度升高发生变化,写出该变化规律并分
析原因 。【答案】(1)8×108 L·mol-1
(2) 高温 AB 1000℃时CH 不参与反应,相同分压的HS经历
4 2
相同的时间转化率相同 先升后降;在低温段,以反应Ⅰ为主,随温度升高,S(g)的体积分数增大;
2
在高温段,随温度升高;反应Ⅱ消耗S 的速率大于反应Ⅰ生成S 的速率,S(g)的体积分数减小
2 2 2
【详解】(1)根据方程式可知该温度下平衡常数K=
;
(2)①根据盖斯定律可知Ⅰ+Ⅱ即得到反应Ⅲ的ΔH=234kJ/mol,这说明反应Ⅲ是吸热的体积增大(即ΔS
>0)的反应,根据ΔG=ΔH-TΔS<0可自发进行可知反应Ⅲ自发进行的条件是高温下自发进行;
②A.Ar是稀有气体,与体系中物质不反应,所以其他条件不变时,用Ar替代N 作稀释气体,对实验结
2
果几乎无影响,A正确;
B.正反应吸热,升高温度平衡正向进行,温度越高,HS的转化率越高,B正确;
2
C.根据表中数据无法得出HS中S-H键和CH 中C-H键的相对强弱,事实上C-H键的键能大于S-H键键
2 4
能,C错误;
D.恒温恒压下,增加N 的体积分数,相当于减压,平衡正向进行,H 的物质的量增加,容器容积增加,
2 2
H 浓度减小,D错误;
2
答案选AB;
③反应I、反应Ⅱ和反应Ⅲ均是吸热反应,则反应过程能量示意图可表示为
;
④根据表中数据可知1000℃时CH 不参与反应,相同分压的HS经历相同的时间转化率相同,所以在
4 2
1000℃常压下,保持通入的HS体积分数不变,提高投料比时HS的转化率不变;
2 2
⑤根据表中数据可知在低温段,以反应Ⅰ为主,随温度升高,S(g)的体积分数增大;在高温段,随温度升
2
高;反应Ⅱ消耗S 的速率大于反应Ⅰ生成S 的速率,S(g)的体积分数减小,因此变化规律是先升后降。
2 2 2
41.(2022·浙江卷)工业上,以煤炭为原料,通入一定比例的空气和水蒸气,经过系列反应可以得到满足
不同需求的原料气。请回答:
(1)在C和O 的反应体系中:
2
反应1:C(s)+O(g)=CO (g) ΔH =-394kJ·mol-1
2 2 1
反应2:2CO(g)+O(g)=2CO (g) ΔH =-566kJ·mol-1
2 2 2
反应3:2C(s)+O(g)=2CO(g) ΔH 。
2 3① 设y=ΔH-TΔS,反应1、2和3的y随温度的变化关系如图1所示。图中对应于反应3的线条是
。
②一定压强下,随着温度的升高,气体中CO与CO 的物质的量之比 。
2
A.不变 B.增大 C.减小 D.无法判断
(2)水煤气反应:C(s)+HO(g)=CO(g)+H (g) ΔH=131kJ·mol-1。工业生产水煤气时,通常交替通入合适量的空
2 2
气和水蒸气与煤炭反应,其理由是 。
(3)一氧化碳变换反应:CO(g)+HO(g)=CO(g)+H(g) ΔH=-41kJ·mol-1。
2 2 2
①一定温度下,反应后测得各组分的平衡压强(即组分的物质的量分数×总压):p(CO)=0.25MPa、
p(H O)=0.25MPa、p(CO)=0.75MPa和p(H )=0.75MPa,则反应的平衡常数K的数值为 。
2 2 2
②维持与题①相同的温度和总压,提高水蒸气的比例,使CO的平衡转化率提高到90%,则原料气中水蒸
气和CO的物质的量之比为 。
③生产过程中,为了提高变换反应的速率,下列措施中合适的是 。
A.反应温度愈高愈好 B.适当提高反应物压强
C.选择合适的催化剂 D.通入一定量的氮气
④以固体催化剂M催化变换反应,若水蒸气分子首先被催化剂的活性表面吸附而解离,能量-反应过程如
图2所示。
用两个化学方程式表示该催化反应历程(反应机理):步骤Ⅰ: ;步骤Ⅱ: 。
【答案】(1) a B
(2)水蒸气与煤炭反应吸热,氧气与煤炭反应放热,交替通入空气和水蒸气有利于维持体系热量平衡,保持
较高温度,有利于加快化学反应速率
(3) 9.0 1.8:1 BC M+H O=MO+H MO+CO=M+CO
2 2 2
【详解】(1)①由已知方程式:(2×反应1-反应2)可得反应3,结合盖斯定律得:
,反应1前后气体分子数不变,升温y不变,对应线
条b,升温促进反应2平衡逆向移动,气体分子数增多,熵增,y值增大,对应线条c,升温促进反应3平衡逆向移动,气体分子数减少,熵减, y值减小,对应线条a,故此处填a;
②温度升高,三个反应平衡均逆向移动,由于反应2焓变绝对值更大,故温度对其平衡移动影响程度大,
故CO 物质的量减小,CO物质的量增大,所以CO与CO 物质的量比值增大,故答案选B;
2 2
(2)由于水蒸气与煤炭反应吸热,会引起体系温度的下降,从而导致反应速率变慢,不利于反应的进行,
通入空气,利用煤炭与O 反应放热从而维持体系温度平衡,维持反应速率,故此处填:水蒸气与煤炭反应
2
吸热,氧气与煤炭反应放热,交替通入空气和水蒸气有利于维持体系热量平衡,保持较高温度,有利于加
快反应速率;
(3)①该反应平衡常数K= ;
②假设原料气中水蒸气为x mol,CO为1 mol,由题意列三段式如下:
,则平衡常数K= ,解得x=1.8,故水蒸气与CO
物质的量之比为1.8:1;
③A.反应温度过高,会引起催化剂失活,导致反应速率变慢,A不符合题意;
B.适当增大压强,可加快反应速率,B符合题意;
C.选择合适的催化剂有利于加快反应速率,C符合题意;
D.若为恒容条件,通入氮气对反应速率无影响,若为恒压条件,通入氮气后,容器体积变大,反应物浓
度减小,反应速率变慢,D不符合题意;
故答案选BC;
④水分子首先被催化剂吸附,根据元素守恒推测第一步产生 H ,第二步吸附CO产生CO ,对应反应历程
2 2
依次为:M+HO=MO+H 、MO+CO=M+CO 。
2 2 2