文档内容
四川省2026年普通高中学业水平选择性考试·第二阶段学情调研测试
化 学 试 题
一、单选题(共15小题,每小题3分,共45分)
1.下列叙述错误的是
A.实验室用镊子夹取钠且剩余的钠可以放回原试剂瓶
B.当火灾现场存放有大量金属钠时不能用水来灭火
C.氯气泄漏应及时将人群逆风转移到地势较高的地方
D.久置氯水漂白性增强
2.下列化学用语或图示正确的是
A.小苏打电离方程式:
B.乙烯的最简式:
C.中子数为12的氖核素:
D.用电子式表示CsCl的形成过程:
3.下列实验操作和现象与结论的关系不相符的是
A B C D
向蔗糖溶液中加入稀硫酸,水浴加热
操 将一小块钠分别投 蔗糖中加入浓硫 向盛有
作 入盛有水和乙醇的 酸,蔗糖逐渐变 一段时间后,再加入新制
固体的锥形瓶中
现 小烧杯中,钠与乙 黑并有刺激性气
滴加稀盐酸,产 悬浊液,用酒精灯加热,未见砖红色
象 醇反应要平缓得多 味的气体产生
生无色气体 沉淀
乙醇羟基中的氢原 不能证明氯元素
结 浓硫酸具有脱水
子不如水分子中的 的非金属性强于 蔗糖未水解
论 性和氧化性
氢原子活泼 碳元素
4.设 为阿伏加德罗常数的值。下列说法正确的是
A.1 mol 中σ键的个数为
B.22.4 L二氧化硫溶于水,溶液中 、 、 的数目总和为
C.1 mol (Cr的化合价为+6)含过氧键的数目为
D.常温下,向100 mL 18 mol·L-1浓硫酸中加入足量的Cu,该过程转移电子的数目为
5.要除去下列物质中的少量杂质(括号内为杂质),下列实验方案设计中,合理的是
A. :将气体先通入氢氧化钠溶液,再通过浓硫酸
B.NaCl溶液 (NaOH):加入过量的 溶液
C. 溶液 :通入适量氯气
D. 溶液 :滴加适量盐酸
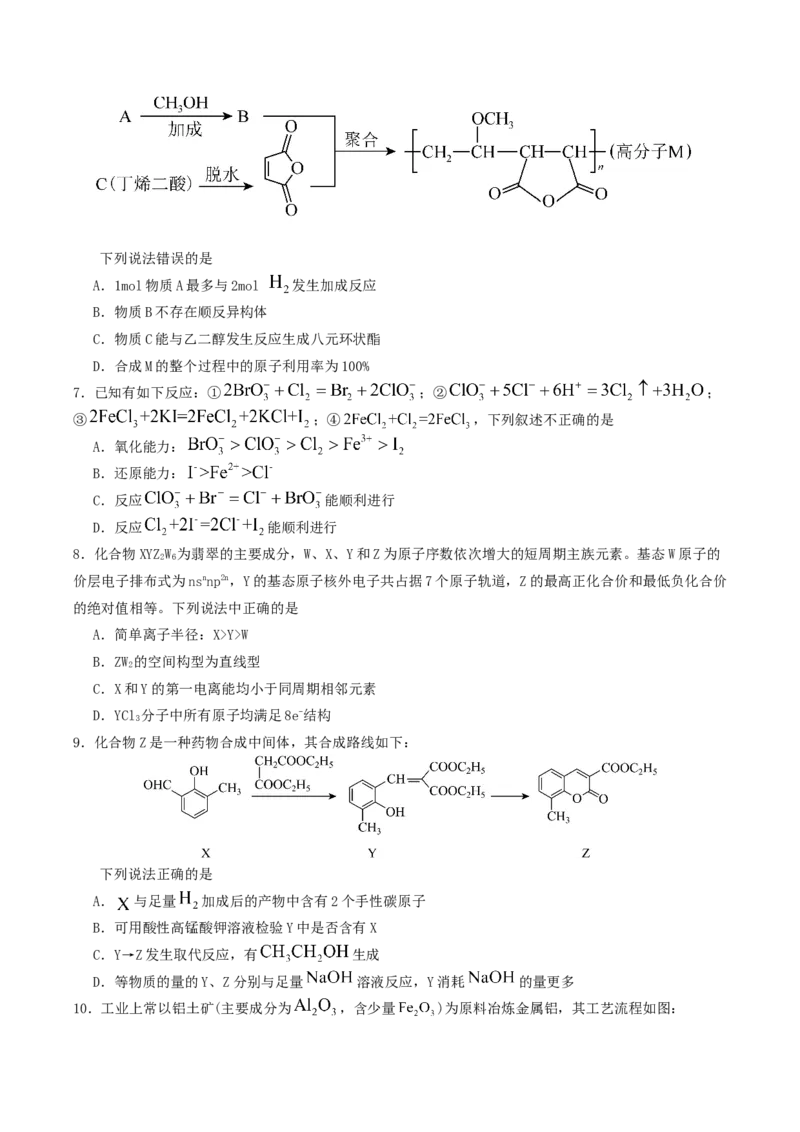
6.高分子M广泛用于牙膏、牙科粘合剂等口腔护理产品中,其合成路线如图所示。下列说法错误的是
A.1mol物质A最多与2mol 发生加成反应
B.物质B不存在顺反异构体
C.物质C能与乙二醇发生反应生成八元环状酯
D.合成M的整个过程中的原子利用率为100%
7.已知有如下反应:① ;② ;
③ ;④ ,下列叙述不正确的是
A.氧化能力:
B.还原能力:
C.反应 能顺利进行
D.反应 能顺利进行
8.化合物XYZW 为翡翠的主要成分,W、X、Y和Z为原子序数依次增大的短周期主族元素。基态W原子的
2 6
价层电子排布式为nsnnp2n,Y的基态原子核外电子共占据7个原子轨道,Z的最高正化合价和最低负化合价
的绝对值相等。下列说法中正确的是
A.简单离子半径:X>Y>W
B.ZW 的空间构型为直线型
2
C.X和Y的第一电离能均小于同周期相邻元素
D.YCl 分子中所有原子均满足8e-结构
3
9.化合物Z是一种药物合成中间体,其合成路线如下:
下列说法正确的是
A. 与足量 加成后的产物中含有2个手性碳原子
B.可用酸性高锰酸钾溶液检验Y中是否含有X
C.Y→Z发生取代反应,有 生成
D.等物质的量的Y、Z分别与足量 溶液反应,Y消耗 的量更多
10.工业上常以铝土矿(主要成分为 ,含少量 )为原料冶炼金属铝,其工艺流程如图:(已知:Na[Al(OH)]+CO=Al(OH)↓+NaHCO)下列说法不正确的是
4 2 3 3
A.“溶解”时发生反应的离子方程式为
B.“过滤1”中所得滤渣的主要成分为红褐色
C.“酸化”时不能用 代替
D.图中所示转化的反应中,只有一个属于氧化还原反应
11.以 和 为原料制备高纯度次氯酸的机理如图, 为元素钒,其最高化合价为+5价,
、 为氨基酸,下列说法错误的是
A.该机理中化合物 是中间产物
B.反应过程中,钒的成键数目发生了改变
C.该催化循环过程中有氢氧键的断裂和形成
D.制备机理的总反应的离子方程式为:
12.下列有关阿伏加德罗常数 的说法正确的是
A.常温常压下, 中的分子总数小于
B.常温常压下,24 g由乙炔和苯组成的混合物中含 个C原子
C.标准状况下,2.8 g硅单质中含有的共价键数目为
D. 中含有 键数目为
13.下列方法不能达到除杂的目的的是
选项 物质(括号内为杂质) 除杂试剂(均适量) 操作方法
A CO(HCl) 饱和碳酸氢钠溶液 洗气
2
B Cl(HCl) NaOH溶液 洗气
2
C MgCl(MgSO) BaCl 溶液 充分反应,过滤,保留滤液
2 4 2
D NaOH溶液(NaCO) Ca(OH) 溶液 充分反应,过滤,保留滤液
2 3 2
14.一种主要成分是FeTiO 的钛铁矿含少量FeO、AlO、SiO 杂质,以该钛铁矿为原料生产TiO 的工艺流
3 2 3 2 2
程如图所示(部分步骤、条件和产物已省略)。已知:TiOSO 极易水解生成TiO(OH) 沉淀。下列说法正确的
4 2
是A.“滤液1”中阴离子主要是 和OH-
B.“操作X”为蒸发浓缩、冷却结晶
C.“调pH”加入铁粉可以防止Fe2+被氧化
D.“灼烧”时必须隔绝空气
15.铁镁合金是一种新型储氢材料,立方晶胞类似于CaF,结构如图所示。该合金储氢后H 位于晶胞的体
2 2
心和棱心位置(晶胞图中未画出),晶胞参数为apm, 为阿伏加德罗常数的值。下列说法错误的是
A.该合金的化学式为:FeMg
2
B.1cm3该合金的质量为:
C.熔融该合金的过程中需要破坏金属键
D.储氢后晶体中的原子个数之比
二、解答题(共4小题,16题13分,17~19题各14分,共55分)
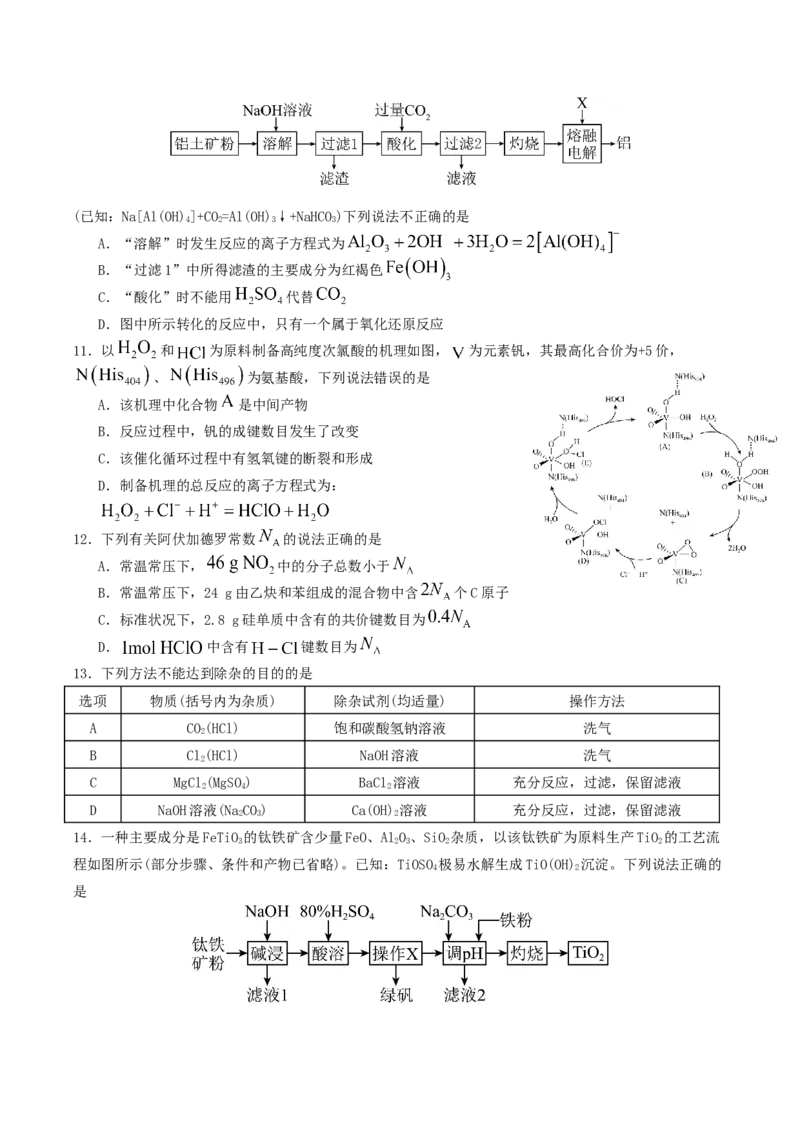
16.某科研人员以废镍催化剂(主要成分为NiO,另含FeO、CaO、CuO、BaO)为原料回收镍,工艺流程如
2 3
图。
已知:常温下,有关氢氧化物开始沉淀和沉淀完全的 如表。
氢氧化物
开始沉淀的 1.5 6.5 7.7
沉淀完全的 3.7 9.7 9.2
回答下列问题:(1)为提高浸取效率,可采取的措施是 。
(2)浸出渣主要成分为 、 。(填化学式)
(3)“除铜”时, 将 氧化为S的反应离子方程式为 。
(4)“氧化”的目的是将溶液中氧 化为 ,写出该反应的离子方程式 。温度需控制在
之间,该步骤温度不能太高的原因是 。
(5)“调 ”时, 的控制范围为 。
(6)“除钙”后,若溶液中F-浓度为 ,则 。[已知常温下,
]
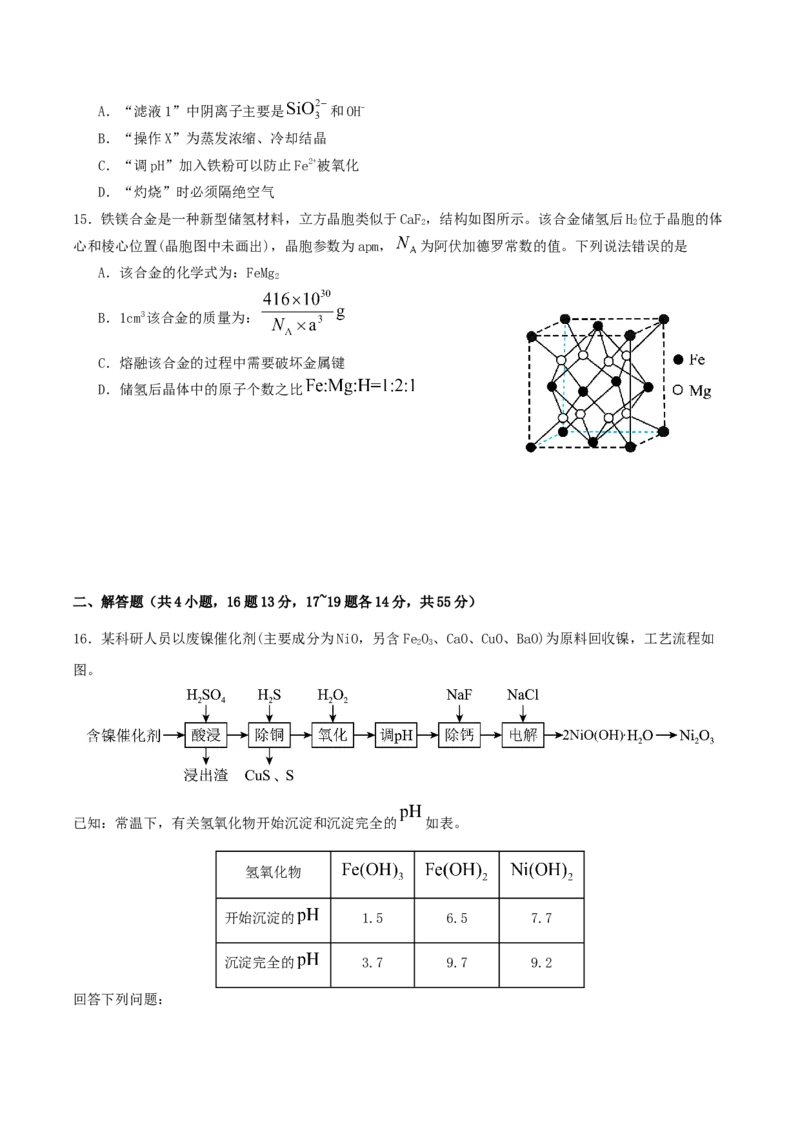
17.镉及其化合物在工业上应用广泛。某地所产的铜镉渣主要含有Cd、CdO,还含有Cu、Zn、Pb、Fe、MnO
和SiO 等杂质,从铜镉渣中回收镉的某种工艺流程如图所示:
2
已知:部分金属离子开始沉淀和完全沉淀的pH如表所示。
Zn2 Cd2 Fe2 Pb2 Cu2 Fe3
金属离子
+ + + + + +
开始沉淀时(c = 0.01 mol⋅L-1) 8.2 7.8 7.5 6.7 5.2 2.2
完全沉淀时(c = 1.0×10-5
9.7 9.3 9.0 8.5 6.7 3.2
mol⋅L-1)
回答下列问题:
(1)Pb为第六周期ⅣA族元素,其价电子排布式为 ;Cd与Zn同族且相邻,则Cu、Zn、Cd、Fe、Mn
五种金属元素中属于ds区的有 种。
(2)为提高“酸浸”速率,可采取的措施是 ;“滤渣Ⅰ”中含有PbSO,写出Pb与稀硫酸生成PbSO
4 4
的反应的离子方程式: 。(3)加入石灰乳调节pH=5后再加入KMnO 氧化,“氧化”时KMnO 的还原产物是MnO,该步骤中Fe2+反应的
4 4 2
离子方程式为 。
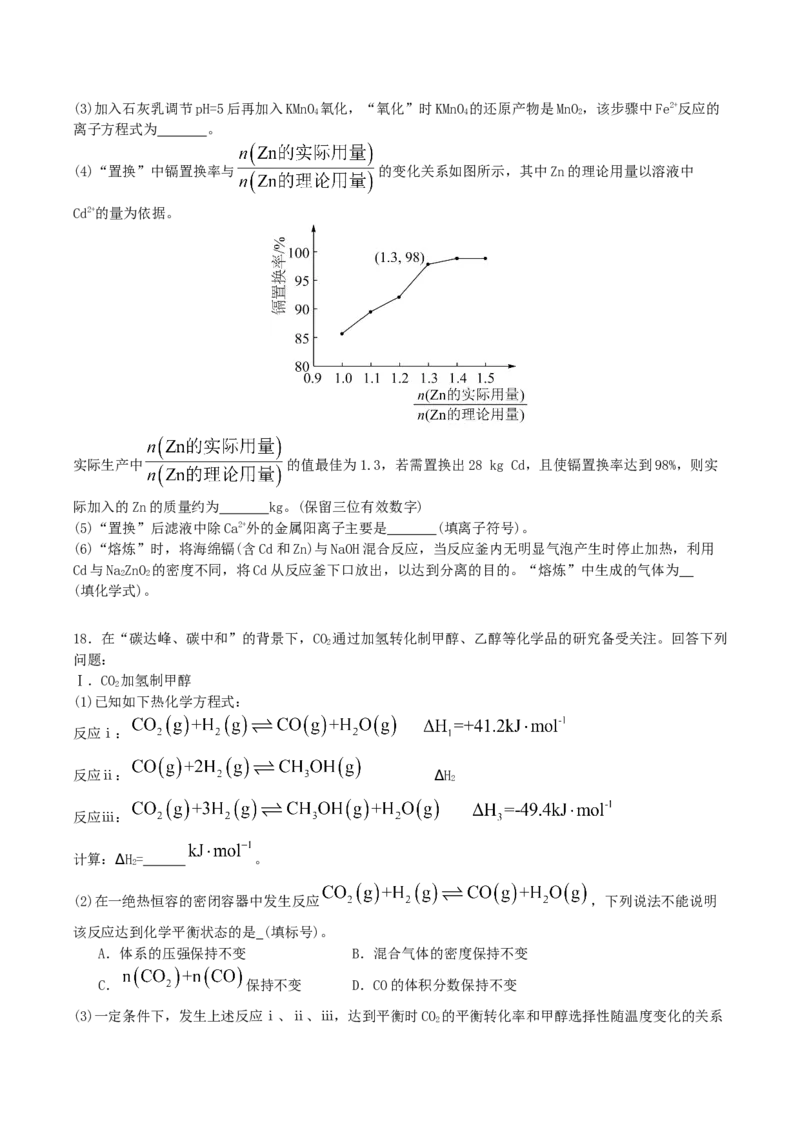
(4)“置换”中镉置换率与 的变化关系如图所示,其中Zn的理论用量以溶液中
Cd2+的量为依据。
实际生产中 的值最佳为1.3,若需置换出28 kg Cd,且使镉置换率达到98%,则实
际加入的Zn的质量约为 kg。(保留三位有效数字)
(5)“置换”后滤液中除Ca2+外的金属阳离子主要是 (填离子符号)。
(6)“熔炼”时,将海绵镉(含Cd和Zn)与NaOH混合反应,当反应釜内无明显气泡产生时停止加热,利用
Cd与NaZnO 的密度不同,将Cd从反应釜下口放出,以达到分离的目的。“熔炼”中生成的气体为
2 2
(填化学式)。
18.在“碳达峰、碳中和”的背景下,CO 通过加氢转化制甲醇、乙醇等化学品的研究备受关注。回答下列
2
问题:
Ⅰ.CO 加氢制甲醇
2
(1)已知如下热化学方程式:
反应ⅰ:
反应ⅱ: ∆H
2
反应ⅲ:
计算:∆H= 。
2
(2)在一绝热恒容的密闭容器中发生反应 ,下列说法不能说明
该反应达到化学平衡状态的是 (填标号)。
A.体系的压强保持不变 B.混合气体的密度保持不变
C. 保持不变 D.CO的体积分数保持不变
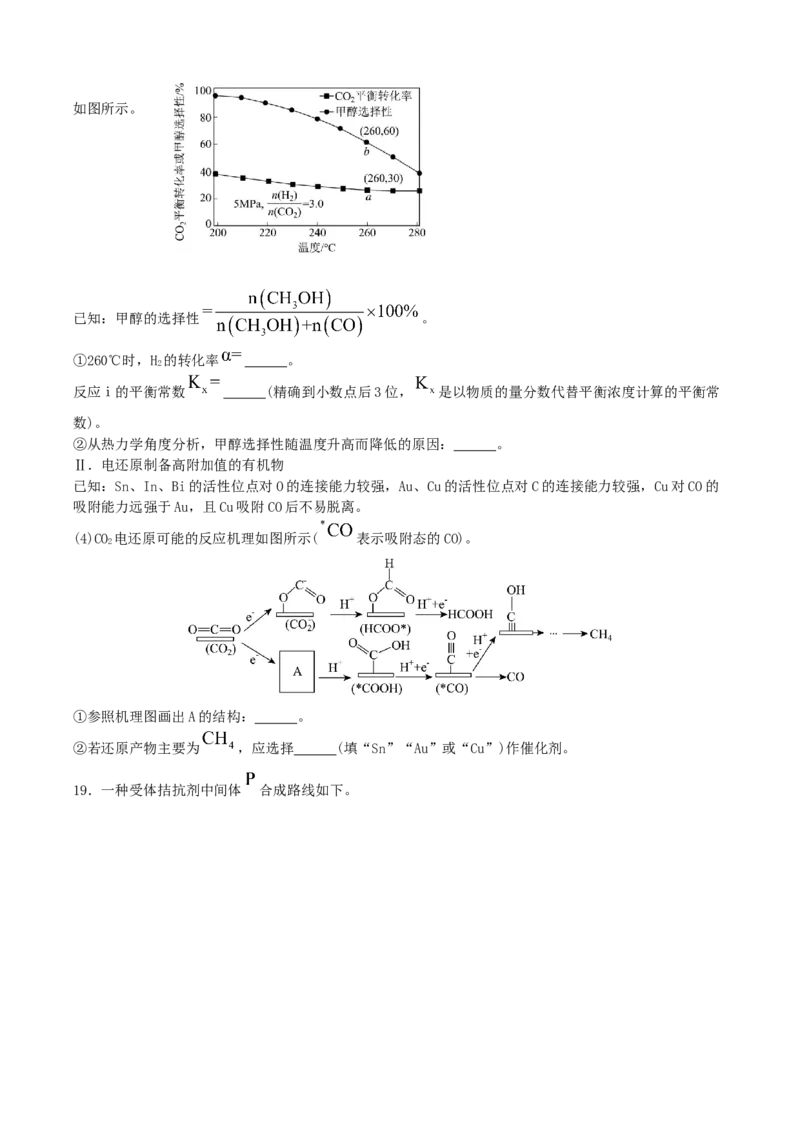
(3)一定条件下,发生上述反应ⅰ、ⅱ、ⅲ,达到平衡时CO 的平衡转化率和甲醇选择性随温度变化的关系
2如图所示。
已知:甲醇的选择性 。
①260℃时,H 的转化率 。
2
反应ⅰ的平衡常数 (精确到小数点后3位, 是以物质的量分数代替平衡浓度计算的平衡常
数)。
②从热力学角度分析,甲醇选择性随温度升高而降低的原因: 。
Ⅱ.电还原制备高附加值的有机物
已知:Sn、In、Bi的活性位点对O的连接能力较强,Au、Cu的活性位点对C的连接能力较强,Cu对CO的
吸附能力远强于Au,且Cu吸附CO后不易脱离。
(4)CO 电还原可能的反应机理如图所示( 表示吸附态的CO)。
2
①参照机理图画出A的结构: 。
②若还原产物主要为 ,应选择 (填“Sn”“Au”或“Cu”)作催化剂。
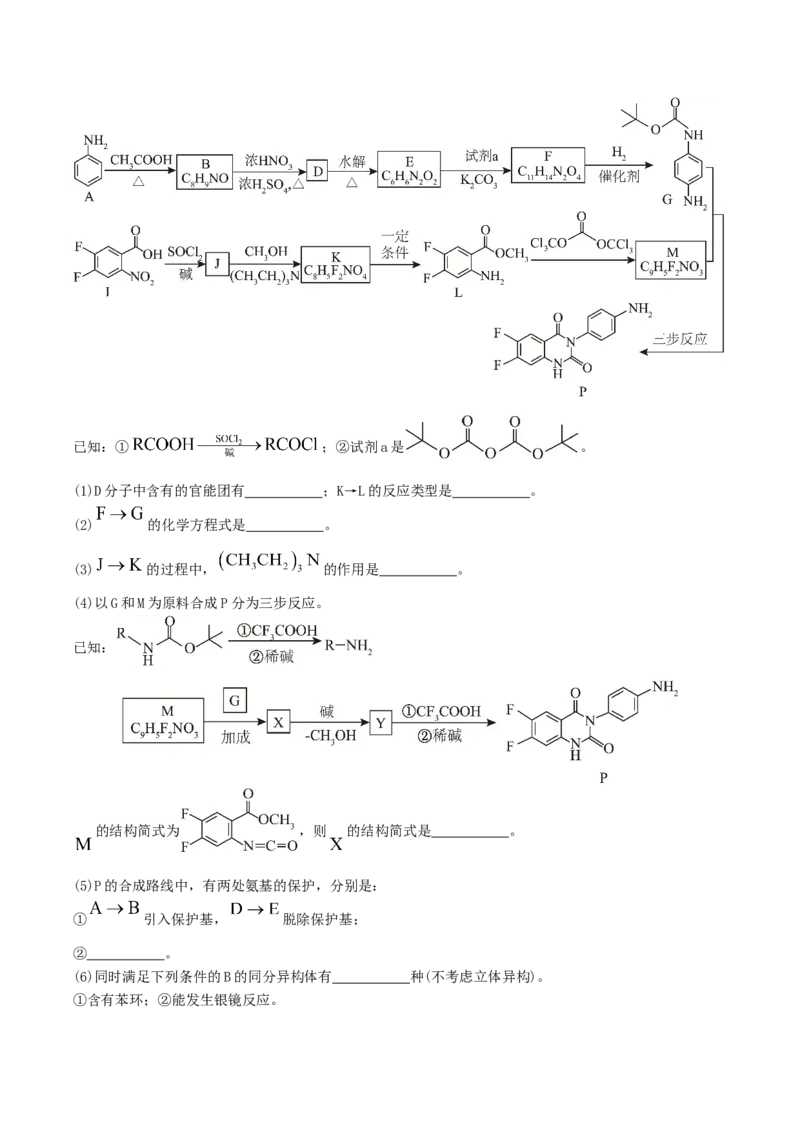
19.一种受体拮抗剂中间体 合成路线如下。已知:① ;②试剂a是 。
(1)D分子中含有的官能团有 ;K→L的反应类型是 。
(2) 的化学方程式是 。
(3) 的过程中, 的作用是 。
(4)以G和M为原料合成P分为三步反应。
已知:
的结构简式为 ,则 的结构简式是 。
(5)P的合成路线中,有两处氨基的保护,分别是:
① 引入保护基, 脱除保护基;
② 。
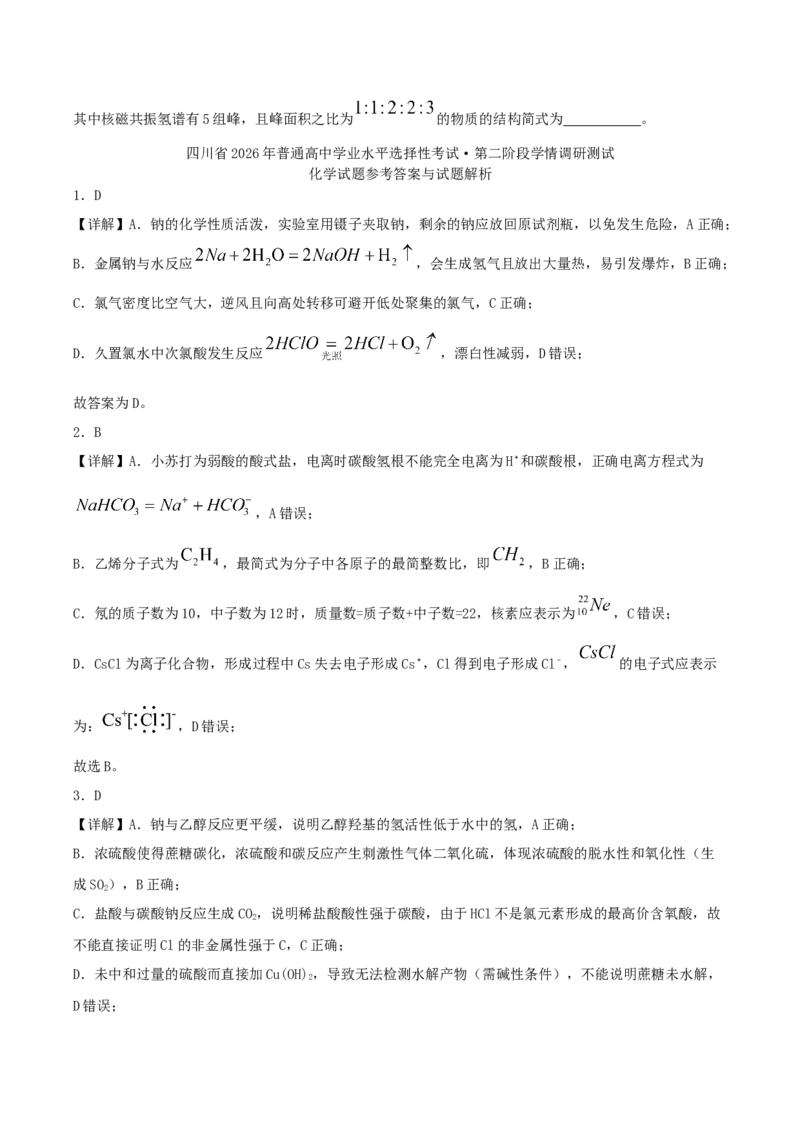
(6)同时满足下列条件的B的同分异构体有 种(不考虑立体异构)。
①含有苯环;②能发生银镜反应。其中核磁共振氢谱有5组峰,且峰面积之比为 的物质的结构简式为 。
四川省2026年普通高中学业水平选择性考试·第二阶段学情调研测试
化学试题参考答案与试题解析
1.D
【详解】A.钠的化学性质活泼,实验室用镊子夹取钠,剩余的钠应放回原试剂瓶,以免发生危险,A正确;
B.金属钠与水反应 ,会生成氢气且放出大量热,易引发爆炸,B正确;
C.氯气密度比空气大,逆风且向高处转移可避开低处聚集的氯气,C正确;
D.久置氯水中次氯酸发生反应 ,漂白性减弱,D错误;
故答案为D。
2.B
【详解】A.小苏打为弱酸的酸式盐,电离时碳酸氢根不能完全电离为H⁺和碳酸根,正确电离方程式为
,A错误;
B.乙烯分子式为 ,最简式为分子中各原子的最简整数比,即 ,B正确;
C.氖的质子数为10,中子数为12时,质量数=质子数+中子数=22,核素应表示为 ,C错误;
D.CsCl为离子化合物,形成过程中Cs失去电子形成Cs⁺,Cl得到电子形成Cl⁻, 的电子式应表示
为: ,D错误;
故选B。
3.D
【详解】A.钠与乙醇反应更平缓,说明乙醇羟基的氢活性低于水中的氢,A正确;
B.浓硫酸使得蔗糖碳化,浓硫酸和碳反应产生刺激性气体二氧化硫,体现浓硫酸的脱水性和氧化性(生
成SO),B正确;
2
C.盐酸与碳酸钠反应生成CO,说明稀盐酸酸性强于碳酸,由于HCl不是氯元素形成的最高价含氧酸,故
2
不能直接证明Cl的非金属性强于C,C正确;
D.未中和过量的硫酸而直接加Cu(OH),导致无法检测水解产物(需碱性条件),不能说明蔗糖未水解,
2
D错误;故选D。
4.C
【详解】A.每个NH 分子含有3个N-H σ键,4个NH 共12个;同时每个NH 与Cu2+形成1个配位键(σ
3 3 3
键),共4个;总σ键数为12+4=16,即1 mol [Cu(NH)]2+中σ键的个数为16N;A错误;
3 4 A
B.未指明气体状态是否为标准状况,无法计算含硫物质的数目,B错误;
C.CrO 中Cr的化合价为+6,则结构为CrO(O),含2个过氧键(O-O),即1 mol CrO 有2N个过氧键,C
5 2 2 5 A
正确;
D.由 可知,每消耗2 mol浓硫酸转移2 N电子,题目共有
A
1.8 mol浓硫酸,反应过程中生成水会稀释浓硫酸,即参与反应的浓硫酸小于1.8 mol,则转移电子数小于
1.8N,D错误;
A
故答案选C。
5.A
【详解】A. 中, 能被氢氧化钠溶液吸收,浓硫酸干燥后得到纯净CO,不引入新杂质,
方案合理,A正确;
B.NaCl溶液(NaOH)中加入过量 溶液,虽除去NaOH但引入过量 和 杂质,方案不
合理,B错误;
C. 溶液 中通入适量氯气,虽氧化 但引入 杂质,方案不合理,C错误;
D. 溶液 中滴加适量盐酸,虽转化 但引入NaCl杂质,方案不合理,D错
误;
故答案选A。
6.D
【详解】A.根据分析,A的结构为 ,为乙炔,含碳碳叁键,则1 mol 最多与2
mol 发生加成反应生成 ,A正确;
B.物质B的结构为CH=CHOCH,其碳碳双键的一端连接的是2个相同的H原子,无法形成顺反异构体,故
2 3
CH=CHOCH 不存在顺反异构体,B正确;
2 3C.物质C的结构为 ,能与 进行多元酯化生
成环状酯结构 ,属于八元环状酯,C正确;
D.合成M的整个过程中,由C脱水生成 时还有副产物 产生且后续未使用,则原子利用率未达
到100%,D错误;
故答案为:D。
7.C
【详解】A.根据反应①得出氧化性 ,反应②得出氧化性 ,反应④得出氧化性
,反应③得出氧化性 ,因此氧化能力顺序为 ,A
正确;
B.由反应③得出还原性 ,由反应④得出还原能力应为 ,因此还原能力顺序应为
,B正确;
C.反应 要顺利进行要求 的氧化性强于 ,但反应①已证明
,因此反应不能进行,C错误;
D.由反应③和④得出氧化性 ,因此 能氧化 为 ,因此反应 能顺利进
行,D正确;
故答案选C。
8.C
【详解】A.电子层数相同,核电荷数越大,半径越小;则简单离子半径: ,即,A错误;
B.ZW 为SiO,其结构为立体网状而非直线型,B错误;
2 2
C.Na的第一电离能小于同周期相邻的Mg,Al的第一电离能小于相邻的Mg和Si,C正确;
D.AlCl 中Al的价层电子数为6,未满足8e-结构,D错误;
3
故答案选C。
9.C
【详解】A.连接4个不同的原子或原子团的碳原子为手性碳原子,X与足量氢气加成后的产物中环上连接
支链的碳原子都是手性碳原子,有3个手性碳原子,A错误;
B.X、Y中酚羟基、甲基都能被酸性高锰酸钾氧化而使得溶液褪色,不可用酸性高锰酸钾溶液检验Y中是
否含有X,B错误;
C.结合质量守恒,Y中酚羟基和酯基发生取代反应生成Z和 ,C正确;
D.酯基水解生成的羧基、酚羟基都能和 以1:1反应,1molY最多消耗 ,Z中酯基
水解生成酚羟基、羧基和醇羟基, 最多消耗 ,D错误;
故答案选C。
10.B
【详解】A.AlO 为两性氧化物,与NaOH溶液反应生成四羟基合铝酸盐,离子方程式为:
2 3
,原子、电荷均守恒,故A正确;
B.FeO 为碱性氧化物,不与NaOH溶液反应,故滤渣主要成分为FeO,而非Fe(OH),故B错误;
2 3 2 3 3
C.“酸化”目的是将 转化为Al(OH) 沉淀,若用过量 ,Al(OH) 会继续溶解,无法
3 3
得到沉淀,故C正确;
D.图中所示转化的反应中,只有电解熔融氧化铝是氧化还原反应,故D正确;
答案选B。
11.A
【详解】A.化合物A先和HO 反应,经过一系列反应又生成了A,因此该机理中化合物A作催化剂,故A
2 2
错误;
B.反应过程中,A到B、B到C,D到E,钒的成键数改变了,故B正确;
C.A→B的反应过程中有氢氧键的断裂,C→D的反应过程中有氢氧键的生成,故C正确;D.根据图中的转化关系得到制备机理的总反应的方程式为: ,故D
正确。
故选A。
12.A
【详解】A.常温常压下,46 g 的物质的量为1 mol,但存在 的平衡,导致分子
总数减少,因此分子数小于 ,A正确;
B.乙炔( )和苯( )的最简式均为CH,24 g混合物中CH的物质的量为
,对应C原子数为 ,而非 ,B错误;
C.2.8 g Si的物质的量为0.1 mol,每个Si原子形成4个共价键,但每个键被两个原子共享,总键数为
,C错误;
D.HClO的结构为H-O-Cl,不存在H-Cl键,因此1 mol HClO中H-Cl键数目为0,D错误;
故选A。
13.B
【详解】A.CO 与饱和NaHCO 溶液不反应,HCl与饱和NaHCO 溶液反应生成CO,可除去CO 中的HCl且不
2 3 3 2 2
引入新杂质,A正确;
B.Cl 和HCl均能与NaOH反应,不能用氢氧化钠溶液除去氯气中的氯化氢气体,B错误;
2
C.MgSO 与BaCl 反应生成BaSO 沉淀和氯化镁,过滤后保留滤液,则加入适量氯化钡溶液,充分反应,过
4 2 4
滤,保留滤液,可除去氯化镁中的硫酸镁且不引入新的杂质,C正确;
D.NaCO 与Ca(OH) 生成CaCO 沉淀和NaOH,过滤后保留滤液,则加入适量的氢氧化钙溶液,充分反应,
2 3 2 3
过滤,保留滤液,可除去氢氧化钠溶液中的碳酸钠且不引入新的杂质,D正确;
故选B。
14.C
【详解】A.“滤液1”中阴离子主要是 、 和OH-,A错误;B.“操作X”为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,B错误;
C.调pH加入铁粉可以防止Fe2+被氧化,防止水解生成氢氧化铁沉淀引入杂质,C正确;
D.TiO(OH) 沉淀灼烧生成TiO 的反应为非氧化还原反应,生成的TiO 很稳定,不需要隔绝空气,D错误;
2 2 2
故选C。
15.D
【详解】A.该合金晶胞类似CaF 结构,CaF 中Ca2+为面心立方堆积(8× +6× = 4个),F-填充8个
2 2
四面体空隙(8个),化学式为CaF(1:2)。类比可知,Fe相当于Ca2+(4个/晶胞),Mg相当于F-(8
2
个/晶胞),Fe:Mg=4:8=1:2,化学式为FeMg,A正确;
2
B.1个晶胞质量为 g,晶胞体积为(a×10-10cm)3 = a³×10-30cm3,密度ρ=
g/cm3,故1cm3质量为 g,B正确;
C.合金属于金属材料,由金属键结合,熔融时需破坏金属键,C正确;
D.储氢后H 位于体心(1个)和棱心(12× =3个),共4个H 分子,含8个H原子。晶胞中Fe=4、
2 2
Mg=8,故Fe:Mg:H=4:8:8=1:2:2≠1:2:1,D错误;
故选D。
16.(1)将含镍催化剂粉碎、适当升高温度、适当增大HSO 的浓度等
2 4
(2) CaSO∙2HO BaSO
4 2 4
(3)2Fe3++HS=2Fe2++S↓+2H+
2
(4) 2Fe2++HO+2H+=2Fe3++2HO 温度太高,HO 受热易分解
2 2 2 2 2
(5)3.7≤pH<7.7
(6)1.0×10-3
【详解】(1)为提高浸取效率,可采取的措施是:将含镍催化剂粉碎、适当升高温度、适当增大HSO 的
2 4
浓度等。
(2)由分析可知,浸出渣主要成分为:CaSO∙2HO、BaSO。
4 2 4
(3)“除铜”时,Fe3+将HS氧化为S,Fe3+被还原为Fe2+,反应离子方程式为:2Fe3++HS=2Fe2++S↓+2H+。
2 2
(4)“氧化”的目的是将溶液中的Fe2+氧化为Fe3+,该反应的离子方程式为2Fe2++HO+2H+=2Fe3++2HO;
2 2 2HO 的热稳定性差,温度需控制在 之间,该步骤温度不能太高的原因是:温度太高,HO 受热
2 2 2 2
易分解。
(5)“调 ”时,应让Fe3+完全沉淀,而Ni2+不生成沉淀,则pH的控制范围为3.7≤pH<7.7。
(6)“除钙”后,若溶液中F-浓度为 ,则 = =
= =1.0×10-3。
17.(1) 6s26p2 3
(2) 将镉废渣粉碎、适当升高温度、适当增大稀硫酸的浓度、搅拌(任写一条即可)
(3)
(4)21.6
(5)K+、Zn2+
(6)H
2
【详解】(1)Pb在元素周期表的位置为第六周期ⅣA族,因此价电子排布式为 6s26p2;Cu、Zn、Cd三种
元素位于周期表ds区;
(2)提高“酸浸”速率措施有将镉废渣粉碎、适当升高温度、适当增大稀硫酸的浓度、搅拌等;Pb与稀
硫酸反应生PbSO 的离子方程式为 ;
4
(3)“氧化”时KMnO 的还原产物是MnO,Fe2+的氧化产物为Fe3+,由于之前已经加入石灰乳调节pH=5,
4 2
因此Fe3+沉淀为Fe(OH),反应的离子方程式为
3
;
(4)要得到28 kg Cd且镉置换率达到98%,需实际存在Cd的质量为 ,物质的量为,Zn置换Cd2+的离子方程式为 ,可得Cd与Zn物质的量之比为
1:1,所以Zn的质量为 ;
(5)“置换”后滤液中除Ca2+外,主要剩余的金属阳离子是K+和Zn2+;
(6)“熔炼”步骤中,Zn与NaOH发生反应放出的气体为H,化学方程式为
2
。
18.(1)-90.6
(2)BC
(3) 22% 0.022 由于反应ⅰ吸热,反应ⅱ、ⅲ放热,所以升高温度,反应ⅰ平衡正向移动,
反应ⅱ、ⅲ平衡逆向移动,甲醇的选择性降低
(4) Cu
19.(1) 硝基、酰胺基 还原反应
(2)
(3)吸收HCl,促进反应正向进行
(4)
(5)E→F引入保护基,Y→P脱除保护基
(6) 26