文档内容
2024 届高三 10 月质量检测
化学
全卷满分100分,考试时间90分钟.
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试卷和答题卡上,并将条形码粘贴在答题卡上的
指定位置.
2.请按题号顺序在答题卡上各题目的答题区域内作答,写在试卷、草稿纸和答题卡上的非答题
区域均无效.
3.选择题用2B铅笔在答题卡上把所选答案的标号涂黑;非选择题用黑色签字笔在答题卡上作
答;字体工整,笔迹清楚.
4.考试结束后,请将试卷和答题卡一并上交.
可能用到的相对原子质量:H 1 N 14 O 16 Na 23 S 32 Ca 40 Cr 52 Fe 56 Cu
64
一、选择题:本题共14小题,每小题3分,共42分.在每小题给出的四个选项中,只有一项
符合题目要求.
1.科学史上每一次重大的发现都极大地推进了科学的发展.下列对化学史的描述错误的是( )
A.门捷列夫制出第一张元素周期表 B.舍勒发现并确认了氯气
C.侯德榜改进了制纯碱的工艺 D.阿伏加德罗提出分子学说
2.下列物质中属于碱性氧化物的是( )
A. B. C. D.
3.下列各组物质相互反应,生成物不随反应条件或反应物的用量变化而变化的是( )
A. 和 B. 溶液和
C. 溶液和 溶液 D. 和
4.室温下,下列各组离子在指定溶液中能大量共存的是( )
A. 溶液中:
B.酸性溶液中:
C.澄清透明的溶液中:
D.使酚唒变红色的溶液中:
5.为除去括号内的杂质,所选用的试剂或方法错误的是( )
A. 固体粉末 :加热到固体质量不再减轻为止B. :将混合气体通过足量的饱和碳酸钠溶液
C. 溶液 :向溶液中通入足量的 气体
D. :将混合气体通过足量的饱和食盐水
6.下列有关物质的性质与用途具有对应关系的是( )
A. 溶液呈碱性,可用作生产普通玻璃的原料
B.氧化铝的熔点高,可用于电解铝
C.氢氧化铝具有弱酸性,可用于治疗胃酸过多
D.铁粉具有还原性,可用于食品袋中的抗氧化剂
7.根据实验操作及现象,下列结论正确的是( )
选
实验操作及现象 结论
项
A 向 溶液中滴加 溶液,生成的白色沉淀迅速变成灰绿色,过一段
有还原性
时间后变为红褐色
原溶液中一定含有
B
向某溶液中滴加 溶液,产生白色沉淀
原溶液中一定含有
C
向某溶液中滴加酸性 溶液,紫色褪去
原溶液中一定含有
D 向某溶液中加入盐酸产生无色气体,该气体能使澄清石灰水变浑浊
A.A B.B C.C D.D
8 . 通 入 的 氢 氧 化 钠 水 溶 液 中 , 能 同 时 发 生 以 下 两 个 反 应 ( 未 配 平 ) :
, ,反应完成后测得溶液中
与 的物质的量浓度之比为 ,则该溶液中 与 的物质的量之比为( )
A. B. C. D.
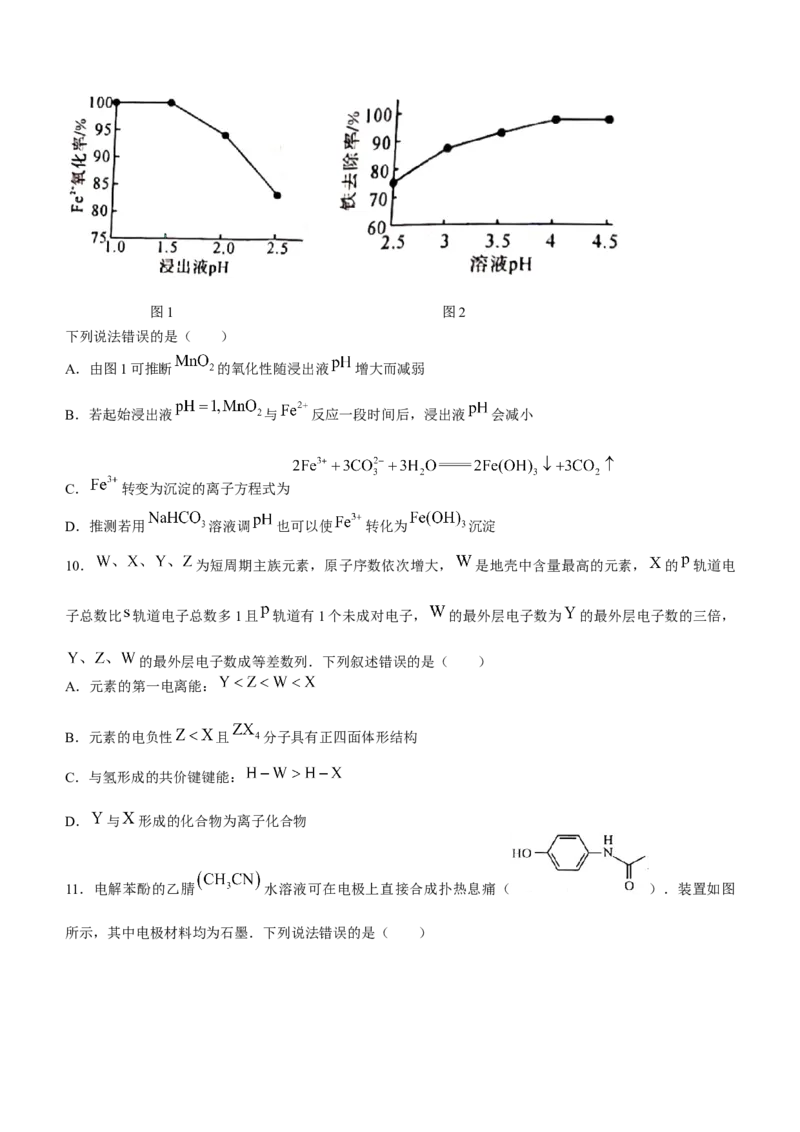
9.科研小组用氧化—沉淀法从废电池浸出液中去除铁:用 氧化废电池浸出液中的 (酸性条件下,
被还原为 ),再加适量 溶液调 使 转化为 沉腚.研究发现 对
氧化率和铁去除率的影响如图1和图2所示.图1 图2
下列说法错误的是( )
A.由图1可推断 的氧化性随浸出液 增大而减弱
B.若起始浸出液 与 反应一段时间后,浸出液 会减小
C. 转变为沉淀的离子方程式为
D.推测若用 溶液调 也可以使 转化为 沉淀
10. 为短周期主族元素,原子序数依次增大, 是地壳中含量最高的元素, 的 轨道电
子总数比 轨道电子总数多1且 轨道有1个未成对电子, 的最外层电子数为 的最外层电子数的三倍,
的最外层电子数成等差数列.下列叙述错误的是( )
A.元素的第一电离能:
B.元素的电负性 且 分子具有正四面体形结构
C.与氢形成的共价键键能:
D. 与 形成的化合物为离子化合物
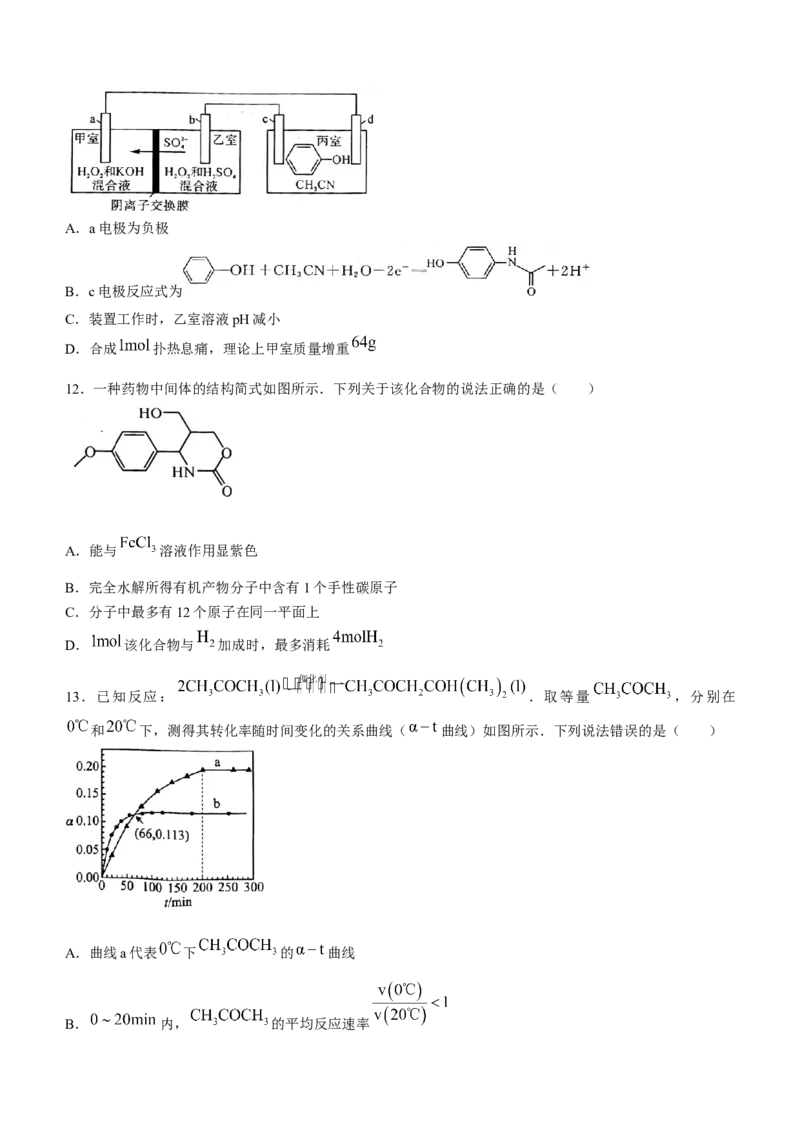
11.电解苯酚的乙腈 水溶液可在电极上直接合成扑热息痛( ).装置如图
所示,其中电极材料均为石墨.下列说法错误的是( )A.a电极为负极
B.c电极反应式为
C.装置工作时,乙室溶液pH减小
D.合成 扑热息痛,理论上甲室质量增重
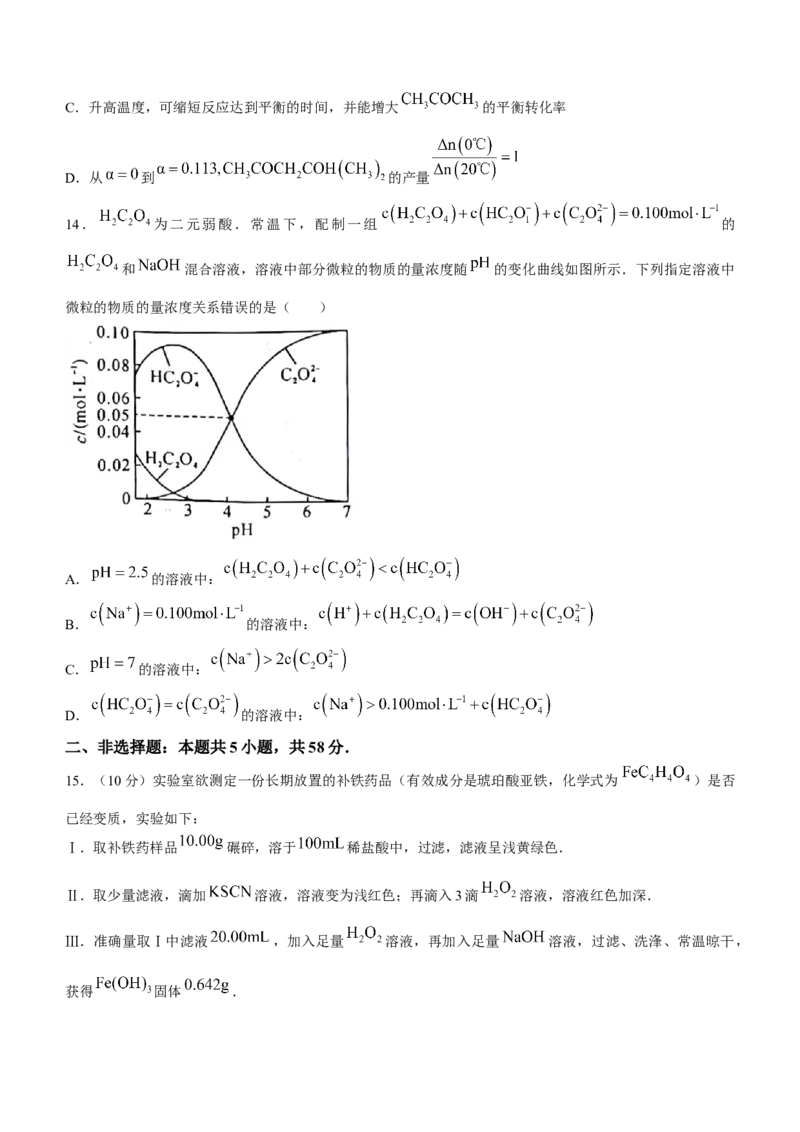
12.一种药物中间体的结构简式如图所示.下列关于该化合物的说法正确的是( )
A.能与 溶液作用显紫色
B.完全水解所得有机产物分子中含有1个手性碳原子
C.分子中最多有12个原子在同一平面上
D. 该化合物与 加成时,最多消耗
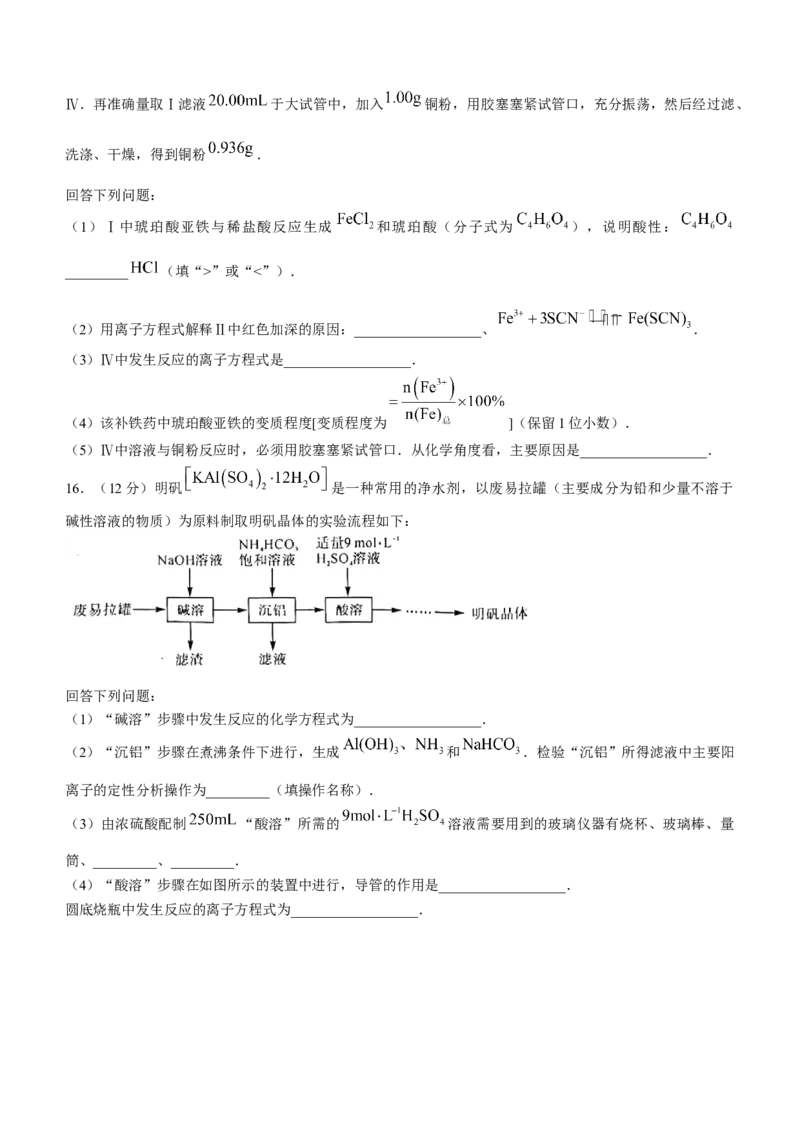
13.已知反应: .取等量 ,分别在
和 下,测得其转化率随时间变化的关系曲线( 曲线)如图所示.下列说法错误的是( )
A.曲线a代表 下 的 曲线
B. 内, 的平均反应速率C.升高温度,可缩短反应达到平衡的时间,并能增大 的平衡转化率
D.从 到 的产量
14. 为二元弱酸.常温下,配制一组 的
和 混合溶液,溶液中部分微粒的物质的量浓度随 的变化曲线如图所示.下列指定溶液中
微粒的物质的量浓度关系错误的是( )
A. 的溶液中:
B. 的溶液中:
C. 的溶液中:
D. 的溶液中:
二、非选择题:本题共5小题,共58分.
15.(10分)实验室欲测定一份长期放置的补铁药品(有效成分是琥珀酸亚铁,化学式为 )是否
已经变质,实验如下:
Ⅰ.取补铁药样品 碾碎,溶于 稀盐酸中,过滤,滤液呈浅黄绿色.
Ⅱ.取少量滤液,滴加 溶液,溶液变为浅红色;再滴入3滴 溶液,溶液红色加深.
Ⅲ.准确量取Ⅰ中滤液 ,加入足量 溶液,再加入足量 溶液,过滤、洗浲、常温晾干,
获得 固体 .Ⅳ.再准确量取Ⅰ滤液 于大试管中,加入 铜粉,用胶塞塞紧试管口,充分振荡,然后经过滤、
洗涤、干燥,得到铜粉 .
回答下列问题:
(1)Ⅰ中琥珀酸亚铁与稀盐酸反应生成 和琥珀酸(分子式为 ),说明酸性:
_________ (填“>”或“<”).
(2)用离子方程式解释Ⅱ中红色加深的原因:__________________、 .
(3)Ⅳ中发生反应的离子方程式是__________________.
(4)该补铁药中琥珀酸亚铁的变质程度[变质程度为 ](保留1位小数).
(5)Ⅳ中溶液与铜粉反应时,必须用胶塞塞紧试管口.从化学角度看,主要原因是__________________.
16.(12分)明矾 是一种常用的净水剂,以废易拉罐(主要成分为铅和少量不溶于
碱性溶液的物质)为原料制取明矾晶体的实验流程如下:
回答下列问题:
(1)“碱溶”步骤中发生反应的化学方程式为__________________.
(2)“沉铝”步骤在煮沸条件下进行,生成 和 .检验“沉铝”所得滤液中主要阳
离子的定性分析操作为_________(填操作名称).
(3)由浓硫酸配制 “酸溶”所需的 溶液需要用到的玻璃仪器有烧杯、玻璃棒、量
筒、_________、_________.
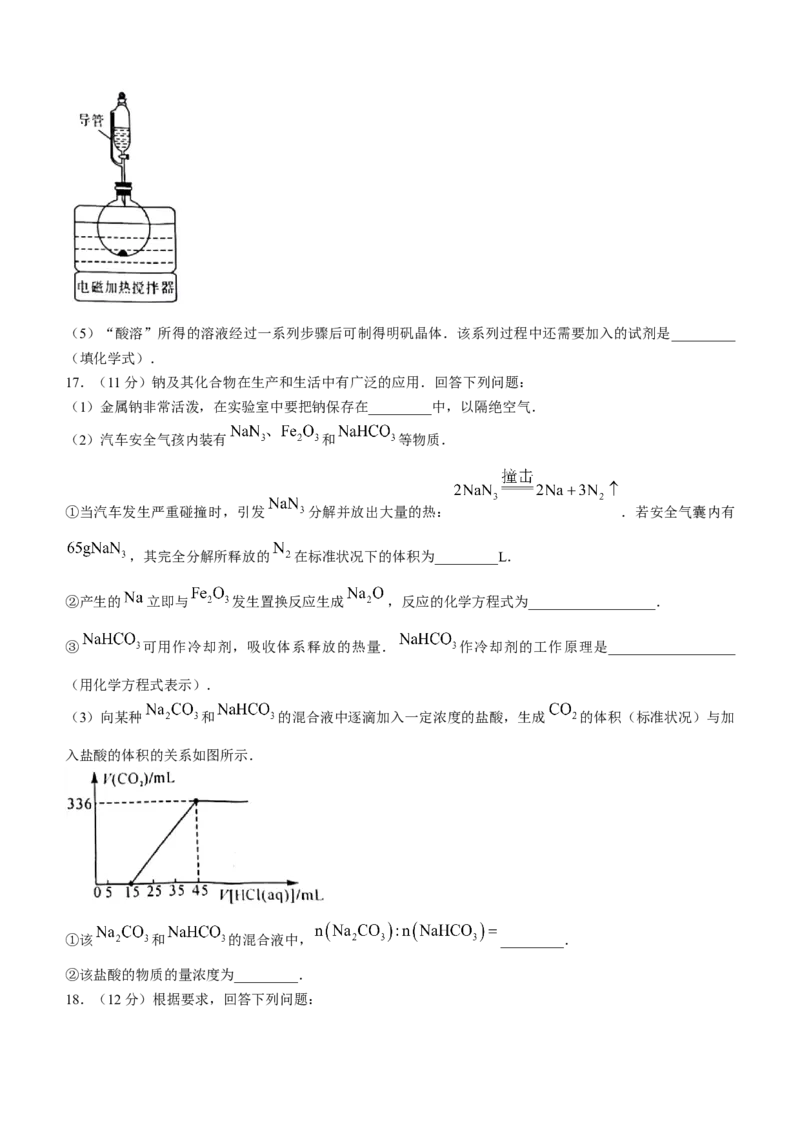
(4)“酸溶”步骤在如图所示的装置中进行,导管的作用是__________________.
圆底烧瓶中发生反应的离子方程式为__________________.(5)“酸溶”所得的溶液经过一系列步骤后可制得明矾晶体.该系列过程中还需要加入的试剂是_________
(填化学式).
17.(11分)钠及其化合物在生产和生活中有广泛的应用.回答下列问题:
(1)金属钠非常活泼,在实验室中要把钠保存在_________中,以隔绝空气.
(2)汽车安全气孩内装有 和 等物质.
①当汽车发生严重碰撞时,引发 分解并放出大量的热: .若安全气囊内有
,其完全分解所释放的 在标准状况下的体积为_________L.
②产生的 立即与 发生置换反应生成 ,反应的化学方程式为__________________.
③ 可用作冷却剂,吸收体系释放的热量. 作冷却剂的工作原理是__________________
(用化学方程式表示).
(3)向某种 和 的混合液中逐滴加入一定浓度的盐酸,生成 的体积(标准状况)与加
入盐酸的体积的关系如图所示.
①该 和 的混合液中, _________.
②该盐酸的物质的量浓度为_________.
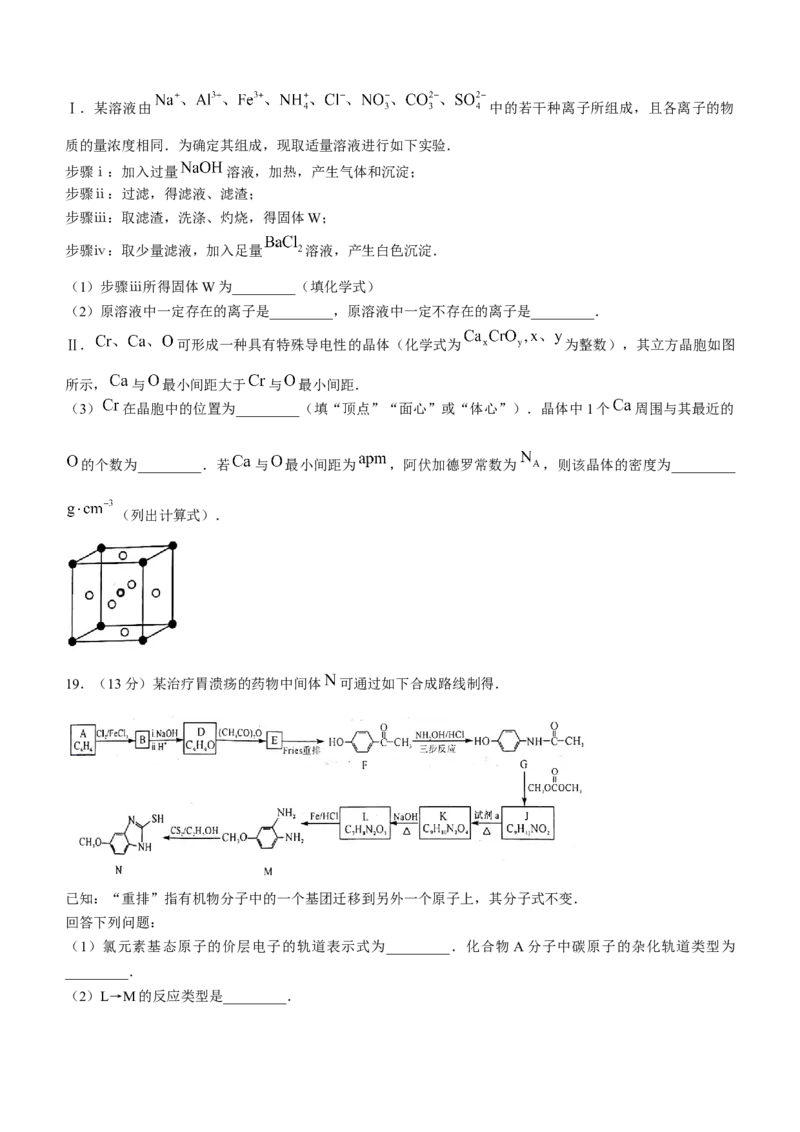
18.(12分)根据要求,回答下列问题:Ⅰ.某溶液由 中的若干种离子所组成,且各离子的物
质的量浓度相同.为确定其组成,现取适量溶液进行如下实验.
步骤ⅰ:加入过量 溶液,加热,产生气体和沉淀;
步骤ⅱ:过滤,得滤液、滤渣;
步骤ⅲ:取滤渣,洗涤、灼烧,得固体W;
步骤ⅳ:取少量滤液,加入足量 溶液,产生白色沉淀.
(1)步骤ⅲ所得固体W为_________(填化学式)
(2)原溶液中一定存在的离子是_________,原溶液中一定不存在的离子是_________.
Ⅱ. 可形成一种具有特殊导电性的晶体(化学式为 为整数),其立方晶胞如图
所示, 与 最小间距大于 与 最小间距.
(3) 在晶胞中的位置为_________(填“顶点”“面心”或“体心”).晶体中1个 周围与其最近的
的个数为_________.若 与 最小间距为 ,阿伏加德罗常数为 ,则该晶体的密度为_________
(列出计算式).
19.(13分)某治疗胃溃疡的药物中间体 可通过如下合成路线制得.
已知:“重排”指有机物分子中的一个基团迁移到另外一个原子上,其分子式不变.
回答下列问题:
(1)氯元素基态原子的价层电子的轨道表示式为_________.化合物A分子中碳原子的杂化轨道类型为
_________.
(2)L→M的反应类型是_________.(3) 与 溶液充分反应,消耗 _________ .
(4)E含有酯基,由D生成E的化学方程式为__________________.
(5)写出符合下列条件的F的同分异构体的结构简式__________________(写出两种).
ⅰ.含有苯环,能发生银镜反应
ⅱ.核磁共振氢谱有四组峰,峰面积之比为3∶2∶2∶1
(6)J含有醚键.试剂a是_________.
(7)加热条件下,K与 溶液反应得到L的化学方程式为__________________.2024 届高三 10 月质量检测·化学
参考答案、提示及评分细则
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 B C D D B D A A B C C B C D
一、选择题:本题共14小题,每小题3分,共42分.在每小题给出的四个选项中,只有一项
符合题目要求.
1.【答案】B
【解析】舍勒发现了氯气,但受当时流行学说的影响,舍勒未能确认氯气.直到 1810年,氯气才被英国化学
家戴维确认,B错误.
2.【答案】C
【解析】 属于酸性氧化物, 不属于碱性氧化物, 属于碱性氧化物, 属于两性氧化物,
C正确.
3.【答案】D
【解析】常温下, 和 反应生成 ,加热下, 和 反应生成 ,A不符合题意;少量
溶液和 反应生成 ,过量 溶液和 反应生成 ,B 不符合题意;
溶液和逐滴滴入的少量 溶液反应,生成 溶液和过量 溶液混合,生成
,C不符合题意; 和 反应生成 ,生成物不随反应条件或反应物的用量变化而变化,D符合
题意.
4.【答案】D
【解析】 在 溶液中会生成 沉淀,A错误;酸性溶液中, 具
有很强的氧化性,能将 氧化成 ,B错误; 能与 发生氧化还原反应,C错误;使酚酞变红色
的溶液呈碱性,碱性溶液中 能大量共存,D正确.
5.【答案】B
【解析】 加热不分解,杂质 加热分解生成 ,A正确; 和 气体都能和
溶液发生反应,B错误;通入足量的 气体,发生反应 ,C正确; 几乎不溶于饱和食盐水,杂质 气体易溶于饱和食盐水,D正确.
6.【答案】D
【解析】制备普通玻璃的原料是纯碱、石灰石和石英砂,与 溶液呈碱性无关,A错误;熔化状态下
的氧化铝能导电,且自然界中铝以铝土矿的形式存在,故氧化铝可用于电解铝,B错误;氢氧化铝具有弱碱
性,可用于治疗胃酸过多,C错误;铁粉具有还原性,可用于食品袋中的抗氧化剂,D正确.
7.【答案】A
【解析】向 溶液中滴加 溶液,生成白色的 沉淀.白色沉淀迅速变成灰绿色,过一段
时间后变为红褐色,是因为 被溶解在溶液中的氧气氧化成了红褐色的 , 有还原
性,A正确;向某溶液中滴加 溶液,产生白色沉淀,原溶液中也可能不含有 而含有 ,B错
误 ; 向 某 溶 液 中 滴 加 酸 性 溶 液 , 紫 色 褪 去 , 原 溶 液 中 也 可 能 不 含 有 而 含 有
或 等,C错误;向某溶液中加入盐酸产生无色气体,该气体能使澄清石灰水变浑浊,
则该气体可能是 或 ,原溶液中也可能不含有 而含有 或 ,D错误.
8.【答案】A
【解析】根据题意,总反应的化学方程式为 ,
该溶液中, ,A正确.
9.【答案】B
【解析】由图1可知, 氧化率随浸出液 增大而减小,故可推断 的氧化性随浸出液 增大而
减 弱 , A 正 确 ; 酸 性 溶 液 中 , 与 反 应 的 离 子 方 程 式 为
,反应一段时间后,浸出液 会增大,B错误;加适量
溶液, 转变为沉淀的离子方程式为 ,C正
确 ; 用 溶 液 调 也 可 以 使 转 化 为 沉 淀 , 反 应 的 离 子 方 程 式 为,D正确.
10.【答案】C
【 解 析 】 根 据 题 意 可 知 元 素 分 别 为 . 元 素 的 第 一 电 离 能 :
,A正确;元素的电负性 且 分子具有正四面体形结构,B正确;与氢形成的共
价键键能: ,C错误; 为离子化合物,D正确.
11.【答案】C
【解析】该装置的左侧为原电池,右侧为电解池.根据原电池中 的移动方向可知, 电极为负极, 电
极 为 正 极 , A 正 确 ; 电 解 池 中 , 电 极 为 阳 极 , 电 极 为 阴 极 , 电 极 反 应 式 为
, 正确; 电极反应式
为 ,装置工作时,乙室消耗 ,乙室溶液 增大,C错误;a电极反应式
为 ,根据关系式 (从甲室
逸出)~ (进入甲室)可知,合成 扑热息痛,理论上甲室质量增重为 ,D正确.
12.【答案】B
【解析】该化合物中不含有酚羟基,不能与 溶液作用显紫色,A错误;该化合物完全水解所得有机产
物为 ,如图所示标有“*”为手性碳原子: ,共有1个
手性碳原子,B正确;苯环和直接连接在苯环上的原子共平面,分子中的单键均可以 旋转,故分子中在
同一平面上的原子数超过12个,C错误;该化合物中只有苯环能与 发生加成反应,则 该化合物与加成时,最多消耗 ,D错误.
13.【答案】C
【解析】温度越高,反应速率越快,到达平衡的时间越短,由图像可看出曲线 首先到达平衡,所以曲线
代表 下 的 曲线,曲线 代表 下 的 曲线,A正确;当反应进行
到 时,从图像中可以看出 曲线对应的 转化率高于 曲线对应的 转化率,
这说明 内, 曲线对应的 的平均反应速率较快,所以 ,B正确;由图
像可知,温度高, 的平衡转化率低,说明升高温度平衡向逆反应方向移动,即正反应是放热反
应,故升高温度,可缩短反应达到平衡的时间,但是减小了 的平衡转化率,C错误;根据图像
可以看出,当反应进行到 时, 曲线对应的 的转化率相同,都是0.113,这说明此时
生成的 一样多,所以从 到 的产量
,D正确.
14.【答案】D
【解析】由图像可知, 的溶液中 和 浓度之和小于 ,即
, A 正 确 ; 依 据 溶 液 中 电 荷 守 恒 和 物 料 守 恒 分 析 ,
的 溶 液 为 溶 液 , 溶 液 中 存 在 电 荷 守 恒
和 物 料 守 恒
,将两式合并得到(或根据 溶液中的质子守恒得
到 ,B正确; 的溶液呈中性, ,根
据 电 荷 守 恒 可 知 ,, 故 , C 正 确 ; 由 图 像 可 知 ,
的 溶 液 呈 酸 性 且 ,
, 电 荷 守 恒
, 因 为 , 故
,D错误.
二、非选择题:本题共5小题,共58分.
15.【答案】(1)<
(2)
(3)
(4)33.3
(5)防止空气中的氧气将 氧化成
16 . 【 答 案 】 ( 1 ) { 或
} (2)焰色试验
(3) 容量瓶(或胶头滴管) 胶头滴管(或 容量瓶)
(4)平衡压强,便于 溶液顺利滴下
(5)
17.【答案】(1)石蜡油(或煤油)
(2)①33.6 ②③
(3)① ②
18.【答案】(1)
(2)
(3)体心 12
【解析】Ⅰ.步骤ⅰ,取该溶液加入过量 溶液,加热,产生气体和沉淀,说明含有 .
与 会发生双水解反应而不能共存,则一定不存在 .步骤ⅳ中,取少量滤液,加入足量
溶液,产生白色沉淀,说明含有 .根据以上分析可知,原溶液中含有 ,由于
各离子的物质的量浓度相同,根据溶液呈电中性规则可知,原溶液中一定还含有 ,另外还一定不
含有 .
Ⅱ. 与 最小间距为晶胞面对角线长度的一半,则晶胞面对角线长度为 ,晶胞参数为 ,
晶体的密度为 .
19.【答案】(1)
(2)还原反应 (3)2
(4)
(5) 、
(6)浓硝酸、浓硫酸(7)