文档内容
五年(2019-2023)年高考真题分项汇编
专题 13 工艺流程综合题
〖203年高考真题〗
考点一 除杂提纯类
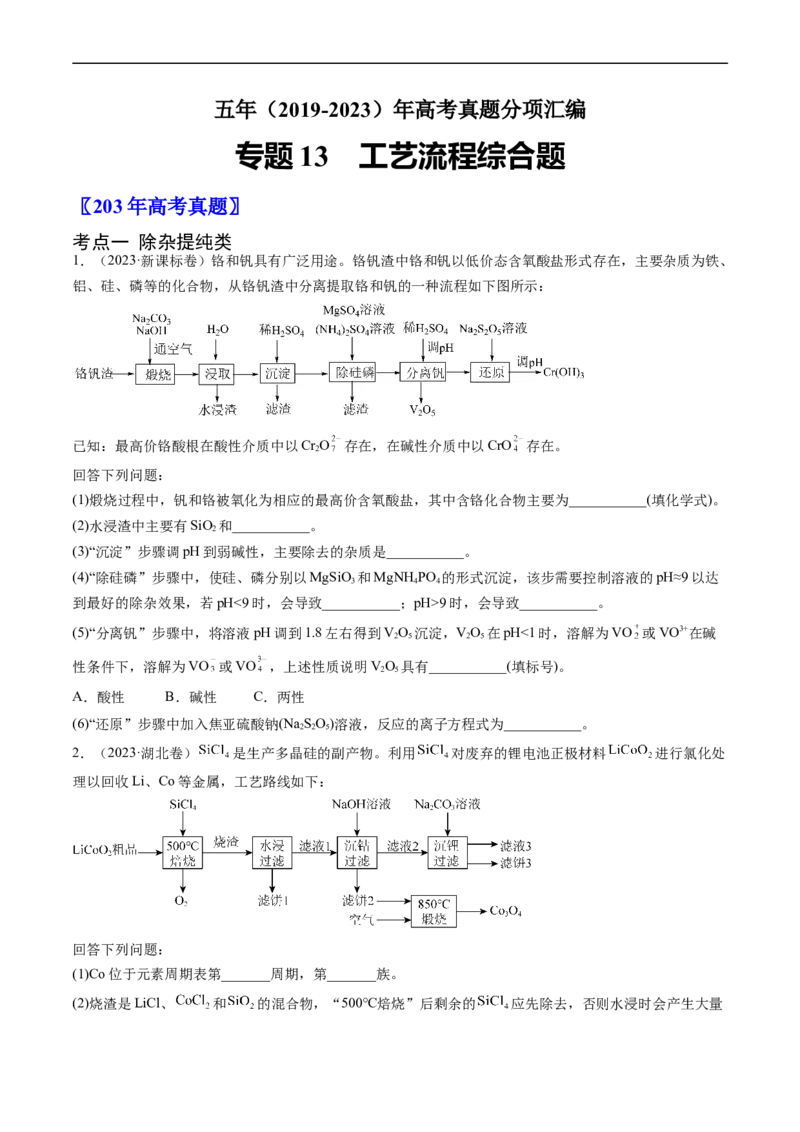
1.(2023·新课标卷)铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、
铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:
已知:最高价铬酸根在酸性介质中以Cr O 存在,在碱性介质中以CrO 存在。
2
回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为___________(填化学式)。
(2)水浸渣中主要有SiO 和___________。
2
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是___________。
(4)“除硅磷”步骤中,使硅、磷分别以MgSiO 和MgNH PO 的形式沉淀,该步需要控制溶液的pH≈9以达
3 4 4
到最好的除杂效果,若pH<9时,会导致___________;pH>9时,会导致___________。
(5)“分离钒”步骤中,将溶液pH调到1.8左右得到VO 沉淀,VO 在pH<1时,溶解为VO 或VO3+在碱
2 5 2 5
性条件下,溶解为VO 或VO ,上述性质说明VO 具有___________(填标号)。
2 5
A.酸性 B.碱性 C.两性
(6)“还原”步骤中加入焦亚硫酸钠(Na SO)溶液,反应的离子方程式为___________。
2 2 5
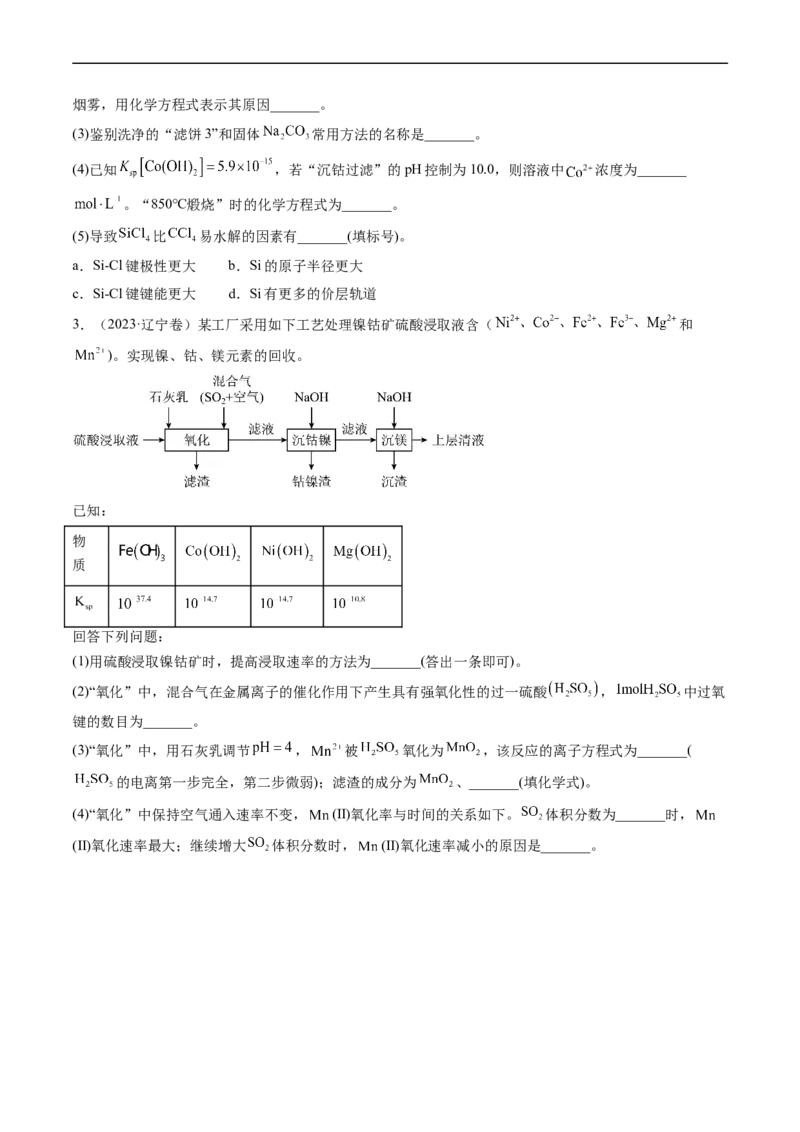
2.(2023·湖北卷) 是生产多晶硅的副产物。利用 对废弃的锂电池正极材料 进行氯化处
理以回收Li、Co等金属,工艺路线如下:
回答下列问题:
(1)Co位于元素周期表第_______周期,第_______族。
(2)烧渣是LiCl、 和 的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因_______。
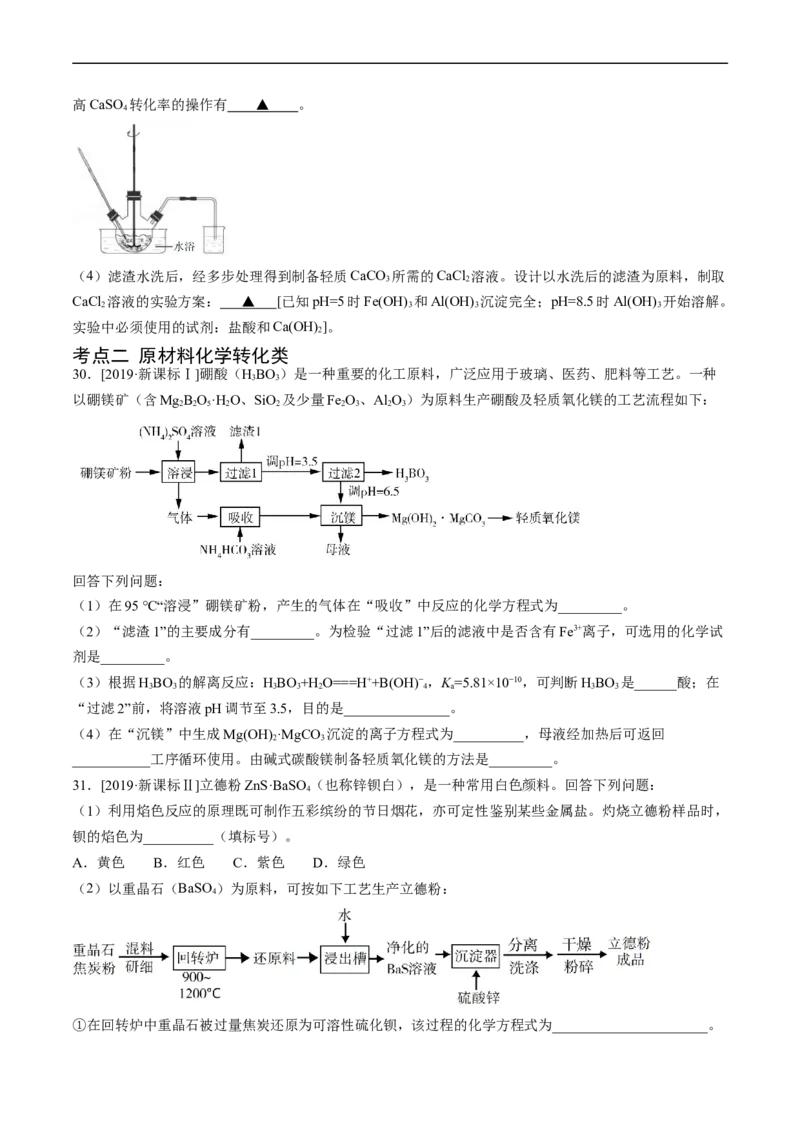
(3)鉴别洗净的“滤饼3”和固体 常用方法的名称是_______。
(4)已知 ,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为_______
。“850℃煅烧”时的化学方程式为_______。
(5)导致 比 易水解的因素有_______(填标号)。
a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
3.(2023·辽宁卷)某工厂采用如下工艺处理镍钴矿硫酸浸取液含( 和
)。实现镍、钴、镁元素的回收。
已知:
物
质
回答下列问题:
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为_______(答出一条即可)。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸 , 中过氧
键的数目为_______。
(3)“氧化”中,用石灰乳调节 , 被 氧化为 ,该反应的离子方程式为_______(
的电离第一步完全,第二步微弱);滤渣的成分为 、_______(填化学式)。
(4)“氧化”中保持空气通入速率不变, (Ⅱ)氧化率与时间的关系如下。 体积分数为_______时,
(Ⅱ)氧化速率最大;继续增大 体积分数时, (Ⅱ)氧化速率减小的原因是_______。(5)“沉钴镍”中得到的 (Ⅱ)在空气中可被氧化成 ,该反应的化学方程式为_______。
(6)“沉镁”中为使 沉淀完全 ,需控制 不低于_______(精确至0.1)。
考点二 原材料化学转化类
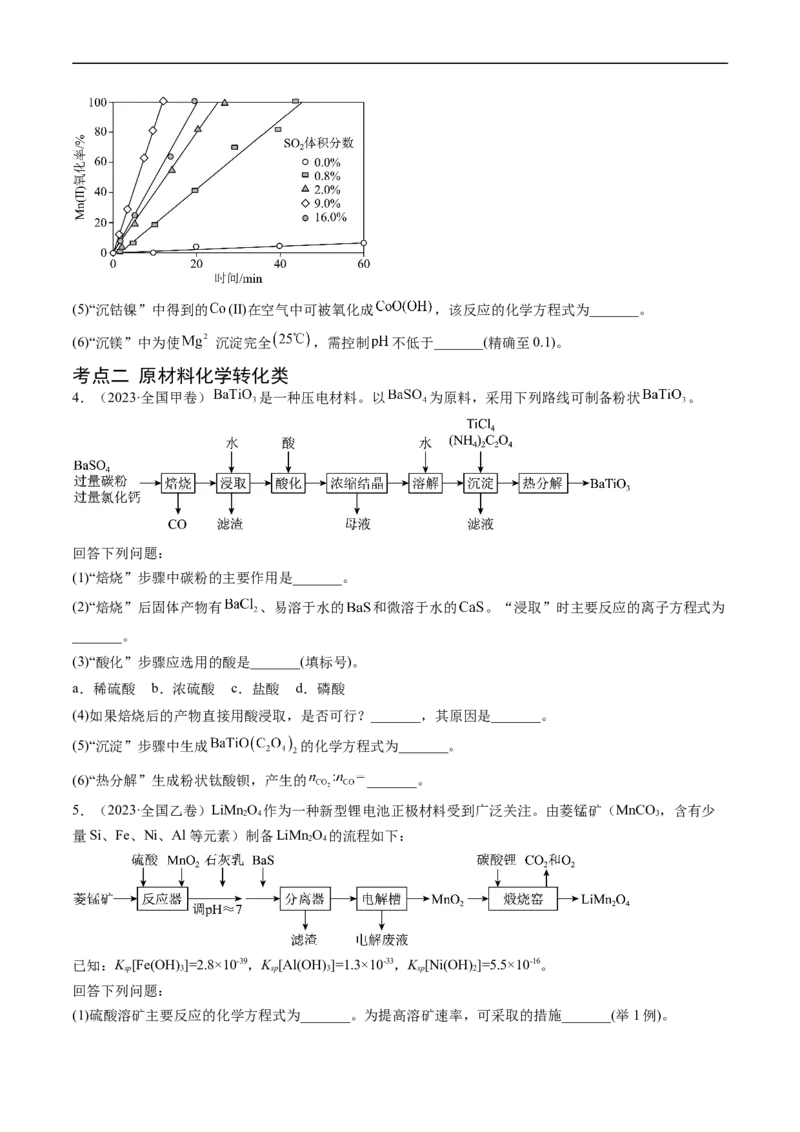
4.(2023·全国甲卷) 是一种压电材料。以 为原料,采用下列路线可制备粉状 。
回答下列问题:
(1)“焙烧”步骤中碳粉的主要作用是_______。
(2)“焙烧”后固体产物有 、易溶于水的 和微溶于水的 。“浸取”时主要反应的离子方程式为
_______。
(3)“酸化”步骤应选用的酸是_______(填标号)。
a.稀硫酸 b.浓硫酸 c.盐酸 d.磷酸
(4)如果焙烧后的产物直接用酸浸取,是否可行?_______,其原因是_______。
(5)“沉淀”步骤中生成 的化学方程式为_______。
(6)“热分解”生成粉状钛酸钡,产生的 _______。
5.(2023·全国乙卷)LiMn O 作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO ,含有少
2 4 3
量Si、Fe、Ni、Al等元素)制备LiMn O 的流程如下:
2 4
已知:K [Fe(OH) ]=2.8×10-39,K [Al(OH) ]=1.3×10-33,K [Ni(OH) ]=5.5×10-16。
sp 3 sp 3 sp 2
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为_______。为提高溶矿速率,可采取的措施_______(举1例)。(2)加入少量MnO 的作用是_______。不宜使用HO 替代MnO ,原因是_______。
2 2 2 2
(3)溶矿反应完成后,反应器中溶液pH=4,此时c(Fe3+)=_______mol·L-1;用石灰乳调节至pH≈7,除去的金
属离子是_______。
(4)加入少量BaS溶液除去Ni2+,生成的沉淀有_______。
(5)在电解槽中,发生电解反应的离子方程式为_______。随着电解反应进行,为保持电解液成分稳定,应
不断_______。电解废液可在反应器中循环利用。
(6)缎烧窑中,生成LiMn O 反应的化学方程式是_______。
2 4
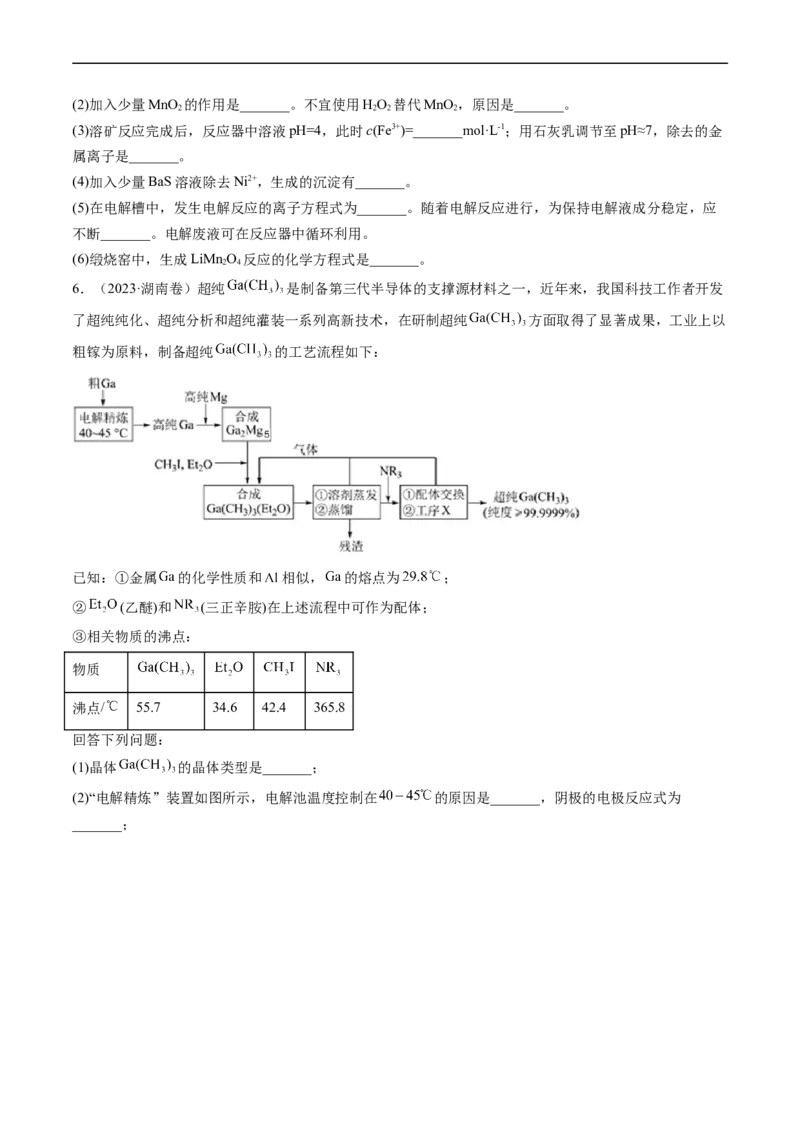
6.(2023·湖南卷)超纯 是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发
了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯 方面取得了显著成果,工业上以
粗镓为原料,制备超纯 的工艺流程如下:
已知:①金属 的化学性质和 相似, 的熔点为 ;
② (乙醚)和 (三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
物质
沸点/ 55.7 34.6 42.4 365.8
回答下列问题:
(1)晶体 的晶体类型是_______;
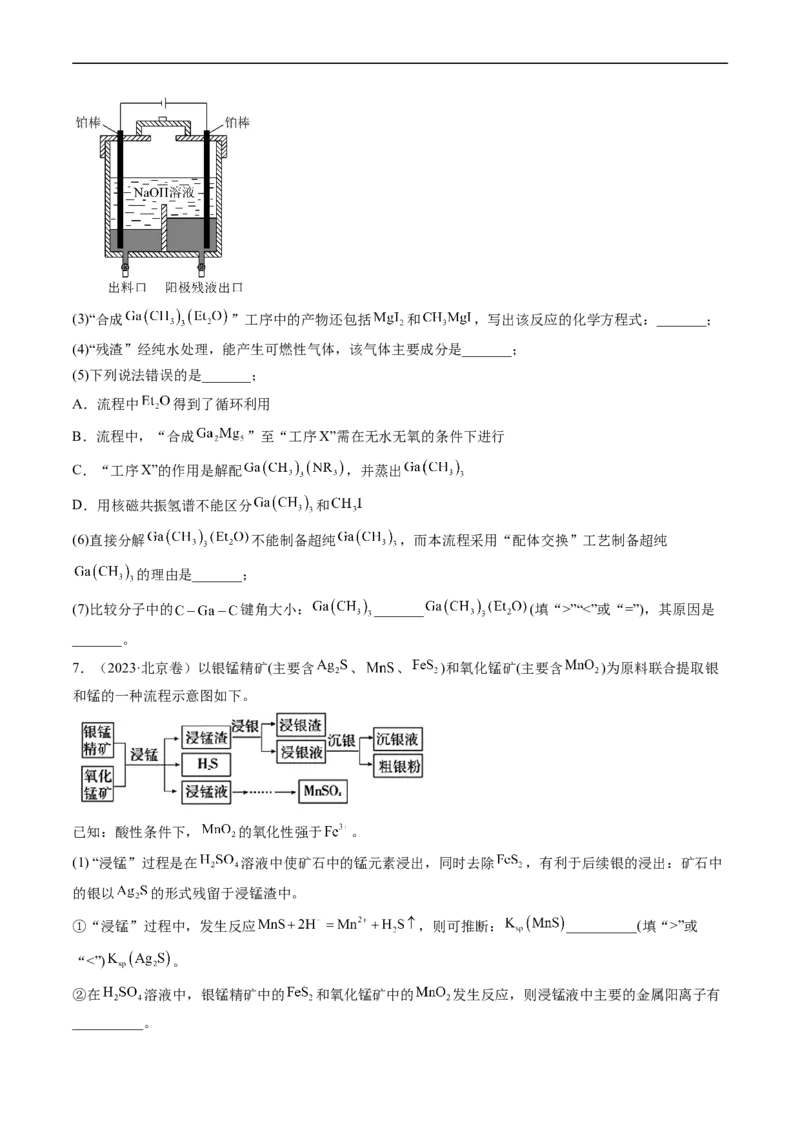
(2)“电解精炼”装置如图所示,电解池温度控制在 的原因是_______,阴极的电极反应式为
_______;(3)“合成 ”工序中的产物还包括 和 ,写出该反应的化学方程式:_______;
(4)“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是_______;
(5)下列说法错误的是_______;
A.流程中 得到了循环利用
B.流程中,“合成 ”至“工序X”需在无水无氧的条件下进行
C.“工序X”的作用是解配 ,并蒸出
D.用核磁共振氢谱不能区分 和
(6)直接分解 不能制备超纯 ,而本流程采用“配体交换”工艺制备超纯
的理由是_______;
(7)比较分子中的 键角大小: _______ (填“>”“<”或“=”),其原因是
_______。
7.(2023·北京卷)以银锰精矿(主要含 、 、 )和氧化锰矿(主要含 )为原料联合提取银
和锰的一种流程示意图如下。
已知:酸性条件下, 的氧化性强于 。
(1) “浸锰”过程是在 溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出:矿石中
的银以 的形式残留于浸锰渣中。
①“浸锰”过程中,发生反应 ,则可推断: __________(填“>”或
“<”) 。
②在 溶液中,银锰精矿中的 和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
__________。(2) “浸银”时,使用过量 和 的混合液作为浸出剂,将 中的银以 形式浸出。
①将“浸银”反应的离子方程式补充完整:__________。
②结合平衡移动原理,解释浸出剂中 的作用:____________________。
(3) “沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有______________________________。
②一定温度下, 的沉淀率随反应时间的变化如图所示。解释 分钟后 的沉淀率逐渐减小的原因:
______________。
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析联合提取银和锰的优势:________。
8.(2023·山东卷)盐湖卤水(主要含 、 和硼酸根等)是锂盐的重要来源。一种以
高镁卤水为原料经两段除镁制备 的工艺流程如下:
已知:常温下, 。相关化合物的溶解度与温度的关系如图所示。
回答下列问题:
(1)含硼固体中的 在水中存在平衡: (常温下, );
与 溶液反应可制备硼砂 。常温下,在 硼砂溶液中,
水解生成等物质的量浓度的 和 ,该水解反应的离子方程式为_____,该溶液 _____。
(2)滤渣Ⅰ的主要成分是_____(填化学式);精制Ⅰ后溶液中 的浓度为 ,则常温下精制Ⅱ过程中
浓度应控制在_____ 以下。若脱硼后直接进行精制Ⅰ,除无法回收 外,还将增加_____的
用量(填化学式)。
(3)精制Ⅱ的目的是_____;进行操作 时应选择的试剂是_____,若不进行该操作而直接浓缩,将导致
_____。
〖2022年高考真题〗
考点一 除杂提纯类
9.(2022·湖南卷)钛(Ti)及其合金是理想的高强度、低密度结构材料。以钛渣(主要成分为TiO ,含少量
2
V、Si和Al的氧化物杂质)为原料,制备金属钛的工艺流程如下:
已知“降温收尘”后,粗TiCl 中含有的几种物质的沸点:
4
物质 TiCl VOCl SiCl AlCl
4 3 4 3
沸点/℃ 136 127 57 180
回答下列问题:
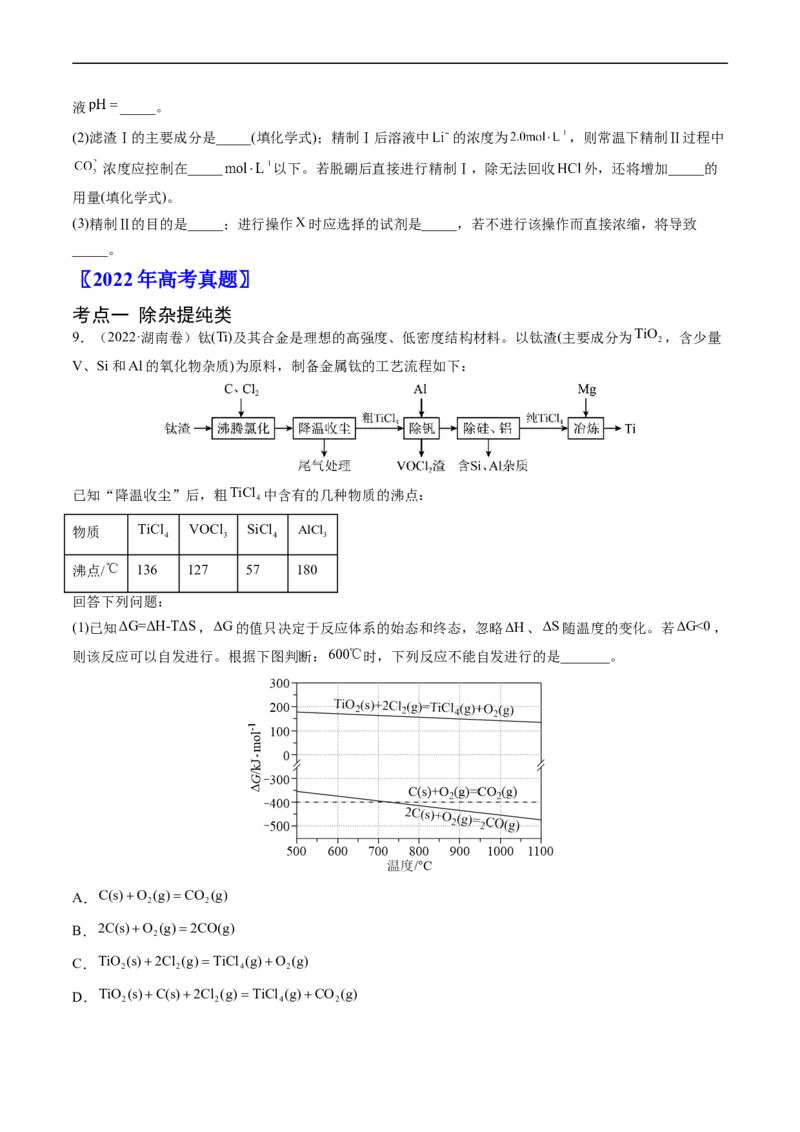
(1)已知ΔG=ΔH-TΔS,ΔG的值只决定于反应体系的始态和终态,忽略ΔH、ΔS随温度的变化。若ΔG<0,
则该反应可以自发进行。根据下图判断:600℃时,下列反应不能自发进行的是_______。
A.C(s)O (g)CO (g)
2 2
B.2C(s)O (g)2CO(g)
2
C.TiO (s)2Cl (g)TiCl (g)O (g)
2 2 4 2
D.TiO (s)C(s)2Cl (g)TiCl (g)CO (g)
2 2 4 2(2)TiO 与C、Cl ,在600℃的沸腾炉中充分反应后,混合气体中各组分的分压如下表:
2 2
物质 TiCl CO CO Cl
4 2 2
分压
4.59102 1.84102 3.70102 5.98109
MPa
①该温度下,TiO 与C、Cl 反应的总化学方程式为_______;
2 2
②随着温度升高,尾气中CO的含量升高,原因是_______。
(3)“除钒”过程中的化学方程式为_______;“除硅、铝”过程中,分离TiCl
4
中含Si、Al杂质的方法是
_______。
(4)“除钒”和“除硅、铝”的顺序_______(填“能”或“不能”)交换,理由是_______。
(5)下列金属冶炼方法与本工艺流程中加入Mg冶炼Ti的方法相似的是_______。
A.高炉炼铁 B.电解熔融氯化钠制钠
C.铝热反应制锰 D.氧化汞分解制汞
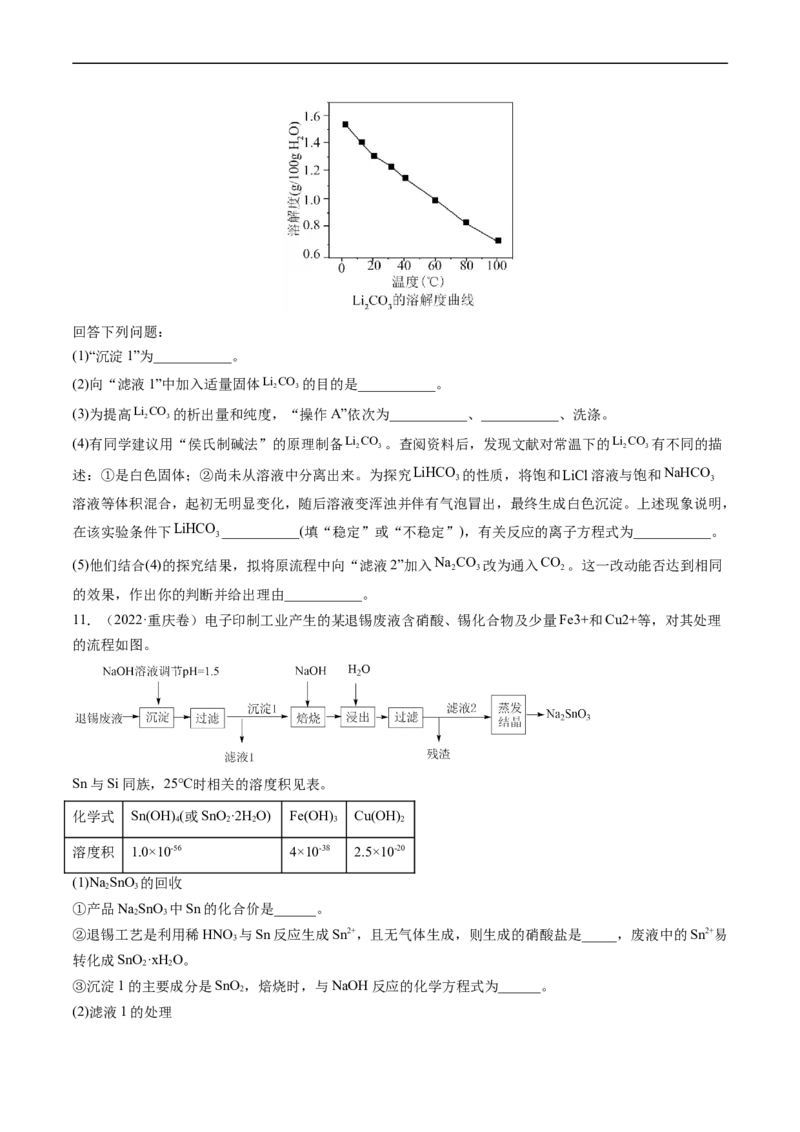
10.(2022·湖北卷)全球对锂资源的需求不断增长,“盐湖提锂”越来越受到重视。某兴趣小组取盐湖水
进行浓缩和初步除杂后,得到浓缩卤水(含有Na+、Li+、Cl-和少量Mg2+、Ca2+),并设计了以下流程通过制
备碳酸锂来提取锂。
25℃时相关物质的参数如下:
LiOH的溶解度:12.4g/100gH O
2
化合物 K
sp
MgOH 5.61012
2
CaOH 5.5106
2
CaCO 2.8109
3
Li CO 2.5102
2 3回答下列问题:
(1)“沉淀1”为___________。
(2)向“滤液1”中加入适量固体Li CO 的目的是___________。
2 3
(3)为提高Li CO 的析出量和纯度,“操作A”依次为___________、___________、洗涤。
2 3
(4)有同学建议用“侯氏制碱法”的原理制备Li CO 。查阅资料后,发现文献对常温下的Li CO 有不同的描
2 3 2 3
述:①是白色固体;②尚未从溶液中分离出来。为探究LiHCO 的性质,将饱和LiCl溶液与饱和NaHCO
3 3
溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。上述现象说明,
在该实验条件下LiHCO ___________(填“稳定”或“不稳定”),有关反应的离子方程式为___________。
3
(5)他们结合(4)的探究结果,拟将原流程中向“滤液2”加入Na CO 改为通入CO 。这一改动能否达到相同
2 3 2
的效果,作出你的判断并给出理由___________。
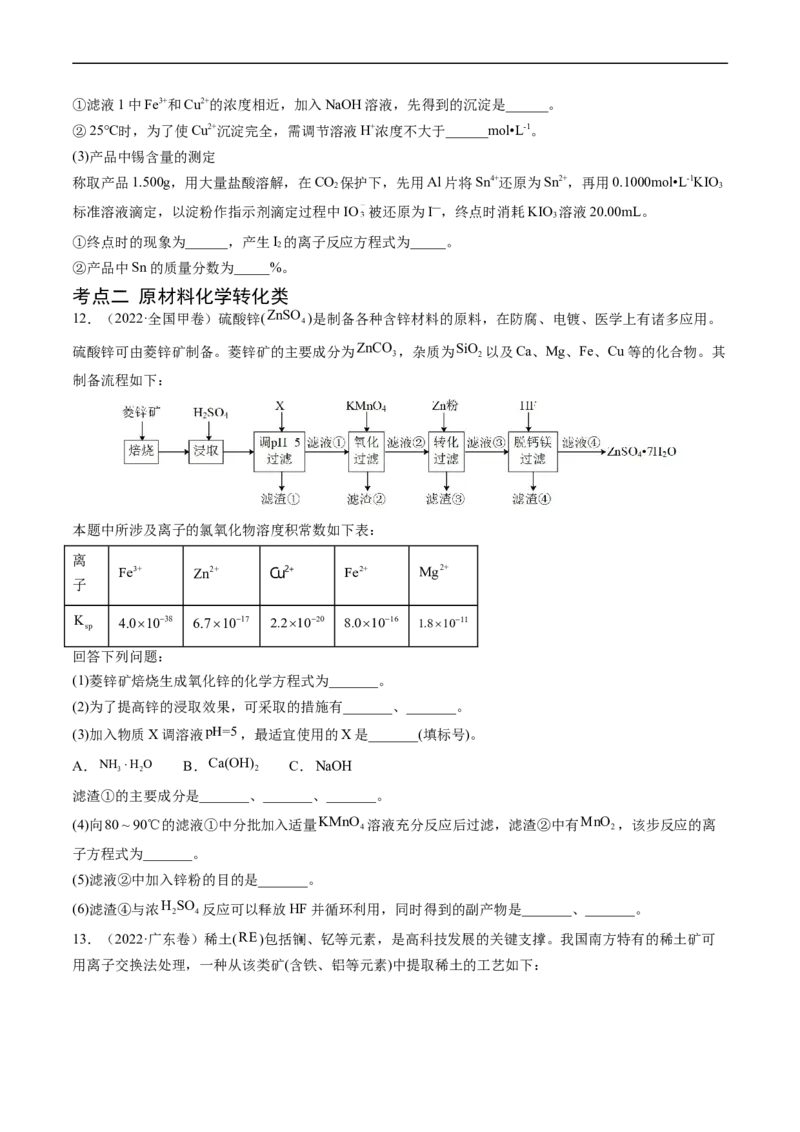
11.(2022·重庆卷)电子印制工业产生的某退锡废液含硝酸、锡化合物及少量Fe3+和Cu2+等,对其处理
的流程如图。
Sn与Si同族,25℃时相关的溶度积见表。
化学式 Sn(OH)(或SnO ·2H O) Fe(OH) Cu(OH)
4 2 2 3 2
溶度积 1.0×10-56 4×10-38 2.5×10-20
(1)Na SnO 的回收
2 3
①产品NaSnO 中Sn的化合价是______。
2 3
②退锡工艺是利用稀HNO 与Sn反应生成Sn2+,且无气体生成,则生成的硝酸盐是_____,废液中的Sn2+易
3
转化成SnO ·xH O。
2 2
③沉淀1的主要成分是SnO ,焙烧时,与NaOH反应的化学方程式为______。
2
(2)滤液1的处理①滤液1中Fe3+和Cu2+的浓度相近,加入NaOH溶液,先得到的沉淀是______。
②25℃时,为了使Cu2+沉淀完全,需调节溶液H+浓度不大于______mol•L-1。
(3)产品中锡含量的测定
称取产品1.500g,用大量盐酸溶解,在CO 保护下,先用Al片将Sn4+还原为Sn2+,再用0.1000mol•L-1KIO
2 3
标准溶液滴定,以淀粉作指示剂滴定过程中IO 被还原为I—,终点时消耗KIO 溶液20.00mL。
3
①终点时的现象为______,产生I 的离子反应方程式为_____。
2
②产品中Sn的质量分数为_____%。
考点二 原材料化学转化类
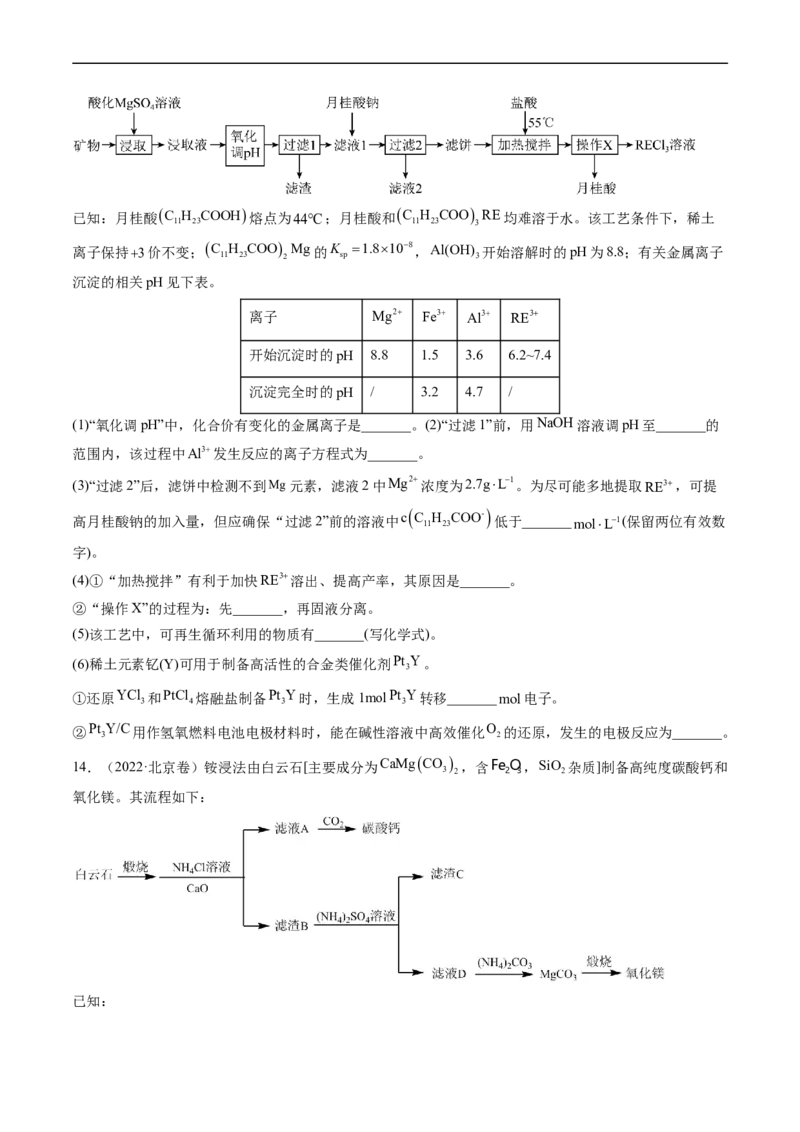
12.(2022·全国甲卷)硫酸锌(ZnSO )是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。
4
硫酸锌可由菱锌矿制备。菱锌矿的主要成分为ZnCO ,杂质为SiO 以及Ca、Mg、Fe、Cu等的化合物。其
3 2
制备流程如下:
本题中所涉及离子的氯氧化物溶度积常数如下表:
离
Fe3+ Zn2+ Cu2+ Fe2+ Mg2+
子
K
sp
4.01038 6.71017 2.21020 8.01016 1.81011
回答下列问题:
(1)菱锌矿焙烧生成氧化锌的化学方程式为_______。
(2)为了提高锌的浸取效果,可采取的措施有_______、_______。
(3)加入物质X调溶液pH=5,最适宜使用的X是_______(填标号)。
A.NH H O B.Ca(OH) C.NaOH
3 2 2
滤渣①的主要成分是_______、_______、_______。
(4)向80~90℃的滤液①中分批加入适量KMnO 溶液充分反应后过滤,滤渣②中有MnO ,该步反应的离
4 2
子方程式为_______。
(5)滤液②中加入锌粉的目的是_______。
(6)滤渣④与浓H SO 反应可以释放HF并循环利用,同时得到的副产物是_______、_______。
2 4
13.(2022·广东卷)稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可
用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:已知:月桂酸 C H COOH 熔点为44C;月桂酸和 C H COO RE均难溶于水。该工艺条件下,稀土
11 23 11 23 3
离子保持3价不变; C H COO Mg的K 1.8108 ,Al(OH) 开始溶解时的pH为8.8;有关金属离子
11 23 2 sp 3
沉淀的相关pH见下表。
离子 Mg2 Fe3 Al3 RE3
开始沉淀时的pH 8.8 1.5 3.6 6.2~7.4
沉淀完全时的pH / 3.2 4.7 /
(1)“氧化调pH”中,化合价有变化的金属离子是_______。(2)“过滤1”前,用NaOH溶液调pH至_______的
范围内,该过程中Al3发生反应的离子方程式为_______。
(3)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2浓度为2.7gL1。为尽可能多地提取RE3,可提
高月桂酸钠的加入量,但应确保“过滤2”前的溶液中c
C
11
H
23
COO-
低于_______molL1(保留两位有效数
字)。
(4)①“加热搅拌”有利于加快RE3溶出、提高产率,其原因是_______。
②“操作X”的过程为:先_______,再固液分离。
(5)该工艺中,可再生循环利用的物质有_______(写化学式)。
(6)稀土元素钇(Y)可用于制备高活性的合金类催化剂Pt Y。
3
①还原YCl 和PtCl 熔融盐制备Pt Y时,生成1molPt Y转移_______mol电子。
3 4 3 3
②Pt Y/C用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化O 的还原,发生的电极反应为_______。
3 2
14.(2022·北京卷)铵浸法由白云石[主要成分为CaMgCO
,含FeO,SiO 杂质]制备高纯度碳酸钙和
3 2 2 3 2
氧化镁。其流程如下:
已知:物
Ca(OH) Mg(OH) CaCO MgCO
2 2 3 3
质
K 5.5106 1.81012 2.8109 3.5108
sp
(1)煅烧白云石的化学方程式为___________。
(2)根据下表数据分析:
MgO wCaCO
nNH 4 Cl:n(CaO) CaO浸出率/ % 浸出率/ wCaCO 3 理论值/ % 3 实测值/
% %
2.1:1 98.4 1.1 99.7 -
2.2:1 98.8 1.5 99.2 99.5
2.3:1 98.9 1.8 98.8 99.5
2.4:1 99.1 6.0 95.6 97.6
已知:i.对浸出率给出定义
ii.对wCaCO
给出定义
3
①“沉钙”反应的化学方程式为___________。
②CaO浸出率远高于MgO浸出率的原因为___________。
③不宜选用的“nNH Cl:n(CaO)”数值为___________。
4
④wCaCO
实测值大于理论值的原因为___________。
3
⑤蒸馏时,随馏出液体积增大,MgO浸出率可出68.7%增加至98.9%,结合化学反应原理解释MgO浸出
率提高的原因为___________。
(3)滤渣C为___________。
(4)可循环利用的物质为___________。
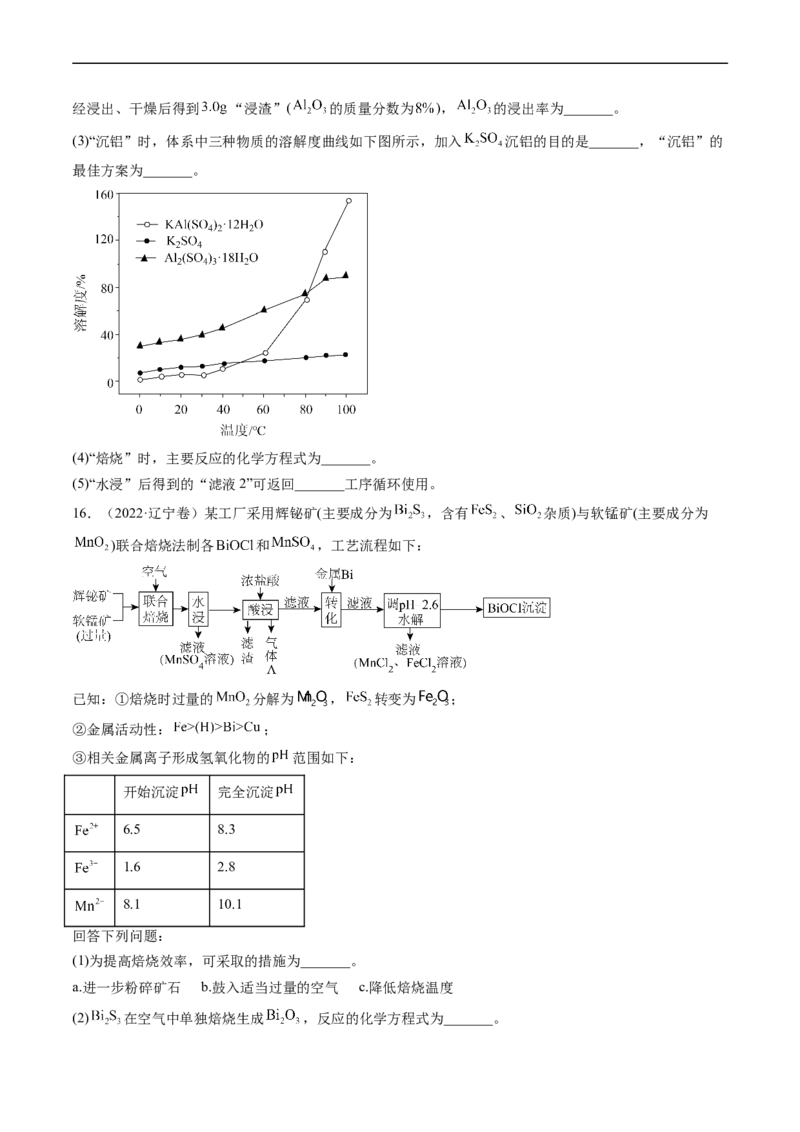
15.(2022·福建卷)粉煤灰是火电厂的大宗固废。以某电厂的粉煤灰为原料(主要含 和
等)提铝的工艺流程如下:
回答下列问题:
(1)“浸出”时适当升温的主要目的是_______, 发生反应的离子方程式为_______。
(2)“浸渣”的主要成分除残余 外,还有_______。实验测得, 粉煤灰( 的质量分数为 )经浸出、干燥后得到 “浸渣”( 的质量分数为 ), 的浸出率为_______。
(3)“沉铝”时,体系中三种物质的溶解度曲线如下图所示,加入 沉铝的目的是_______,“沉铝”的
最佳方案为_______。
(4)“焙烧”时,主要反应的化学方程式为_______。
(5)“水浸”后得到的“滤液2”可返回_______工序循环使用。
16.(2022·辽宁卷)某工厂采用辉铋矿(主要成分为 ,含有 、 杂质)与软锰矿(主要成分为
)联合焙烧法制各 和 ,工艺流程如下:
已知:①焙烧时过量的 分解为 , 转变为 ;
②金属活动性: ;
③相关金属离子形成氢氧化物的 范围如下:
开始沉淀 完全沉淀
6.5 8.3
1.6 2.8
8.1 10.1
回答下列问题:
(1)为提高焙烧效率,可采取的措施为_______。
a.进一步粉碎矿石 b.鼓入适当过量的空气 c.降低焙烧温度
(2) 在空气中单独焙烧生成 ,反应的化学方程式为_______。(3)“酸浸”中过量浓盐酸的作用为:①充分浸出 和 ;②_______。
(4)滤渣的主要成分为_______(填化学式)。
(5)生成气体A的离子方程式为_______。
(6)加入金属Bi的目的是_______。
(7)将100kg辉铋矿进行联合焙烧,转化时消耗1.1kg金属Bi,假设其余各步损失不计,干燥后称量
产品质量为32kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为_______。
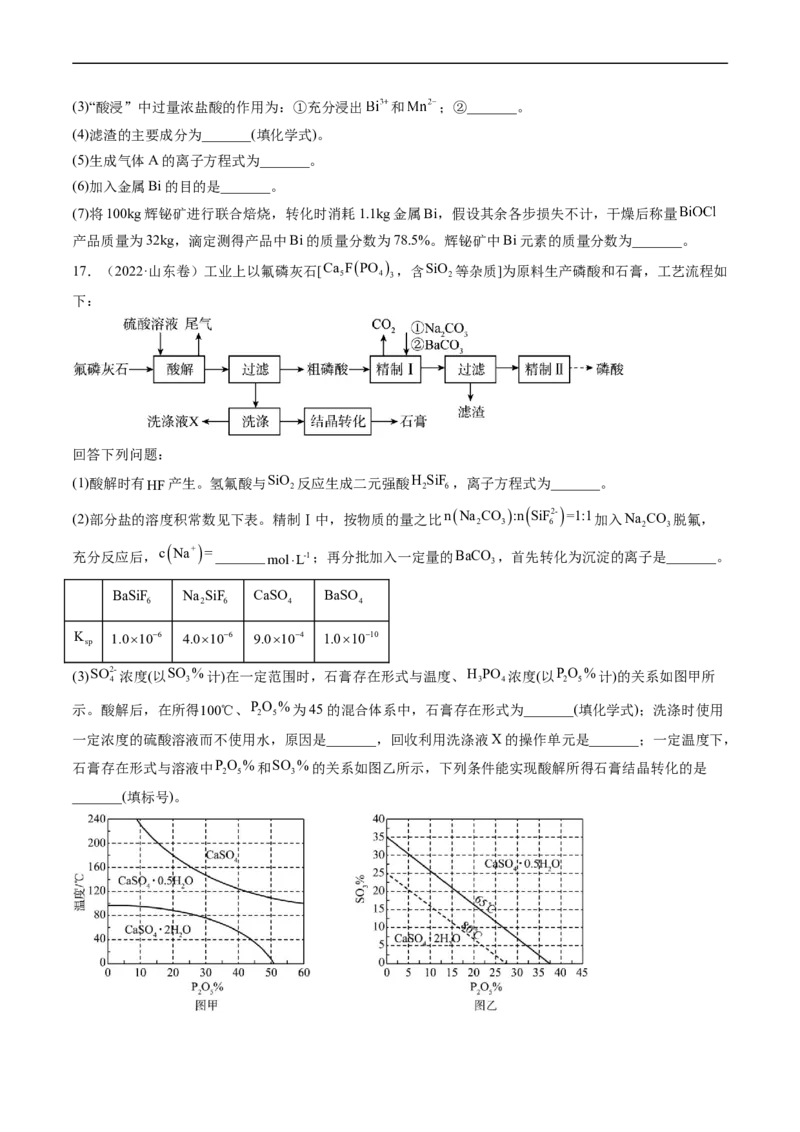
17.(2022·山东卷)工业上以氟磷灰石[Ca FPO ,含SiO 等杂质]为原料生产磷酸和石膏,工艺流程如
5 4 3 2
下:
回答下列问题:
(1)酸解时有HF产生。氢氟酸与SiO
2
反应生成二元强酸H
2
SiF
6
,离子方程式为_______。
(2)部分盐的溶度积常数见下表。精制Ⅰ中,按物质的量之比nNa CO :n SiF2- =1:1加入Na CO 脱氟,
2 3 6 2 3
充分反应后,c
Na+
=_______molL-1;再分批加入一定量的BaCO
3
,首先转化为沉淀的离子是_______。
BaSiF Na SiF CaSO BaSO
6 2 6 4 4
K 1.0106 4.0106 9.0104 1.01010
sp
(3)SO2- 浓度(以SO %计)在一定范围时,石膏存在形式与温度、H PO 浓度(以PO %计)的关系如图甲所
4 3 3 4 2 5
示。酸解后,在所得100℃、P
2
O
5
%为45的混合体系中,石膏存在形式为_______(填化学式);洗涤时使用
一定浓度的硫酸溶液而不使用水,原因是_______,回收利用洗涤液X的操作单元是_______;一定温度下,
石膏存在形式与溶液中PO %和SO %的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是
2 5 3
_______(填标号)。A.65℃、P
2
O
5
%=15、SO
3
%=15 B.80℃、P
2
O
5
%=10、SO
3
%=20
C.65℃、P
2
O
5
%=10、SO
3
%=30 D.80℃、P
2
O
5
%=10、SO
3
%=10
〖2021年高考真题〗
考点一 除杂提纯类
18.(2021·全国乙卷)磁选后的炼铁高钛炉渣,主要成分有 、 、 、 、 以及
少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺条件下,有关金属离子开始沉淀和沉淀完全的 见下表
金属离子
开始沉淀的 2.2 3.5 9.5 12.4
沉淀完全 的 3.2 4.7 11.1 13.8
回答下列问题:
(1)“焙烧”中, 、 几乎不发生反应, 、 、 、 转化为相应的硫酸盐,写出
转化为 的化学方程式_______。
(2)“水浸”后“滤液”的 约为2.0,在“分步沉淀”时用氨水逐步调节 至11.6,依次析出的金属离子是
_______。
(3)“母液①"中 浓度为_______ 。
(4)“水浸渣”在160℃“酸溶”最适合的酸是_______。“酸溶渣”的成分是_______、_______。
(5)“酸溶”后,将溶液适当稀释并加热, 水解析出 沉淀,该反应的离子方程式是
_______。
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得_______,循环利用。
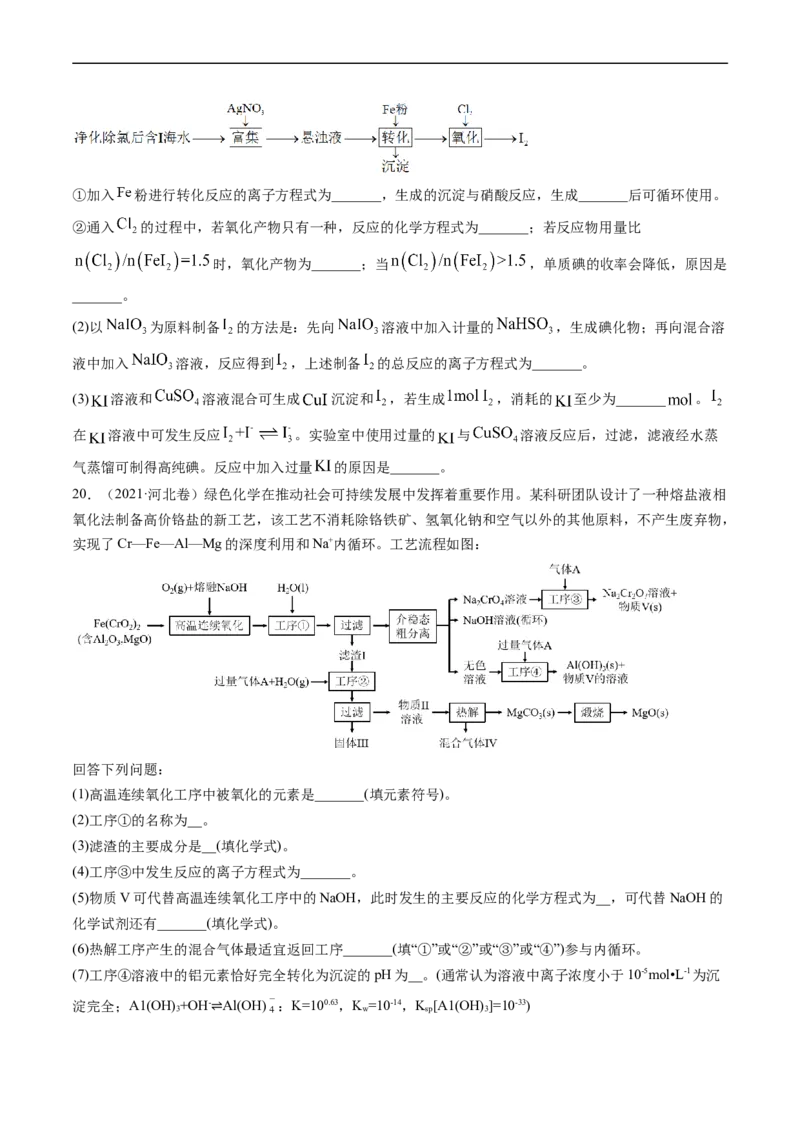
19.(2021·全国甲卷)碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1) 的一种制备方法如下图所示:①加入 粉进行转化反应的离子方程式为_______,生成的沉淀与硝酸反应,生成_______后可循环使用。
②通入 的过程中,若氧化产物只有一种,反应的化学方程式为_______;若反应物用量比
时,氧化产物为_______;当 ,单质碘的收率会降低,原因是
_______。
(2)以 为原料制备 的方法是:先向 溶液中加入计量的 ,生成碘化物;再向混合溶
液中加入 溶液,反应得到 ,上述制备 的总反应的离子方程式为_______。
(3) 溶液和 溶液混合可生成 沉淀和 ,若生成 ,消耗的 至少为_______ 。
在 溶液中可发生反应 。实验室中使用过量的 与 溶液反应后,过滤,滤液经水蒸
气蒸馏可制得高纯碘。反应中加入过量 的原因是_______。
20.(2021·河北卷)绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相
氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,
实现了Cr—Fe—Al—Mg的深度利用和Na+内循环。工艺流程如图:
回答下列问题:
(1)高温连续氧化工序中被氧化的元素是_______(填元素符号)。
(2)工序①的名称为__。
(3)滤渣的主要成分是__(填化学式)。
(4)工序③中发生反应的离子方程式为_______。
(5)物质V可代替高温连续氧化工序中的NaOH,此时发生的主要反应的化学方程式为__,可代替NaOH的
化学试剂还有_______(填化学式)。
(6)热解工序产生的混合气体最适宜返回工序_______(填“①”或“②”或“③”或“④”)参与内循环。
(7)工序④溶液中的铝元素恰好完全转化为沉淀的pH为__。(通常认为溶液中离子浓度小于10-5mol•L-1为沉
淀完全;A1(OH) +OH- Al(OH) :K=100.63,K =10-14,K [A1(OH) ]=10-33)
3 w sp 3
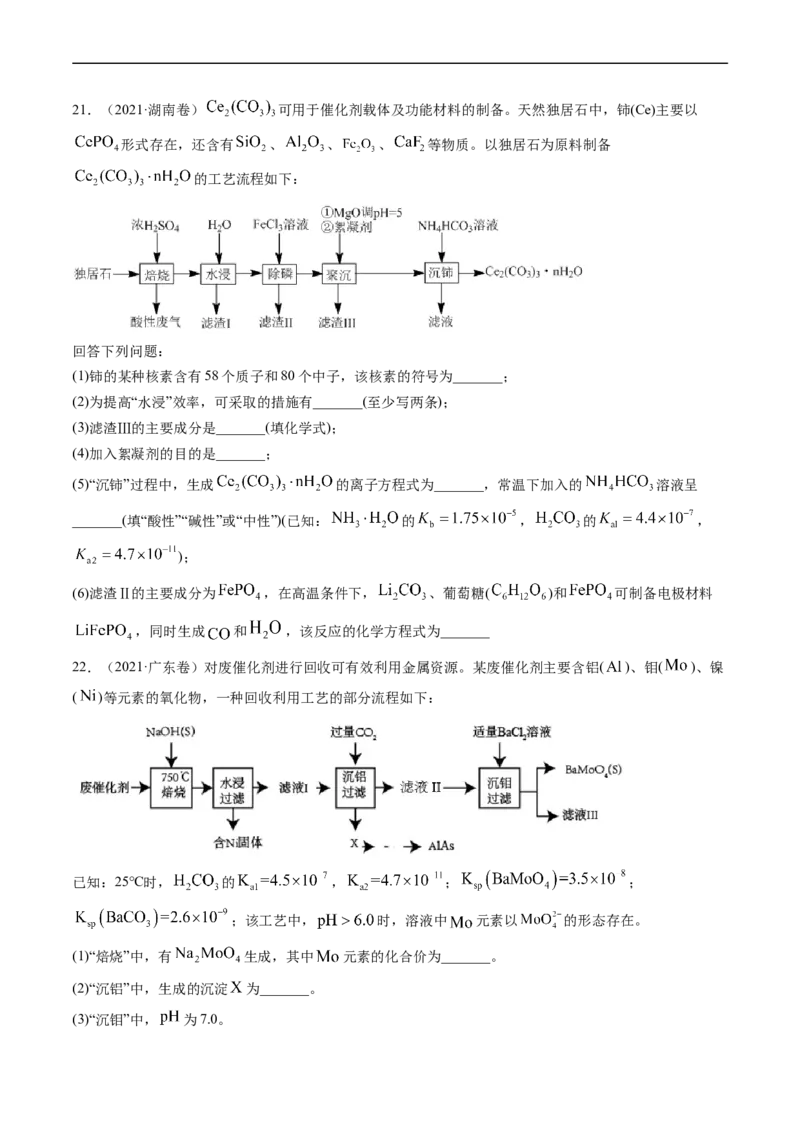
⇌21.(2021·湖南卷) 可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以
形式存在,还含有 、 、 、 等物质。以独居石为原料制备
的工艺流程如下:
回答下列问题:
(1)铈的某种核素含有58个质子和80个中子,该核素的符号为_______;
(2)为提高“水浸”效率,可采取的措施有_______(至少写两条);
(3)滤渣Ⅲ的主要成分是_______(填化学式);
(4)加入絮凝剂的目的是_______;
(5)“沉铈”过程中,生成 的离子方程式为_______,常温下加入的 溶液呈
_______(填“酸性”“碱性”或“中性”)(已知: 的 , 的 ,
);
(6)滤渣Ⅱ的主要成分为 ,在高温条件下, 、葡萄糖( )和 可制备电极材料
,同时生成 和 ,该反应的化学方程式为_______
22.(2021·广东卷)对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝( )、钼( )、镍
( )等元素的氧化物,一种回收利用工艺的部分流程如下:
已知:25℃时, 的 , ; ;
;该工艺中, 时,溶液中 元素以 的形态存在。
(1)“焙烧”中,有 生成,其中 元素的化合价为_______。
(2)“沉铝”中,生成的沉淀 为_______。
(3)“沉钼”中, 为7.0。①生成 的离子方程式为_______。
②若条件控制不当, 也会沉淀。为避免 中混入 沉淀,溶液中
_______(列出算式)时,应停止加入 溶液。
(4)①滤液Ⅲ中,主要存在的钠盐有 和 , 为_______。
②往滤液Ⅲ中添加适量 固体后,通入足量_______(填化学式)气体,再通入足量 ,可析出 。
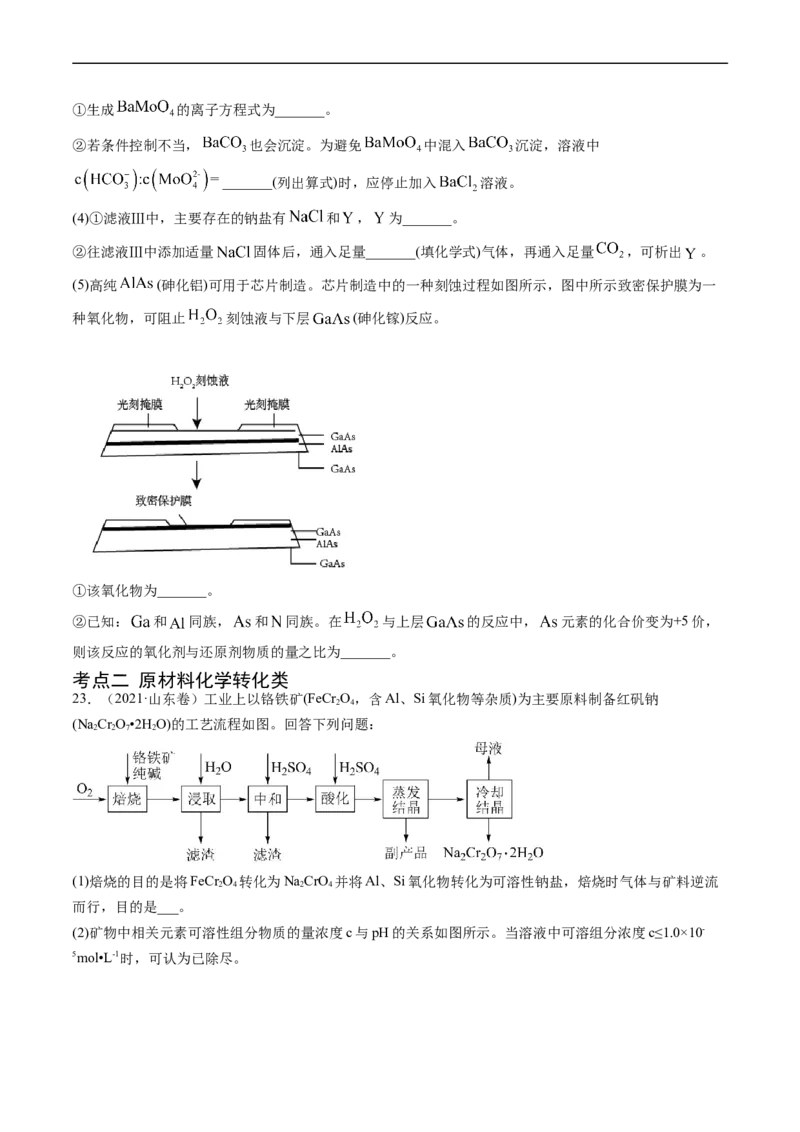
(5)高纯 (砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一
种氧化物,可阻止 刻蚀液与下层 (砷化镓)反应。
①该氧化物为_______。
②已知: 和 同族, 和 同族。在 与上层 的反应中, 元素的化合价变为+5价,
则该反应的氧化剂与还原剂物质的量之比为_______。
考点二 原材料化学转化类
23.(2021·山东卷)工业上以铬铁矿(FeCr O,含Al、Si氧化物等杂质)为主要原料制备红矾钠
2 4
(NaCr O•2HO)的工艺流程如图。回答下列问题:
2 2 7 2
(1)焙烧的目的是将FeCr O 转化为NaCrO 并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流
2 4 2 4
而行,目的是___。
(2)矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示。当溶液中可溶组分浓度c≤1.0×10-
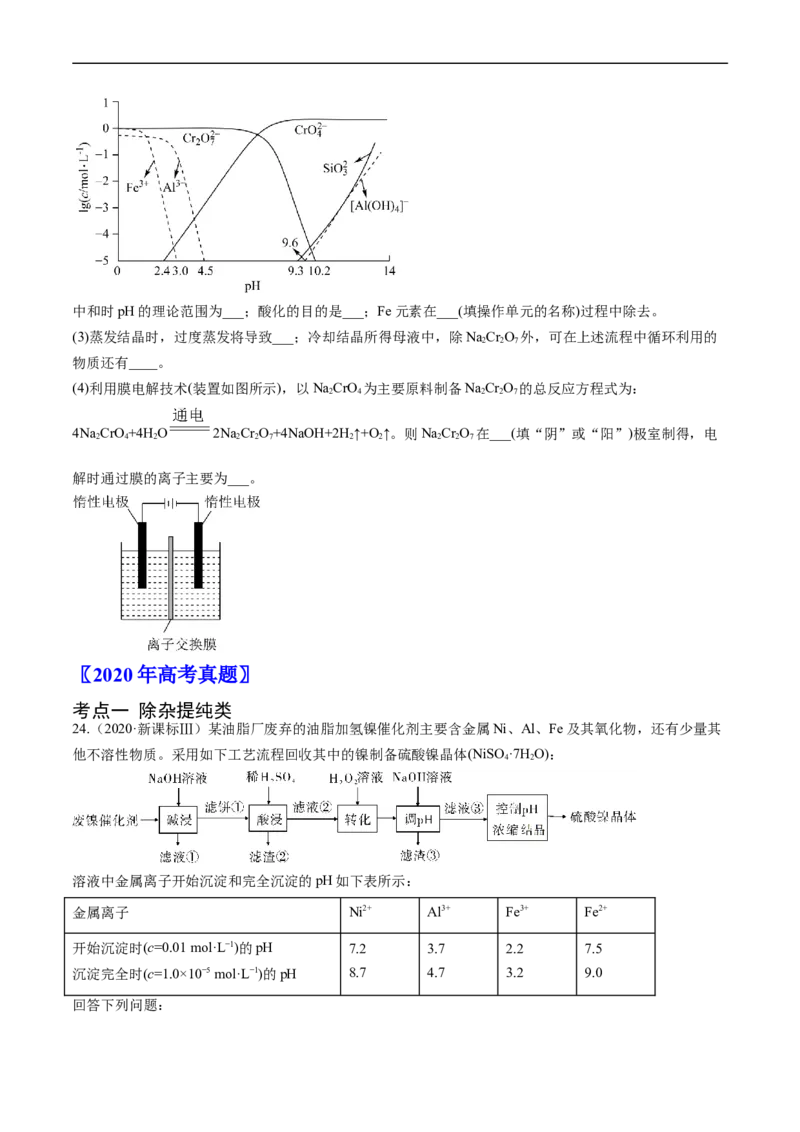
5mol•L-1时,可认为已除尽。中和时pH的理论范围为___;酸化的目的是___;Fe元素在___(填操作单元的名称)过程中除去。
(3)蒸发结晶时,过度蒸发将导致___;冷却结晶所得母液中,除NaCr O 外,可在上述流程中循环利用的
2 2 7
物质还有____。
(4)利用膜电解技术(装置如图所示),以NaCrO 为主要原料制备NaCr O 的总反应方程式为:
2 4 2 2 7
4NaCrO+4HO 2NaCr O+4NaOH+2H↑+O↑。则NaCr O 在___(填“阴”或“阳”)极室制得,电
2 4 2 2 2 7 2 2 2 2 7
解时通过膜的离子主要为___。
〖2020年高考真题〗
考点一 除杂提纯类
24.(2020·新课标Ⅲ)某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其
他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO ·7H O):
4 2
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 Ni2+ Al3+ Fe3+ Fe2+
开始沉淀时(c=0.01 mol·L−1)的pH 7.2 3.7 2.2 7.5
沉淀完全时(c=1.0×10−5 mol·L−1)的pH 8.7 4.7 3.2 9.0
回答下列问题:(1)“碱浸”中NaOH的两个作用分别是____________________________________。为回收金属,用稀
硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式_________________________。
(2)“滤液②”中含有的金属离子是_________________________。
(3)“转化”中可替代HO 的物质是_________________________。若工艺流程改为先“调pH”后“转
2 2
化”,即
“滤液③”中可能含有的杂质离子为_________________________。
(4)利用上述表格数据,计算Ni(OH) 的K =______________(列出计算式)。如果“转化”后的溶液中
2 sp
Ni2+浓度为1.0 mol·L−1,则“调pH”应控制的pH范围是_________________________。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离
子方程式_________________________。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是_________________________。
25.(2020·江苏卷)实验室由炼钢污泥(简称铁泥,主要成份为铁的氧化物)制备软磁性材料α-Fe O。
2 3
其主要实验流程如下:
(1)酸浸:用一定浓度的HSO 溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高
2 4
铁元素浸出率的有___________(填序号)。
A.适当升高酸浸温度
B.适当加快搅拌速度
C.适当缩短酸浸时间
(2)还原:向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+。“还原”过程中除生成Fe2+外,
还会生成___________(填化学式);检验Fe3+是否还原完全的实验操作是______________。
(3)除杂:向“还原”后的滤液中加入NH F溶液,使Ca2+转化为CaF 沉淀除去。若溶液的pH偏低、将
4 2
会导致CaF 沉淀不完全,其原因是___________[ , ]。
2
(4)沉铁:将提纯后的FeSO 溶液与氨水-NH HCO 混合溶液反应,生成FeCO 沉淀。
4 4 3 3
①生成FeCO 沉淀的离子方程式为____________________________________。
3
②设计以FeSO 溶液、氨水- NHHCO 混合溶液为原料,制备FeCO 的实验方案:______________。
4 4 3 3
【FeCO 沉淀需“洗涤完全”,Fe(OH) 开始沉淀的pH=6.5】。
3 2
考点二 原材料化学转化类
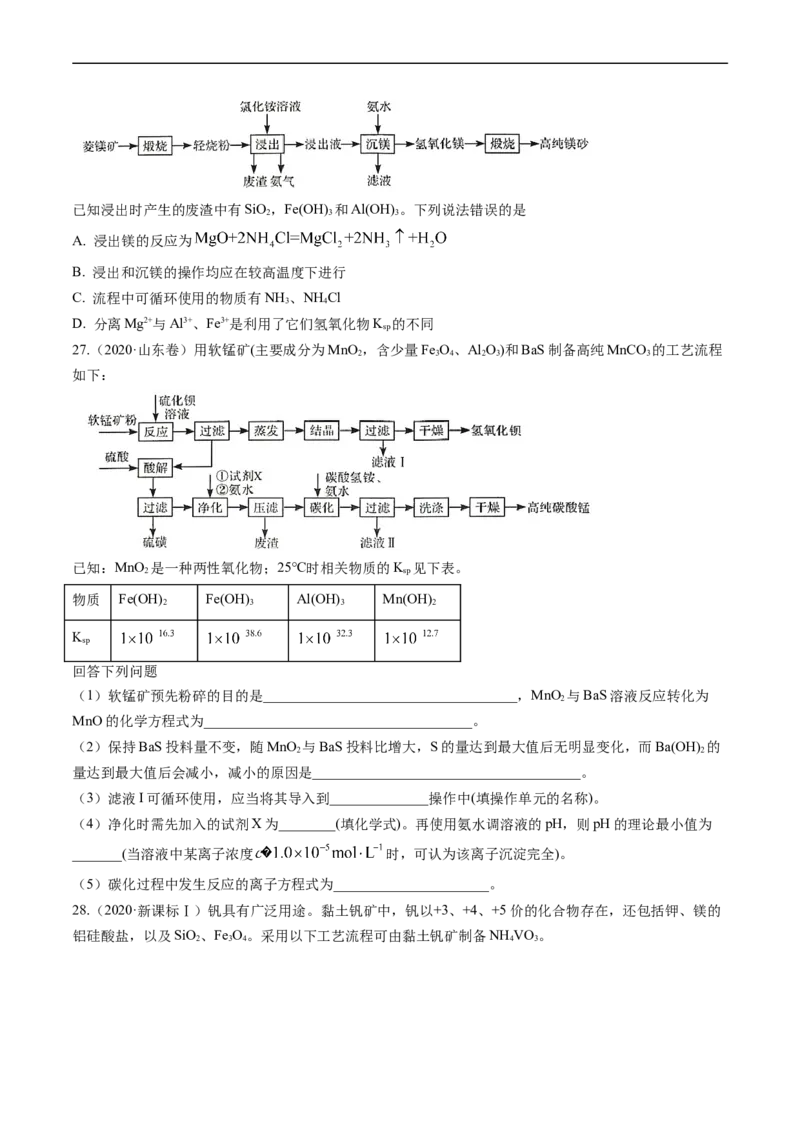
26.(2020·山东卷)以菱镁矿(主要成分为MgCO ,含少量SiO,Fe O 和A1 O)为原料制备高纯镁砂的工
3 2 2 3 2 3
艺流程如下:已知浸出时产生的废渣中有SiO,Fe(OH) 和Al(OH) 。下列说法错误的是
2 3 3
A. 浸出镁的反应为
B. 浸出和沉镁的操作均应在较高温度下进行
C. 流程中可循环使用的物质有NH 、NH Cl
3 4
D. 分离Mg2+与Al3+、Fe3+是利用了它们氢氧化物K 的不同
sp
27.(2020·山东卷)用软锰矿(主要成分为MnO ,含少量Fe O、Al O)和BaS制备高纯MnCO 的工艺流程
2 3 4 2 3 3
如下:
已知:MnO 是一种两性氧化物;25℃时相关物质的K 见下表。
2 sp
物质 Fe(OH) Fe(OH) Al(OH) Mn(OH)
2 3 3 2
K
sp
回答下列问题
(1)软锰矿预先粉碎的目的是____________________________________,MnO 与BaS溶液反应转化为
2
MnO的化学方程式为______________________________________。
(2)保持BaS投料量不变,随MnO 与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH) 的
2 2
量达到最大值后会减小,减小的原因是______________________________________。
(3)滤液I可循环使用,应当将其导入到______________操作中(填操作单元的名称)。
(4)净化时需先加入的试剂X为________(填化学式)。再使用氨水调溶液的pH,则pH的理论最小值为
_______(当溶液中某离子浓度 时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为______________________。
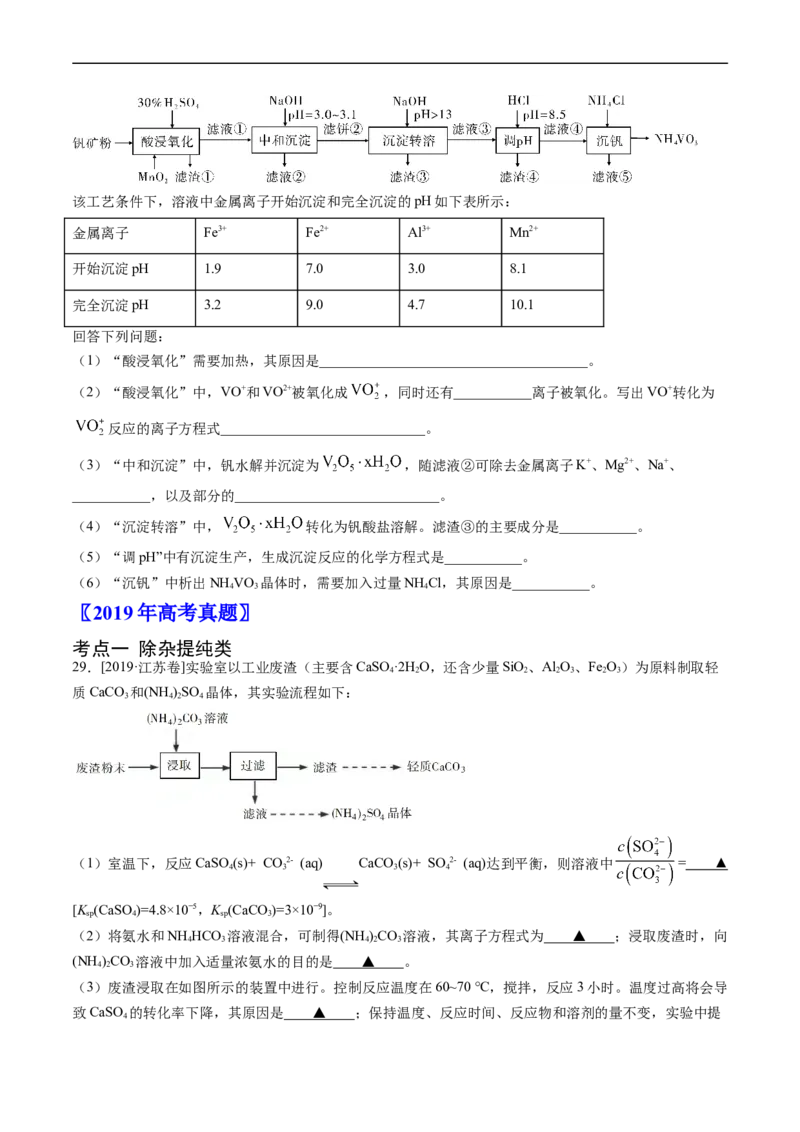
28.(2020·新课标Ⅰ)钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的
铝硅酸盐,以及SiO、Fe O。采用以下工艺流程可由黏土钒矿制备NH VO 。
2 3 4 4 3该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 Fe3+ Fe2+ Al3+ Mn2+
开始沉淀pH 1.9 7.0 3.0 8.1
完全沉淀pH 3.2 9.0 4.7 10.1
回答下列问题:
(1)“酸浸氧化”需要加热,其原因是______________________________________。
(2)“酸浸氧化”中,VO+和VO2+被氧化成 ,同时还有___________离子被氧化。写出VO+转化为
反应的离子方程式_____________________________。
(3)“中和沉淀”中,钒水解并沉淀为 ,随滤液②可除去金属离子K+、Mg2+、Na+、
___________,以及部分的_____________________________。
(4)“沉淀转溶”中, 转化为钒酸盐溶解。滤渣③的主要成分是___________。
(5)“调pH”中有沉淀生产,生成沉淀反应的化学方程式是___________。
(6)“沉钒”中析出NH VO 晶体时,需要加入过量NH Cl,其原因是___________。
4 3 4
〖2019年高考真题〗
考点一 除杂提纯类
29.[2019·江苏卷]实验室以工业废渣(主要含CaSO·2H O,还含少量SiO、Al O、Fe O)为原料制取轻
4 2 2 2 3 2 3
质CaCO 和(NH )SO 晶体,其实验流程如下:
3 4 2 4
(1)室温下,反应CaSO(s)+ CO2- (aq) CaCO (s)+ SO 2- (aq)达到平衡,则溶液中 = ▲
4 3 3 4
[K (CaSO)=4.8×10−5,K (CaCO)=3×10−9]。
sp 4 sp 3
(2)将氨水和NH HCO 溶液混合,可制得(NH )CO 溶液,其离子方程式为 ▲ ;浸取废渣时,向
4 3 4 2 3
(NH )CO 溶液中加入适量浓氨水的目的是 ▲ 。
4 2 3
(3)废渣浸取在如图所示的装置中进行。控制反应温度在60~70 ℃,搅拌,反应3小时。温度过高将会导
致CaSO 的转化率下降,其原因是 ▲ ;保持温度、反应时间、反应物和溶剂的量不变,实验中提
4高CaSO 转化率的操作有 ▲ 。
4
(4)滤渣水洗后,经多步处理得到制备轻质CaCO 所需的CaCl 溶液。设计以水洗后的滤渣为原料,制取
3 2
CaCl 溶液的实验方案: ▲ [已知pH=5时Fe(OH) 和Al(OH) 沉淀完全;pH=8.5时Al(OH) 开始溶解。
2 3 3 3
实验中必须使用的试剂:盐酸和Ca(OH) ]。
2
考点二 原材料化学转化类
30.[2019·新课标Ⅰ]硼酸(HBO)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种
3 3
以硼镁矿(含MgB O·H O、SiO 及少量Fe O、Al O)为原料生产硼酸及轻质氧化镁的工艺流程如下:
2 2 5 2 2 2 3 2 3
回答下列问题:
(1)在95 ℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为_________。
(2)“滤渣1”的主要成分有_________。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试
剂是_________。
(3)根据HBO 的解离反应:HBO+H O===H++B(OH)−,K=5.81×10−10,可判断HBO 是______酸;在
3 3 3 3 2 4 a 3 3
“过滤2”前,将溶液pH调节至3.5,目的是_______________。
(4)在“沉镁”中生成Mg(OH) ·MgCO 沉淀的离子方程式为__________,母液经加热后可返回
2 3
___________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是_________。
31.[2019·新课标Ⅱ]立德粉ZnS·BaSO(也称锌钡白),是一种常用白色颜料。回答下列问题:
4
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,
钡的焰色为__________(填标号)。
A.黄色 B.红色 C.紫色 D.绿色
(2)以重晶石(BaSO)为原料,可按如下工艺生产立德粉:
4
①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为______________________。回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO 和一种清洁能源气体,该反应
2
的化学方程式为______________________。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”
表面生成了难溶于水的___________(填化学式)。
③沉淀器中反应的离子方程式为______________________。
(3)成品中S2−的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000
mol·L−1的I−KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉为指示剂,
2
过量的I 用0.1000 mol·L−1NaSO 溶液滴定,反应式为I+2 ==2I−+ 。测定时消耗NaSO 溶液
2 2 2 3 2 2 2 3
体积V mL。终点颜色变化为_________________,样品中S2−的含量为______________(写出表达式)。
32.[2019·新课标Ⅲ] 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫
化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
0
金属离子 Mn2+ Fe2+ Fe3+ Al3+ Mg2+ Zn2+ Ni2+
开始沉淀的pH 8.1 6.3 1.5 3.4 8.9 6.2 6.9
沉淀完全的pH 10.1 8.3 2.8 4.7 10.9 8.2 8.9
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方
程式____________________________________________________。
(2)“氧化”中添加适量的MnO 的作用是________________________。
2
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF 沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
2
_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNiCoMnO,其中Ni、Co、Mn的
x y z 2
化合价分别为+2、+3、+4。当x=y= 时,z=___________。