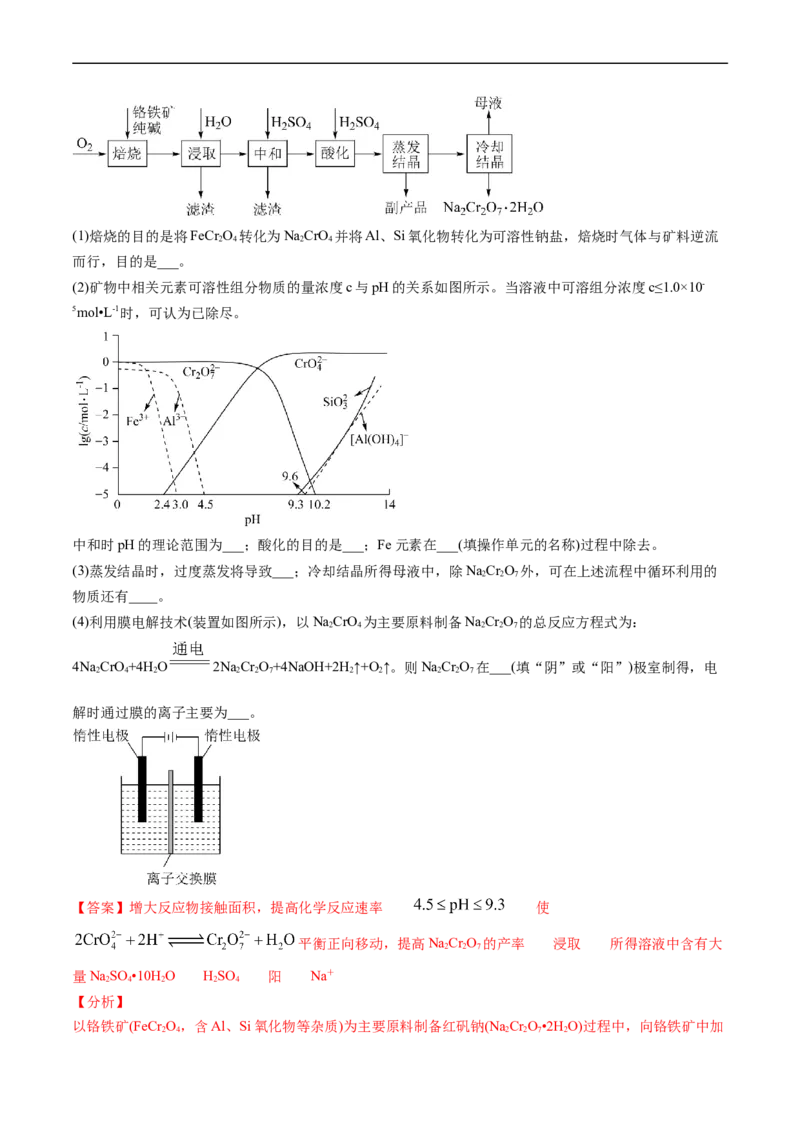
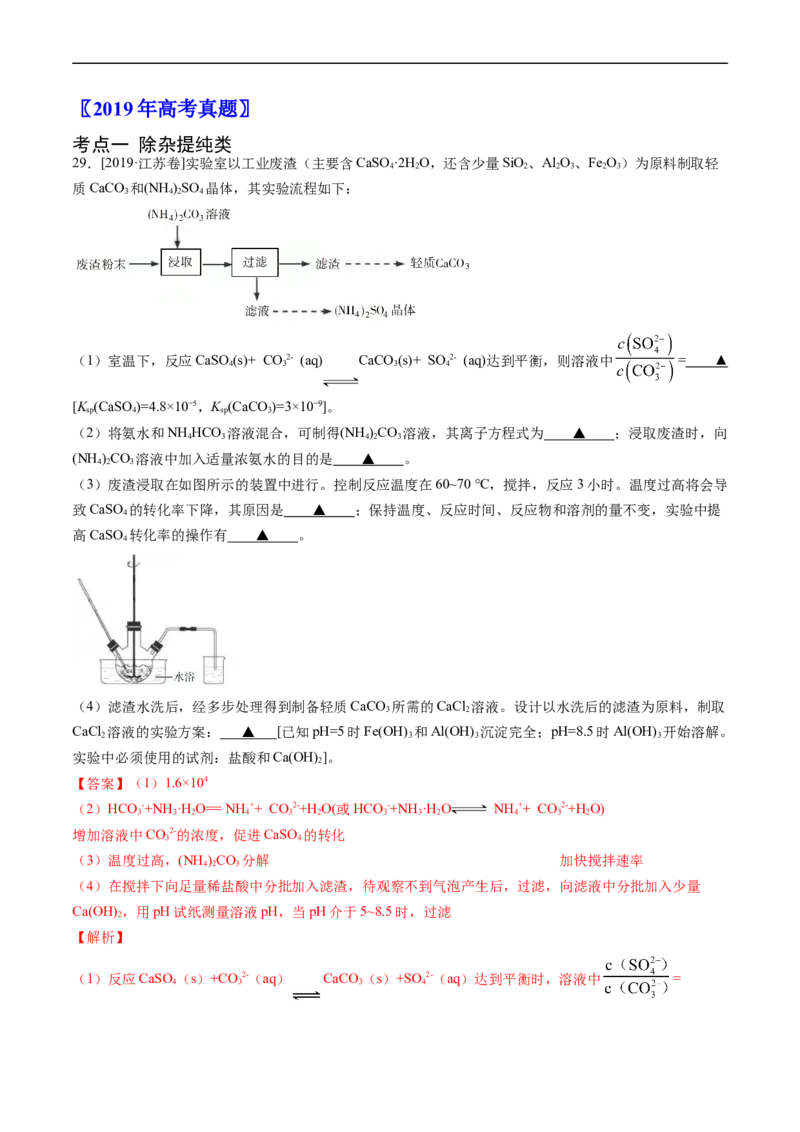
文档内容
五年(2019-2023)年高考真题分项汇编
专题 13 工艺流程综合题
〖203年高考真题〗
考点一 除杂提纯类
1.(2023·新课标卷)铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、
铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:
已知:最高价铬酸根在酸性介质中以Cr O 存在,在碱性介质中以CrO 存在。
2
回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为___________(填化学式)。
(2)水浸渣中主要有SiO 和___________。
2
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是___________。
(4)“除硅磷”步骤中,使硅、磷分别以MgSiO 和MgNH PO 的形式沉淀,该步需要控制溶液的pH≈9以达
3 4 4
到最好的除杂效果,若pH<9时,会导致___________;pH>9时,会导致___________。
(5)“分离钒”步骤中,将溶液pH调到1.8左右得到VO 沉淀,VO 在pH<1时,溶解为VO 或VO3+在碱
2 5 2 5
性条件下,溶解为VO 或VO ,上述性质说明VO 具有___________(填标号)。
2 5
A.酸性 B.碱性 C.两性
(6)“还原”步骤中加入焦亚硫酸钠(Na SO)溶液,反应的离子方程式为___________。
2 2 5
【答案】(1)Na CrO
2 4
(2)Fe O
2 3
(3)Al(OH)
3
(4) 磷酸根会与H+反应使其浓度降低导致MgNH PO 无法完全沉淀,同时可能产生硅酸胶状沉淀不宜处理
4 4
会导镁离子生成氢氧化镁沉淀,不能形成MgSiO 沉淀,导致产品中混有杂质,同时溶液中铵根离子浓度
3
降低导致MgNH PO 无法完全沉淀
4 4
(5)C
(6)2Cr O +3S O +10H+=4Cr3++6SO +5H O
2 2 2
【分析】由题给流程可知,铬钒渣在氢氧化钠和空气中煅烧,将钒、铬、铝、硅、磷等元素转化为相应的
最高价含氧酸盐,煅烧渣加入水浸取、过滤得到含有二氧化硅、氧化铁的滤渣和滤液;向滤液中加入稀硫
酸调节溶液pH将Al元素转化为氢氧化铝沉淀,过滤得到强氧化铝滤渣和滤液;向滤液中加入硫酸镁溶液、硫酸铵溶液将硅元素、磷元素转化为MgSiO 和MgNH PO 沉淀,过滤得到含有MgSiO 、MgNH PO 的滤
3 4 4 3 4 4
渣和滤液;向滤液中加入稀硫酸调节溶液pH将钒元素转化为五氧化二钒,过滤得到五氧化二钒和滤液;
向滤液中焦亚硫酸钠溶液将铬元素转化为三价铬离子,调节溶液pH将铬元素转化为氢氧化铬沉淀,过滤
得到氢氧化铬。
【详解】(1)由分析可知,煅烧过程中,铬元素转化为铬酸钠,故答案为:NaCrO;
2 4
(2)由分析可知,水浸渣中主要有二氧化硅、氧化铁,故答案为:Fe O;
2 3
(3)由分析可知,沉淀步骤调pH到弱碱性的目的是将Al元素转化为氢氧化铝沉淀,故答案为:
Al(OH) ;
3
(4)由分析可知,加入硫酸镁溶液、硫酸铵溶液的目的是将硅元素、磷元素转化为MgSiO 和MgNH PO
3 4 4
沉淀,若溶液pH<9时,磷酸根会与H+反应使其浓度降低导致MgNH PO 无法完全沉淀,同时可能产生硅
4 4
酸胶状沉淀不宜处理;若溶液pH>9时,会导镁离子生成氢氧化镁沉淀,不能形成MgSiO 沉淀,导致产品
3
中混有杂质,同时溶液中铵根离子浓度降低导致MgNH PO 无法完全沉淀,故答案为:磷酸根会与H+反应
4 4
使其浓度降低导致MgNH PO ,同时可能产生硅酸胶状沉淀不宜处理;会导镁离子生成氢氧化镁沉淀,不
4 4
能形成MgSiO 沉淀,导致产品中混有杂质,同时溶液中铵根离子浓度降低导致MgNH PO 无法完全沉淀;
3 4 4
(5)由题给信息可知,五氧化二钒水能与酸溶液反应生成盐和水,也能与碱溶液发生生成盐和水的两性
氧化物,故选C;
(6)由题意可知,还原步骤中加入焦亚硫酸钠溶液的目的是将铬元素转化为铬离子,反应的离子方程式
为2Cr O +3S O +10H+=4Cr3++6SO +5H O,故答案为:2Cr O +3S O +10H+=4Cr3++6SO +5H O。
2 2 2 2 2 2
2.(2023·湖北卷) 是生产多晶硅的副产物。利用 对废弃的锂电池正极材料 进行氯化处
理以回收Li、Co等金属,工艺路线如下:
回答下列问题:
(1)Co位于元素周期表第_______周期,第_______族。
(2)烧渣是LiCl、 和 的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量
烟雾,用化学方程式表示其原因_______。
(3)鉴别洗净的“滤饼3”和固体 常用方法的名称是_______。
(4)已知 ,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为_______
。“850℃煅烧”时的化学方程式为_______。
(5)导致 比 易水解的因素有_______(填标号)。a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
【答案】(1) 4 Ⅷ
(2)
(3)焰色反应
(4)
(5)abd
【分析】由流程和题中信息可知, 粗品与 在500℃焙烧时生成氧气和烧渣,烧渣是LiCl、
和 的混合物;烧渣经水浸、过滤后得滤液1和滤饼1,滤饼1的主要成分是 和 ;滤
液1用氢氧化钠溶液沉钴,过滤后得滤饼2(主要成分为 )和滤液2(主要溶质为LiCl);滤饼2
置于空气中在850℃煅烧得到 ;滤液2经碳酸钠溶液沉锂,得到滤液3和滤饼3,滤饼3为 。
【详解】(1)Co是27号元素,其原子有4个电子层,其价电子排布为 ,元素周期表第8、9、10
三个纵行合称第Ⅷ族,因此,其位于元素周期表第4周期、第Ⅷ族。
(2)“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,由此可知,四氯化硅与可水
反应且能生成氯化氢和硅酸,故其原因是: 遇水剧烈水解,生成硅酸和氯化氢,该反应的化学方程
式为 。
(3)洗净的“滤饼3”的主要成分为 ,常用焰色反应鉴别 和 , 的焰色反应为
紫红色,而 的焰色反应为黄色。故鉴别“滤饼3”和固体 常用方法的名称是焰色反应。
(4)已知 ,若“沉钴过滤”的pH控制为10.0,则溶液中
, 浓度为 。“850℃煅烧”时,
与 反应生成 和 ,该反应的化学方程式为 。
(5)a.Si-Cl键极性更大,则 Si-Cl键更易断裂,因此, 比 易水解,a有关;
b.Si的原子半径更大,因此, 中的共用电子对更加偏向于 ,从而导致Si-Cl键极性更大,且Si原
子更易受到水电离的 的进攻,因此, 比 易水解,b有关;
c.通常键能越大化学键越稳定且不易断裂,因此,Si-Cl键键能更大不能说明Si-Cl更易断裂,故不能说明
比 易水解,c无关;
d.Si有更多的价层轨道,因此更易与水电离的 形成化学键,从而导致 比 易水解,d有关;
综上所述,导致 比 易水解的因素有abd。
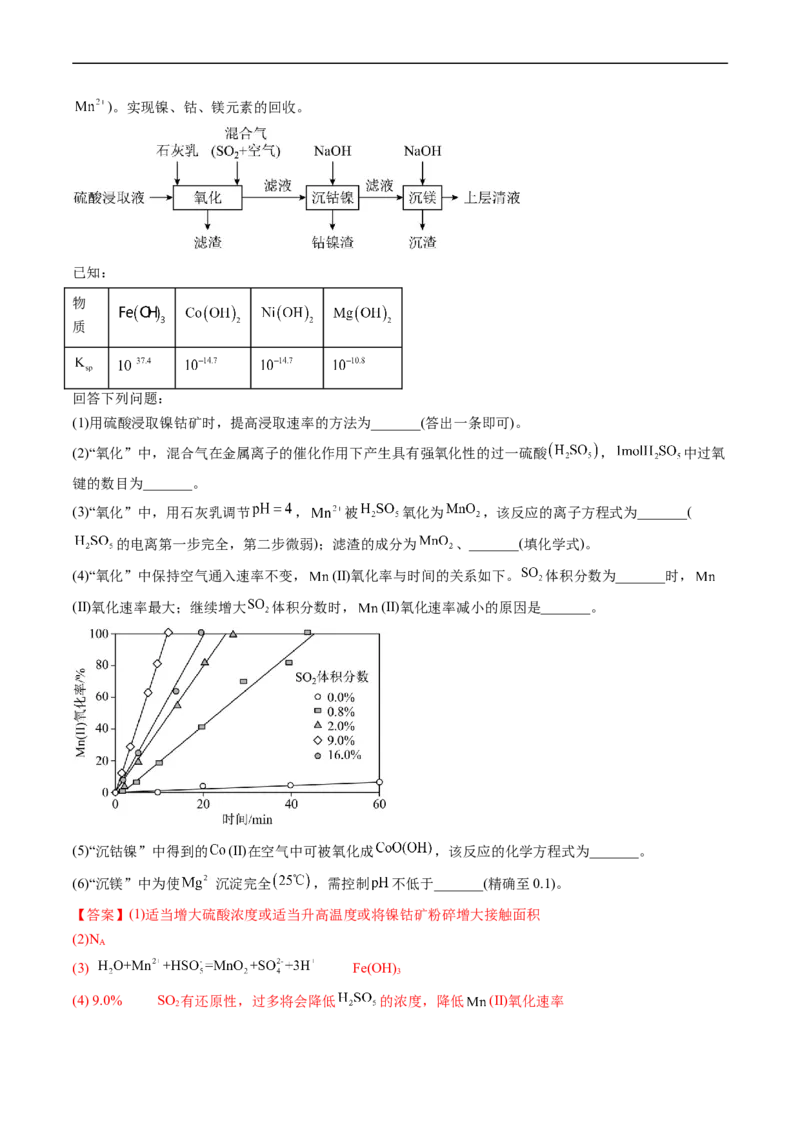
3.(2023·辽宁卷)某工厂采用如下工艺处理镍钴矿硫酸浸取液含( 和)。实现镍、钴、镁元素的回收。
已知:
物
质
回答下列问题:
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为_______(答出一条即可)。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸 , 中过氧
键的数目为_______。
(3)“氧化”中,用石灰乳调节 , 被 氧化为 ,该反应的离子方程式为_______(
的电离第一步完全,第二步微弱);滤渣的成分为 、_______(填化学式)。
(4)“氧化”中保持空气通入速率不变, (Ⅱ)氧化率与时间的关系如下。 体积分数为_______时,
(Ⅱ)氧化速率最大;继续增大 体积分数时, (Ⅱ)氧化速率减小的原因是_______。
(5)“沉钴镍”中得到的 (Ⅱ)在空气中可被氧化成 ,该反应的化学方程式为_______。
(6)“沉镁”中为使 沉淀完全 ,需控制 不低于_______(精确至0.1)。
【答案】(1)适当增大硫酸浓度或适当升高温度或将镍钴矿粉碎增大接触面积
(2)N
A
(3) Fe(OH)
3
(4) 9.0% SO 有还原性,过多将会降低 的浓度,降低 (Ⅱ)氧化速率
2(5)
(6)11.1
【分析】在“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸 ,用石灰
乳调节 , 被 氧化为 ,发生反应 ,Fe3+水解同
时生成氢氧化铁,“沉钻镍”过程中,Co2+变为Co(OH) ,在空气中可被氧化成 。
2
【详解】(1)用硫酸浸取镍钴矿时,为提高浸取速率可适当增大硫酸浓度、升高温度或将镍钴矿粉碎增
大接触面积
(2) 的结构简式为 ,所以 中过氧键的数目为N
A
(3)用石灰乳调节 , 被 氧化为 ,该反应的离子方程式为:
;氢氧化铁的Ksp=10-37.4,当铁离子完全沉淀时,溶液中c(Fe3+)=10-
5mol/L, ,c(OH-)=10-10.8mol/L,根据Kw=10-14,pH=3.2,此时溶
液的pH=4,则铁离子完全水解,生成氢氧化铁沉淀,故滤渣还有氢氧化铁;
(4)根据图示可知 体积分数为0.9%时, (Ⅱ)氧化速率最大;继续增大 体积分数时,由于SO 有
2
还原性,过多将会降低 的浓度,降低 (Ⅱ)氧化速率
(5)“沉钻镍”中得到的Co(OH) ,在空气中可被氧化成 ,该反应的化学方程式为:
2
;
(6)氢氧化镁的Ksp=10-10.8, 当镁离子完全沉淀时,c(Mg2+)=10-5mol/L,根据Ksp可计算c(OH-)=10-
2.9mol/L,根据Kw=10-14,c(H+)=10-11.1mol/L,所以溶液的pH=11.1;
考点二 原材料化学转化类
4.(2023·全国甲卷) 是一种压电材料。以 为原料,采用下列路线可制备粉状 。
回答下列问题:
(1)“焙烧”步骤中碳粉的主要作用是_______。
(2)“焙烧”后固体产物有 、易溶于水的 和微溶于水的 。“浸取”时主要反应的离子方程式为
_______。
(3)“酸化”步骤应选用的酸是_______(填标号)。
a.稀硫酸 b.浓硫酸 c.盐酸 d.磷酸(4)如果焙烧后的产物直接用酸浸取,是否可行?_______,其原因是_______。
(5)“沉淀”步骤中生成 的化学方程式为_______。
(6)“热分解”生成粉状钛酸钡,产生的 _______。
【答案】(1)做还原剂,将 还原
(2)
(3)c
(4)不可行 产物中的硫化物与酸反应生成的有毒气体 会污染空气,而且 与盐酸反应生成可溶
于水的 ,导致 溶液中混有 杂质无法除去、最终所得产品的纯度降低
(5)
(6)
【分析】由流程和题中信息可知, 与过量的碳粉及过量的氯化钙在高温下焙烧得到 、 、易
溶于水的 和微溶于水的 ;烧渣经水浸取后过滤,滤渣中碳粉和 ,滤液中有 和 ;滤
液经酸化后浓缩结晶得到 晶体; 晶体溶于水后,加入 和 将钡离子充分沉淀得
到 ; 经热分解得到 。
【详解】(1)“焙烧”步骤中, 与过量的碳粉及过量的氯化钙在高温下焙烧得到 、 、
和 , 被还原为 ,因此,碳粉的主要作用是做还原剂,将 还原。
(2)“焙烧”后固体产物有 、易溶于水的 和微溶于水的 。易溶于水的 与过量的
可以发生复分解反应生成硫化钙沉淀,因此,“浸取”时主要反应的离子方程式为 。
(3)“酸化”步骤是为了将 转化为易溶液于的钡盐,由于硫酸钡和磷酸钡均不溶于水,而 可溶
于水,因此,应选用的酸是盐酸,选c。
(4)如果焙烧后的产物直接用酸浸取是不可行的,其原因是:产物中的硫化物与酸反应生成的有毒气体
会污染空气,而且 与盐酸反应生成可溶于水的 ,导致 溶液中混有 杂质无法除去、
最终所得产品的纯度降低。
(5)“沉淀”步骤中生成 的化学方程式为: + + =
。
(6)“热分解”生成粉状钛酸钡,该反应的化学方程式为, ,
因此,产生的 = 。
5.(2023·全国乙卷)LiMn O 作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO ,含有少
2 4 3
量Si、Fe、Ni、Al等元素)制备LiMn O 的流程如下:
2 4已知:K [Fe(OH) ]=2.8×10-39,K [Al(OH) ]=1.3×10-33,K [Ni(OH) ]=5.5×10-16。
sp 3 sp 3 sp 2
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为_______。为提高溶矿速率,可采取的措施_______(举1例)。
(2)加入少量MnO 的作用是_______。不宜使用HO 替代MnO ,原因是_______。
2 2 2 2
(3)溶矿反应完成后,反应器中溶液pH=4,此时c(Fe3+)=_______mol·L-1;用石灰乳调节至pH≈7,除去的金
属离子是_______。
(4)加入少量BaS溶液除去Ni2+,生成的沉淀有_______。
(5)在电解槽中,发生电解反应的离子方程式为_______。随着电解反应进行,为保持电解液成分稳定,应
不断_______。电解废液可在反应器中循环利用。
(6)缎烧窑中,生成LiMn O 反应的化学方程式是_______。
2 4
【答案】(1) MnCO+H SO =MnSO +H O+CO↑ 粉碎菱锰矿
3 2 4 4 2 2
(2)将Fe2+氧化为Fe3+ Fe3+可以催化HO 分解
2 2
(3) 2.8×10-9 Al3+
(4)BaSO 、NiS
4
(5) Mn2++2H O H↑+MnO↓+2H+ 加入Mn(OH)
2 2 2 2
(6)2Li CO+8MnO 4LiMn O+2CO ↑+O ↑
2 3 2 2 4 2 2
【分析】根据题给的流程,将菱锰矿置于反应器中,加入硫酸和MnO ,可将固体溶解为离子,将杂质中
2
的Fe、Ni、Al等元素物质也转化为其离子形式,同时,加入的MnO 可以将溶液中的Fe2+氧化为Fe3+;随
2
后将溶液pH调至制约等于7,此时,根据已知条件给出的三种氢氧化物的溶度积可以将溶液中的Al3+沉淀
出来;随后加入BaS,可以将溶液中的Ni2+沉淀,得到相应的滤渣;后溶液中含有大量的Mn2+,将此溶液
置于电解槽中电解,得到MnO ,将MnO 与碳酸锂共同煅烧得到最终产物LiMn O。
2 2 2 4
【详解】(1)菱锰矿中主要含有MnCO ,加入硫酸后可以与其反应,硫酸溶矿主要反应的化学方程式为:
3
MnCO +H SO =MnSO +H O+CO↑;为提高溶矿速率,可以将菱锰矿粉碎;故答案为:
3 2 4 4 2 2
MnCO +H SO =MnSO +H O+CO↑、粉碎菱锰矿。
3 2 4 4 2 2
(2)根据分析,加入MnO 的作用是将酸溶后溶液中含有的Fe2+氧化为Fe3+,但不宜使用HO 氧化Fe2+,
2 2 2
因为氧化后生成的Fe3+可以催化HO 分解,不能使溶液中的Fe2+全部氧化为Fe3+;故答案为:将Fe2+氧化
2 2
为Fe3+、Fe3+可以催化HO 分解。
2 2
(3)溶矿完成以后,反应器中溶液pH=4,此时溶液中c(OH-)=1.0×10-10mol·L-1,此时体系中含有的
c(Fe3+)= =2.8×10-9mol·L-1,这时,溶液中的c(Fe3+)小于1.0×10-5,认为Fe3+已经沉淀完全;用石灰乳调节至pH≈7,这时溶液中c(OH-)=1.0×10-7mol·L-1,溶液中c(Al3+)=1.3×10-12mol·L-1,c(Ni2+)=5.5×10-
4mol·L-1,c(Al3+)小于1.0×10-5,Al3+沉淀完全,这一阶段除去的金属离子是Al3+;故答案为:2.8×10-9、
Al3+。
(4)加入少量BaS溶液除去Ni2+,此时溶液中发生的离子方程式为BaS+Ni2++SO =BaSO ↓+NiS↓,生成
4
的沉淀有BaSO、NiS。
4
(5)在电解槽中,Mn2+发生反应生成MnO ,反应的离子方程式为Mn2++2H O H↑+MnO↓+2H+;电解
2 2 2 2
时电解液中Mn2+大量减少,H+大量增加,需要加入Mn(OH) 以保持电解液成分的稳定;故答案为:Mn2+
2
+2H O H↑+MnO↓+2H+、加入Mn(OH) 。
2 2 2 2
(6)煅烧窑中MnO 与LiCO 发生反应生成LiMn O,反应的化学方程式为2LiCO+8MnO
2 2 3 2 4 2 3 2
4LiMn O+2CO ↑+O ↑;故答案为:2LiCO+8MnO 4LiMn O+2CO ↑+O ↑。
2 4 2 2 2 3 2 2 4 2 2
6.(2023·湖南卷)超纯 是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发
了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯 方面取得了显著成果,工业上以
粗镓为原料,制备超纯 的工艺流程如下:
已知:①金属 的化学性质和 相似, 的熔点为 ;
② (乙醚)和 (三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
物质
沸点/ 55.7 34.6 42.4 365.8
回答下列问题:
(1)晶体 的晶体类型是_______;
(2)“电解精炼”装置如图所示,电解池温度控制在 的原因是_______,阴极的电极反应式为
_______;(3)“合成 ”工序中的产物还包括 和 ,写出该反应的化学方程式:_______;
(4)“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是_______;
(5)下列说法错误的是_______;
A.流程中 得到了循环利用
B.流程中,“合成 ”至“工序X”需在无水无氧的条件下进行
C.“工序X”的作用是解配 ,并蒸出
D.用核磁共振氢谱不能区分 和
(6)直接分解 不能制备超纯 ,而本流程采用“配体交换”工艺制备超纯
的理由是_______;
(7)比较分子中的 键角大小: _______ (填“>”“<”或“=”),其原因是
_______。
【答案】(1)分子晶体
(2)保证Ga为液体,便于纯Ga流出 Ga3++3eˉ=Ga
(3)8CH I+2EtO+Ga Mg=2 +3 +2 ;
3 2 2 5
(4)CH
4
(5)D
(6)NR 沸点较高,易与Ga(CH ) 分离,EtO的沸点低于Ga(CH ),一起气化,难以得到超纯Ga(CH )
3 3 3 2 3 3 3 3
(7) > Ga(CH ) 中Ga为sp2杂化,所以为平面结构,而Ga(CH )(Et O)中Ga为sp3杂化,所以为四面体
3 3 3 3 2
结构,故夹角较小
【分析】以粗镓为原料,制备超纯 ,粗Ga经过电解精炼得到纯Ga,Ga和Mg反应生产
GaMg,GaMg 和CHI、EtO反应生成 、MgI 和CHMgI,然后经过蒸发溶剂、蒸馏,
2 5 2 5 3 2 2 3
除去残渣MgI 、CHMgI,加入NR 进行配体交换、进一步蒸出得到超纯 ,EtO重复利用,据此
2 3 3 2
解答。【详解】(1)晶体 的沸点较低,晶体类型是分子晶体;
(2)电解池温度控制在 可以保证Ga为液体,便于纯Ga流出;粗Ga在阳极失去电子,阴极得到
Ga,电极反应式为Ga3++3eˉ=Ga;
(3)“合成 ”工序中的产物还包括 和 ,该反应的化学方程式
8CHI+2EtO+Ga Mg=2 +3 +2 ;
3 2 2 5
(4)“残渣”含 ,经纯水处理,能产生可燃性气体CH;
4
(5)A.根据分析,流程中 得到了循环利用,A正确;
B. 容易和水反应,容易被氧化,则流程中,“合成 ”至“工序X”需在无水无氧
的条件下进行,B正确;
C. “配体交换”得到 ,“工序X”先解构 后蒸出 ,C正确;
D.二者甲基的环境不同,核磁共振氢谱化学位移不同,用核磁共振氢谱能区分 和 ,D错误;
故选D;
(6)直接分解 时由于EtO的沸点较低,与Ga(CH ) 一起蒸出,不能制备超纯 ,
2 3 3
而本流程采用“配体交换”工艺制备超纯 的理由是,根据题给相关物质沸点可知,NR 沸点远高
3
于Ga(CH ),与Ga(CH ) 易分离;
3 3 3 3
(7)分子中的 键角 > ,其原因是Ga(CH ) 中Ga为sp2杂化,所以为
3 3
平面结构,而Ga(CH )(Et O)中Ga为sp3杂化,所以为四面体结构,故夹角较小。
3 3 2
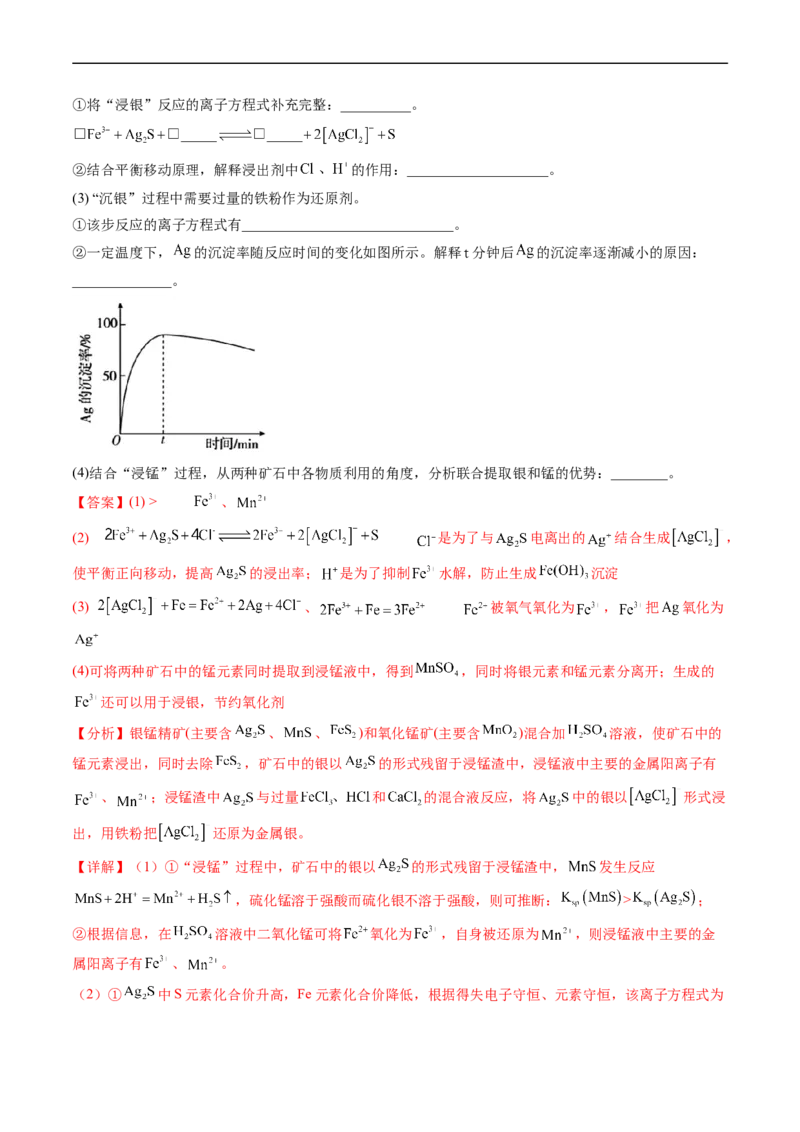
7.(2023·北京卷)以银锰精矿(主要含 、 、 )和氧化锰矿(主要含 )为原料联合提取银
和锰的一种流程示意图如下。
已知:酸性条件下, 的氧化性强于 。
(1) “浸锰”过程是在 溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出:矿石中
的银以 的形式残留于浸锰渣中。
①“浸锰”过程中,发生反应 ,则可推断: __________(填“>”或
“<”) 。
②在 溶液中,银锰精矿中的 和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
__________。
(2) “浸银”时,使用过量 和 的混合液作为浸出剂,将 中的银以 形式浸出。①将“浸银”反应的离子方程式补充完整:__________。
②结合平衡移动原理,解释浸出剂中 的作用:____________________。
(3) “沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有______________________________。
②一定温度下, 的沉淀率随反应时间的变化如图所示。解释 分钟后 的沉淀率逐渐减小的原因:
______________。
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析联合提取银和锰的优势:________。
【答案】(1) > 、
(2) 是为了与 电离出的 结合生成 ,
使平衡正向移动,提高 的浸出率; 是为了抑制 水解,防止生成 沉淀
(3) 、 被氧气氧化为 , 把 氧化为
(4)可将两种矿石中的锰元素同时提取到浸锰液中,得到 ,同时将银元素和锰元素分离开;生成的
还可以用于浸银,节约氧化剂
【分析】银锰精矿(主要含 、 、 )和氧化锰矿(主要含 )混合加 溶液,使矿石中的
锰元素浸出,同时去除 ,矿石中的银以 的形式残留于浸锰渣中,浸锰液中主要的金属阳离子有
、 ;浸锰渣中 与过量 和 的混合液反应,将 中的银以 形式浸
出,用铁粉把 还原为金属银。
【详解】(1)①“浸锰”过程中,矿石中的银以 的形式残留于浸锰渣中, 发生反应
,硫化锰溶于强酸而硫化银不溶于强酸,则可推断: > ;
②根据信息,在 溶液中二氧化锰可将 氧化为 ,自身被还原为 ,则浸锰液中主要的金
属阳离子有 、 。
(2)① 中S元素化合价升高,Fe元素化合价降低,根据得失电子守恒、元素守恒,该离子方程式为;
② 是为了与 电离出的 结合生成 ,使平衡正向移动,提高 的浸出率; 是为了
抑制 水解,防止生成 沉淀。
(3)①铁粉可将 还原为单质银,过量的铁粉还可以与铁离子发生反应,因此离子方程式为
、 ;
②溶液中生成的 会被空气中的氧气缓慢氧化为 , 把部分 氧化为 ,因此 后银的沉
淀率逐渐降低。
(4)联合提取银和锰的优势在于“浸锰”过程可将两种矿石中的锰元素同时提取到浸锰液中,将银元素
和锰元素分离开,利用 的氧化性将 中的 氧化为 ,同时生成的 还可以用于浸银,节
约氧化剂,同时得到 。
8.(2023·山东卷)盐湖卤水(主要含 、 和硼酸根等)是锂盐的重要来源。一种以
高镁卤水为原料经两段除镁制备 的工艺流程如下:
已知:常温下, 。相关化合物的溶解度与温度的关系如图所示。
回答下列问题:
(1)含硼固体中的 在水中存在平衡: (常温下, );
与 溶液反应可制备硼砂 。常温下,在 硼砂溶液中,
水解生成等物质的量浓度的 和 ,该水解反应的离子方程式为_____,该溶
液 _____。
(2)滤渣Ⅰ的主要成分是_____(填化学式);精制Ⅰ后溶液中 的浓度为 ,则常温下精制Ⅱ过程中
浓度应控制在_____ 以下。若脱硼后直接进行精制Ⅰ,除无法回收 外,还将增加_____的
用量(填化学式)。(3)精制Ⅱ的目的是_____;进行操作 时应选择的试剂是_____,若不进行该操作而直接浓缩,将导致
_____。
【答案】(1)
(2) 纯碱
(3)加入纯碱将精制Ⅰ所得滤液中的 转化为 (或除去精制Ⅰ所得滤液中的 ),提高
纯度 盐酸 浓缩液中因 浓度过大使得 过早沉淀,即浓缩结晶得到的 中会混有 ,
最终所得 的产率减小
【分析】由流程可知,卤水中加入盐酸脱镁后过滤,所得滤液经浓缩结晶后得到晶体,该晶体中含有
Na+、Li+、Cl-、 等,焙烧后生成HCl气体;烧渣水浸后过滤,滤液中加生石灰后产生沉淀,在此条件
下溶解度最小的是 ,则滤渣Ⅰ的主要成分为 ;由于 微溶于水,精制Ⅰ所得滤液中再加
纯碱又生成沉淀,则滤渣Ⅱ为 ;精制Ⅱ所得滤液经操作X后,所得溶液经浓缩结晶、过滤得到氯化
钠,浓缩后的滤液中加入饱和碳酸钠溶液沉锂,得到 。
【详解】(1)含硼固体中的 在水中存在平衡: (常温下,
); 与 溶液反应可制备硼砂 。常温下.在 硼砂溶液
中, 水解生成等物质的量浓度的 和 ,该水解反应的离子方程式为
,由B元素守恒可知, 和 的浓度均为
, ,则该溶液 。
(2)由分析可知,滤渣I的主要成分是 ;精制I后溶液中 的浓度为2.0 ,由
可知,则常温下精制Ⅱ过程中 浓度应控制在
以下。若脱硼后直接进行精制Ⅰ,除无法回收HCl外,后续在浓缩结晶时将生成更多的氯化钠晶体,
因此,还将增加纯碱( )的用量。
(3)精制Ⅰ中,烧渣水浸后的滤液中加生石灰后产生的滤渣Ⅰ的主要成分为 ;由于 微溶于
水,精制Ⅰ所得滤液中还含有一定浓度的 ,还需要除去 ,因此,精制Ⅱ的目的是:加入纯碱将精
制Ⅰ所得滤液中的 转化为 (或除去精制Ⅰ所得滤液中的 ),提高 纯度。操作X是
为了除去剩余的碳酸根离子,为了防止引入杂质离子,应选择的试剂是盐酸;加入盐酸的目的是除去剩余
的碳酸根离子,若不进行该操作而直接浓缩,将导致浓缩液中因 浓度过大使得 过早沉淀,即浓缩
结晶得到的 中会混有 ,最终所得 的产率减小。
〖2022年高考真题〗考点一 除杂提纯类
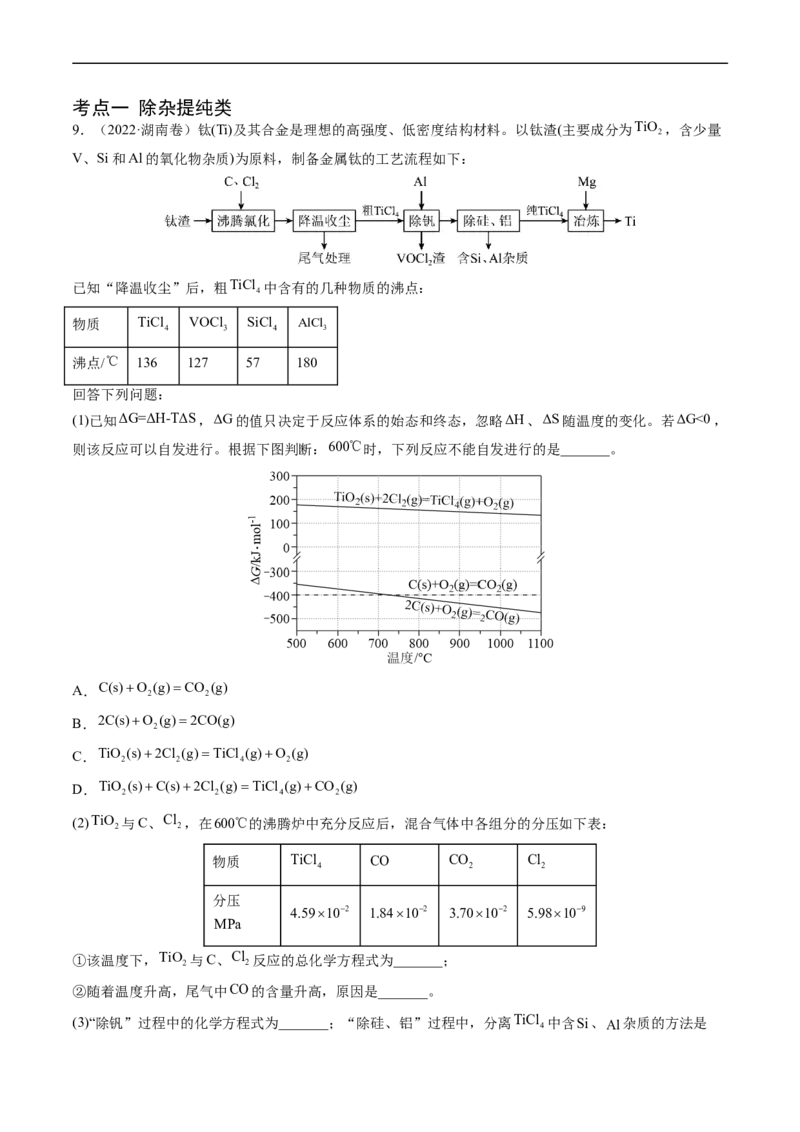
9.(2022·湖南卷)钛(Ti)及其合金是理想的高强度、低密度结构材料。以钛渣(主要成分为TiO ,含少量
2
V、Si和Al的氧化物杂质)为原料,制备金属钛的工艺流程如下:
已知“降温收尘”后,粗TiCl 中含有的几种物质的沸点:
4
物质 TiCl VOCl SiCl AlCl
4 3 4 3
沸点/℃ 136 127 57 180
回答下列问题:
(1)已知ΔG=ΔH-TΔS,ΔG的值只决定于反应体系的始态和终态,忽略ΔH、ΔS随温度的变化。若ΔG<0,
则该反应可以自发进行。根据下图判断:600℃时,下列反应不能自发进行的是_______。
A.C(s)O (g)CO (g)
2 2
B.2C(s)O (g)2CO(g)
2
C.TiO (s)2Cl (g)TiCl (g)O (g)
2 2 4 2
D.TiO (s)C(s)2Cl (g)TiCl (g)CO (g)
2 2 4 2
(2)TiO 与C、Cl ,在600℃的沸腾炉中充分反应后,混合气体中各组分的分压如下表:
2 2
物质 TiCl CO CO Cl
4 2 2
分压
4.59102 1.84102 3.70102 5.98109
MPa
①该温度下,TiO 与C、Cl 反应的总化学方程式为_______;
2 2
②随着温度升高,尾气中CO的含量升高,原因是_______。
(3)“除钒”过程中的化学方程式为_______;“除硅、铝”过程中,分离TiCl
4
中含Si、Al杂质的方法是_______。
(4)“除钒”和“除硅、铝”的顺序_______(填“能”或“不能”)交换,理由是_______。
(5)下列金属冶炼方法与本工艺流程中加入Mg冶炼Ti的方法相似的是_______。
A.高炉炼铁 B.电解熔融氯化钠制钠
C.铝热反应制锰 D.氧化汞分解制汞
【答案】(1)C
高温
600℃
(2) 5TiO+6C+10Cl 5TiCl +2CO+4CO 随着温度升高,CO 与C发生反应C+CO 2CO
2 2 4 2 2 2
(3) 3VOCl +Al=3VOCl +AlCl 蒸馏
3 2 3
(4)不能 若先“除硅、铝”再“除钒”,“除钒”时需要加入Al,又引入Al杂质;
(5)AC
【解析】钛渣中加入C、Cl 进行沸腾氯化,转化为相应的氯化物,降温收尘后得到粗TiCl ,加入单质Al
2 4
除钒,再除硅、铝得到纯TiCl ,加入Mg还原得到Ti。
4
(1)记①C(s)+O (g)=CO (g),②2C(s)+O (g)=2CO(g),③TiO (s)+2Cl (g)=TiCl (g)+O (g),④
2 2 2 2 2 4 2
TiO (s)+C(s)+2Cl (g)=TiCl (g)+CO (g);
2 2 4 2
A.由图可知,600℃时C(s)+O (g)=CO (g)的G<0,反应自发进行,故A不符合题意;
2 2
B.由图可知,600℃时2C(s)+O (g)=2CO(g)的G<0,反应自发进行,故B不符合题意;
2
C.由图可知,600℃时TiO (s)+2Cl (g)=TiCl (g)+O (g)的G>0,反应不能自发进行,故C符合题意;
2 2 4 2
D.根据盖斯定律,TiO (s)+C(s)+2Cl (g)=TiCl (g)+CO (g)可由①+③得到,则600℃时其G<0,反应自
2 2 4 2
发进行,故D不符合题意;
故选C;
(2)①根据表中数据可知,该温度下C主要生成CO和CO,根据相同条件下气体的压强之比是物质的量之
2
比可知TiCl 、CO和CO 的物质的量之比约是5:2:4,所以TiO 与C、Cl 反应的总化学方程式为
4 2 2 2
600℃ 600℃
5TiO+6C+10Cl 5TiCl +2CO+4CO ,故答案为:5TiO+6C+10Cl 5TiCl +2CO+4CO ;
2 2 4 2 2 2 4 2
高温
②随着温度升高,CO 与C发生反应C+CO 2CO,导致CO含量升高,故答案为:随着温度升高,
2 2
高温
CO 与C发生反应C+CO 2CO;
2 2
(3)“降温收尘”后钒元素主要以VOCl 形式存在,加入Al得到VOCl 渣,根据得失电子守恒和元素守恒配
3 2
平方程式为3VOCl +Al=3VOCl +AlCl ;AlCl 、SiCl 与TiCl 沸点差异较大,“除硅、铝"过程中可采用蒸
3 2 3 3 4 4
馏的方法分离AlCl 、SiCl ,故答案为:3VOCl +Al=3VOCl +AlCl ;蒸馏;
3 4 3 2 3
(4)若先“除硅、铝”再“除钒”,“除钒”时需要加入Al,又引入Al杂质,因此“除钒”和“除硅、
铝”的顺序不能交换,故答案为:不能;若先“除硅、铝”再“除钒”,“除钒”时需要加入Al,又引入Al杂质;
(5)本工艺中加入Mg冶炼Ti的方法为热还原法;
A.高炉炼铁的原理是用还原剂将铁矿石中铁的氧化物还原成金属铁,属于热还原法,故A符合题意;
B.电解熔融氯化钠制取金属钠的原理是电解法,故B不符合题意;
C.铝热反应制锰是利用Al作还原剂,将锰从其化合物中还原出来,为热还原法,故C符合题意;
D.Hg为不活泼金属,可以直接用加热分解氧化汞的方法制备汞,故D不符合题意;
故答案选AC,故答案为:AC。
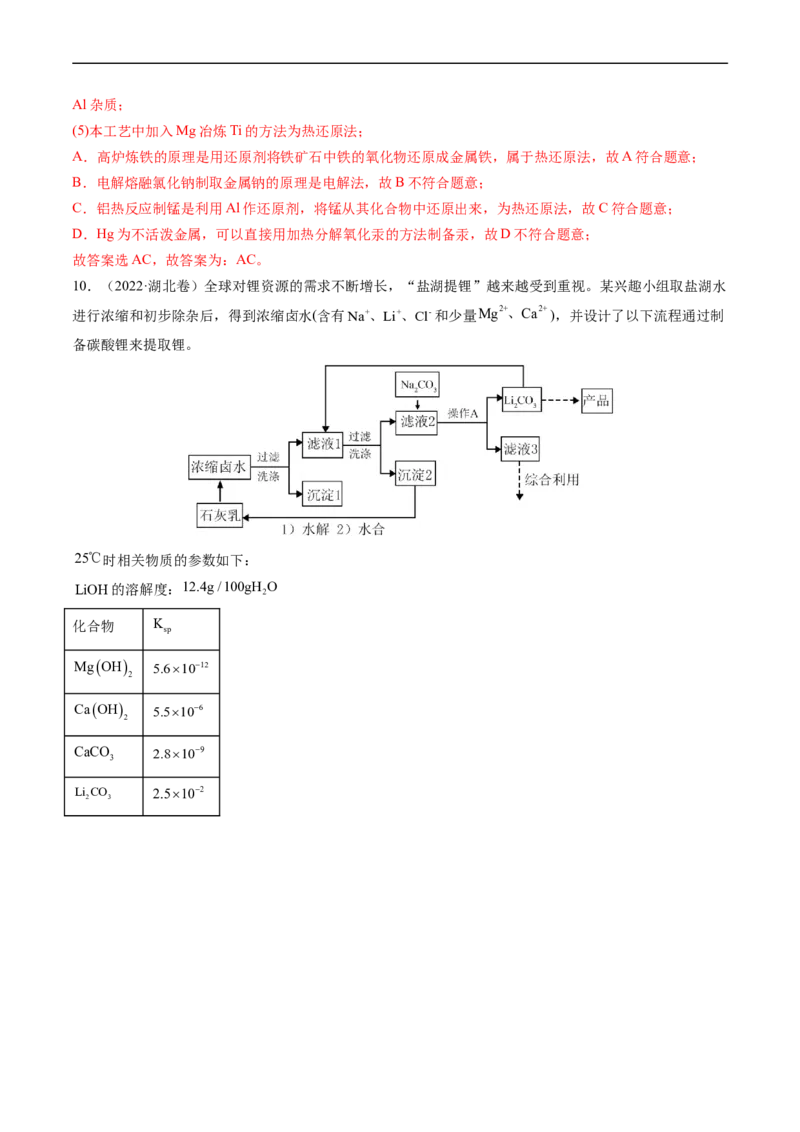
10.(2022·湖北卷)全球对锂资源的需求不断增长,“盐湖提锂”越来越受到重视。某兴趣小组取盐湖水
进行浓缩和初步除杂后,得到浓缩卤水(含有Na+、Li+、Cl-和少量Mg2+、Ca2+),并设计了以下流程通过制
备碳酸锂来提取锂。
25℃时相关物质的参数如下:
LiOH的溶解度:12.4g/100gH O
2
化合物 K
sp
MgOH 5.61012
2
CaOH 5.5106
2
CaCO 2.8109
3
Li CO 2.5102
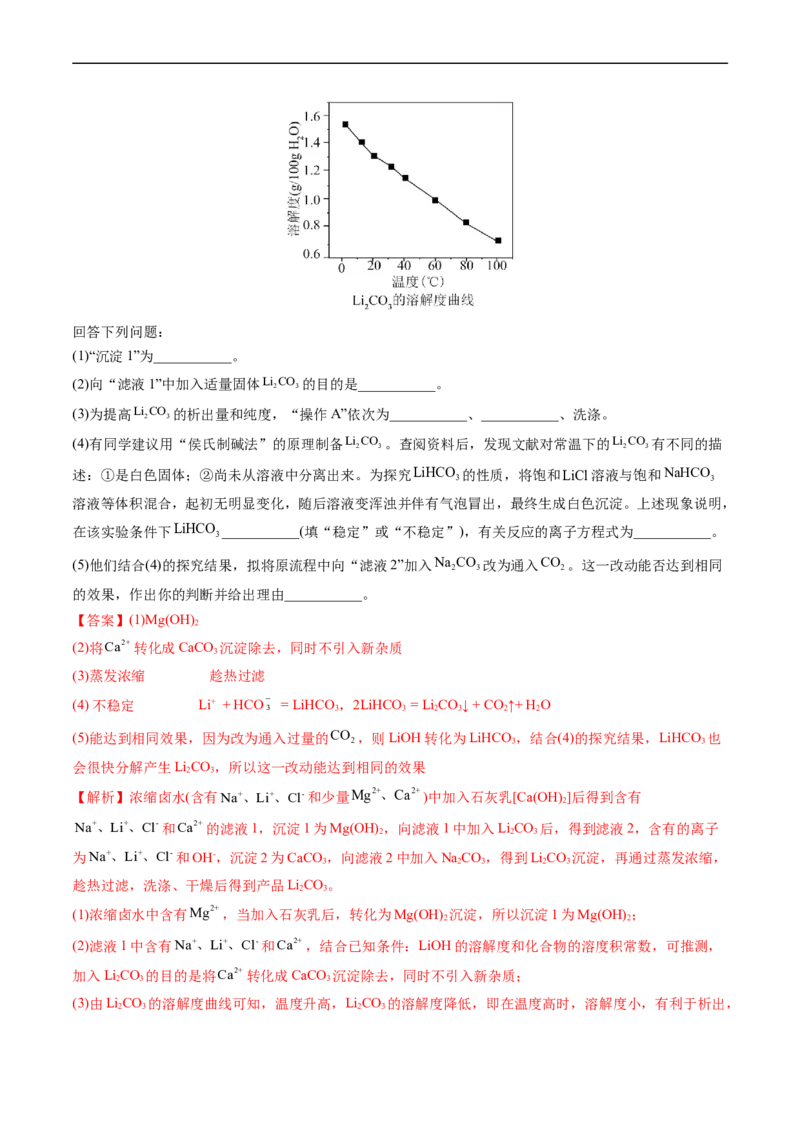
2 3回答下列问题:
(1)“沉淀1”为___________。
(2)向“滤液1”中加入适量固体Li CO 的目的是___________。
2 3
(3)为提高Li CO 的析出量和纯度,“操作A”依次为___________、___________、洗涤。
2 3
(4)有同学建议用“侯氏制碱法”的原理制备Li CO 。查阅资料后,发现文献对常温下的Li CO 有不同的描
2 3 2 3
述:①是白色固体;②尚未从溶液中分离出来。为探究LiHCO 的性质,将饱和LiCl溶液与饱和NaHCO
3 3
溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。上述现象说明,
在该实验条件下LiHCO ___________(填“稳定”或“不稳定”),有关反应的离子方程式为___________。
3
(5)他们结合(4)的探究结果,拟将原流程中向“滤液2”加入Na CO 改为通入CO 。这一改动能否达到相同
2 3 2
的效果,作出你的判断并给出理由___________。
【答案】(1)Mg(OH)
2
(2)将Ca2+转化成CaCO 沉淀除去,同时不引入新杂质
3
(3)蒸发浓缩 趁热过滤
(4) 不稳定 Li+ + HCO = LiHCO,2LiHCO = Li CO↓ + CO ↑+ H O
3 3 3 2 3 2 2
(5)能达到相同效果,因为改为通入过量的CO ,则LiOH转化为LiHCO ,结合(4)的探究结果,LiHCO 也
2 3 3
会很快分解产生LiCO,所以这一改动能达到相同的效果
2 3
【解析】浓缩卤水(含有Na+、Li+、Cl-和少量Mg2+、Ca2+)中加入石灰乳[Ca(OH) ]后得到含有
2
Na+、Li+、Cl-和Ca2+的滤液1,沉淀1为Mg(OH) ,向滤液1中加入LiCO 后,得到滤液2,含有的离子
2 2 3
为Na+、Li+、Cl-和OH-,沉淀2为CaCO ,向滤液2中加入NaCO,得到LiCO 沉淀,再通过蒸发浓缩,
3 2 3 2 3
趁热过滤,洗涤、干燥后得到产品LiCO。
2 3
(1)浓缩卤水中含有Mg2+,当加入石灰乳后,转化为Mg(OH) 沉淀,所以沉淀1为Mg(OH) ;
2 2
(2)滤液1中含有Na+、Li+、Cl-和Ca2+,结合已知条件:LiOH的溶解度和化合物的溶度积常数,可推测,
加入LiCO 的目的是将Ca2+转化成CaCO 沉淀除去,同时不引入新杂质;
2 3 3
(3)由LiCO 的溶解度曲线可知,温度升高,LiCO 的溶解度降低,即在温度高时,溶解度小,有利于析出,
2 3 2 3所以为提高Li CO 的析出量和纯度,需要在较高温度下析出并过滤得到沉淀,即依次蒸发浓缩,趁热过滤,
2 3
洗涤。故答案为:蒸发浓缩,趁热过滤;
(4)饱和LiCl和饱和NaHCO 等体积混合后,产生了LiHCO 和NaCl,随后LiHCO 分解产生了CO 和
3 3 3 2
LiCO。故答案为:不稳定,Li+ + HCO = LiHCO,2LiHCO = Li CO↓ + CO ↑+ H O;
2 3 3 3 3 2 3 2 2
(5)“滤液2”中含有LiOH,加入Na CO ,目的是将LiOH转化为LiCO。若改为通入过量的CO ,则LiOH
2 3 2 3 2
转化为LiHCO ,结合(4)的探究结果,LiHCO 也会很快分解产生LiCO,所以这一改动能达到相同的效果。
3 3 2 3
故答案为:能达到相同效果,因为改为通入过量的CO ,则LiOH转化为LiHCO ,结合(4)的探究结果,
2 3
LiHCO 也会很快分解产生LiCO,所以这一改动能达到相同的效果。
3 2 3
11.(2022·重庆卷)电子印制工业产生的某退锡废液含硝酸、锡化合物及少量Fe3+和Cu2+等,对其处理
的流程如图。
Sn与Si同族,25℃时相关的溶度积见表。
化学式 Sn(OH)(或SnO ·2H O) Fe(OH) Cu(OH)
4 2 2 3 2
溶度积 1.0×10-56 4×10-38 2.5×10-20
(1)Na SnO 的回收
2 3
①产品NaSnO 中Sn的化合价是______。
2 3
②退锡工艺是利用稀HNO 与Sn反应生成Sn2+,且无气体生成,则生成的硝酸盐是_____,废液中的Sn2+易
3
转化成SnO ·xH O。
2 2
③沉淀1的主要成分是SnO ,焙烧时,与NaOH反应的化学方程式为______。
2
(2)滤液1的处理
①滤液1中Fe3+和Cu2+的浓度相近,加入NaOH溶液,先得到的沉淀是______。
②25℃时,为了使Cu2+沉淀完全,需调节溶液H+浓度不大于______mol•L-1。
(3)产品中锡含量的测定
称取产品1.500g,用大量盐酸溶解,在CO 保护下,先用Al片将Sn4+还原为Sn2+,再用0.1000mol•L-1KIO
2 3
标准溶液滴定,以淀粉作指示剂滴定过程中IO 被还原为I—,终点时消耗KIO 溶液20.00mL。
3
①终点时的现象为______,产生I 的离子反应方程式为_____。
2
②产品中Sn的质量分数为_____%。
【答案】(1) +4价 Sn(NO )、NH NO SnO +2NaOH NaSnO +H O
3 2 4 3 2 2 3 2
(2) Fe(OH) 2×10-7
3
(3) 滴入最后一滴KIO 标准溶液,溶液由无色变为蓝色,且半分钟内不褪色 IO +5I-
3+6H+=3I +3H O 47.6%
2 2
【分析】由题给流程可知,向退锡废液中加入氢氧化钠溶液调节溶液pH为1.5,将锡的化合物转化为二氧
化锡,过滤得到含有铁离子、铜离子的滤液1和沉淀1;向沉淀1中加入氢氧化钠焙烧将二氧化锡转化为
锡酸钠后,水浸、过滤得到锡酸钠溶液,溶液经蒸发结晶得到锡酸钠。
【详解】(1)①由化合价代数和为0可知,锡酸钠中锡元素的化合价为+4价,故答案为:+4价;
②由分析可知,退锡工艺中发生的反应为锡与稀硝酸反应生成硝酸亚锡、硝酸铵和水,则则生成的硝酸盐
是硝酸亚锡和硝酸铵,故答案为:Sn(NO )、NH NO ;
3 2 4 3
③由沉淀1的主要成分是二氧化锡可知,焙烧时发生的反应为二氧化锡和氢氧化钠高温条件下反应生成锡
酸钠和水,反应的化学方程式为SnO +2NaOH NaSnO +H O,故答案为:SnO +2NaOH
2 2 3 2 2
NaSnO +H O;
2 3 2
(2)①由溶度积可知,向滤液1中加入氢氧化钠溶液,溶解度小的氢氧化铁先沉淀,故答案为:
Fe(OH) ;
3
②由溶度积可知,25℃时,铜离子沉淀完全时,溶液中的氢氧根离子浓度为 =5×10-8mol/L,
则溶液中的氢离子浓度不大于2×10-7mol/L,故答案为:2×10-7;
(3)①由题意可知,碘酸钾先与二价锡离子反应生成碘离子,当二价锡反应完,碘离子与碘酸根反应生
成碘单质,碘遇淀粉溶液变蓝色时,溶液由无色变为蓝色,则终点时的现象为滴入最后一滴碘酸钾标准溶
液,溶液由无色变为蓝色,且半分钟内不褪色,反应生成碘的离子方程式为IO +3Sn2++6H+=I-+3Sn4+
+3H O,IO +5I-+6H+=3I +3 H O,故答案为:滴入最后一滴KIO 标准溶液,溶液由无色变为蓝色,且半分
2 2 2 3
钟内不褪色;IO +5I-+6H+=3I +3 H O;
2 2
②由得失电子数目守恒可知,滴定消耗20.00mL0.1000mol•L-1碘酸钾溶液,则1.500g产品中锡元素的质量
分数为 ×100%=47.6%,故答案为:47.6%。
考点二 原材料化学转化类
12.(2022·全国甲卷)硫酸锌(ZnSO )是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。
4
硫酸锌可由菱锌矿制备。菱锌矿的主要成分为ZnCO ,杂质为SiO 以及Ca、Mg、Fe、Cu等的化合物。其
3 2
制备流程如下:
本题中所涉及离子的氯氧化物溶度积常数如下表:离
Fe3+ Zn2+ Cu2+ Fe2+ Mg2+
子
K
sp
4.01038 6.71017 2.21020 8.01016 1.81011
回答下列问题:
(1)菱锌矿焙烧生成氧化锌的化学方程式为_______。
(2)为了提高锌的浸取效果,可采取的措施有_______、_______。
(3)加入物质X调溶液pH=5,最适宜使用的X是_______(填标号)。
A.NH H O B.Ca(OH) C.NaOH
3 2 2
滤渣①的主要成分是_______、_______、_______。
(4)向80~90℃的滤液①中分批加入适量KMnO 溶液充分反应后过滤,滤渣②中有MnO ,该步反应的离
4 2
子方程式为_______。
(5)滤液②中加入锌粉的目的是_______。
(6)滤渣④与浓H SO 反应可以释放HF并循环利用,同时得到的副产物是_______、_______。
2 4
焙烧
【答案】(1)ZnCO ZnO+CO ↑
3 2
(2) 将焙烧后的产物碾碎,增大接触面积 增大硫酸的浓度等
(3) B Fe(OH) CaSO SiO
3 4 2
(4)3Fe2++MnO- +7H O=3Fe(OH) ↓+MnO↓+5H+
4 2 3 2
(5)置换Cu2+为Cu从而除去
(6) CaSO MgSO
4 4
【解析】由题干信息,菱锌矿的主要成分为ZnCO ,杂质为SiO 以及Ca、Mg、Fe、Cu等的化合物,结合
3 2
焙烧
流程图分析,菱锌矿焙烧,主要发生反应ZnCO ZnO+CO ↑,再加入HSO 酸浸,得到含Zn2+、Ca2+、
3 2 2 4
Mg2+、Fe2+、Fe3+、Cu2+的溶液,加入物质X调节pH=5,结合表格数据,过滤得到Fe(OH) 、CaSO、SiO
3 4 2
的滤渣①,滤液①中主要含有Zn2+、Cu2+、Mg2+、Ca2+、Fe2+,再向滤液①中加入KMnO 溶液氧化Fe2+,过
4
滤得到Fe(OH) 和MnO 的滤渣②,滤液②中加入锌粉,发生反应Zn+Cu2+=Zn2+=Cu,过滤后得到滤渣③为
3 2
Cu,再向滤液③中加入HF脱钙镁,过滤得到滤渣④为CaF 、MgF ,滤液④为ZnSO 溶液,经一系列处理
2 2 4
得到ZnSO·7H O,据此分析解答。
4 2
焙烧
(1)由分析,焙烧时,生成ZnO的反应为:ZnCO ZnO+CO ↑;
3 2
(2)可采用将焙烧后的产物碾碎,增大接触面积、增大硫酸的浓度等方式提高锌的浸取率;
(3)A.NH ·H O易分解产生NH 污染空气,且经济成本较高,故A不适宜;B.Ca(OH) 不会引入新的杂质,
3 2 3 2
且成本较低,故B适宜;C.NaOH会引入杂质Na+,且成本较高,C不适宜;故答案选B;
当沉淀完全时(离子浓度小于10-5mol/L),结合表格Ksp计算各离子完全沉淀时pH<5的只有Fe3+,故滤渣①中有Fe(OH) ,又CaSO 是微溶物,SiO 不溶于酸,故滤渣①的主要成分是Fe(OH) 、CaSO、SiO;
3 4 2 3 4 2
(4)向80~90℃滤液①中加入KMnO 溶液,可氧化Fe2+,得到Fe(OH) 和MnO 的滤渣②,反应的离子方程
4 3 2
式为3Fe2++MnO- +7H O=3Fe(OH) ↓+MnO↓+5H+;
4 2 3 2
(5)滤液②中加入锌粉,发生反应Zn+Cu2+=Zn2+=Cu,故加入锌粉的目的为置换Cu2+为Cu从而除去;
(6)由分析,滤渣④为CaF 、MgF ,与浓硫酸反应可得到HF,同时得到的副产物为CaSO、MgSO 。
2 2 4 4
13.(2022·广东卷)稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可
用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
已知:月桂酸 C H COOH 熔点为44C;月桂酸和 C H COO RE均难溶于水。该工艺条件下,稀土
11 23 11 23 3
离子保持3价不变; C H COO Mg的K 1.8108 ,Al(OH) 开始溶解时的pH为8.8;有关金属离子
11 23 2 sp 3
沉淀的相关pH见下表。
离子 Mg2 Fe3 Al3 RE3
开始沉淀时的pH 8.8 1.5 3.6 6.2~7.4
沉淀完全时的pH / 3.2 4.7 /
(1)“氧化调pH”中,化合价有变化的金属离子是_______。(2)“过滤1”前,用NaOH溶液调pH至_______的
范围内,该过程中Al3发生反应的离子方程式为_______。
(3)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2浓度为2.7gL1。为尽可能多地提取RE3,可提
高月桂酸钠的加入量,但应确保“过滤2”前的溶液中c
C
11
H
23
COO-
低于_______molL1(保留两位有效数
字)。
(4)①“加热搅拌”有利于加快RE3溶出、提高产率,其原因是_______。
②“操作X”的过程为:先_______,再固液分离。
(5)该工艺中,可再生循环利用的物质有_______(写化学式)。
(6)稀土元素钇(Y)可用于制备高活性的合金类催化剂Pt Y。
3
①还原YCl 和PtCl 熔融盐制备Pt Y时,生成1molPt Y转移_______mol电子。
3 4 3 3
②Pt Y/C用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化O 的还原,发生的电极反应为_______。
3 2
【答案】(1)Fe2+
(2) 4.7pH<6.2 Al3 3OH AlOH
3
(3)4.010-4(4) 加热搅拌可加快反应速率 冷却结晶
(5)MgSO
4
(6) 15 O+4e-+2H O=4OH-
2 2
【解析】由流程可知,该类矿(含铁、铝等元素)加入酸化MgSO 溶液浸取,得到浸取液中含有RE3、
4
Mg2、Fe2、Fe3、Al3、SO
4
2 等离子,经氧化调pH使Fe3、Al3形成沉淀,经过滤除去,滤液1中含
有RE3、Mg2、SO
4
2等离子,加入月桂酸钠,使RE3形成 C
11
H
23
COO
3
RE沉淀,滤液2主要含有
MgSO 溶液,可循环利用,滤饼加盐酸,经加热搅拌溶解后,再冷却结晶,析出月桂酸,再固液分离得到
4
RECl 溶液。
3
(1)由分析可知,“氧化调pH”目的是除去含铁、铝等元素的离子,需要将Fe2+氧化为Fe3+,以便后续除杂,
所以化合价有变化的金属离子是Fe2+,故答案为:Fe2+;
(2)由表中数据可知,Al3沉淀完全的pH为4.7,而RE3开始沉淀的pH为6.2~7.4,所以为保证Fe3、Al3
沉淀完全,且RE3不沉淀,要用NaOH溶液调pH至4.7pH<6.2的范围内,该过程中Al3发生反应的离子
方程式为Al3 3OH AlOH ,故答案为:4.7pH<6.2;Al3 3OH AlOH ;
3 3
(3)滤液2中Mg2浓度为2.7gL1,即0.1125mol/L,根据K [C H COO Mg]=c(Mg2)c2 C H COO- ,
sp 11 23 2 11 23
若要加入月桂酸钠后只生成 C H COO RE,而不产生 C H COO Mg,则
11 23 3 11 23 2
K C H COO Mg
c C H COO- sp 11 23 2 = 1.8108 =4 10-4 ,故答案为:4 10-4;
11 23 c(Mg2) 0.1125 molL1
(4)①“加热搅拌”有利于加快RE3溶出、提高产率,其原因是加热搅拌可加快反应速率,故答案为:加
热搅拌可加快反应速率;
② “操作X”的结果是分离出月桂酸,由信息可知,月桂酸 C H COOH 熔点为44C,故“操作X”的过
11 23
程为:先冷却结晶,再固液分离,故答案为:冷却结晶;
(5)由分析可知,该工艺中,可再生循环利用的物质有MgSO ,故答案为:MgSO ;
4 4
(6)①YCl 中Y为+3价,PtCl 中Pt为+4价,而Pt Y中金属均为0价,所以还原YCl 和PtCl 熔融盐制备
3 4 3 3 4
Pt Y时,生成1molPt Y转移15mol电子,故答案为:15;
3 3
②碱性溶液中,氢氧燃料电池正极发生还原反应,发生的电极反应为O+4e-+2H O=4OH,故答案为:
2 2
O+4e-+2H O=4OH-。
2 2
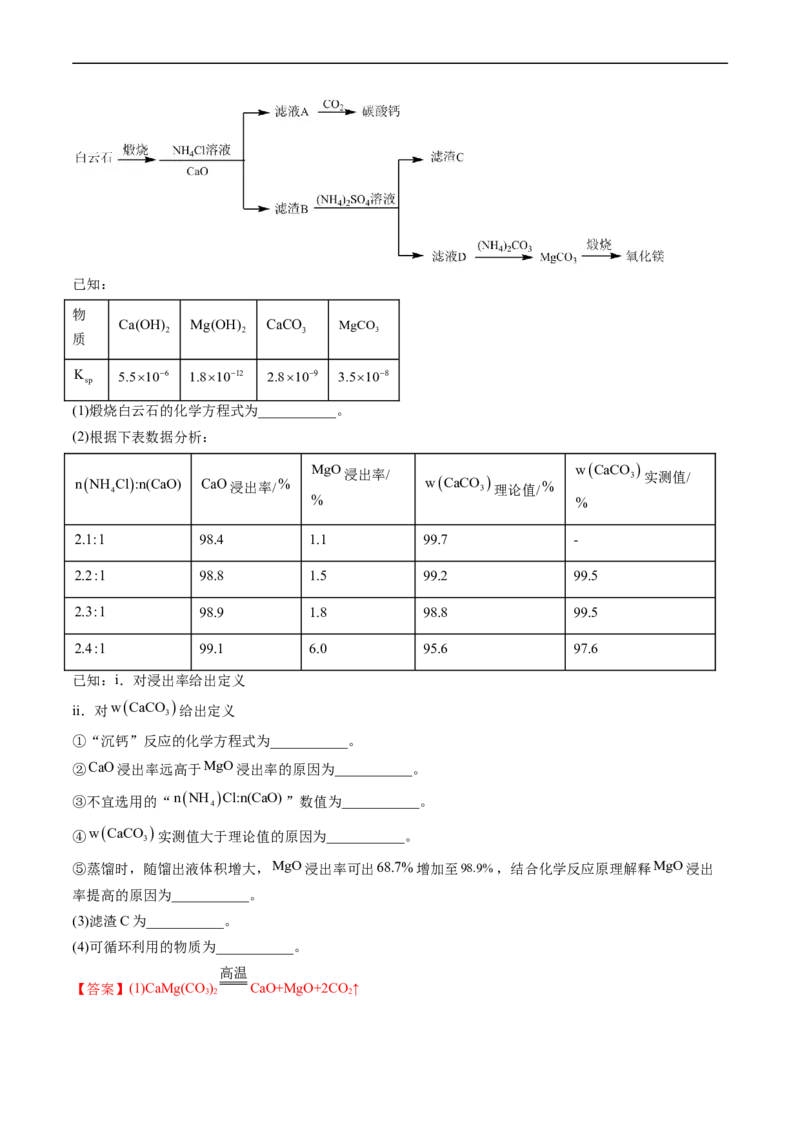
14.(2022·北京卷)铵浸法由白云石[主要成分为CaMgCO
,含FeO,SiO 杂质]制备高纯度碳酸钙和
3 2 2 3 2
氧化镁。其流程如下:已知:
物
Ca(OH) Mg(OH) CaCO MgCO
2 2 3 3
质
K 5.5106 1.81012 2.8109 3.5108
sp
(1)煅烧白云石的化学方程式为___________。
(2)根据下表数据分析:
MgO wCaCO
nNH 4 Cl:n(CaO) CaO浸出率/ % 浸出率/ wCaCO 3 理论值/ % 3 实测值/
% %
2.1:1 98.4 1.1 99.7 -
2.2:1 98.8 1.5 99.2 99.5
2.3:1 98.9 1.8 98.8 99.5
2.4:1 99.1 6.0 95.6 97.6
已知:i.对浸出率给出定义
ii.对wCaCO
给出定义
3
①“沉钙”反应的化学方程式为___________。
②CaO浸出率远高于MgO浸出率的原因为___________。
③不宜选用的“nNH Cl:n(CaO)”数值为___________。
4
④wCaCO
实测值大于理论值的原因为___________。
3
⑤蒸馏时,随馏出液体积增大,MgO浸出率可出68.7%增加至98.9%,结合化学反应原理解释MgO浸出
率提高的原因为___________。
(3)滤渣C为___________。
(4)可循环利用的物质为___________。
高温
【答案】(1)CaMg(CO ) CaO+MgO+2CO ↑
3 2 2(2) CaCl +NH·H O+CO=CaCO ↓+NHCl+H O Ca(OH) 的溶度积大于Mg(OH) ,溶液中Ca(OH) 能与
2 3 2 2 3 4 2 2 2 2
NH Cl反应,而Mg(OH) 不能 2.4:1 反应加入的CaO也转化为CaCO Mg(OH) +(NH)SO
4 2 3 2 4 2 4
Δ
MgSO +2NH↑+2H O,蒸馏时,NH 逸出促进NH 水解,溶液中H+浓度增大,有利于Mg(OH) 完全转
4 3 2 3 + 2
4
化为MgSO
4
(3)SiO、Fe O
2 2 3
(4)NH Cl、(NH )SO
4 4 2 4
【解析】由题给流程可知,白云石煅烧时,CaMg(CO ) 高温分解生成氧化钙和氧化镁,向煅烧后的固体中
3 2
加入氯化铵溶液和氧化钙,氧化钙和氯化铵溶液反应生成氯化钙和一水合氨,氧化镁与水反应生成氢氧化
镁,过滤得到含有氯化钙、一水合氨的滤液A和含有氢氧化镁、氧化铁、二氧化硅的滤渣B;向滤液A中
通入二氧化碳,二氧化碳与滤液A反应、过滤得到碳酸钙沉淀和氯化铵溶液;向滤渣B中加入硫酸铵溶液
蒸馏,将氢氧化镁转化为硫酸镁,氧化铁、二氧化硅与硫酸铵溶液不反应,过滤得到含有氧化铁、二氧化
硅的滤渣C和含有硫酸镁的滤液D;向滤液D中加入碳酸铵溶液,碳酸铵溶液与滤液D反应、过滤得到碳
酸镁沉淀和硫酸铵溶液,煅烧碳酸镁得到氧化镁,制备分离过程中氯化铵溶液和硫酸铵溶液可以循环利用。
(1)由分析可知,白云石煅烧时,CaMg(CO ) 高温分解生成氧化钙、氧化镁和二氧化碳,反应的化学方程式
3 2
高温 高温
为CaMg(CO ) CaO+MgO+2CO ↑,故答案为:CaMg(CO ) CaO+MgO+2CO ↑;
3 2 2 3 2 2
(2)①由分析可知,“沉钙”时发生的反应为二氧化碳与氯化钙和一水合氨混合溶液反应生成碳酸钙沉淀、
氯化铵和水,反应的化学方程式为CaCl +NH·H O+CO=CaCO ↓+NHCl+H O,故答案为:
2 3 2 2 3 4 2
CaCl +NH·H O+CO=CaCO ↓+NHCl+H O;
2 3 2 2 3 4 2
②由题给溶度积数据可知,氢氧化钙的溶度积大于氢氧化镁,溶液中氢氧化钙的浓度大于氢氧化镁,能与
氯化铵溶液反应生成氯化钙和一水合氨,而氢氧化镁不能反应,所以氧化钙的浸出率远高于氧化镁,故答
案为:Ca(OH) 的溶度积大于Mg(OH) ,溶液中Ca(OH) 能与NH Cl反应,而Mg(OH) 不能;
2 2 2 4 2
③由题给数据可知,氯化铵和氧化钙的物质的量比为2.4:1时,氧化镁的浸出率最高,而碳酸钙的质量分
数无论是理论值还是实测值都最低,所以不宜选用的物质的量比为2.4:1,故答案为:2.4:1;
④硫酸铵是强酸弱碱盐,铵根离子在溶液中的水解反应为吸热反应,加热蒸馏时,氨气逸出促进铵根离子
水解,溶液中氢离子浓度增大,有利于氢氧化镁完全溶解转化为硫酸铵,所以氧化镁浸出率提高,故答案
Δ
为:Mg(OH) +(NH)SO MgSO +2NH↑+2H O,蒸馏时,NH 逸出促进NH 水解,溶液中H+浓度增大,
2 4 2 4 4 3 2 3 +
4
有利于Mg(OH) 完全转化为MgSO ;
2 4
(3)由分析可知,滤渣C为氧化铁、二氧化硅,故答案为:SiO、Fe O;
2 2 3
(4)由分析可知,制备分离过程中氯化铵溶液和硫酸铵溶液可以循环利用,故答案为:NH Cl、(NH )SO 。
4 4 2 4
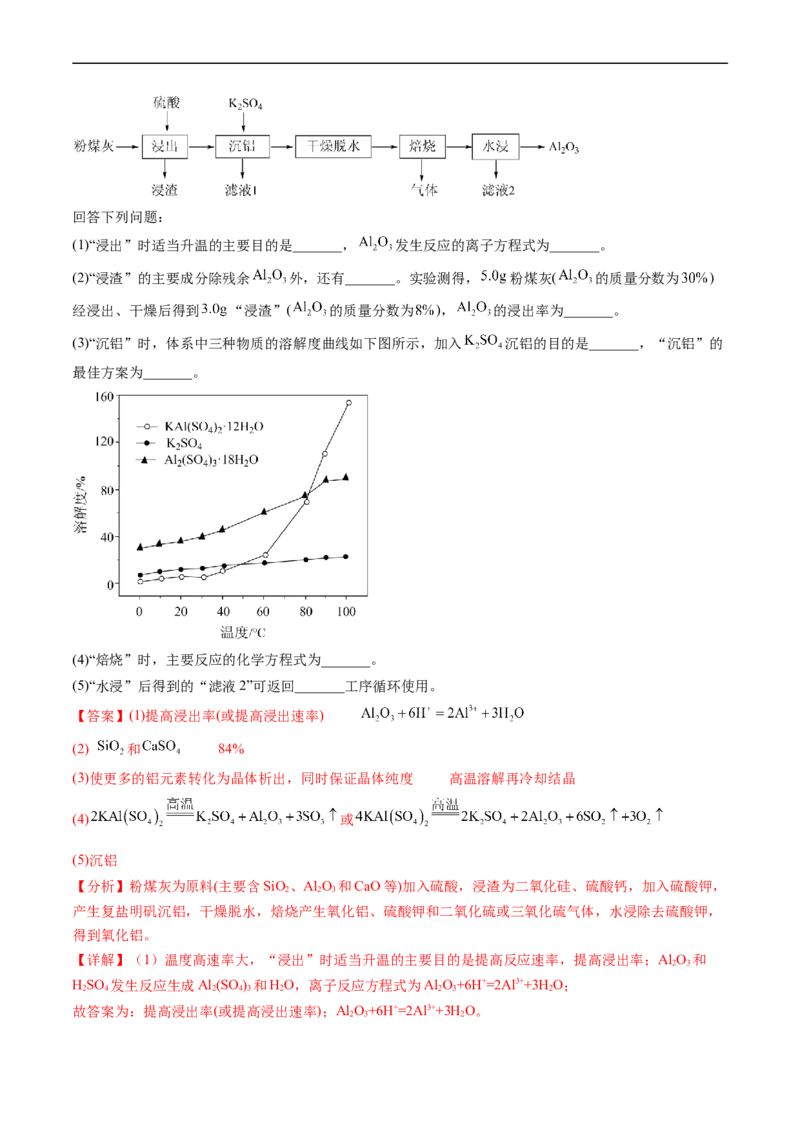
15.(2022·福建卷)粉煤灰是火电厂的大宗固废。以某电厂的粉煤灰为原料(主要含 和
等)提铝的工艺流程如下:回答下列问题:
(1)“浸出”时适当升温的主要目的是_______, 发生反应的离子方程式为_______。
(2)“浸渣”的主要成分除残余 外,还有_______。实验测得, 粉煤灰( 的质量分数为 )
经浸出、干燥后得到 “浸渣”( 的质量分数为 ), 的浸出率为_______。
(3)“沉铝”时,体系中三种物质的溶解度曲线如下图所示,加入 沉铝的目的是_______,“沉铝”的
最佳方案为_______。
(4)“焙烧”时,主要反应的化学方程式为_______。
(5)“水浸”后得到的“滤液2”可返回_______工序循环使用。
【答案】(1)提高浸出率(或提高浸出速率)
(2) 和 84%
(3)使更多的铝元素转化为晶体析出,同时保证晶体纯度 高温溶解再冷却结晶
(4) 或
(5)沉铝
【分析】粉煤灰为原料(主要含SiO、Al O 和CaO等)加入硫酸,浸渣为二氧化硅、硫酸钙,加入硫酸钾,
2 2 3
产生复盐明矾沉铝,干燥脱水,焙烧产生氧化铝、硫酸钾和二氧化硫或三氧化硫气体,水浸除去硫酸钾,
得到氧化铝。
【详解】(1)温度高速率大,“浸出”时适当升温的主要目的是提高反应速率,提高浸出率;Al O 和
2 3
HSO 发生反应生成Al (SO ) 和HO,离子反应方程式为Al O+6H+=2Al3++3H O;
2 4 2 4 3 2 2 3 2
故答案为:提高浸出率(或提高浸出速率);Al O+6H+=2Al3++3H O。
2 3 2(2)“浸渣”的主要成分除残余Al O 外,还有二氧化硅、硫酸钙;5.0g粉煤灰Al O 的质量为
2 3 2 3
5.0g×30%=1.5g,3.0g“浸渣”Al O 的质量为3.0g×8%=0.24g,则Al O 的浸出率为 ;
2 3 2 3
故答案为:SiO 和CaSO;84%。
2 4
(3)根据沉铝体系中,Al (SO )·18H O溶解度最大,KAl(SO )·12H O溶解度最小,更容易析出,加入
2 4 3 2 4 2 2
KSO 沉铝的目的是更多的使Al (SO ) 转化为KAl(SO )·12H O,使更多的铝元素转化为晶体析出,同时保
2 4 2 4 3 4 2 2
证晶体纯度;KAl(SO )·12H O溶解度受温度影响较大,“沉铝”的最佳方案为高温溶解再冷却结晶;
4 2 2
故答案为:使更多的铝元素转化为晶体析出,同时保证晶体纯度;高温溶解再冷却结晶。
(4)“焙烧”时,KAl(SO ) 分解为KSO 、Al O 和SO 或KSO 、Al O、SO 和O,反应方程式为
4 2 2 4 2 3 3 2 4 2 3 2 2
2KAl(SO ) KSO +AlO+3SO↑或4KAl(SO ) 2KSO +2AlO+6SO↑+3O ↑;
4 2 2 4 2 3 3 4 2 2 4 2 3 2 2
故答案为:2KAl(SO ) KSO +AlO+3SO↑或4KAl(SO ) 2KSO +2AlO+6SO↑+3O ↑。
4 2 2 4 2 3 3 4 2 2 4 2 3 2 2
(5)“水浸”后得到的“滤液2”成分为KSO ,可在沉铝工序循环使用;
2 4
故答案为:沉铝。
16.(2022·辽宁卷)某工厂采用辉铋矿(主要成分为 ,含有 、 杂质)与软锰矿(主要成分为
)联合焙烧法制各 和 ,工艺流程如下:
已知:①焙烧时过量的 分解为 , 转变为 ;
②金属活动性: ;
③相关金属离子形成氢氧化物的 范围如下:
开始沉淀 完全沉淀
6.5 8.3
1.6 2.8
8.1 10.1
回答下列问题:
(1)为提高焙烧效率,可采取的措施为_______。
a.进一步粉碎矿石 b.鼓入适当过量的空气 c.降低焙烧温度
(2) 在空气中单独焙烧生成 ,反应的化学方程式为_______。(3)“酸浸”中过量浓盐酸的作用为:①充分浸出 和 ;②_______。
(4)滤渣的主要成分为_______(填化学式)。
(5)生成气体A的离子方程式为_______。
(6)加入金属Bi的目的是_______。
(7)将100kg辉铋矿进行联合焙烧,转化时消耗1.1kg金属Bi,假设其余各步损失不计,干燥后称量
产品质量为32kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为_______。
【答案】(1)ab
(2)
(3)抑制金属离子水解
(4)SiO
2
(5)
(6)将Fe3+转化为Fe2+
(7)24.02%
【分析】已知①焙烧时过量的 分解为 , 转变为 , 在空气中单独焙烧生成
和二氧化硫,经过酸浸,滤渣为二氧化硅, 与浓盐酸生成A氯气,滤液中含有Bi3+、Fe3+,加入Bi将
Fe3+转化为Fe2+,调节pH得到 ,据此分析解题。
【详解】(1)为提高焙烧效率,可采取的措施为:进一步粉碎矿石增大与氧气的接触面积;鼓入适当过
量的空气 使燃烧更加充分,故选ab;
(2) 在空气中单独焙烧生成 和二氧化硫,反应的化学方程式为 ;
(3)“酸浸”中由于铁离子、Bi3+易水解,因此溶浸时加入过量浓盐酸的目的是防止FeCl 及BiCl 水解生
3 3
成不溶性沉淀,提高原料的浸出率;过量浓盐酸的作用为:①充分浸出 和 ;②抑制金属离子水解;
(4)由于SiO 不溶于酸和水中,故滤渣的主要成分为SiO;
2 2
(5)A为氯气,生成气体A的离子方程式为 ;
(6)金属活动性: ,Fe3+在pH为1.6时则产生沉淀,为了铁元素不以沉淀形式出现故加入
金属Bi将Fe3+转化为Fe2+,形成氯化亚铁溶液;
(7)辉铋矿中Bi元素的质量分数为 。
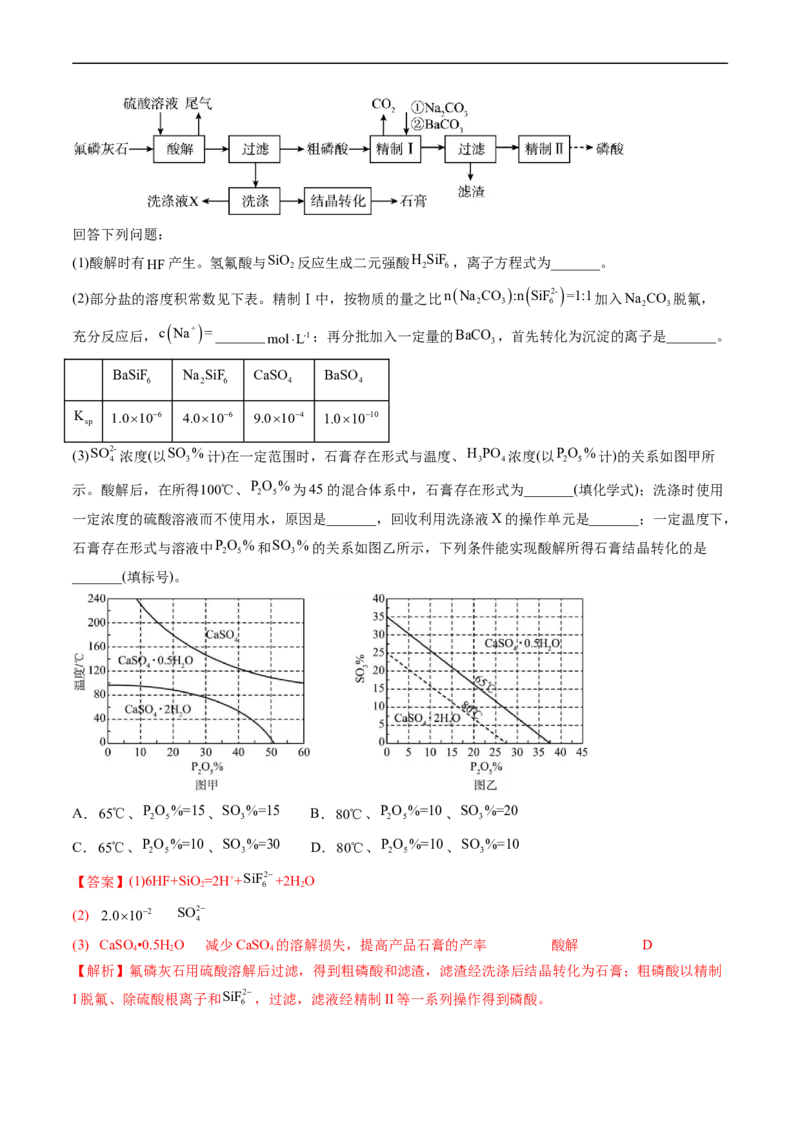
17.(2022·山东卷)工业上以氟磷灰石[Ca FPO ,含SiO 等杂质]为原料生产磷酸和石膏,工艺流程如
5 4 3 2
下:回答下列问题:
(1)酸解时有HF产生。氢氟酸与SiO
2
反应生成二元强酸H
2
SiF
6
,离子方程式为_______。
(2)部分盐的溶度积常数见下表。精制Ⅰ中,按物质的量之比nNa CO :n SiF2- =1:1加入Na CO 脱氟,
2 3 6 2 3
充分反应后,c
Na+
=_______molL-1;再分批加入一定量的BaCO
3
,首先转化为沉淀的离子是_______。
BaSiF Na SiF CaSO BaSO
6 2 6 4 4
K 1.0106 4.0106 9.0104 1.01010
sp
(3)SO2- 浓度(以SO %计)在一定范围时,石膏存在形式与温度、H PO 浓度(以PO %计)的关系如图甲所
4 3 3 4 2 5
示。酸解后,在所得100℃、P
2
O
5
%为45的混合体系中,石膏存在形式为_______(填化学式);洗涤时使用
一定浓度的硫酸溶液而不使用水,原因是_______,回收利用洗涤液X的操作单元是_______;一定温度下,
石膏存在形式与溶液中PO %和SO %的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是
2 5 3
_______(填标号)。
A.65℃、P
2
O
5
%=15、SO
3
%=15 B.80℃、P
2
O
5
%=10、SO
3
%=20
C.65℃、P
2
O
5
%=10、SO
3
%=30 D.80℃、P
2
O
5
%=10、SO
3
%=10
【答案】(1)6HF+SiO
=2H++SiF2
+2H O
2 6 2
(2) 2.0102 SO2
4
(3) CaSO•0.5HO 减少CaSO 的溶解损失,提高产品石膏的产率 酸解 D
4 2 4
【解析】氟磷灰石用硫酸溶解后过滤,得到粗磷酸和滤渣,滤渣经洗涤后结晶转化为石膏;粗磷酸以精制
I脱氟、除硫酸根离子和SiF2
,过滤,滤液经精制II等一系列操作得到磷酸。
6(1)氢氟酸与SiO 反应生成二元强酸HSiF,该反应的离子方程式为6HF+SiO
=2H++SiF2
+2H O。
2 2 6 2 6 2
(2)精制1中,按物质的量之比n(Na
CO):n(SiF2
)= 1:1加入NaCO 脱氟,该反应的化学方程式为HSiF+
2 3 6 2 3 2 6
NaCO= Na SiF↓+CO ↑+ H O,充分反应后得到沉淀NaSiF,溶液中有饱和的NaSiF,且c(Na+)=2c(
2 3 2 6 2 2 2 6 2 6
4.0106
),根据NaSiF 的溶度积可知Ksp= c2(Na+)• c( )=4c3( ),c( ) =3 1.0102
SiF2 2 6 SiF2 SiF2 SiF2
4
6 6 6 6
mol•L-1,因此c(Na+)=2c(SiF2 )=2.0102mol•L-1;同时,粗磷酸中还有硫酸钙的饱和溶液,c(Ca2+)=c(SO2
6 4
)= 9.0104 3.0102mol•L-1;分批加入一定量的BaCO ,当BaSiF 沉淀开始生成时,c(Ba2+)=
3 6
1.0106 1.01010
1.0103 mol•L-1,当BaSO 沉淀开始生成时,c(Ba2+)= 3.3109 mol•L-1,因此,首
1.0103 4 3.0102
先转化为沉淀的离子是SO2,然后才是SiF2。
4 6
(3)根据图中的坐标信息,酸解后,在所得100℃、PO%为45的混合体系中,石膏存在形式为
2 5
CaSO•0.5HO;CaSO 在硫酸中的溶解度小于在水中的,因此,洗涤时使用一定浓度的硫酸溶液而不使用
4 2 4
水的原因是:减少CaSO 的溶解损失,提高产品石膏的产率;洗涤液X中含有硫酸,其具有回收利用的价
4
值,由于酸解时使用的也是硫酸,因此,回收利用洗涤液X的操作单元是:酸解。由图甲信息可知,温度
越低,越有利于实现酸解所得石膏结晶的转化,由图乙信息可知,位于65℃线上方的晶体全部以
CaSO•0.5HO形式存在,位于80℃线下方,晶体全部以CaSO•2H O形式存在,在两线之间的以两种晶体
4 2 4 2
的混合物形式存在:
A. PO%= l5、SO %= 15,由图乙信息可知,该点坐标位于两个温度线之间,故不能实现晶体的完全转
2 5 3
化,A不符合题意;
B. PO%= 10、SO %= 20,由图乙信息可知,该点坐标位于两个温度线(65℃、80℃)之间,故不能实
2 5 3
现晶体的完全转化, B不符合题意;
C.PO%= 10、SO %= 30,由图乙信息可知,该点坐标位于,该点坐标位于65℃线上方,晶体全部以
2 5 3
CaSO•0.5HO形式存在,故不能实现晶体转化, C不符合题意;
4 2
D. PO%=10、SO %= 10,由图乙信息可知,该点坐标位于80℃线下方,晶体全部以CaSO•2H O形式
2 5 3 4 2
存在,故能实现晶体的完全转化,D符合题意;
综上所述,能实现酸解所得石膏结晶转化的是D。
〖2021年高考真题〗
考点一 除杂提纯类
18.(2021·全国乙卷)磁选后的炼铁高钛炉渣,主要成分有 、 、 、 、 以及
少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。该工艺条件下,有关金属离子开始沉淀和沉淀完全的 见下表
金属离子
开始沉淀的 2.2 3.5 9.5 12.4
沉淀完全 的 3.2 4.7 11.1 13.8
回答下列问题:
(1)“焙烧”中, 、 几乎不发生反应, 、 、 、 转化为相应的硫酸盐,写出
转化为 的化学方程式_______。
(2)“水浸”后“滤液”的 约为2.0,在“分步沉淀”时用氨水逐步调节 至11.6,依次析出的金属离子是
_______。
(3)“母液①"中 浓度为_______ 。
(4)“水浸渣”在160℃“酸溶”最适合的酸是_______。“酸溶渣”的成分是_______、_______。
(5)“酸溶”后,将溶液适当稀释并加热, 水解析出 沉淀,该反应的离子方程式是
_______。
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得_______,循环利用。
【答案】
硫酸
【分析】
由题给流程可知,高钛炉渣与硫酸铵混合后焙烧时,二氧化钛和二氧化硅不反应,氧化铝、氧化镁、氧化
钙、氧化铁转化为相应的硫酸盐,尾气为氨气;将焙烧后物质加入热水水浸,二氧化钛、二氧化硅不溶于
水,微溶的硫酸钙部分溶于水,硫酸铁、硫酸镁和硫酸铝铵溶于水,过滤得到含有二氧化钛、二氧化硅、
硫酸钙的水浸渣和含有硫酸铁、硫酸镁、硫酸铝铵和硫酸钙的滤液;向pH约为2.0的滤液中加入氨水至
11.6,溶液中铁离子、铝离子和镁离子依次沉淀,过滤得到含有硫酸铵、硫酸钙的母液①和氢氧化物沉淀;向水浸渣中加入浓硫酸加热到160℃酸溶,二氧化硅和硫酸钙与浓硫酸不反应,二氧化钛与稀硫酸反应得
到TiOSO ,过滤得到含有二氧化硅、硫酸钙的酸溶渣和TiOSO 溶液;将TiOSO 溶液加入热水稀释并适当
4 4 4
加热,使TiOSO 完全水解生成TiO·x H O沉淀和硫酸,过滤得到含有硫酸的母液②和TiO·x H O。
4 2 2 2 2
【详解】
(1)氧化铝转化为硫酸铝铵发生的反应为氧化铝、硫酸铵在高温条件下反应生成硫酸铝铵、氨气和水,反应
的化学方程式为Al O+4(NH )SO NH Al(SO )+4NH↑+3H O,故答案为:Al O+4(NH )SO
2 3 4 2 4 4 4 2 3 2 2 3 4 2 4
NH Al(SO )+4NH↑+3H O;
4 4 2 3 2
(2)由题给开始沉淀和完全沉淀的pH可知,将pH约为2.0的滤液加入氨水调节溶液pH为11.6时,铁离子
首先沉淀、然后是铝离子、镁离子,钙离子没有沉淀,故答案为:Fe3+、Al3+、Mg2+;
(3)由镁离子完全沉淀时,溶液pH为11.1可知,氢氧化镁的溶度积为1×10—5×(1×10—2.9)2=1×10—10.8,当溶液
pH为11.6时,溶液中镁离子的浓度为 =1×10—6mol/L,故答案为:1×10—6;
(4)增大溶液中硫酸根离子浓度,有利于使微溶的硫酸钙转化为沉淀,为了使微溶的硫酸钙完全沉淀,减少
TiOSO 溶液中含有硫酸钙的量,应加入浓硫酸加热到160℃酸溶;由分析可知,二氧化硅和硫酸钙与浓硫
4
酸不反应,则酸溶渣的主要成分为二氧化硅和硫酸钙,故答案为:硫酸;SiO、CaSO;
2 4
(5)酸溶后将TiOSO 溶液加入热水稀释并适当加热,能使TiOSO 完全水解生成TiO·x H O沉淀和硫酸,反
4 4 2 2
应的离子方程式为TiO2++(x+1)HO TiO·xHO+2H+,故答案为:TiO2++(x+1)HO TiO·xHO+2H+;
2 2 2 2 2 2
(6)由分析可知,尾气为氨气,母液①为硫酸铵、母液②为硫酸,将母液①和母液②混合后吸收氨气得到硫
酸铵溶液,可以循环使用,故答案为:(NH )SO 。
4 2 4
19.(2021·全国甲卷)碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1) 的一种制备方法如下图所示:
①加入 粉进行转化反应的离子方程式为_______,生成的沉淀与硝酸反应,生成_______后可循环使用。
②通入 的过程中,若氧化产物只有一种,反应的化学方程式为_______;若反应物用量比
时,氧化产物为_______;当 ,单质碘的收率会降低,原因是
_______。
(2)以 为原料制备 的方法是:先向 溶液中加入计量的 ,生成碘化物;再向混合溶
液中加入 溶液,反应得到 ,上述制备 的总反应的离子方程式为_______。
(3) 溶液和 溶液混合可生成 沉淀和 ,若生成 ,消耗的 至少为_______ 。
在 溶液中可发生反应 。实验室中使用过量的 与 溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量 的原因是_______。
【答案】2AgI+Fe=2Ag+ Fe2++2I- AgNO FeI+Cl= I +FeCl I、FeCl I 被过量的 进一步
3 2 2 2 2 2 3 2
氧化 4 防止单质碘析出
【详解】
(1) ①由流程图可知悬浊液中含AgI ,AgI可与Fe反应生成FeI 和Ag,FeI 易溶于水,在离子方程式中能
2 2
拆,故加入 粉进行转化反应的离子方程式为2AgI+Fe=2Ag+ Fe2++2I-,生成的银能与硝酸反应生成硝酸
银参与循环中,故答案为:2AgI+Fe=2Ag+ Fe2++2I-;AgNO;
3
②通入 的过程中,因I-还原性强于Fe2+, 先氧化还原性强的I-,若氧化产物只有一种,则该氧化产
物只能是I,故反应的化学方程式为FeI+Cl= I +FeCl ,若反应物用量比 时即 过
2 2 2 2 2
量,先氧化完全部I-再氧化Fe2+,恰好将全部I-和Fe2+氧化,故氧化产物为I、FeCl ,当
2 3
即 过量特别多,多余的氯气会与生成的单质碘以及水继续发生氧化还原反应,
单质碘的收率会降低,故答案为:FeI+Cl= I +FeCl ;I、FeCl ;I 被过量的 进一步氧化;
2 2 2 2 2 3 2
(2)先向 溶液中加入计量的 ,生成碘化物即含I-的物质;再向混合溶液中(含I-)加入
溶液,反应得到 ,上述制备 的两个反应中I-为中间产物,总反应为 与 发生氧化还原
反应,生成 和 ,根据得失电子守恒、电荷守恒]及元素守恒配平离子方程式即可得:
,故答案为: ;
(3) 溶液和 溶液混合可生成 沉淀和 ,化学方程式为4KI+2CuSO =2CuI +I +2K SO ,
4 2 2 4
若生成 ,则消耗的 至少为4mol;反应中加入过量 ,I-浓度增大,可逆反应 平衡
右移,增大 溶解度,防止 升华,有利于蒸馏时防止单质碘析出,故答案为:4;防止单质碘析出。
20.(2021·河北卷)绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相
氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,
实现了Cr—Fe—Al—Mg的深度利用和Na+内循环。工艺流程如图:
回答下列问题:(1)高温连续氧化工序中被氧化的元素是_______(填元素符号)。
(2)工序①的名称为__。
(3)滤渣的主要成分是__(填化学式)。
(4)工序③中发生反应的离子方程式为_______。
(5)物质V可代替高温连续氧化工序中的NaOH,此时发生的主要反应的化学方程式为__,可代替NaOH的
化学试剂还有_______(填化学式)。
(6)热解工序产生的混合气体最适宜返回工序_______(填“①”或“②”或“③”或“④”)参与内循环。
(7)工序④溶液中的铝元素恰好完全转化为沉淀的pH为__。(通常认为溶液中离子浓度小于10-5mol•L-1为沉
淀完全;A1(OH) +OH- Al(OH) :K=100.63,K =10-14,K [A1(OH) ]=10-33)
3 w sp 3
⇌
【答案】Fe、Cr 溶解浸出 MgO、Fe O 2Na++2 +2CO +H O= +2NaHCO↓
2 3 2 2 3
4Fe(CrO )+ 7O +16NaHCO 8NaCrO+2 Fe O+ 16CO+8H O NaCO ② 8.37
2 2 2 3 2 4 2 3 2 2 2 3
【分析】
由题给流程可知,铬铁矿、氢氧化钠和空气在高温下连续氧化发生的反应为,在熔融氢氧化钠作用下,
Fe(CrO ) 被氧气高温氧化生成铬酸钠和氧化铁,氧化铝与熔融氢氧化钠反应转化为偏铝酸钠,氧化镁不反
2 2
应;将氧化后的固体加水溶解,过滤得到含有氧化镁、氧化铁的滤渣1和含有过量氢氧化钠、铬酸钠、偏
铝酸钠的滤液;将滤液在介稳态条件下分离得到铬酸钠溶液、氢氧化钠溶液和偏铝酸钠溶液;向铬酸钠溶
液中通入过量的二氧化碳得到重铬酸钠和碳酸氢钠沉淀;向偏铝酸钠溶液中通入过量的二氧化碳气体得到
氢氧化铝沉淀和碳酸氢钠;向滤渣1中通入二氧化碳和水蒸气,氧化镁与二氧化碳和水蒸气反应转化为碳
酸氢镁溶液;碳酸氢镁溶液受热分解得到碳酸镁固体和二氧化碳、水蒸气,二氧化碳、水蒸气可以在工序
②循环使用;碳酸镁高温煅烧得到氧化镁。
【详解】
(1)由分析可知,高温连续氧化工序中被氧化的元素是铁元素和铬元素,故答案为:Fe、Cr;
(2)由分析可知,工序①为将氧化后的固体加水溶解浸出可溶性物质,故答案为:溶解浸出;
(3)由分析可知,滤渣Ⅰ的主要成分是氧化铁和氧化镁,故答案为:MgO、Fe O;
2 3
(4)工序③中发生的反应为铬酸钠溶液与过量的二氧化碳反应生成重铬酸钠和碳酸氢钠沉淀,反应的离子方
程式为2Na++2 +2CO +H O= +2NaHCO↓,故答案为:2Na++2 +2CO +H O=
2 2 3 2 2
+2NaHCO↓;
3
(5)碳酸氢钠代替高温连续氧化工序中的氢氧化钠发生的主要反应为高温下,,Fe(CrO ) 与氧气和碳酸氢钠
2 2
反应生成铬酸钠、氧化铁、二氧化碳和水,反应的化学方程式为4Fe(CrO )+ 7O +16NaHCO
2 2 2 3
8NaCrO+2 Fe O+ 16CO+8H O;若将碳酸氢钠换为碳酸钠也能发生类似的反应,故答案为:4Fe(CrO )+
2 4 2 3 2 2 2 2
7O+16NaHCO 8NaCrO+2 Fe O+ 16CO+8H O;
2 3 2 4 2 3 2 2(6)热解工序产生的混合气体为二氧化碳和水蒸气,将混合气体通入滤渣1中可以将氧化镁转化为碳酸氢镁
溶液,则混合气体最适宜返回工序为工序②,故答案为:②;
(7)工序④溶液中的铝元素恰好完全转化为沉淀的反应为 ,反应的平
衡常数为K= = = =1013.37,当 为10—
1
5mol/L时,溶液中氢离子浓度为 = mol/L=10—8.37mol/L,则溶液的pH为
8.37,故答案为:8.37。
21.(2021·湖南卷) 可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以
形式存在,还含有 、 、 、 等物质。以独居石为原料制备
的工艺流程如下:
回答下列问题:
(1)铈的某种核素含有58个质子和80个中子,该核素的符号为_______;
(2)为提高“水浸”效率,可采取的措施有_______(至少写两条);
(3)滤渣Ⅲ的主要成分是_______(填化学式);
(4)加入絮凝剂的目的是_______;
(5)“沉铈”过程中,生成 的离子方程式为_______,常温下加入的 溶液呈
_______(填“酸性”“碱性”或“中性”)(已知: 的 , 的 ,
);
(6)滤渣Ⅱ的主要成分为 ,在高温条件下, 、葡萄糖( )和 可制备电极材料
,同时生成 和 ,该反应的化学方程式为_______
【答案】 适当升高温度,将独居石粉碎等 Al(OH) 促使铝离子沉淀
3
↑ 碱性 6 + +12
=12 +6CO↑+6H O+6CO↑
2 2【分析】
焙烧浓硫酸和独居石的混合物、水浸, 转化为Ce (SO ) 和HPO , 与硫酸不反应, 转
2 4 3 3 4
化为Al (SO ), 转化为Fe (SO ), 转化为CaSO 和HF,酸性废气含HF;后过滤,滤渣Ⅰ为
2 4 3 2 4 3 4
和磷酸钙、FePO ,滤液主要含HPO ,Ce (SO ),Al (SO ),Fe (SO ),加氯化铁溶液除磷,滤渣Ⅱ
4 3 4 2 4 3 2 4 3 2 4 3
为FePO ;聚沉将铁离子、铝离子转化为沉淀,过滤除去,滤渣Ⅲ主要为氢氧化铝,还含氢氧化铁;加碳
4
酸氢铵沉铈得Ce (CO)·nH O。
2 3 3 2
【详解】
(1)铈的某种核素含有58个质子和80个中子,则质量数为58+80=138,该核素的符号为 ;
(2)为提高“水浸”效率,可采取的措施有适当升高温度,将独居石粉碎等;
(3)结合流程可知,滤渣Ⅲ的主要成分是Al(OH) ;
3
(4)加入絮凝剂的目的是促使铝离子沉淀;
(5)用碳酸氢铵“沉铈”,则结合原子守恒、电荷守恒可知生成 的离子方程式为
↑;铵根离子的水解常数K( )=
h
≈5.7×10-10,碳酸氢根的水解常数K( )== ≈2.3×10-8,则K( )13,VO·xH O转化为钒酸盐溶解,Al(OH) 转化为NaAlO ,则滤渣③的主要成分为Fe(OH) ;滤液③
2 5 2 3 2 3
中含钒酸盐、偏铝酸钠,加入HCl调pH=8.5,NaAlO 转化为Al(OH) 沉淀而除去;最后向滤液④中加入
2 3
NH Cl“沉钒”得到NH VO 。
4 4 3
(1)“酸浸氧化”需要加热,其原因是:升高温度,加快酸浸和氧化反应速率(促进氧化完全);
(2) “酸浸氧化”中,钒矿粉中的Fe O 与硫酸反应生成FeSO 、Fe (SO ) 和水,MnO 具有氧化性,Fe2+具
3 4 4 2 4 3 2
有还原性,则VO+和VO2+被氧化成 的同时还有Fe2+被氧化,反应的离子方程式为MnO +2Fe2++4H+=
2
Mn2++2Fe3++2H O;VO+转化为 时,钒元素的化合价由+3价升至+5价,1molVO+失去2mol电子,
2
MnO 被还原为Mn2+,Mn元素的化合价由+4价降至+2价,1molMnO 得到2mol电子,根据得失电子守恒、
2 2
原子守恒和电荷守恒,VO+转化为 反应的离子方程式为VO++MnO+2H+= +Mn2++H O;
2 2
(3)根据分析,“中和沉淀”中,钒水解并沉淀为VO·xH O,随滤液②可除去金属离子K+、Mg2+、
2 5 2
Na+、Mn2+,以及部分的Fe3+、Al3+;
(4)根据分析,滤渣③的主要成分是Fe(OH) ;
3
(5)“调pH”中有沉淀生成,是NaAlO 与HCl反应生成Al(OH) 沉淀,生成沉淀反应的化学方程式是
2 3
NaAlO +HCl+H O=NaCl+Al(OH) ↓或Na[Al(OH)]+HCl= NaCl+Al(OH) ↓+H O。
2 2 3 4 3 2
(6)“沉钒”中析出NH VO 晶体时,需要加入过量NH Cl,其原因是:增大NH +离子浓度,利用同离子
4 3 4 4
效应,促进NH VO 尽可能析出完全。
4 3〖2019年高考真题〗
考点一 除杂提纯类
29.[2019·江苏卷]实验室以工业废渣(主要含CaSO·2H O,还含少量SiO、Al O、Fe O)为原料制取轻
4 2 2 2 3 2 3
质CaCO 和(NH )SO 晶体,其实验流程如下:
3 4 2 4
(1)室温下,反应CaSO(s)+ CO2- (aq) CaCO (s)+ SO 2- (aq)达到平衡,则溶液中 = ▲
4 3 3 4
[K (CaSO)=4.8×10−5,K (CaCO)=3×10−9]。
sp 4 sp 3
(2)将氨水和NH HCO 溶液混合,可制得(NH )CO 溶液,其离子方程式为 ▲ ;浸取废渣时,向
4 3 4 2 3
(NH )CO 溶液中加入适量浓氨水的目的是 ▲ 。
4 2 3
(3)废渣浸取在如图所示的装置中进行。控制反应温度在60~70 ℃,搅拌,反应3小时。温度过高将会导
致CaSO 的转化率下降,其原因是 ▲ ;保持温度、反应时间、反应物和溶剂的量不变,实验中提
4
高CaSO 转化率的操作有 ▲ 。
4
(4)滤渣水洗后,经多步处理得到制备轻质CaCO 所需的CaCl 溶液。设计以水洗后的滤渣为原料,制取
3 2
CaCl 溶液的实验方案: ▲ [已知pH=5时Fe(OH) 和Al(OH) 沉淀完全;pH=8.5时Al(OH) 开始溶解。
2 3 3 3
实验中必须使用的试剂:盐酸和Ca(OH) ]。
2
【答案】(1)1.6×104
(2)HCO -+NH·H O== NH++ CO2-+H O(或HCO -+NH·H O NH ++ CO2-+H O)
3 3 2 4 3 2 3 3 2 4 3 2
增加溶液中CO2-的浓度,促进CaSO 的转化
3 4
(3)温度过高,(NH )CO 分解 加快搅拌速率
4 2 3
(4)在搅拌下向足量稀盐酸中分批加入滤渣,待观察不到气泡产生后,过滤,向滤液中分批加入少量
Ca(OH) ,用pH试纸测量溶液pH,当pH介于5~8.5时,过滤
2
【解析】
(1)反应CaSO(s)+CO 2-(aq) CaCO (s)+SO2-(aq)达到平衡时,溶液中 =
4 3 3 4= = =1.6×104。
(2)NH HCO 属于酸式盐,与氨水反应生成(NH )CO,反应的化学方程式为NH HCO +NH·H O=
4 3 4 2 3 4 3 3 2
(NH )CO+H O[或NH HCO +NH·H O (NH )CO+H O],离子方程式为HCO -+NH·H O=NH +
4 2 3 2 4 3 3 2 4 2 3 2 3 3 2 4
+CO 2-+H O(或HCO -+NH·H O NH ++CO 2-+H O);浸取废渣时,加入的(NH )CO 属于弱酸弱碱
3 2 3 3 2 4 3 2 4 2 3
盐,溶液中存在水解平衡:CO2-+NH++H O HCO -+NH·H O,加入适量浓氨水,水解平衡逆向移动,
3 4 2 3 3 2
溶液中CO2-的浓度增大,反应CaSO(s)+CO 2-(aq) CaCO (s)+SO2-(aq)正向移动,促进
3 4 3 3 4
CaSO 的转化。
4
(3)由于铵盐具有不稳定性,受热易分解,所以温度过高,(NH )CO 分解,从而使CaSO 转化率下降;
4 2 3 4
由于浸取过程中的反应属于固体与溶液的反应(或发生沉淀的转化),保持温度、反应时间、反应物和溶
剂的量不变,提高CaSO 转化率即提高反应速率,结合外界条件对化学反应速率的影响,实验过程中提高
4
CaSO 转化率的操作为加快搅拌速率(即增大接触面积,加快反应速率,提高浸取率)。
4
(4)工业废渣主要含CaSO·2H O,还含有少量SiO、Al O 和Fe O,加入(NH )CO 溶液浸取,其中
4 2 2 2 3 2 3 4 2 3
CaSO 与(NH )CO 反应生成CaCO 和(NH )SO ,SiO、Al O 和Fe O 都不反应,过滤后所得滤渣中
4 4 2 3 3 4 2 4 2 2 3 2 3
含CaCO 、SiO、Al O 和Fe O;若以水洗后的滤渣为原料制取CaCl 溶液,根据题给试剂,首先要加入足
3 2 2 3 2 3 2
量盐酸将CaCO 完全转化为CaCl ,发生的反应为CaCO +2HCl=CaCl +H O+CO↑,与此同时发生反应
3 2 3 2 2 2
Al O+6HCl=2AlCl +3H O、Fe O+6HCl=2FeCl +3H O,SiO 不反应,经过滤除去SiO;得到的滤液中含
2 3 3 2 2 3 3 2 2 2
CaCl 、AlCl 、FeCl ,根据“pH=5时Fe(OH) 和Al(OH) 沉淀完全,pH=8.5时Al(OH) 开始溶
2 3 3 3 3 3
解”,为了将滤液中Al3+、Fe3+完全除去,应加入Ca(OH) 调节溶液的pH介于5~8.5[加入Ca(OH) 的
2 2
过程中要边加边测定溶液的pH],然后过滤即可制得CaCl 溶液。
2
考点二 原材料化学转化类
30.[2019·新课标Ⅰ]硼酸(HBO)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种
3 3
以硼镁矿(含MgB O·H O、SiO 及少量Fe O、Al O)为原料生产硼酸及轻质氧化镁的工艺流程如下:
2 2 5 2 2 2 3 2 3
回答下列问题:
(1)在95 ℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为_________。
(2)“滤渣1”的主要成分有_________。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试
剂是_________。
(3)根据HBO 的解离反应:HBO+H O===H++B(OH)−,K=5.81×10−10,可判断HBO 是______酸;在
3 3 3 3 2 4 a 3 3
“过滤2”前,将溶液pH调节至3.5,目的是_______________。
(4)在“沉镁”中生成Mg(OH) ·MgCO 沉淀的离子方程式为__________,母液经加热后可返回
2 3___________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是_________。
【答案】(1)NH HCO +NH== (NH )CO
4 3 3 4 2 3
(2)SiO、Fe O、Al O KSCN
2 2 3 2 3
(3)一元弱 转化为HBO,促进析出
3 3
(4)2Mg2++3 CO2-+2H O==Mg(OH) ·MgCO ↓+2 HCO -
3 2 2 3 3
(或2Mg2++2 CO2-+H O==Mg(OH) ·MgCO ↓+CO ↑) 溶浸 高温焙烧
3 2 2 3 2
【解析】(1)根据流程图知硼镁矿粉中加入硫酸铵溶液产生的气体为氨气,用碳酸氢铵溶液吸收,反应
方程式为:NH +NHHCO == (NH )CO。
3 4 3 4 2 3
(2)滤渣I为不与硫酸铵溶液反应的Fe O、Al O、SiO;检验Fe3+,可选用的化学试剂为KSCN,
2 3 2 3 2
(3)由硼酸的离解方程式知,硼酸在水溶液中是通过与水分子的配位作用产生氢离子,而三价硼原子最
多只能再形成一个配位键,且硼酸不能完全解离,所以硼酸为一元弱酸;在“过滤2”前,将溶液pH调节
至3.5,目的是将B(OH)− 转化为HBO,并促进HBO 析出,
4 3 3 3 3
(4)沉镁过程中用碳酸铵溶液与Mg2+反应生成Mg(OH) ∙MgCO,沉镁过程的离子反应为:2Mg2+
2 3
+2H O+3CO2-==Mg(OH) ∙MgCO↓+2HCO-;母液加热分解后生成硫酸铵溶液,可以返回“溶浸”工序循
2 3 2 3 3
环使用;碱式碳酸镁不稳定,高温下可以分解,故由碱式碳酸镁制备轻质氧化镁的方法是高温焙烧。
31.[2019·新课标Ⅱ]立德粉ZnS·BaSO(也称锌钡白),是一种常用白色颜料。回答下列问题:
4
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,
钡的焰色为__________(填标号)。
A.黄色 B.红色 C.紫色 D.绿色
(2)以重晶石(BaSO)为原料,可按如下工艺生产立德粉:
4
①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为______________________。
回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO 和一种清洁能源气体,该反应
2
的化学方程式为______________________。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”
表面生成了难溶于水的___________(填化学式)。
③沉淀器中反应的离子方程式为______________________。
(3)成品中S2−的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000
mol·L−1的I−KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉为指示剂,
2
过量的I 用0.1000 mol·L−1NaSO 溶液滴定,反应式为I+2 ==2I−+ 。测定时消耗NaSO 溶液
2 2 2 3 2 2 2 3
体积V mL。终点颜色变化为_________________,样品中S2−的含量为______________(写出表达式)。
【答案】(1)D(2)①BaSO+4C==BaS+4CO↑ CO+HO==CO+H
4 2 2 2
②BaCO
3
③S2−+Ba2++Zn2++ == BaSO·ZnS↓
4
(3)浅蓝色至无色
【解析】
(1)焰色反应不是化学变化,常用来检验金属元素存在,常见金属元素焰色:A.钠的焰色为黄色,故A
错误;B.钙的焰色为红色,故B错误;C.钾的焰色为紫色,故C错误;D.钡的焰色为绿色,故D正确;
故选D。
(2)①注意焦炭过量生成CO,反应物为硫酸钡与焦炭,产物为BaS与CO,写出方程式
BaSO+4C==BaS+4CO↑;CO与水蒸气反应生成CO 与H,写出方程式:CO+HO==CO+H 。
4 2 2 2 2 2
②根据信息臭鸡蛋气味气体为硫化氢气体,由强酸制弱酸原理,还原料硫化钡与空气中水,二氧化碳反应
生成了碳酸钡与硫化氢气体。
③硫化钡与硫酸锌为可溶性强电解质,写成离子形式,产物硫酸钡与硫化锌为沉淀,不可电离,写出离子
方程式:S2−+Ba2++Zn2++ SO 2-==BaSO·ZnS↓。
4 4
(3)碘单质与硫离子的反应:S2-+I ==S+2I-;碘单质与淀粉混合为蓝色,用硫代硫酸钠滴定过量的I,故
2 2
终点颜色变化为浅蓝色至无色;根据氧化还原反应得失电子数相等,利用关系式法解题;根据化合价升降
相等列关系式,设硫离子物质的量为n mol:
S2- ~ I 2SO2- ~ I
2 2 3 2
1 mol 1 mol 2 mol 1 mol
n mol n mol 0.1V×10-3mol 0.1V×10-3mol
n+ 0.1V×10-3mol=25 0.1V×10-3mol,得n=(25- V)0.1×10-3mol
则样品中硫离子含量为: ×100%= ×100%。
32.[2019·新课标Ⅲ] 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫
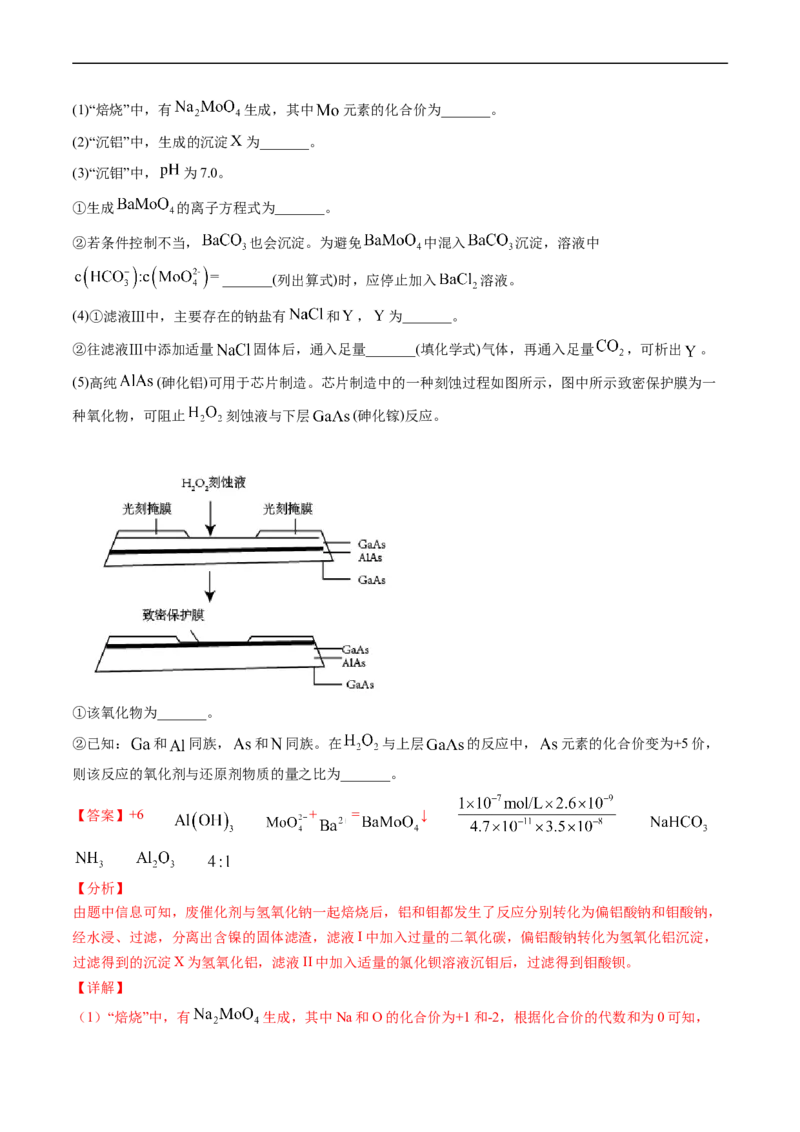
化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
0
金属离子 Mn2+ Fe2+ Fe3+ Al3+ Mg2+ Zn2+ Ni2+开始沉淀的pH 8.1 6.3 1.5 3.4 8.9 6.2 6.9
沉淀完全的pH 10.1 8.3 2.8 4.7 10.9 8.2 8.9
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方
程式____________________________________________________。
(2)“氧化”中添加适量的MnO 的作用是________________________。
2
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF 沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
2
_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNiCoMnO,其中Ni、Co、Mn的
x y z 2
化合价分别为+2、+3、+4。当x=y= 时,z=___________。
【答案】(1)SiO(不溶性硅酸盐) MnO +MnS+2H SO ==2MnSO +S+2H O
2 2 2 4 4 2
(2)将Fe2+氧化为Fe3+
(3)4.7
(4)NiS和ZnS
(5)F−与H+结合形成弱电解质HF,MgF Mg2++2F−平衡向右移动
2
(6)Mn2++2 HCO -==MnCO ↓+CO ↑+H O
3 3 2 2
(7)
【解析】(1)Si元素以SiO 或不溶性硅盐存在,SiO 与硫酸不反应,所以滤渣I中除了S还有SiO;在硫
2 2 2
酸的溶浸过程中,二氧化锰和硫化锰发生了氧化还原反应,二氧化锰作氧化剂,硫化锰作还原剂,方程式
为:MnO +MnS+2H SO ==2MnSO +S+2H O。
2 2 4 4 2
(2)二氧化锰作为氧化剂,使得MnS反应完全,且将溶液中Fe2+氧化为Fe3+。
(3)由表中数据知pH在4.7时,Fe3+和Al3+沉淀完全,所以应该控制pH在4.7~6之间。
(4)根据题干信息,加入NaS除杂为了除去锌离子和镍离子,所以滤渣3是生成的沉淀ZnS和NiS。
2
(5)由HF H++F-知,酸度过大,F-浓度减低,使得MgF Mg2++2F-平衡向沉淀溶解方向移动,
2
Mg2+沉淀不完全。
(6)根据题干信息沉锰的过程是生成了MnCO 沉淀,所以反应离子方程式为:Mn2++2HCO-
3 3
==MnCO ↓+CO ↑+H O。
3 2 2
(7)根据化合物中各元素化合价代数和为0的规律得:1+2x+3y+4z=6,已知,x=y=1/3,带入计算得:
z=1/3。