文档内容
{#{QQABTQaUggCgAJIAABgCQQVCCkEQkAGCACoOQAAIsAABSRNABAA=}#}{#{QQABTQaUggCgAJIAABgCQQVCCkEQkAGCACoOQAAIsAABSRNABAA=}#}{#{QQABTQaUggCgAJIAABgCQQVCCkEQkAGCACoOQAAIsAABSRNABAA=}#}{#{QQABTQaUggCgAJIAABgCQQVCCkEQkAGCACoOQAAIsAABSRNABAA=}#}{#{QQABTQaUggCgAJIAABgCQQVCCkEQkAGCACoOQAAIsAABSRNABAA=}#}{#{QQABTQaUggCgAJIAABgCQQVCCkEQkAGCACoOQAAIsAABSRNABAA=}#}{#{QQABTQaUggCgAJIAABgCQQVCCkEQkAGCACoOQAAIsAABSRNABAA=}#}{#{QQABTQaUggCgAJIAABgCQQVCCkEQkAGCACoOQAAIsAABSRNABAA=}#}雅礼中学 2024 届高三综合自主测试(4 月)
化学参考答案
一、选择题(本题共14小题,每小题3分,共42分)
1、A【解析】A.SO 具有强还原性,具防腐和抗氧化等作用,可作为食品添加剂,SO 在保
2 2
鲜时体现了还原性,故A不正确;B.环状聚烯烃是高分子,是混合物,故B正确;C.电子
芯片的材料主要是Si,射频芯片也是电子芯片,故C正确;D.不锈钢是铁合金,铁合金与
铝合金均属于金属材料,故D正确;答案选A。
2、B【解析】A.pH=2的硫酸溶液中,未告知溶液的体积,无法计算溶液中氢离子数,故A
不正确;B.在常温常压下,V>22.4L/mol,11.2LCO 物质的量小于0.5mol,则含含氧原子数
m 2
目小于N,故B正确;C.21gCH 分子的物质的量为0.5mol,但CH 有两种结构:丙烯(CHCH=CH)
A 3 6 3 6 3 2
和环丙烷(△),前者含有8个σ键,后者含有9个σ键,则0.5molCH 分子中含极性键数
3 6
目不一定是4N,故C不正确;D.在反应KClO 6HClKCl3Cl 3HO中,KClO 中Cl的
A 3 2 2 3
化合价降低了5价,转移了5个电子,故每生成3mol Cl ,转移的电子数为5N ,故D不正
2 A
确;答案选B。
3、C【解析】A.使用ClO 进行饮用水处理(即杀菌消毒),是利用其氧化性,A项错误;B.含
2
硫化合物中硫元素的化合价一般为低价硫,硫酸盐中硫元素的化合价为+6,该转化过程涉及
氧化还原反应,B项错误;C.铝硅酸盐分子筛中有许多笼状空穴和通道,具有强吸附性,
对酒精进行吸附脱水处理制备无水乙醇是物理变化,未涉及氧化还原反应,C项正确;D.苹
果和土豆切开一段时间后表面发生褐变的原因是二者均被氧气氧化,该过程涉及氧化还原反
应,D项错误;故正确答案选C。
4、C【解析】A.a为泥三角、f为坩埚,泥三角和坩埚均可用于灼烧,而不是蒸发结晶,故
A错误;B.c为量筒无“0”刻度,d为碱式滴定管其零刻度在上端,故B错误;C.b、e、
g分别为蒸馏烧瓶、直形冷凝管和球形分液漏斗,常用于物质的分离,故C正确;D.d、f、
g分别为碱式滴定管、坩埚和球形分液漏斗,其中只有坩埚在使用前不需捡漏外其余在使用
前均要捡漏,故D错误;答案选C。
5、D【解析】A.ClO会氧化S2:ClOS2H OClS2OH ,A错误;B.Al3会
2
c(H+)
与HCO发生双水解:Al3 3HCO Al(OH) 3CO ,B错误;C. =1010即
3 3 3 2 c(OH-)
pH12;NHOH NH H O,C错误;D.“酚酞变红色”是碱性溶液,此时NO不
4 3 2 3
能氧化SO2,D中的离子能共存,故D正确;故选:D。
3
6、C【解析】A.由电离常数可知酸性HCO>HCN>HCO,则反应的离子方程式为CN﹣
2 3 3
化学(YL)答案 (第 1 页,共 7 页)
{#{QQABTQaUggCgAJIAABgCQQVCCkEQkAGCACoOQAAIsAABSRNABAA=}#}+HO+CO=HCN+HCO,故A错误;B.将少量SO 通入Ca(ClO) 溶液中,二者发生氧化还原
2 2 3 2 2
反应,正确的离子方程式为:Ca2++3ClO﹣+HO+SO═CaSO↓+2HClO+Cl﹣,故B错误;C.Fe(OH)
2 2 4
溶于HI,后生成的Fe3+能将I﹣氧化为I,自身被还原为Fe2+,离子方程式为2Fe(OH)+6H++2I
3 2 3
﹣=2Fe2++I+6HO,故C正确;D.Ba(OH)溶液中加入少量NaHCO 溶液,HCO完全转化成BaCO
2 2 2 3 3 3
沉淀,正确的离子方程式为:HCO+Ba2++OH﹣=BaCO↓+HO,故D错误;故选C。
3 3 2
7、D【解析】反应①是1,3-丁二烯与乙烯发生1,4-加成的成环反应,环己烯与H 发生加
2
成反应可以生成船式环己烷,也可以生成椅式环己烷,都是放热反应。A.1,3-丁二烯结构
中含有2个碳碳双键,分子式为C H ,而乙烯结构中只含有1个碳碳双键,分子式为C H ,
4 6 2 4
不符合同系物结构相似、组成相差若干个“CH ”原子团,A错误;B.环己烯与Br 发生加
2 2
成反应生成的1,2-二溴环己烷能溶于环己烷中,B错误;C.反应①是1,3-丁二烯与乙烯
发生1,4-加成的成环反应, 与乙烯发生反应生成 ,C错误;D.环己烯与H
2
发生加成反应生成船式环己烷或生成椅式环己烷都是放热反应,根据ΔH ΔH 可知,生成
1 2
船式环己烷放出的热量小于生成椅式环己烷放出的热量,说明椅式环己烷能量更低,更稳定,
D正确;答案选D。
8、B【解析】A.OF 中心原子(氧原子)的杂化方式为sp3,则OF 的VSEPR模型为四面体
2 2
形,A正确;B.F的电负性大于N,N−F中成键电子对偏向F,导致NF中的N原子核对孤
3
电子对的吸引力增强,难以形成配位键,则NF不易与Cu2形成配离子,B错误;C.NaF中
3
的Na、F的电荷数与 中的阳、阴离子的电荷数相同,但Na、F的半
径小,NaF的离子键更强,熔、沸点更高,则x<993、y<1695;OF 和NF均为分子晶体,NF
2 3 3
的相对分子质量大于OF 的相对分子质量,相对分子质量越大,物质的熔、沸点就越高,则
2
m> −223.8、n> −144.8,C正确;D. 与BF的相互作用为离子键,
4
中存在极性键和非极性键,BF中存在极性键,则 中
4
化学(YL)答案 (第 2 页,共 7 页)
{#{QQABTQaUggCgAJIAABgCQQVCCkEQkAGCACoOQAAIsAABSRNABAA=}#}存在离子键、极性键和非极性键,D正确;故选B。
9、B【解析】A.亚硫酸钠和氯化钡也会生成白色沉淀,不能检验NaSO 溶液是否变质,A
2 3
不符合题意;B.向5mL浓度均为0.05molL-1的NaI、NaCl混合溶液中滴加2滴
0.05molL-1AgNO 溶液,银离子不足,而先产生黄色沉淀,证明K AgIc NH+ >cNH H O>c CO2- ,故D正确;故选B。
3 4 3 2 3
1 1
14、B【解析】A.根据均摊原则,晶胞中Ca2+数为8 1 、A离子数为6 3、B离子数
8 2
为1,根据化合价代数和等于0,A是O2-、B是Ti4+,钛酸钙的化学式为CaTiO ,故A正确;
3
1 1
B.根据均摊原则,图2中,CH NH数为8 1、X离子数为1、Y离子数6 3,根据
3 3 8 2
化合价代数和等于0,Y为I、X为Pb2,故B错误;C.N原子能形成3个共价键,CH NH
3 3
中有1个N-H键为配位键,故C正确;D.根据图示,图1中与每个Ca2紧邻的O2有12个,
故D正确;选B。
二、非选择题(本题共4小题,共58分)
15、(1)向分液漏斗中加少量水,检查活塞处是否漏水,旋转1800再看活塞处是否漏水。
将漏斗倒转过来,检查玻璃塞是否漏水
(2)−1 HO+TiO2++4HO = [TiO(OH)(HO)]++H+
2 2 2 2 2 4
(3)温度为10~15℃时,钪的萃取率较高而且钛的萃取率较低
(4)Mn2H O 2OH MnO 2H O
2 2 2 2
(5)Sc O 3C3Cl 2ScCl 3CO
2 3 2 3
(6)5.0103或0.005
【解析】
(1)萃取操作使用到的仪器为分液漏斗,检漏的方法为向分液漏斗中加少量水,检查活塞
处是否漏水,旋转1800再看活塞处是否漏水。将漏斗倒转过来,检查玻璃塞是否漏水;
(2)依据[TiO(OH)(HO)]+中Ti的化合价为+4且有一个OH-,整个原子团离子带一个
2 2 4
单位正电荷,则另外两个氧原子只有是才可能满足条件,故除去OH-和HO外的其余氧元素
2
价态为―1价;该反应的离子方程式为HO+TiO2++4HO = [TiO(OH)(HO)]++H+;
2 2 2 2 2 4
(3)根据表格数据可知温度为10~15℃时,钪的萃取率较高而且钛的萃取率较低,得到的
钪纯度相对较高;
(4)碱性条件下双氧水可以氧化Mn2+生成MnO,根据电子守恒可知HO 和Mn2+的系数比为1∶
2 2 2
1,再结合元素守恒可得离子方程式为Mn2H O 2OH MnO 2H O;
2 2 2 2
(5)根据题意加热氯化可得到一种使热的氧化铜由黑变红的气体只能为CO,再综合题意并
化学(YL)答案 (第 4 页,共 7 页)
{#{QQABTQaUggCgAJIAABgCQQVCCkEQkAGCACoOQAAIsAABSRNABAA=}#}
结合元素守恒和电子守恒可知ScO 制备ScCl 反应的化学方程式为ScO 3C3Cl 2ScCl 3CO;
2 3 3 2 3 2 3
(6)若在滴定时盛装标准溶液的滴定管未润洗,则相当于将标准溶液稀释,从而导致测得
的纯度偏高;当溶液中恰好沿淀完全时,依题此时有:c(Ag+)=210-5mol/L,故有:c(CrO2)
4
2.01012
= mol/L=0.005mol/L或5.0103mol/L。
(2.0105)2
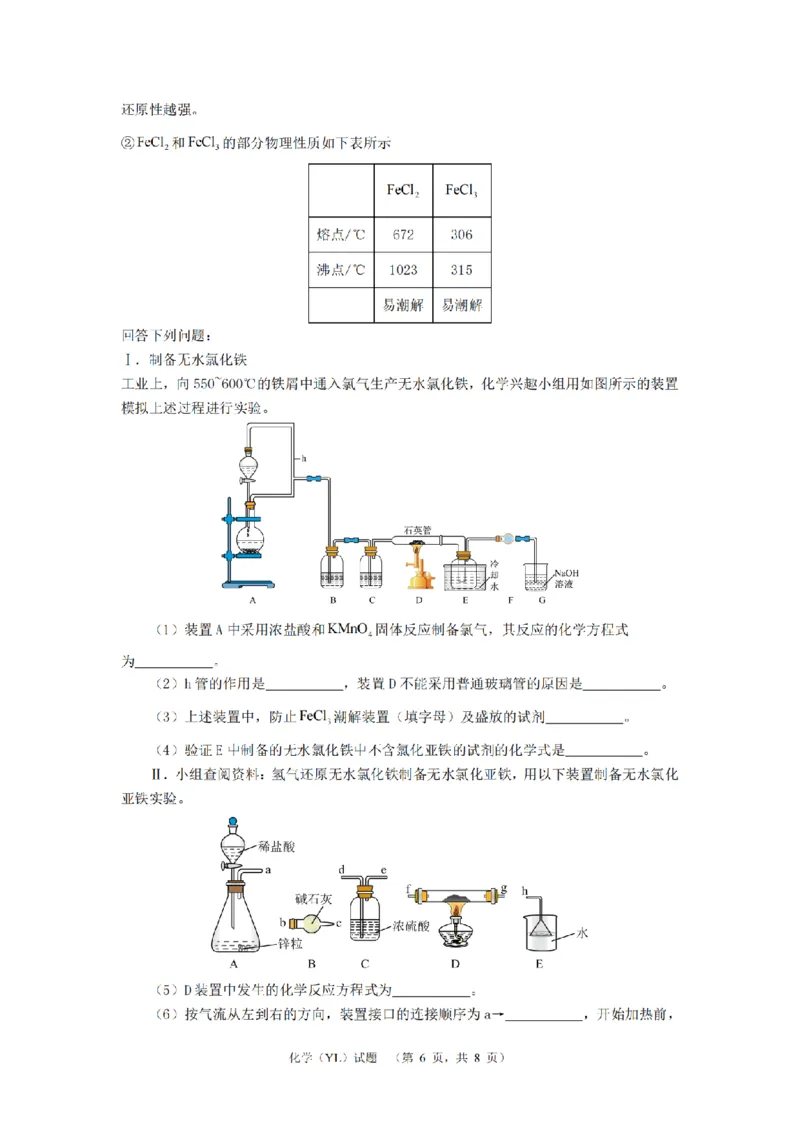
16、(1)2KMnO +16HCl(浓)=2KCl+2MnCl +5Cl +8H O
4 2 2 2
(2)平衡装置中压强,使得液体能顺利滴下(1分) 普通玻璃管不能承受较高的温度
(1分)
(3)C盛放浓硫酸干燥剂、F盛放碱石灰干燥剂
(4)K[Fe(CN)] (1分)
3 6
Δ
(5)2FeCl +H 2FeCl +2HCl
3 2 2
(6) defgbch(或degfbch) 检查气密性(1分)
(7)氯化铁可能被氢气还原为铁单质
【解析】
(1)高锰酸钾和浓盐酸常温反应生成氯化钾、氯化锰、氯气和水,
2KMnO +16HCl(浓)=2KCl+2MnCl +5Cl +8H O;
4 2 2 2
(2)h管的作用是平衡装置中压强,使得液体能顺利滴下;550~600℃的铁屑中通入氯气生
产无水氯化铁,装置D不能采用普通玻璃管的原因是铁屑和氯气反应需要温度要求较高,普
通玻璃管不能承受较高的温度;
(3)FeCl 易潮解,则生成氯化铁的装置D前后均需要干燥装置,故C盛放浓硫酸干燥剂、
3
F盛放碱石灰干燥剂;
(4)亚铁离子会和K[Fe(CN)]溶液会生成蓝色沉淀;故检验亚铁离子的试剂为K[Fe(CN)
3 6 3
;
6
(5)氢气还原无水氯化铁制备无水氯化亚铁,则D装置中发生的化学反应方程式为
Δ
2FeCl +H 2FeCl +2HCl;
3 2 2
(6)由分析可知,按气流从左到右的方向,装置接口的连接顺序为a→defgbch,实验中涉
及气体的发生和反应,故开始加热前,应先检查装置的气密性;
(7)无水氯化铁的转化率并未降低,但无水氯化亚铁的产率会明显降低,则说明氯化铁参
与了反应但是并未生成氯化亚铁,则氯化铁可能被氢气还原为铁单质,导致氯化亚铁产率降
低。
17、(1)634.3kJmol1(2分)
(2)ACD(2分)
(3)0.1molL1min1(2分) 66.7%(2分) 1.67(2分)
(4)使用更高效的催化剂或增大催化剂的比表面积(2分)
(5)Fe(2分) 3d6(1分)
【解析】
(1)根据盖斯定律反应Ⅲ×2-反应Ⅰ=Ⅳ,则ΔH=2×ΔH-ΔH=(-395.6×2+156.9)
4 3 1
化学(YL)答案 (第 5 页,共 7 页)
{#{QQABTQaUggCgAJIAABgCQQVCCkEQkAGCACoOQAAIsAABSRNABAA=}#}kJ/mol=-634.3kJ/mol,故答案为:-634.3kJ/mol;
(2)CO 加氢合成甲烷时,也有副产物发生,主反应是放热反应,副反应是吸热反应,通常
2
控制温度为500℃左右,此时催化剂的活性高,反应速率快,由于有副反应发生,因此应是
主反应催化剂选择性好,而温度高,对副反应平衡正向移动,对主反应平衡逆向移动,故答
案为:ACD;
(3)500℃时,向1L恒容密闭容器中充入4molCO 和12molH,初始压强为p,20min时主、
2 2
3
副反应都达到平衡状态,测得 c(HO)=5mol⋅ L-1,体系压强为 p,建立三段式:
2
4
CO(g) +4H(g) CH(g)+2H O(g )
2 2 4 2
起始量(mol) 4 12 0 0
,
转化量(mol) x 4x x 2x
平衡量(mol) 4-x 12-4x x 2x
CO(g) +H(g) CO(g)+H O(g)
2 2 2
起始量(mol) 4-x 12-4x 0 2x
,则有2x+y=5,根据物质的量之比等于压强
转化量(mol) y y y y
平衡量(mol) 4-x-y 12-4x-y y 2x+y
3
16-2x p c 2mol
之比得到 = 4 ,解得x=2,y=1,则0~20min内 (CH)= = =0.1mol/
16 4 t 1L×20min
p
2
(L•min),平衡时CH 选择性 ×100%≈66.7%,c(CO)=1mol⋅ L-1,c(H)=3mol⋅ L-1,
4 12 2 2
c(CO)=1mol⋅ L-1,c(HO)=5mol⋅ L-1 副反应Kc=[c(CO)c(HO)]/[c(CO)c(H)]=
2 2 2 2
(1×5)/(1×3)=1.67,故答案为:0.1mol/(L•min);66.7%;1.67;
(4)当改变外界条件时,实验数据5如图中的曲线b所示,斜率降低,说明活化能降低,
则实验可能改变的外界条件是使用更高效的催化剂或增大催化剂的比表面积,故答案为:使
用更高效的催化剂或增大催化剂的比表面积;
1 1
(5)由图可知,黑球代表M(NH),位于顶点和面心,个数为8× +6× =4,白球代表
3 6 8 2
BH,位于体内,个数为8,则黑球:白球=4:8=1:2,则化学式为M(NH)(BH),摩尔
4 3 6 4 2
质量为188g•mol-1,则M的摩尔质量为(188-17×6-15×2)g•mol-1=56g•mol-1,则M元素为
Fe;M(NH)(BH) 中,NH 为分子,不带电荷,BH- 带1个单位负电荷,则Fe为+2价,
3 6 4 2 3 4
其价电子排布式为3d6,故答案为:Fe;3d6。
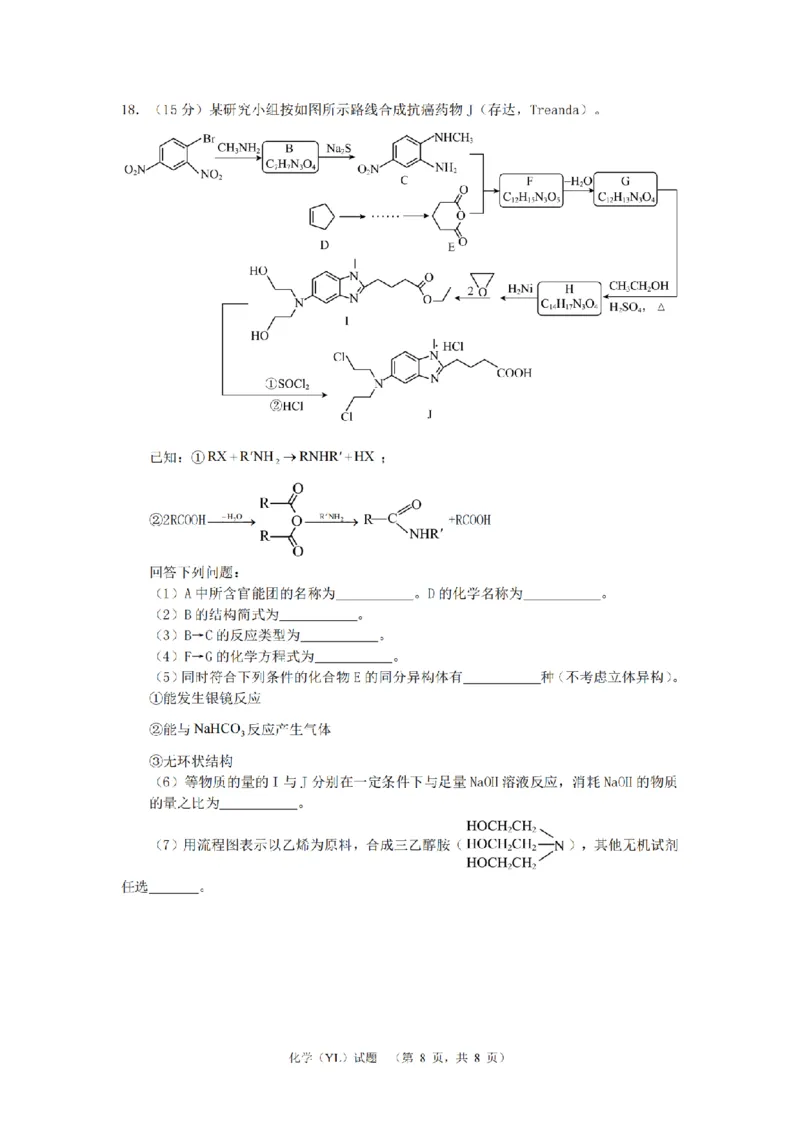
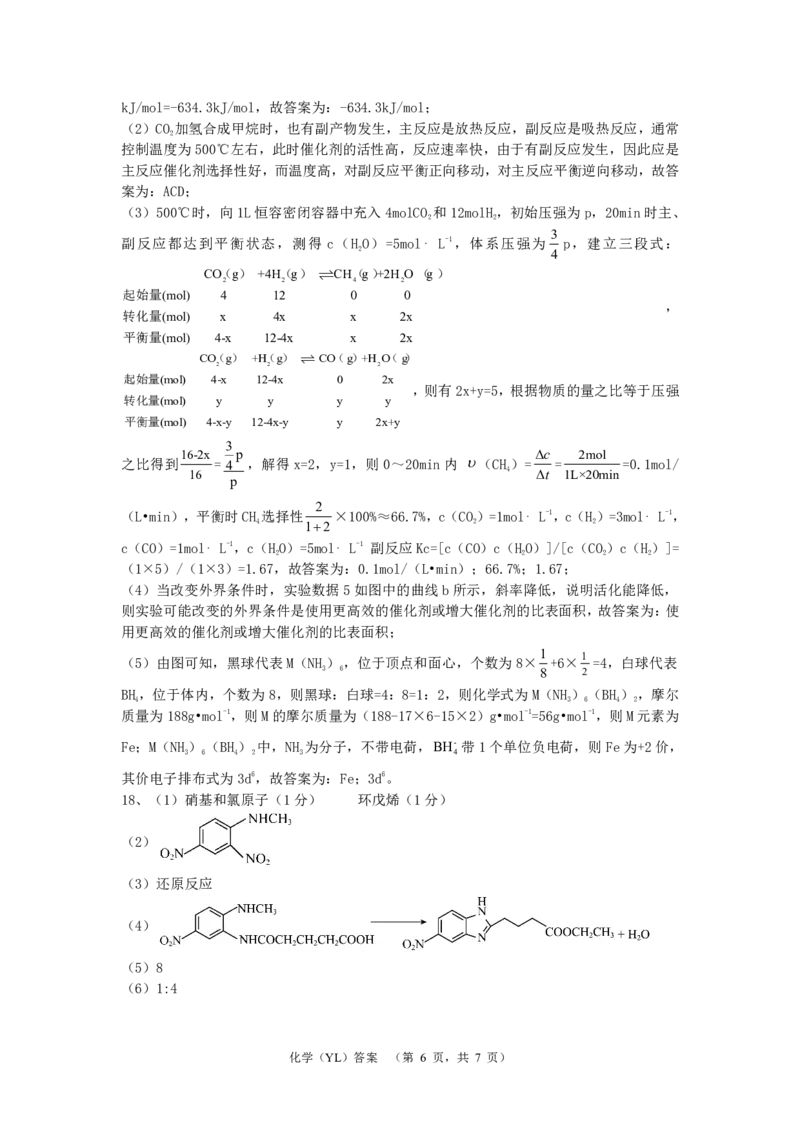
18、(1)硝基和氯原子(1分) 环戊烯(1分)
(2)
(3)还原反应
(4)
(5)8
(6)1:4
化学(YL)答案 (第 6 页,共 7 页)
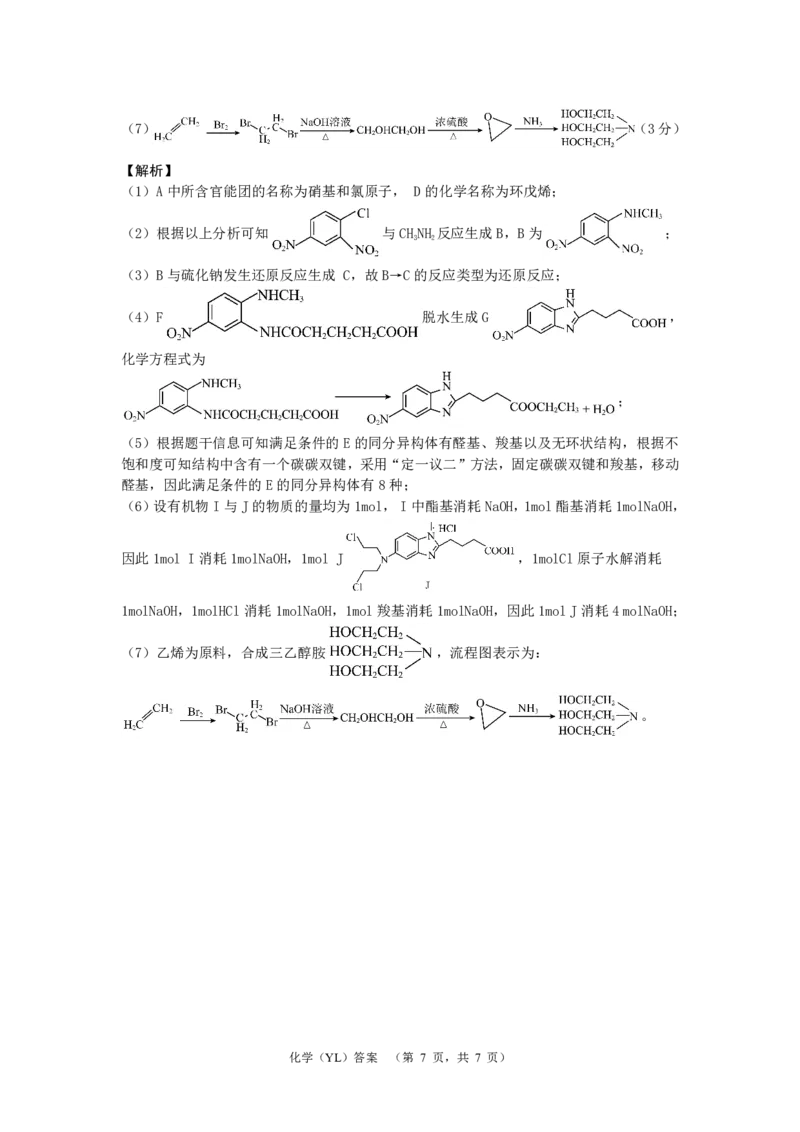
{#{QQABTQaUggCgAJIAABgCQQVCCkEQkAGCACoOQAAIsAABSRNABAA=}#}(7) (3分)
【解析】
(1)A中所含官能团的名称为硝基和氯原子, D的化学名称为环戊烯;
(2)根据以上分析可知 与CHNH 反应生成B,B为 ;
3 2
(3)B与硫化钠发生还原反应生成 C,故B→C的反应类型为还原反应;
(4)F 脱水生成G ,
化学方程式为
;
(5)根据题干信息可知满足条件的E的同分异构体有醛基、羧基以及无环状结构,根据不
饱和度可知结构中含有一个碳碳双键,采用“定一议二”方法,固定碳碳双键和羧基,移动
醛基,因此满足条件的E的同分异构体有8种;
(6)设有机物I与J的物质的量均为1mol,I中酯基消耗NaOH,1mol酯基消耗1molNaOH,
因此1mol I消耗1molNaOH,1mol J ,1molCl原子水解消耗
1molNaOH,1molHCl消耗1molNaOH,1mol羧基消耗1molNaOH,因此1molJ消耗4molNaOH;
(7)乙烯为原料,合成三乙醇胺 ,流程图表示为:
。
化学(YL)答案 (第 7 页,共 7 页)
{#{QQABTQaUggCgAJIAABgCQQVCCkEQkAGCACoOQAAIsAABSRNABAA=}#}