文档内容
福建省漳州市 2024 届高三毕业班第四次教学质量检测
化学试题
本试题卷共6页,14题。全卷满分100分。考试用时75分钟。
可能用到的相对原子质量:H1 C12 O16 S32 Fe56 Cu64 Zn65 Zr91
Sn119
一、选择题:本题共10小题,每小题4分,共40分。在每小题给出的四个选项中,只有一
个选项是符合题目要求的。
1.传统米酒酿造工艺是在小麦、高粱中加入酒曲进行发酵。下列说法错误的是( )
A.小麦、高粱含有的淀粉属于天然有机高分子
B.酿造过程中只发生水解反应
C.通过蒸馏法可以提高米酒的酒精度
D.酒曲起到催化剂的作用
2. 咖啡酰奎尼酸( )是金银花中抗菌、抗病毒的有效成分之一,其分子结构如图。下列关于
M说法正确的是( )
A. 最多能与 反应
B.能发生加聚反应,不能发生缩聚反应
C.能与 反应生成
D.所有碳原子不可能共平面
3.用 与 制备纳米零价铁的反应为
。设 为阿伏伽德罗常数的值,下列
说法正确的是( )
A. 溶液中 数为
B. 固体中 键数为
C.每生成 ,转移的电子数为
学科网(北京)股份有限公司D. 中采取 杂化的原子数为
4.下列离子方程式书写错误的是( )
A.向银氨溶液中滴入乙醛:
B.向硫代硫酸钠溶液中加入稀硫酸:
C.向漂白粉溶液中通入少量 :
D.向加有 的 溶液中通入 :
5.化合物 是一种常见补血剂。已知短周期主族元素X、Y、Z、W的原子序数
依次增大,X原子半径最小,Z与Y、W相邻,基态Z原子的s能级与p能级电子数相同,R位于第四周期
且基态原子有4个未成对电子。下列说法错误的是( )
A.第一电离能:
B.简单氢化物的沸点:
C.该化合物可溶于水,难溶于
D.最高价含氧酸根的键角:
6.连二亚硫酸钠 俗称保险粉,是印染工业中常用的漂白剂。实验室制备流程如下:
下列说法错误的是( )
A.将锌粉溶于水形成悬浊液可以提高反应速率
B.生成 的反应中氧化剂和还原剂物质的量之比为
C.温度超过 会导致 溶解度降低
学科网(北京)股份有限公司D.加入 有利于 析出,提高产率
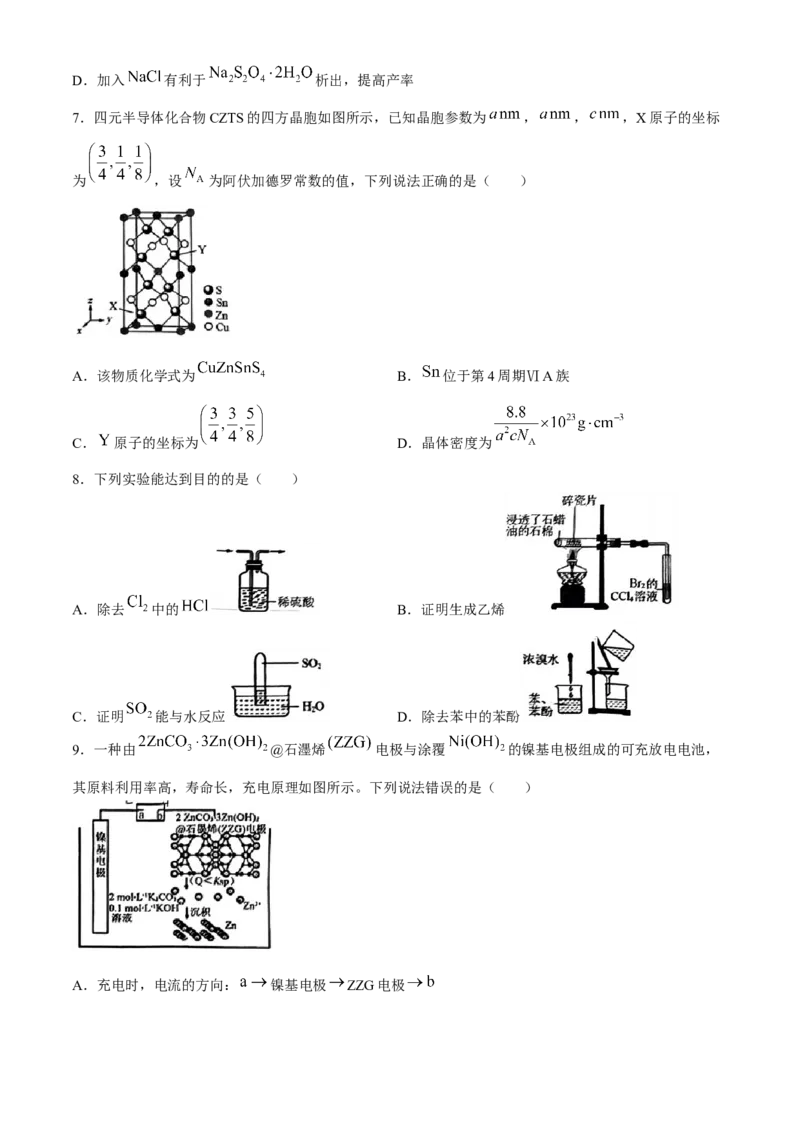
7.四元半导体化合物CZTS的四方晶胞如图所示,已知晶胞参数为 , , ,X原子的坐标
为 ,设 为阿伏加德罗常数的值,下列说法正确的是( )
A.该物质化学式为 B. 位于第4周期ⅥA族
C. 原子的坐标为 D.晶体密度为
8.下列实验能达到目的的是( )
A.除去 中的 B.证明生成乙烯
C.证明 能与水反应 D.除去苯中的苯酚
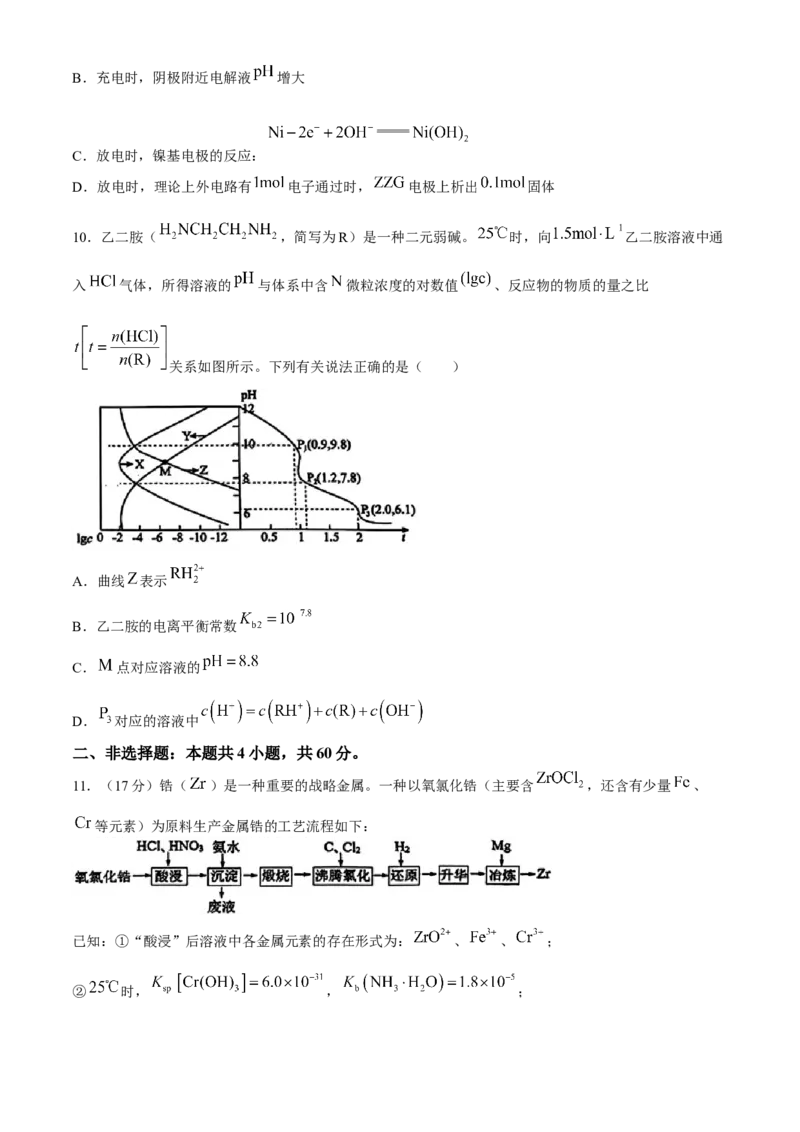
9.一种由 @石濹烯 电极与涂覆 的镍基电极组成的可充放电电池,
其原料利用率高,寿命长,充电原理如图所示。下列说法错误的是( )
A.充电时,电流的方向: 镍基电极 ZZG电极
学科网(北京)股份有限公司B.充电时,阴极附近电解液 增大
C.放电时,镍基电极的反应:
D.放电时,理论上外电路有 电子通过时, 电极上析出 固体
10.乙二胺( ,简写为R)是一种二元弱碱。 时,向 乙二胺溶液中通
入 气体,所得溶液的 与体系中含 微粒浓度的对数值 、反应物的物质的量之比
关系如图所示。下列有关说法正确的是( )
A.曲线 表示
B.乙二胺的电离平衡常数
C. 点对应溶液的
D. 对应的溶液中
二、非选择题:本题共4小题,共60分。
11.(17分)锆( )是一种重要的战略金属。一种以氧氯化锆(主要含 ,还含有少量 、
等元素)为原料生产金属锆的工艺流程如下:
已知:①“酸浸”后溶液中各金属元素的存在形式为: 、 、 ;
② 时, , ;
学科网(北京)股份有限公司③“还原”前后相关物质沸点如下:
物质
沸点 331 315 1300 700 1150
回答下列问题:
(1) 是 的同族相邻元素,基态 原子的价电子排布式是_______。
(2) 通常采用“一酸一碱”法生产,主要生产过程为:将锆英砂与氢氧化钠混合熔融得到难溶于
水的 ,再以盐酸酸化得到 ,写出酸化过程的离子方程式
(3)“沉淀”后,废液中 ,则废液中 为_______ 。
(4)“沸腾氯化”时, 转化为 ,同时生成一种还原性气体,该反应的化学方程式为
______________。
(5)①气态 通常以二聚体 的形式存在,分子结构为 ,二聚体中 的杂化
轨道类型为_______。 易溶于水,也易溶于乙醚等有机溶剂,请判断其晶体类型为_______。
②“还原”的主要目的是_______。
(6)下列金属冶炼方法与本工艺流程中加入 冶炼 的方法相似的是_______
A.高炉炼铁 B.电解熔融氯化钠制钠
C.铝热反应制锰 D.氧化汞分解制汞
(7)实验室可以用络合滴定法快速测定“酸浸”溶液中锆的含量,步骤如下:
①在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于
管口,_______,继续摇动锥形瓶,观察溶液颜色变化。
②已知 与EDTA发生 络合反应,则酸浸液中含量(以 计)为_______ 。
12.(16分)硫脲[ ]可用于制造药物,是一种白色晶体,熔点 ,易溶于水,受热时部分
发生反应而生成 。某化学小组在实验室制备硫脲并对其性质进行探究,回答下列问题:
Ⅰ.制备硫脲
将石灰氮( )溶液加热至 ,通入 气体反应可生成 溶液和石灰乳。
学科网(北京)股份有限公司A B C D
(1)装置A中发生反应的离子方程式为_______。
(2)实验前检查装置气密性的步骤为:①_______,在装置D中加水至浸没导管末端;②微热装置A,当
观察到装置D处_______说明装置气密性良好。
(3)仪器M的名称为_______,装置C的作用为_______。
(4)M中生成 的化学方程式为______________。
(5)反应后,过滤M中的混合物,将滤液_______,过滤,干燥即可得到产品。
Ⅱ.探究硫搌的性质
(6)① 结构式为_______,其中S元素的化合价为_______。
②推测 具有_______(填“氧化性”或“还原性”)。选择合适试剂设计实验证明:_______
(可供选择的试剂:酸性 溶液、淀粉 溶液、稀盐酸、 溶液)。
13.(13分)利用 脱除烟气中的 具有重要意义。已知在 还原 过程中,会发生如下反应:
反应i
反应ii
反应iii
回答下列问题:
(1)已知 , 和 的燃烧热分别为 、
,则反应i的 为_______ 。
(2)下列有利于提高反应i中 的平衡转化率的是_______。
学科网(北京)股份有限公司a.恒容时增大 浓度 b.降低温度
c.选择合适的催化剂 d.减小容器的容积
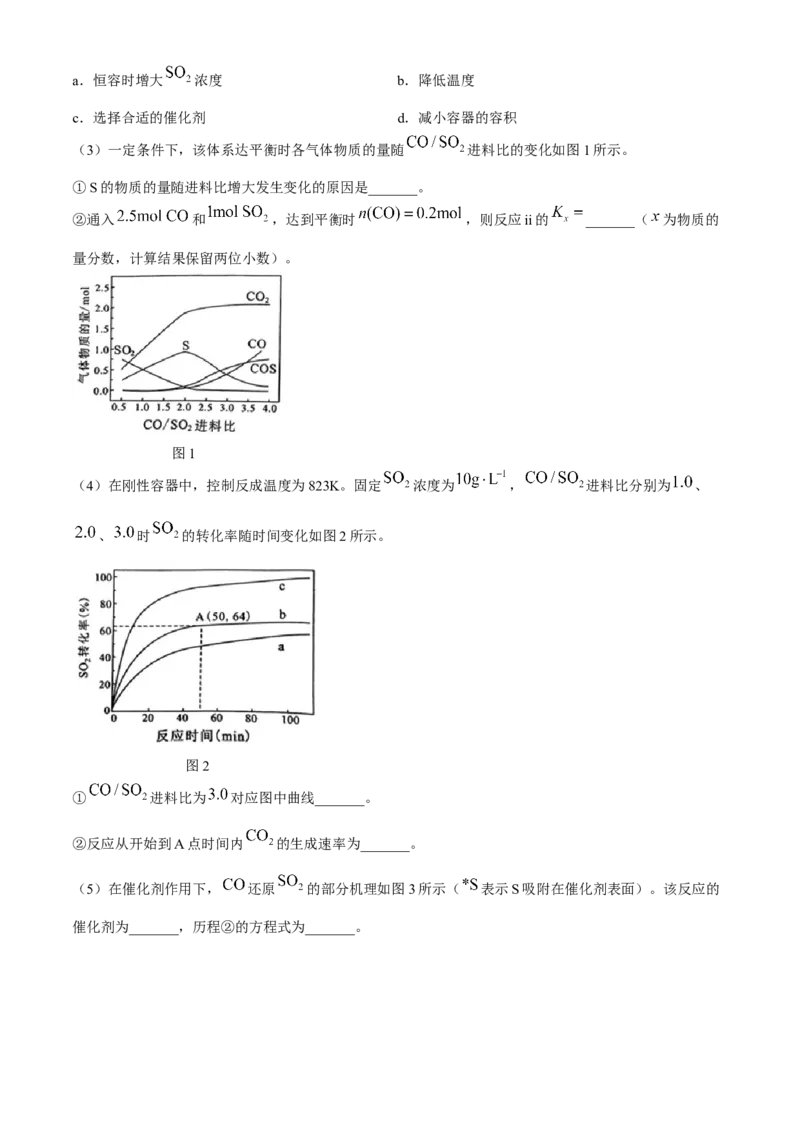
(3)一定条件下,该体系达平衡时各气体物质的量随 进料比的变化如图1所示。
①S的物质的量随进料比增大发生变化的原因是_______。
②通入 和 ,达到平衡时 ,则反应ii的 _______( 为物质的
量分数,计算结果保留两位小数)。
图1
(4)在刚性容器中,控制反成温度为823K。固定 浓度为 , 进料比分别为 、
、 时 的转化率随时间变化如图2所示。
图2
① 进料比为 对应图中曲线_______。
②反应从开始到A点时间内 的生成速率为_______。
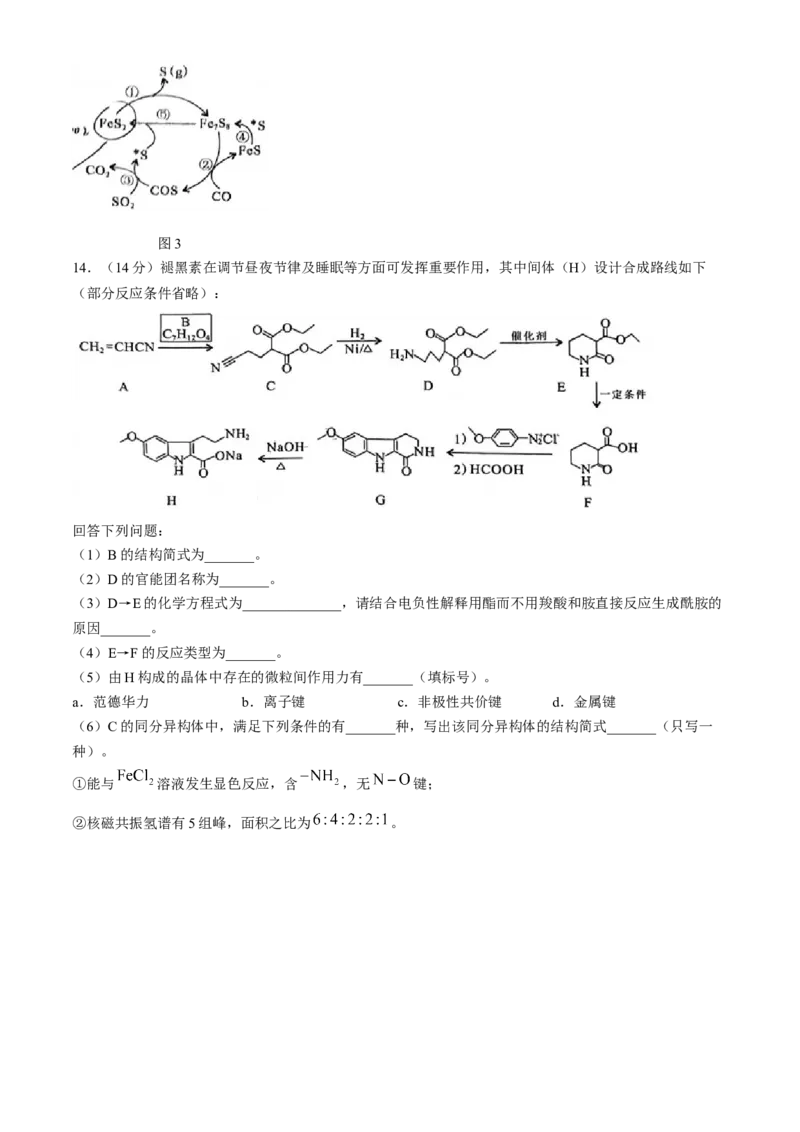
(5)在催化剂作用下, 还原 的部分机理如图3所示( 表示S吸附在催化剂表面)。该反应的
催化剂为_______,历程②的方程式为_______。
学科网(北京)股份有限公司图3
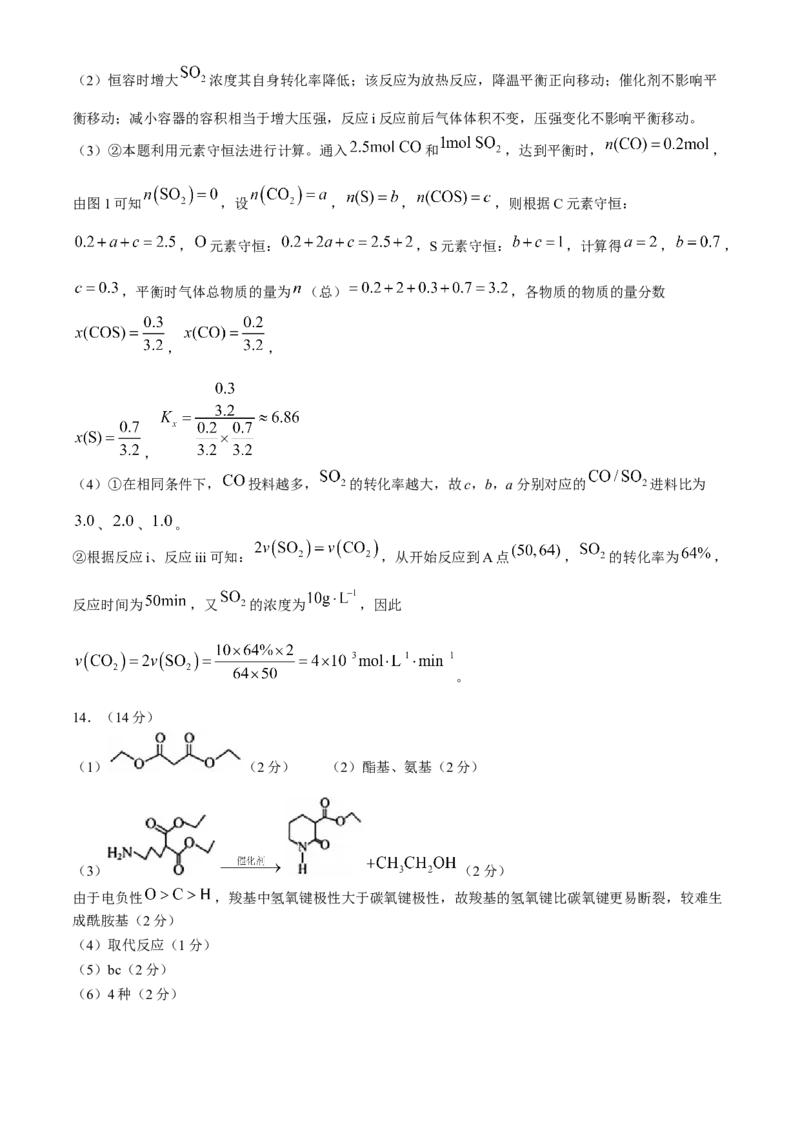
14.(14分)褪黑素在调节昼夜节律及睡眠等方面可发挥重要作用,其中间体(H)设计合成路线如下
(部分反应条件省略):
回答下列问题:
(1)B的结构简式为_______。
(2)D的官能团名称为_______。
(3)D→E的化学方程式为______________,请结合电负性解释用酯而不用羧酸和胺直接反应生成酰胺的
原因_______。
(4)E→F的反应类型为_______。
(5)由H构成的晶体中存在的微粒间作用力有_______(填标号)。
a.范德华力 b.离子键 c.非极性共价键 d.金属键
(6)C的同分异构体中,满足下列条件的有_______种,写出该同分异构体的结构简式_______(只写一
种)。
①能与 溶液发生显色反应,含 ,无 键;
②核磁共振氢谱有5组峰,面积之比为 。
学科网(北京)股份有限公司福建省漳州市 2024 届高三毕业班第四次教学质量检测
化学答案解析
1.B【解析】酿造过程中除了发生淀粉水解反应,还有葡萄糖转化为酒精。
2.D【解析】 含有 酚羟基、 酯基,最多能与 反应; 因含多个羟基能
发生缩聚;酚羟基不能与 反应;六个碳原子以单键形成的环状结构所有碳原子不可能共面。
3.B【解析】 会发生水解: 中 与 为离子键,而1个 中有4个 键;生成
转移电子数为 ; 分子中, 原子采取 杂化, 原子采取 杂化。
4.A【解析】 在水中能完全电离成 和 。
5.D【解析】由题目信息可以判断出X、Y、Z、W、R分别为H、N、O、S、Fe元素,N和S元素最高价
含氧酸根分别为 和 , 中 为 杂化,键角 , 中S为 杂化,键角 ;
该化合物为离子化合物,根据相似相溶原理判断其难溶于 。
6.B【解析】锌粉溶于水形成悬浊液可增大反应接触面积从而提高反应速率;生成 的反应为
,氯化剂和还原剂物质的量之比为 ;温度过高会降低气体溶解度;根据同离
子效应加入 可降低 溶解度,提高产率。
7.D【解析】根据均摊法计算,晶胞中含4个 ,2个 ,2个 ,8个 ,化学式为 ;
位于第5周期ⅥA族;Y原子的坐标为 ;晶体密度为
。
8.A【解析】石蜡油受热分解生成的烯烃不一定是乙烯;充满 的试管倒扣到水槽中液面上升可能是
溶于水也可能是 与水反应;浓溴水与苯酚生成的三溴苯酚可溶于苯。
学科网(北京)股份有限公司9.C【解析】根据题意,充电过程 电极有 沉积,电极反应为
判断该电极为阴极,因为有 、 生成阴
极附近溶液 增大;放电时镍基电极为原电池正极,电极反应式为 ;
放电时 电极反应为 ,故理论上转移 电
子生成 固体。
10.C【解析】乙二胺为二元弱碱,电离方程式为 ,
。随 气体通入, 不断减小, 先增大后减小, 不
断增大,故曲线 代表 , 代表 , 代表 。对于乙二胺,
, ,图中 与 的交点 ,
,则 , 与 的交点 , ,则
;图中 点是 与 的交点, ,因
,
, ,
,故 点 ; 所示溶液 ,溶质为 ,对应质子
守恒为 。
11.(17分)
(1) (1分)
学科网(北京)股份有限公司(2) (2分)
(3) (2分)
(4) (2分)
(5)① 杂化(1分) 分子晶体(1分)
②将 转化为 ,防止 升华影响产品纯度(2分)
(6)AC(2分)
(7)①用锥形瓶内壁将半滴溶液沾落,再用洗瓶以少量蒸馏水冲洗锥形瓶内壁(2分)
② (2分)
【解析】
(2) 难溶于水,不拆分;锆元素在酸溶液中以 形式存在。
(3)根据 可得 ,
。
(5) 的沸点为 , 的沸点为 ,二者沸点接近,一起升华产品纯度降低,故将
转化为沸点更高的 。
(6)该流程中金属冶炼方法为热还原法。
(7)依据 与EDTA发生 络合反应,滴定消耗 ,则 酸浸液
中 ,锆含量(以 计)
。
12.(16分)
(1) (2分)
学科网(北京)股份有限公司(2)①关闭 、 (1分) ②导管口有气泡冒出,装置冷却后导管形成一段水柱(1分)
(3)三颈烧瓶(1分)防倒吸(1分)
(4) (2分)
(5)减压蒸发浓缩,冷却结晶(2分)
(6)① (2分) (1分)
②还原性(1分)
取少量产品配成溶液,滴入酸性 溶液, 溶液褪色,说明硫脲具有还原性(2分)
【解析】
(5)硫脲受热时会部分反应生成 ,需采用减压蒸发浓缩,降低水的沸点。
(6)② 、 均为最低价,可推测 可能具有还原性。
13.(13分)
(1) (2分)
(2)b(1分)
(3)①投料比小于 时, 物质的量变化不大,几乎为0,以反应i为主;当投料比超过 时,
物质的量增大,反应ii的程度大于反应iii(2分)
② (2分)
(4)①c(1分) ② (2分)
(5) (1分) (2分)
【解析】
(1)根据燃烧热的定义可知:①
② ,③ ,
则反应 ① ② ③,即 。
学科网(北京)股份有限公司(2)恒容时增大 浓度其自身转化率降低;该反应为放热反应,降温平衡正向移动;催化剂不影响平
衡移动;减小容器的容积相当于增大压强,反应i反应前后气体体积不变,压强变化不影响平衡移动。
(3)②本题利用元素守恒法进行计算。通入 和 ,达到平衡时, ,
由图1可知 ,设 , , ,则根据C元素守恒:
, 元素守恒: ,S元素守恒: ,计算得 , ,
,平衡时气体总物质的量为 (总) ,各物质的物质的量分数
, ,
,
(4)①在相同条件下, 投料越多, 的转化率越大,故c,b,a分别对应的 进料比为
、 、 。
②根据反应i、反应iii可知: ,从开始反应到A点 , 的转化率为 ,
反应时间为 ,又 的浓度为 ,因此
。
14.(14分)
(1) (2分) (2)酯基、氨基(2分)
(3) (2分)
由于电负性 ,羧基中氢氧键极性大于碳氧键极性,故羧基的氢氧键比碳氧键更易断裂,较难生
成酰胺基(2分)
(4)取代反应(1分)
(5)bc(2分)
(6)4种(2分)
学科网(北京)股份有限公司(1分)
【解析】
(1)A和B发生加成反应生成C,根据A.C的结构简式推出B为 。
(3)D→E为D分子内氨基与酯基反应成酰胺基。
(4)E→F反应中酯基水解,为取代反应
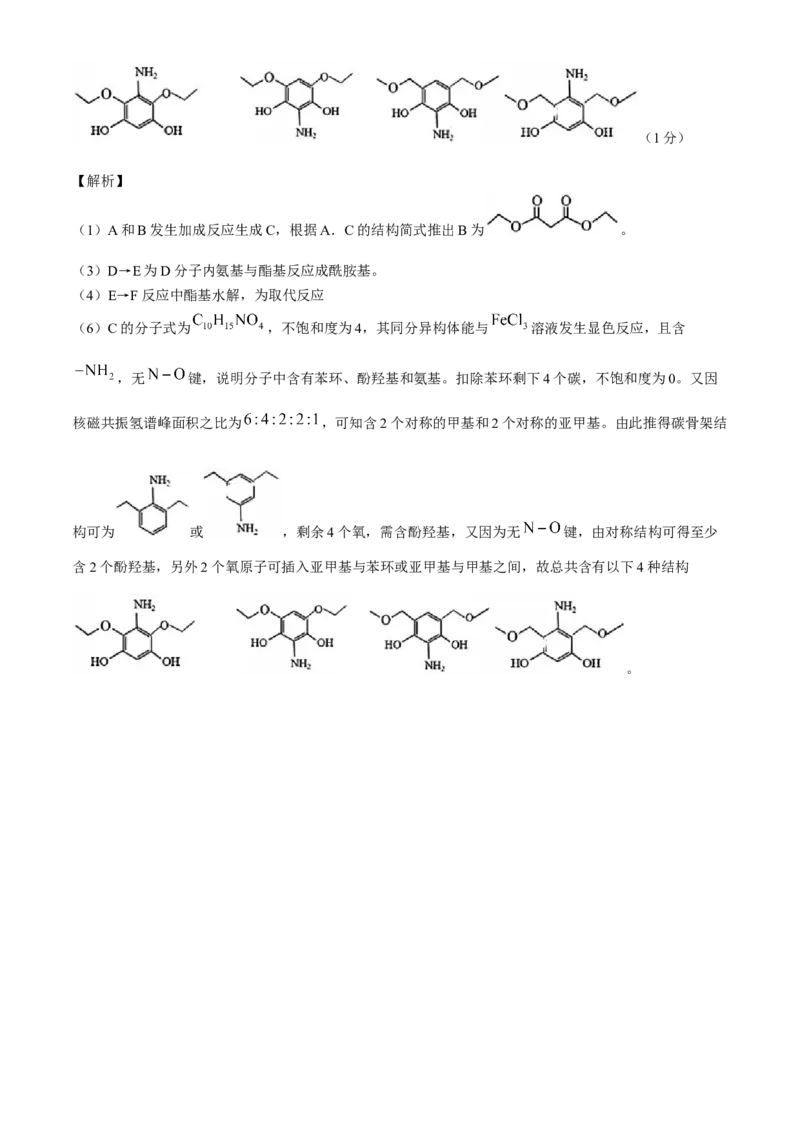
(6)C的分子式为 ,不饱和度为4,其同分异构体能与 溶液发生显色反应,且含
,无 键,说明分子中含有苯环、酚羟基和氨基。扣除苯环剩下4个碳,不饱和度为0。又因
核磁共振氢谱峰面积之比为 ,可知含2个对称的甲基和2个对称的亚甲基。由此推得碳骨架结
构可为 或 ,剩余4个氧,需含酚羟基,又因为无 键,由对称结构可得至少
含2个酚羟基,另外2个氧原子可插入亚甲基与苯环或亚甲基与甲基之间,故总共含有以下4种结构
。
学科网(北京)股份有限公司