文档内容
台州市 2023 学年第二学期高二年级期末质量评估试题
化学
选择题部分
一、选择题(本大题共16小题,每小题 3分,共 48分。每小题列出的四个备选项中只有一
个是符合题目要求的,不选、多选、错选均不得分)
1.下列物质属于强电解质的是( )
A.氨气 B.硬脂酸钠 C.醋酸 D.石灰水
2.下列关于铁及其化合物的叙述不
.
正
.
确
.
的是( )
A.红热的铁与水蒸气反应生成氢氧化铁和氢气
B.FeO在空气里受热,能迅速被氧化成Fe O
3 4
C.隔绝空气的条件下,向FeCl 溶液中加入Na O 后得到红褐色沉淀Fe OH
2 2 2 3
D.FeCl 溶液可用于有机物中酚羟基的检验
3
3.下列表述不
.
正
.
确
.
的是( )
A.富勒烯与金刚石互为同素异形体
B.乙炔中碳原子杂化轨道电子云轮廓图:
C.五氯化磷的电子式中每个原子都满足最外层8电子结构
D.CH CH CH CH CH CH CH CH CH CH 的名称:3-甲基-5-乙基庚烷
3 2 2 3 2 3 2 3
4.三氟化溴遇水立即发生反应3BrF 5H O HBrO Br 9HFO 。下列有关该反应的说法正
3 2 3 2 2
确的是( )
A.氧化剂与还原剂的物质的量之比为2:3
B.反应中每转移1mol e生成0.25mol O
2
C.反应中生成的两种酸都是强酸
D.BrF 中心原子价层电子对数为4
3
5.常温下,下列各组离子在指定条件下能大量共存的是( )
A.0.1mol/L HNO 溶液中:Na、K、SiO2、Cl
3 3
B.SO 水溶液中:Ba2、Fe3、Br、Cl
2
C.使紫色石蕊变红的溶液:K、MnO、Cl、NO
4 3
学科网(北京)股份有限公司D.使酚酞变红的溶液:Na、K、
Al OH
4
、CH
3
COO
6.实验室制取Ca IO H O( (一水合碘酸钙)的实验流程如图所示:
3 2 2
已知:常温下Ca IO H O微溶于水,难溶于乙醇。下列说法不正确的是( )
...
3 2 2
A.四氯化碳的作用增大I 的溶解度,以提高I 利用率
2 2
B.操作1的名称为分液
C.加入Ca OH 后水层中的杂质为Ca ClO
2 3 2
D.操作2可以在冷却后加入乙醇促进产品析出
7.N 为阿伏加德罗常数的值,下列说法正确的是( )
A
A.71g Na SO 和Na HPO 固体混合物中,阳离子总数大于N
2 4 2 4 A
B.足量的浓盐酸与8.7g MnO 反应,转移电子的数目为0.4N
2 A
C.50g46%的乙醇水溶液中含有的氢原子数为6N
A
D.1L pH 4的0.1molL1 K Cr O 溶液中Cr O2离子数为0.1N
2 2 7 2 7 A
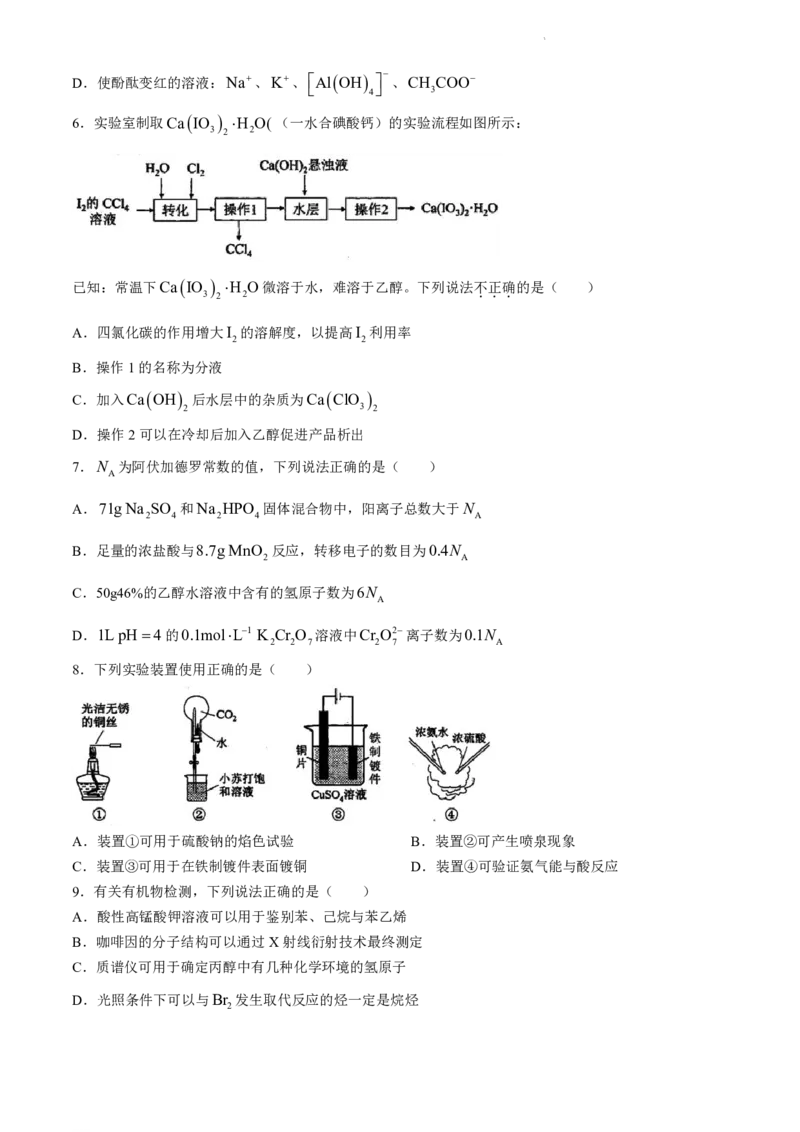
8.下列实验装置使用正确的是( )
A.装置①可用于硫酸钠的焰色试验 B.装置②可产生喷泉现象
C.装置③可用于在铁制镀件表面镀铜 D.装置④可验证氨气能与酸反应
9.有关有机物检测,下列说法正确的是( )
A.酸性高锰酸钾溶液可以用于鉴别苯、己烷与苯乙烯
B.咖啡因的分子结构可以通过X射线衍射技术最终测定
C.质谱仪可用于确定丙醇中有几种化学环境的氢原子
D.光照条件下可以与Br 发生取代反应的烃一定是烷烃
2
学科网(北京)股份有限公司10.下列方程式与所给事实相符的是( )
A.将少量SO 通入Ca ClO 溶液中:Ca2 ClO SO H O CaSO Cl 2H
2 2 2 2 4
B.银氨溶液中加入足量盐酸产生沉淀:
Ag NH
3
2
2H Cl AgCl2NH
4
C.利用MnCl 与NH HCO 制备MnCO 沉淀:Mn2 2HCO MnCO H OCO
2 4 3 3 3 3 2 2
D.加热氯化铜溶液,溶液由绿色变为黄绿色: Cu H 2 O 4 2 4Cl CuCl 4 2 4H 2 OH0
11.苯氧乙酸是制备某种香料的中间体,其制备原理如下图所示:
下列说法正确的是( )
A.环氧乙烷只能由乙烯氧化法制得
B.苯氧乙酸含有3种含氧官能团
C.苯氧乙醇的结构简式可能为
D.步骤2可以选用CuO或Ag O作为氧化剂
2
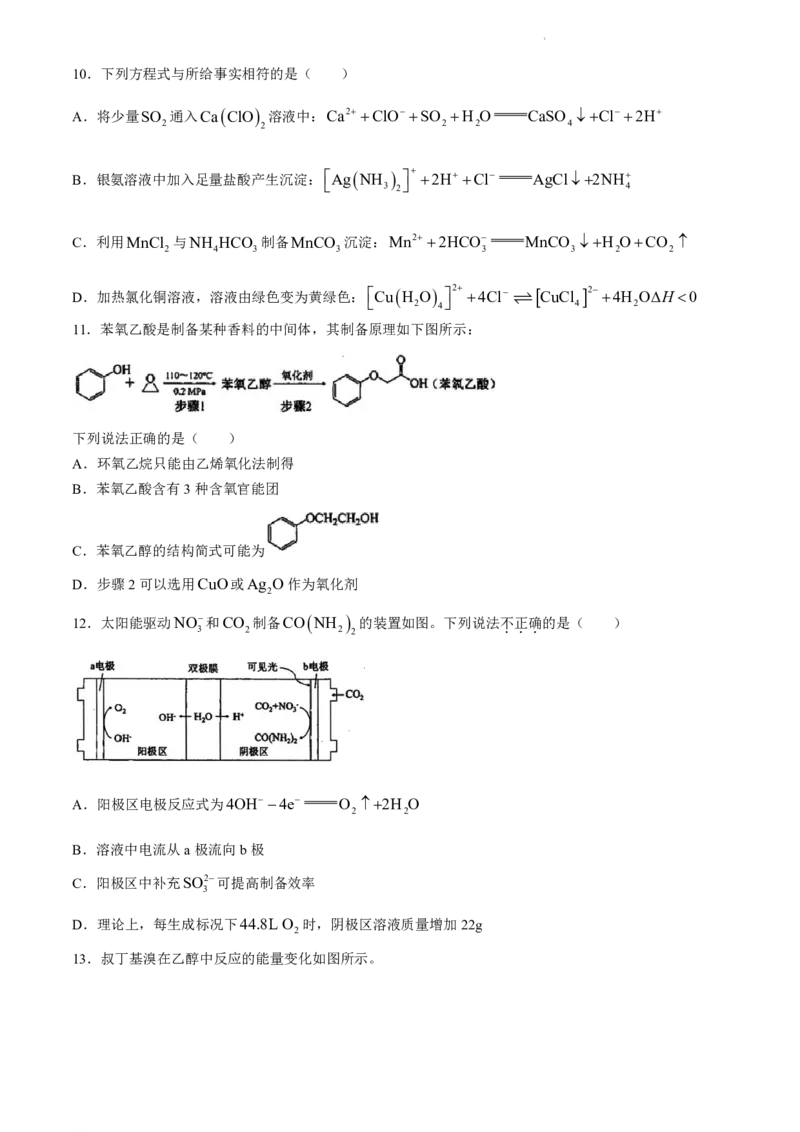
12.太阳能驱动NO和CO 制备CO NH 的装置如图。下列说法不
.
正
.
确
.
的是( )
3 2 2 2
A.阳极区电极反应式为4OH 4e O 2H O
2 2
B.溶液中电流从a极流向b极
C.阳极区中补充SO2可提高制备效率
3
D.理论上,每生成标况下44.8L O 时,阴极区溶液质量增加22g
2
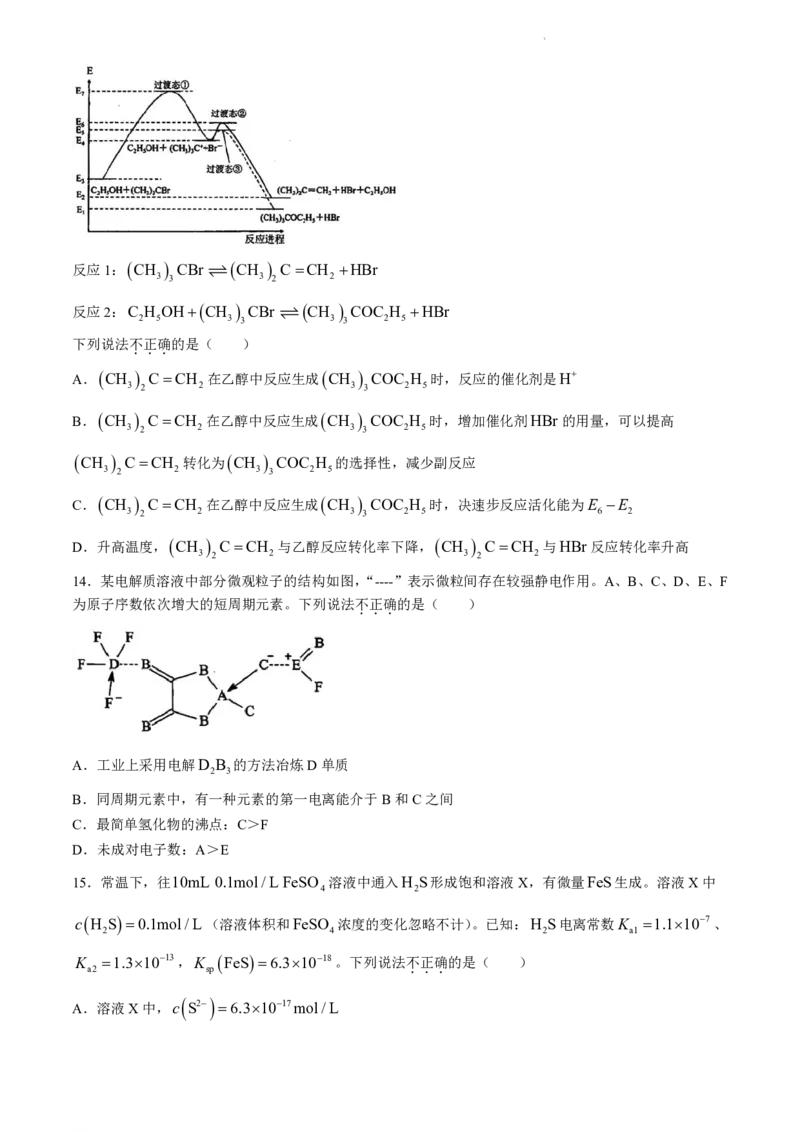
13.叔丁基溴在乙醇中反应的能量变化如图所示。
学科网(北京)股份有限公司反应1: CH CBr CH C CH HBr
3 3 3 2 2
反应2:C H OH CH CBr CH COC H HBr
2 5 3 3 3 3 2 5
下列说法不正确的是( )
...
A. CH CCH 在乙醇中反应生成 CH COC H 时,反应的催化剂是H
3 2 2 3 3 2 5
B. CH CCH 在乙醇中反应生成 CH COC H 时,增加催化剂HBr的用量,可以提高
3 2 2 3 3 2 5
CH CCH 转化为 CH COC H 的选择性,减少副反应
3 2 2 3 3 2 5
C. CH CCH 在乙醇中反应生成 CH COC H 时,决速步反应活化能为E E
3 2 2 3 3 2 5 6 2
D.升高温度, CH CCH 与乙醇反应转化率下降, CH CCH 与HBr反应转化率升高
3 2 2 3 2 2
14.某电解质溶液中部分微观粒子的结构如图,“----”表示微粒间存在较强静电作用。A、B、C、D、E、F
为原子序数依次增大的短周期元素。下列说法不正确的是( )
...
A.工业上采用电解D B 的方法冶炼D单质
2 3
B.同周期元素中,有一种元素的第一电离能介于B和C之间
C.最简单氢化物的沸点:C>F
D.未成对电子数:A>E
15.常温下,往10mL 0.1mol/L FeSO 溶液中通入H S形成饱和溶液X,有微量FeS生成。溶液X中
4 2
c H S 0.1mol/L(溶液体积和FeSO 浓度的变化忽略不计)。已知:H S电离常数K 1.1107、
2 4 2 a1
K 1.31013,K FeS 6.31018。下列说法不正确的是( )
...
a2 sp
A.溶液X中,c S2 6.31017mol/L
学科网(北京)股份有限公司B.反应FeS s 2H aq Fe2 aq H S aq 的K 4.4102
2
C.溶液X中,c
HS
c
OH
D.溶液X中存在2c Fe2 c H c OH c HS 2c S2
16.下列方案设计、现象和结论都正确的是( )
选项 目的 方案设计 现象和结论
探 究 H O 和
2 2 将稀硫酸酸化的 H O 加入 若溶液出现黄色,则说明H O 的氧化
2 2 2 2
A
Fe3 的氧化性强
Fe NO 溶液中 性比Fe2强
3 2
弱
比 较 ClO 、 分别配得相同pH的NaClO溶 pH NaClO pH CH COONa ,
3
B CH COO 结 合 液与CH COONa 溶液,稀释 说 明 ClO 结 合 H 的 能 力 强 于
3 3
H的能力强弱 10倍后,用pH计测定溶液pH CH COO
3
向 5mL 0.05mol/L FeCl3 溶
液 中 加 入
5mL 0.15mol/L KSCN 溶
探究浓度对平衡的 若b中颜色比a浅,c中颜色比a深,
C 液,溶液呈红色,再三等分于a、
影响 则说明浓度对平衡产生影响
b、c三支试管中,向b中加入铁
粉 、 向 c 中 滴 加 4 滴
1mol/L KSCN 溶液
取 2mL20%的蔗糖溶液于试管
中,加入适量稀H SO 后水浴
探究蔗糖在酸性水 2 4 若没有生成砖红色沉淀,则蔗糖在酸
D
溶液中的稳定性 加热 5min;再加入适量新制 性水溶液中稳定
Cu OH 悬浊液并加热
2
非选择题部分
二、非选择题(本大题共 5小题,共 52分)
17.(10分)锗是一种战略性金属,广泛应用于光学及电子工业领域,工业上可由GeS 提取Ge,并制造
2
CsGeBr 晶体,生产一种用于制作太阳能电池的材料。
3
(1)Ge的价层电子排布式为_________,基态Br原子有_________种空间运动状态。
(2)比较Cs与K的金属性强弱的实验方法:_________。
(3)SO 固态时,以环状和链状 SO 两种形式存在,下列说法不
.
正
.
确
.
的是_________。
3 3 n
学科网(北京)股份有限公司A.单分子SO 中心原子为sp2杂化,空间结构为平面三角形
3
B.环状 SO 中硫原子的杂化轨道类型为sp2
3 n
C.单分子SO 和链状 SO 均是分子晶体
3 3 n
D.链状 SO 中最多可能有6个原子在同一平面上
3 3
(4)硫酸可以和硝酸反应生成NO,比较键角ONO,NO _________NO(填“>”、“<”或“=”),
2 2 3
理由是__________________。
(5)CsGeBr 的晶胞如图所示。Cs与Br的最短距离比Ge与Br的最短距离大,则Ge在晶胞中的位置为
3
_________(填“A”、“B”或“C”)所处的位置,晶体中一个Cs周围与其距离最近的Br的个数为_________。
18.(10分)氮气是一种重要的工业基础原料,可按如下流程进行转化利用。反应Ⅱ的原子利用率100%,
硝酸氯可溶于水,Y是硝酸氯的同分异构体,结构中有一个三元环,氮原子的杂化方式为sp3,盐A是84
消毒液的主要成分,流程图中的水已省略。
(1)化合物X的化学式_________。
(2)写出反应Ⅲ的化学方程式_________。
(3)下列说法正确的是_________。
A.薯片的包装袋中、灯泡中、工业制镁的电解槽中都充入氮气做保护气
B.硝酸氯分子中的所有原子可能处于同一平面
C.为了加快反应速率,可以加热反应I
D.反应Ⅳ属于氧化还原反应
(4)通常情况下硝酸氯与HNO 均为液体,但硝酸氯的沸点明显低于HNO ,且比HNO 更易发生分解,
3 3 3
试分析原因_________。
学科网(北京)股份有限公司(5)设计实验验证硝酸氯中的氯元素_________。
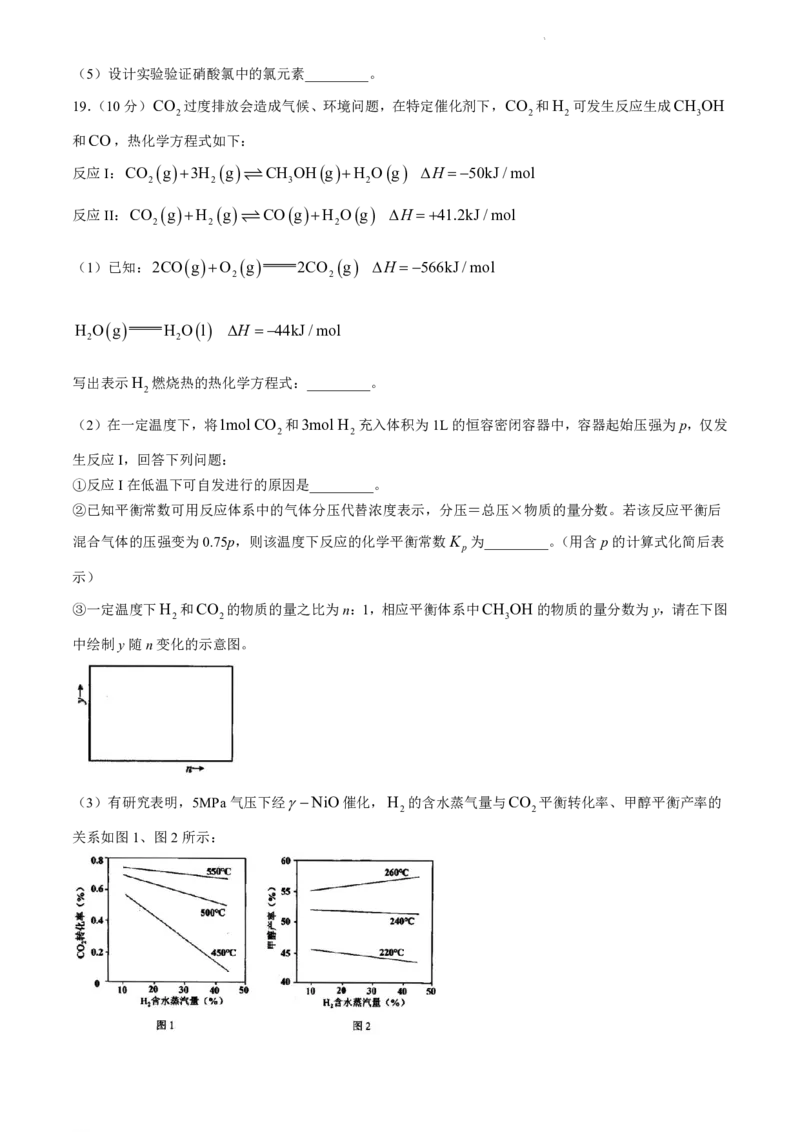
19.(10分)CO 过度排放会造成气候、环境问题,在特定催化剂下,CO 和H 可发生反应生成CH OH
2 2 2 3
和CO,热化学方程式如下:
反应I:CO g 3H g CH OH g H O g H50kJ/mol
2 2 3 2
反应II:CO g H g CO g H O g H41.2kJ/mol
2 2 2
(1)已知:2CO g O g 2CO g H 566kJ/mol
2 2
H O g H O l H 44kJ/mol
2 2
写出表示H 燃烧热的热化学方程式:_________。
2
(2)在一定温度下,将1mol CO 和3mol H 充入体积为1L的恒容密闭容器中,容器起始压强为p,仅发
2 2
生反应I,回答下列问题:
①反应I在低温下可自发进行的原因是_________。
②已知平衡常数可用反应体系中的气体分压代替浓度表示,分压=总压×物质的量分数。若该反应平衡后
混合气体的压强变为0.75p,则该温度下反应的化学平衡常数K 为_________。(用含p的计算式化简后表
p
示)
③一定温度下H 和CO 的物质的量之比为n:1,相应平衡体系中CH OH的物质的量分数为y,请在下图
2 2 3
中绘制y随n变化的示意图。
(3)有研究表明,5MPa气压下经NiO催化,H 的含水蒸气量与CO 平衡转化率、甲醇平衡产率的
2 2
关系如图1、图2所示:
学科网(北京)股份有限公司①下列说法不
.
正
.
确
.
的是_________。
A.其他条件不变,增大H 含水蒸气的量一定可以使反应I的平衡逆移,CO 平衡浓度增大
2 2
B.H 中的水蒸气在高温下可以作为反应的热源,有利于反应I的速率加快
2
C.图1中450℃下的图像变化说明高温下H 含水蒸气量增大不利于甲醇生成
2
D.改用活性更好的催化剂能使图2中各温度下的甲醇产率都增大
②图2中260℃时甲醇产率变化趋势与220、240℃时相反,请从温度与水蒸气含量的角度对此作出合理的
解释_________。
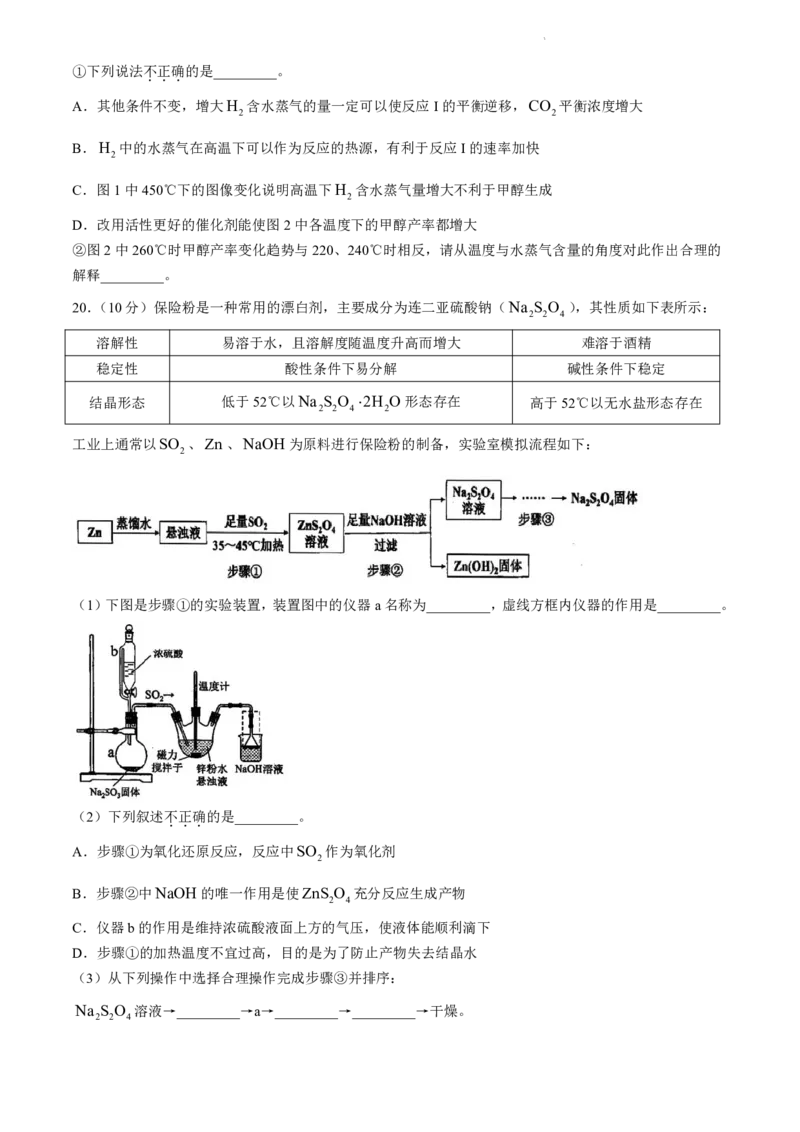
20.(10分)保险粉是一种常用的漂白剂,主要成分为连二亚硫酸钠(Na S O ),其性质如下表所示:
2 2 4
溶解性 易溶于水,且溶解度随温度升高而增大 难溶于酒精
稳定性 酸性条件下易分解 碱性条件下稳定
结晶形态 低于52℃以Na S O 2H O形态存在 高于52℃以无水盐形态存在
2 2 4 2
工业上通常以SO 、Zn、NaOH为原料进行保险粉的制备,实验室模拟流程如下:
2
(1)下图是步骤①的实验装置,装置图中的仪器a名称为_________,虚线方框内仪器的作用是_________。
(2)下列叙述不
.
正
.
确
.
的是_________。
A.步骤①为氧化还原反应,反应中SO 作为氧化剂
2
B.步骤②中NaOH的唯一作用是使ZnS O 充分反应生成产物
2 4
C.仪器b的作用是维持浓硫酸液面上方的气压,使液体能顺利滴下
D.步骤①的加热温度不宜过高,目的是为了防止产物失去结晶水
(3)从下列操作中选择合理操作完成步骤③并排序:
Na S O 溶液→_________→a→_________→_________→干燥。
2 2 4
学科网(北京)股份有限公司a.搅拌下通入略高于60℃的水蒸气;
b.分批逐步加入细食盐粉,搅拌使其结晶,用倾析法除去上层溶液,余少量母液;
c.趁热过滤; d.热酒精水溶液洗涤;
e.热酒精洗涤; f.热水洗涤
(4)副产物纯度测定
副产物Zn OH 固体中通常含有ZnSO 杂质,为了测定其纯度,取25.00g产品投入足量稀硫酸中充分溶
2 3
解,用足量25.00mL 0.5000mol/L的酸性KMnO 溶液充分吸收逸出的气体,并将所得溶液在容量瓶中
4
稀释至250mL,用移液管取10mL至锥形瓶中,使用0.01000mol/L的Na C O 标准溶液滴定至终点,消耗
2 2 4
Na C O 标准溶液25.00mL。则产品的纯度为_________。(精确到0.01%)
2 2 4
下列操作会导致测定的纯度偏
.
低
.
的是_________。
A.装Na C O 标准溶液的滴定管用蒸馏水洗涤后没有用标准液润洗
2 2 4
B.滴定前尖嘴处有气泡,滴定后无气泡
C.起始读数正确,滴定后俯视读数
D.滴定时当溶液由紫红色变成无色时立即读数,半分钟后又变回紫红色
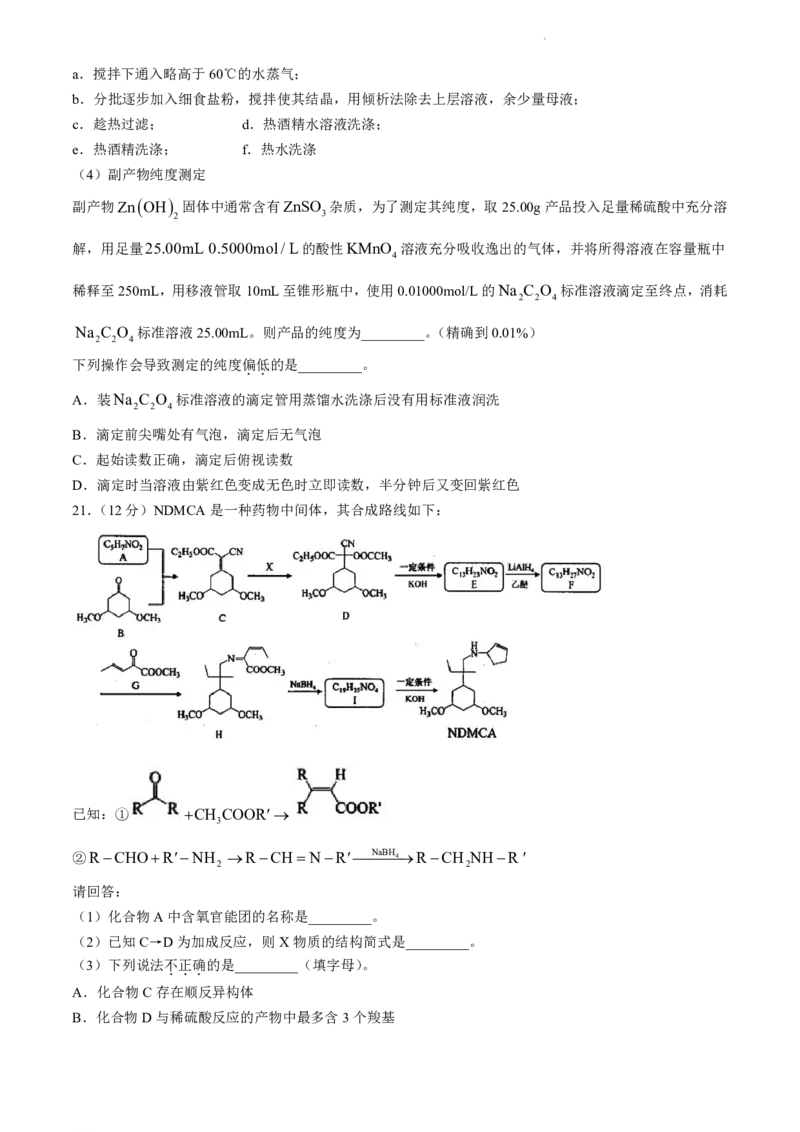
21.(12分)NDMCA是一种药物中间体,其合成路线如下:
已知:① CH COOR
3
②RCHORNH RCH NRNaBH 4RCH NHR
2 2
请回答:
(1)化合物A中含氧官能团的名称是_________。
(2)已知C→D为加成反应,则X物质的结构简式是_________。
(3)下列说法不
.
正
.
确
.
的是_________(填字母)。
A.化合物C存在顺反异构体
B.化合物D与稀硫酸反应的产物中最多含3个羧基
学科网(北京)股份有限公司C.E→F、H→I的反应类型均为还原反应
D.NDMCA的分子式是C H NO
18 31 2
(4)已知D→E的产物中有一种无机正盐,写出该反应的化学方程式_________。
(5)设计以乙醛为原料合成化合物G的路线(用流程图表示,无机试剂任选)_________。
(6)写出3种同时符合下列条件的化合物B的同分异构体的结构简式_________。
①分子中没有环状结构;
②不与Na 反应,1mol分子最多可与2mol NaOH发生水解反应。
③分子中共有3种不同化学环境的H。
学科网(北京)股份有限公司