文档内容
湖北省重点高中智学联盟 2025 届新高三 8 月考试
化 学 试 卷
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Ga-70
一、选择题:本题共 15小题,每小题 3分,共 45分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
1.我国饮食注重营养均衡,讲究“色香味形”。下列说法不正确的是
A.烹饪糖醋排骨用蔗糖炒出焦糖色,蔗糖属于寡糖
B.新鲜榨得的花生油具有独特油香,花生油的主要成分为不饱和高级脂肪酸
C.凉拌黄瓜加醋使其具有可口酸味,食醋中含有极性分子
D.端午时节用棕叶将糯米包裹成形,糯米中的淀粉属于有机高分子
2.根据材料的组成和结构变化可推测其性能变化,下列推测不
.
合
.
理
.
的是
选项 材料 组成和结构变化 性能变化
A 钛合金 减小晶粒大小至纳米量级 熔点降低
B 晶体硅 用碳原子取代部分硅原子 硬度增强
C 纤维素 一定条件和硝酸发生酯化反应 可燃性增强
D 聚乙烯 较高温度和压力下制得的聚乙烯含较多支链 密度增大
3.下列关于物质的检验、分离、提纯方法正确的是
A.用溴水鉴别苯酚和苯甲醛
B.用酸性KMnO 溶液除去乙炔中硫化氢气体
4
C.用BaCl 溶液检验Na SO 溶液是否变质
2 2 3
D.在提纯KNO (混有少量KCl)晶体过程中,可采取蒸发结晶的方法
3
4.下列化学用语或图示表达正确的是
A.砷原子的简化电子排布式为:[Ar]4s24p3
B.用电子式表示HCl的形成过程:
C.Cl 分子中p-pσ键的电子云轮廓图:
2
D. 的化学名称N:N—二甲基甲酰胺
5.下列方程式书写正确的是
A.向NaClO溶液中通入少量SO 的离子方程式为:ClO-+SO +H O=SO 2-+Cl-+2H+
2 2 2 4
B.向0.1mol/L的KAl(SO ) ·12H O溶液中滴加等体积等浓度的Ba(OH) 的溶液的离子方程式:
4 2 2 2
1Al3++2SO2-+2Ba2++4OH-=2BaSO + Al OH -
4 4 4
C.MgHCO 溶液与足量的NaOH溶液反应:Mg2HCOOH MgCO H O
3 2 3 3 2
D.HCHO溶液和过量的新制Cu(OH) 溶液混合加热反应:
2
HCHO+4Cu(OH) +2OH- CO 2-+2Cu O↓+6H O
2 3 2 2
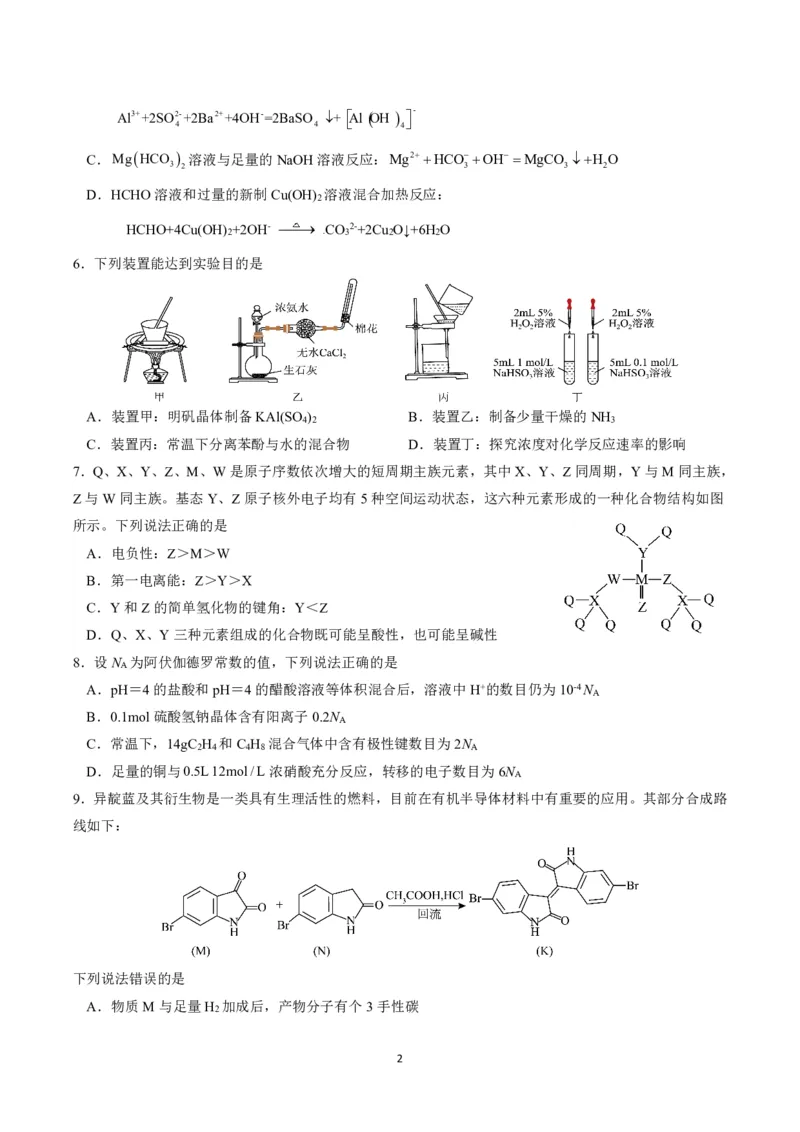
6.下列装置能达到实验目的是
A.装置甲:明矾晶体制备KAl(SO ) B.装置乙:制备少量干燥的NH
4 2 3
C.装置丙:常温下分离苯酚与水的混合物 D.装置丁:探究浓度对化学反应速率的影响
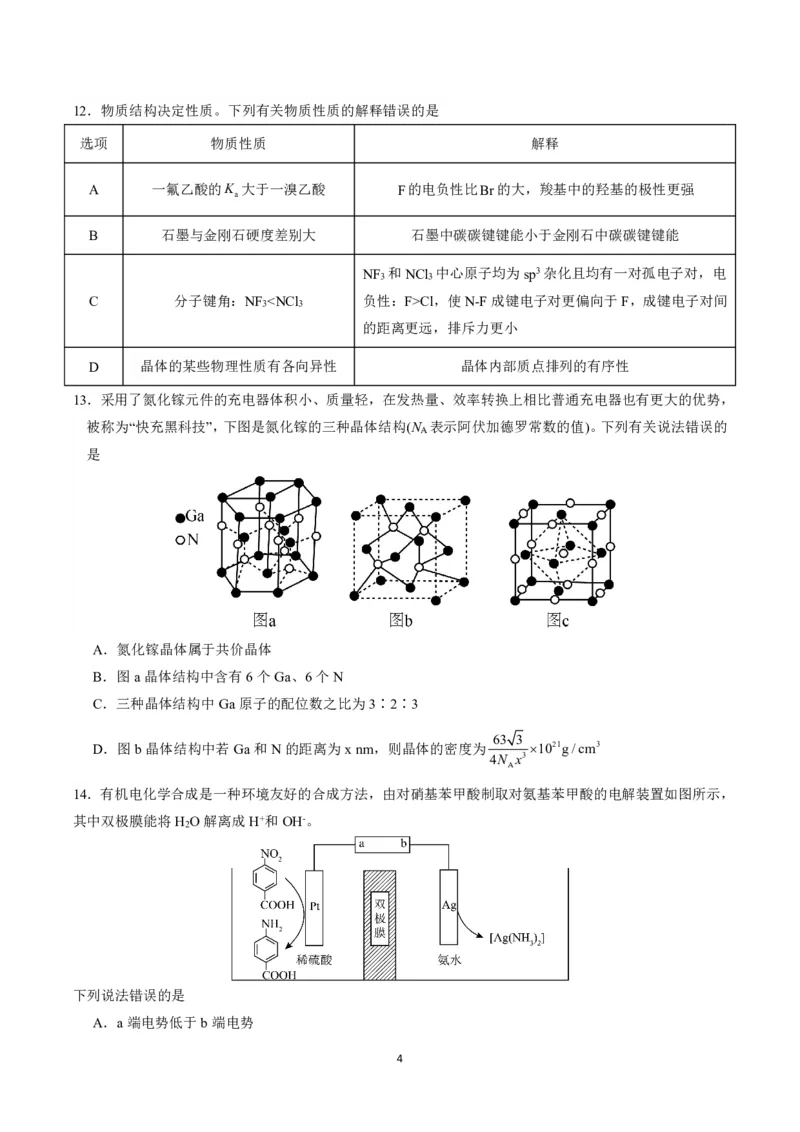
7.Q、X、Y、Z、M、W是原子序数依次增大的短周期主族元素,其中X、Y、Z同周期,Y与M同主族,
Z与W同主族。基态Y、Z原子核外电子均有5种空间运动状态,这六种元素形成的一种化合物结构如图
所示。下列说法正确的是
A.电负性:Z>M>W
B.第一电离能:Z>Y>X
C.Y和Z的简单氢化物的键角:Y<Z
D.Q、X、Y三种元素组成的化合物既可能呈酸性,也可能呈碱性
8.设N 为阿伏伽德罗常数的值,下列说法正确的是
A
A.pH=4的盐酸和pH=4的醋酸溶液等体积混合后,溶液中H+的数目仍为10-4N
A
B.0.1mol硫酸氢钠晶体含有阳离子0.2N
A
C.常温下,14gC H 和C H 混合气体中含有极性键数目为2N
2 4 4 8 A
D.足量的铜与0.5L 12mol/L浓硝酸充分反应,转移的电子数目为6N
A
9.异靛蓝及其衍生物是一类具有生理活性的燃料,目前在有机半导体材料中有重要的应用。其部分合成路
线如下:
下列说法错误的是
A.物质M与足量H 加成后,产物分子有个3手性碳
2
2B.向1molN中加入足量NaOH溶液,最多与3molNaOH反应
C.物质K中含3种官能团
D.物质K核磁共振氢谱有4组峰
10.研究小组以Cr O (绿色固体)、CCl 等物质为原料制备无水CrCl (紫色固体,易升华、凝华),反应原理
2 3 4 3
660℃
为Cr O +3CCl 2CrCl +3COCl ,制备装置如图所示(夹持装置略),反应管右端有15cm在加热炉外,
2 3 4 3 2
其作用是使CrCl 凝华,收集产品。已知:COCl 有剧毒,与水反应生成两种酸性气体。下列说法错误的是
3 2
A.实验中需持续通入N ,其目的为排除装置中的空气,将四氯化碳吹入反应管
2
B.装置B处应增加一个装有浓硫酸的U形管,防止锥形瓶内水蒸气进入
C.装置中锥形瓶内NaOH溶液吸收尾气后可以得到两种盐
D.当反应管中固体消失时,停止加热,待装置冷却后,停止通入N
2
11.冠醚能与碱金属离子结合(如下图所示),是有机反应很好的催化剂,例如能加快酸性KMnO 溶液与环
4
己烯的反应速率。
用结合常数表示冠醚与碱金属离子的结合能力,结合常数越大,两者结合能力越强。
下列说法正确的是
A.冠醚通过与K+结合将MnO -携带进入有机相,从而加快反应速率
4
B.结合常数的大小与碱金属离子直径有关,与冠醚空腔直径无关
C.如图所示的实验中c(Na+):①>②>③
D.为加快酸性KMnO 溶液与环己烯的反应速率,选择冠醚B比冠醚A更合适
4
312.物质结构决定性质。下列有关物质性质的解释错误的是
选项 物质性质 解释
A 一氟乙酸的K 大于一溴乙酸 F的电负性比Br的大,羧基中的羟基的极性更强
a
B 石墨与金刚石硬度差别大 石墨中碳碳键键能小于金刚石中碳碳键键能
NF 和NCl 中心原子均为sp3杂化且均有一对孤电子对,电
3 3
C 分子键角:NF Cl,使N-F成键电子对更偏向于F,成键电子对间
3 3
的距离更远,排斥力更小
D 晶体的某些物理性质有各向异性 晶体内部质点排列的有序性
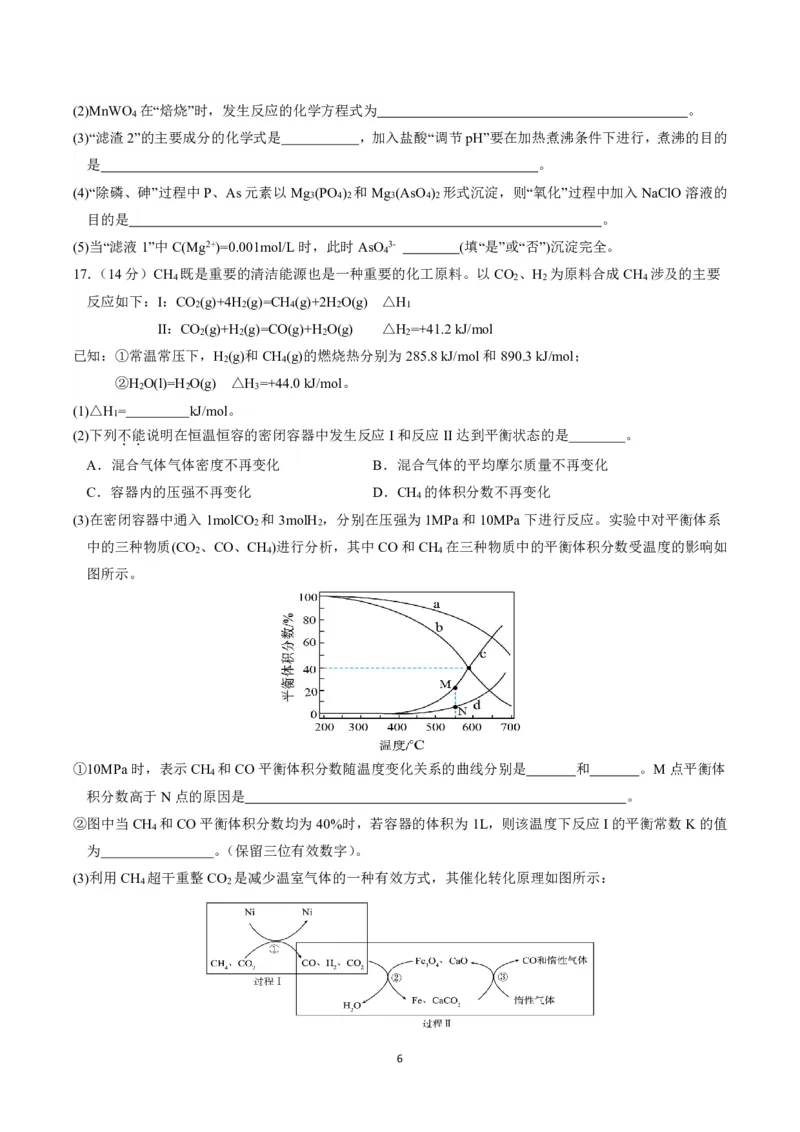
13.采用了氮化镓元件的充电器体积小、质量轻,在发热量、效率转换上相比普通充电器也有更大的优势,
被称为“快充黑科技”,下图是氮化镓的三种晶体结构(N 表示阿伏加德罗常数的值)。下列有关说法错误的
A
是
A.氮化镓晶体属于共价晶体
B.图a晶体结构中含有6个Ga、6个N
C.三种晶体结构中Ga原子的配位数之比为3∶2∶3
63 3
D.图b晶体结构中若Ga和N的距离为xnm,则晶体的密度为 1021g/cm3
4N x3
A
14.有机电化学合成是一种环境友好的合成方法,由对硝基苯甲酸制取对氨基苯甲酸的电解装置如图所示,
其中双极膜能将H O解离成H+和OH-。
2
下列说法错误的是
A.a端电势低于b端电势
4B.电解后阴极区溶液pH降低
C.每产生1mol[Ag(NH ) ]+就有1molH O发生解离
3 2 2
D.Pt的电极反应方程式可表示为: 6H6e 2H O
2
15.某氨基酸衍生物AcryMet(简称H L)的pK 1.47,pK 7.90。常温下构建Cu2 H L体系,其中
2 al a2 2
c Cu2 0.0125molL1,c Cu2 :c H L1:2.2,体系中含Cu物种分布系数与pH关系如图所示,下
0 0 0 2
列说法正确的是
A.CuHL CuHL HL K 0.008
2
B.pH4.5时c CuHL + >c HL- >c H+ >c OH-
C.pH11时,存在2c L2- +c HL- +c CuLOH - +c OH- =2c Cu2+ +c CuHL+ +c H+
D.pH12后继续增大pH,溶液中的c
CuLOH
一定继续增大
二、非选择题:本题共4小题,共55分。
16.(12分)钨酸(H WO )是一种重要的化工原料,用作媒染剂催化剂,制造防火材料等。一种以黑钨矿(主
2 4
要成分是FeWO 和MnWO ,还含有Si、P、As等元素的杂质)为原料制备钨酸的工业流程如下图所示。
4 4
已知:①“滤渣1”的成分是Mn O 和Fe O
3 4 2 3。
②“水浸”后滤液中主要阴离子为WO2、PO3、AsO3、AsO3和SiO2。
4 4 4 3 3
③K [Mg (AsO ) ]=1×10-20。
sp 3 4 2
回答下列问题:
(1)基态Fe2+的价电子排布式为 。
5(2)MnWO 在“焙烧”时,发生反应的化学方程式为 。
4
(3)“滤渣2”的主要成分的化学式是 ,加入盐酸“调节pH”要在加热煮沸条件下进行,煮沸的目的
是 。
(4)“除磷、砷”过程中P、As元素以Mg (PO ) 和Mg (AsO ) 形式沉淀,则“氧化”过程中加入NaClO溶液的
3 4 2 3 4 2
目的是 。
(5)当“滤液1”中C(Mg2+)=0.001mol/L时,此时AsO 3- (填“是”或“否”)沉淀完全。
4
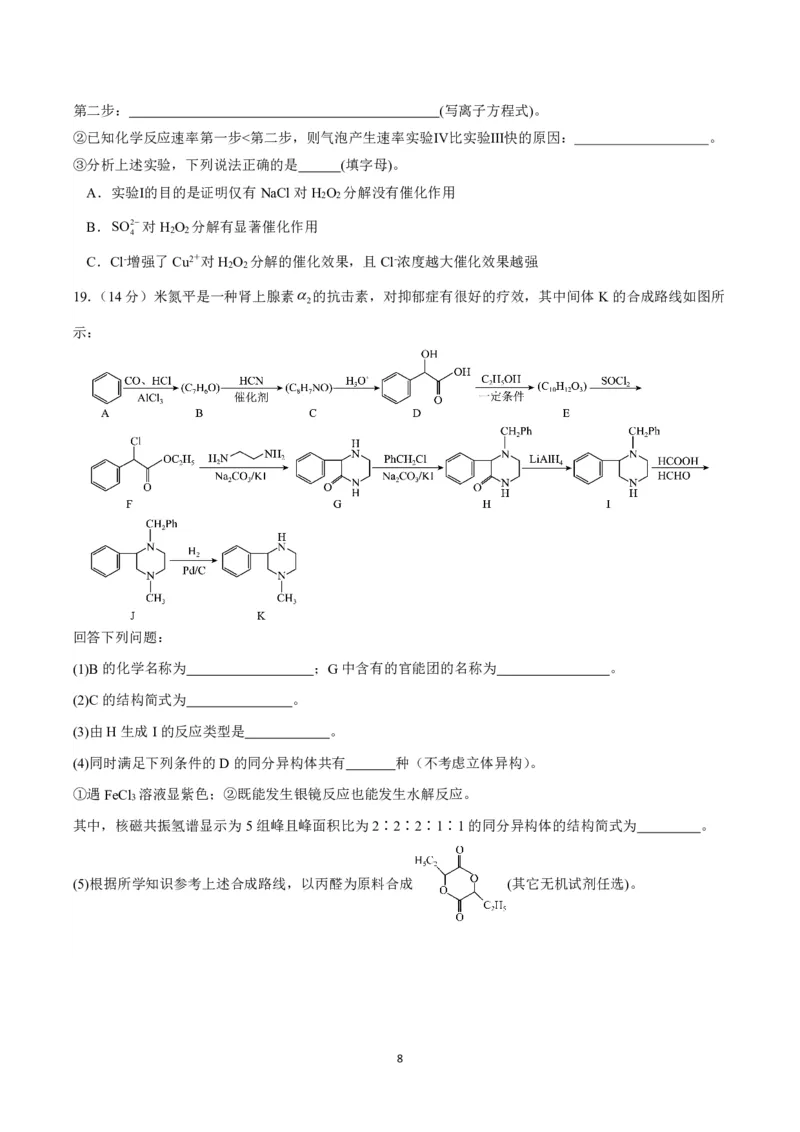
17.(14分)CH 既是重要的清洁能源也是一种重要的化工原料。以CO 、H 为原料合成CH 涉及的主要
4 2 2 4
反应如下:Ⅰ:CO (g)+4H (g)=CH (g)+2H O(g) △H
2 2 4 2 1
Ⅱ:CO (g)+H (g)=CO(g)+H O(g) △H =+41.2kJ/mol
2 2 2 2
已知:①常温常压下,H (g)和CH (g)的燃烧热分别为285.8kJ/mol和890.3kJ/mol;
2 4
②H O(l)=H O(g) △H =+44.0kJ/mol。
2 2 3
(1)△H = kJ/mol。
1
(2)下列不
.
能
.
说明在恒温恒容的密闭容器中发生反应I和反应II达到平衡状态的是 。
A.混合气体气体密度不再变化 B.混合气体的平均摩尔质量不再变化
C.容器内的压强不再变化 D.CH 的体积分数不再变化
4
(3)在密闭容器中通入1molCO 和3molH ,分别在压强为1MPa和10MPa下进行反应。实验中对平衡体系
2 2
中的三种物质(CO 、CO、CH )进行分析,其中CO和CH 在三种物质中的平衡体积分数受温度的影响如
2 4 4
图所示。
①10MPa时,表示CH 和CO平衡体积分数随温度变化关系的曲线分别是 和 。M点平衡体
4
积分数高于N点的原因是 。
②图中当CH 和CO平衡体积分数均为40%时,若容器的体积为1L,则该温度下反应I的平衡常数K的值
4
为 。(保留三位有效数字)。
(3)利用CH 超干重整CO 是减少温室气体的一种有效方式,其催化转化原理如图所示:
4 2
6①CH 与CO 超干重整总反应的化学方程式为 。
4 2
②有关转化过程,下列说法正确的是_______(填序号)。
A.过程Ⅰ中CO 未参与反应
2
B.过程Ⅱ实现了含碳物质与含氢物质的分离
C.转化②中CaO消耗过程中的CO ,有利于反应正向进行
2
D.转化③中Fe与CaCO 反应的物质的量之比为4∶3
3
18.(15分)CuCl 是常见的化学试剂,某小组利用废铜屑“湿法”制备CuCl ·2H O并开展相关探究。
2 2 2
已知:氯化铜在不同温度下结晶形成的结晶水合物
温度 15℃以下 15~25.7℃ 26~42℃ 42℃以上
结晶水合物 CuCl ·4H O CuCl ·3H O CuCl ·2H O CuCl ·H O
2 2 2 2 2 2 2 2
回答下列问题:
(1)仪器a的名称为 。
(2)上述方法制备CuCl 的离子方程式为 。
2
(3)为得到纯净的CuCl ·2H O晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤
2 2
液中持续通入HCl气体,加热蒸发浓缩, ,过滤,洗涤,低温干燥。持
续通入HCl气体的目的是 。
(4)实验中,H O 的实际用量要大于理论用量,可能因素为:原因1: ;
2 2
原因2:生成的CuCl 催化了H O 的分解。
2 2 2
(5)该小组对“原因2”进行拓展探究。为验证CuCl 对H O 分解的催化作用,该小组向5支盛有10mL5%H O
2 2 2 2 2
的试管中滴加不同溶液,实验记录如下表(忽略溶液体积的微小变化;已知一定条件下,还原产物的浓度越
小,氧化剂的氧化性越强):
实验 Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ
滴加 2滴 2滴 2滴 2滴1mol/LCuSO 和 2滴1mol/LCuSO 和
4 4
试剂 1mol/LNaCl 1mol/LNa SO 1mol/LCuSO 2滴1mol/LNaCl 4滴1mol/LNaCl
2 4 4
现象 无气泡产生 无气泡产生 均产生气泡,且气泡速率从Ⅲ到Ⅴ依次加快
①实验Ⅳ过程中观察到有白色沉淀(经检验为CuCl)生成,反应的机理表示为:
第一步:H O +2Cu2++2Cl-=O ↑+2CuCl+2H+;
2 2 2
7第二步: (写离子方程式)。
②已知化学反应速率第一步<第二步,则气泡产生速率实验Ⅳ比实验Ⅲ快的原因: 。
③分析上述实验,下列说法正确的是 (填字母)。
A.实验Ⅰ的目的是证明仅有NaCl对H O 分解没有催化作用
2 2
B.SO2对H O 分解有显著催化作用
4 2 2
C.Cl-增强了Cu2+对H O 分解的催化效果,且Cl-浓度越大催化效果越强
2 2
19.(14分)米氮平是一种肾上腺素的抗击素,对抑郁症有很好的疗效,其中间体K的合成路线如图所
2
示:
回答下列问题:
(1)B的化学名称为 ;G中含有的官能团的名称为 。
(2)C的结构简式为 。
(3)由H生成I的反应类型是 。
(4)同时满足下列条件的D的同分异构体共有 种(不考虑立体异构)。
①遇FeCl 溶液显紫色;②既能发生银镜反应也能发生水解反应。
3
其中,核磁共振氢谱显示为5组峰且峰面积比为2∶2∶2∶1∶1的同分异构体的结构简式为 。
(5)根据所学知识参考上述合成路线,以丙醛为原料合成 (其它无机试剂任选)。
8