文档内容
湘 豫 名 校 联 考
#$#%年#月高三第一次模拟考试
化学参考答案
题号 & ’ ( !$ !! !# !)
答案 * + * , - + ,
一!选择题"本题共&小题#每小题.分#共%#分$每小题只有一个选项符合题目
要求$
&/*!%解析&小苏打是012*3
)
!加热时分解生成物中有*3
#
!能使面食疏松多孔!松软可口!可作面食的膨松
剂!+项正确"二氧化硫具有还原性!葡萄酒中添加适量二氧化硫可起到抗氧化和杀菌的作用!规定可用于葡
萄酒和果酒中的最大使用量是$/#"4#546!!残留量不得超过$/$"4#546!!-项正确"78$32%
)
胶体具有
吸附性!可促进水中悬浮颗粒物的沉降!用于自来水的净化!不可用于自来水的杀菌消毒!*项错误"石油的
裂解是石油的深度裂化!其主要目的是获得短链有机小分子!如乙烯和丙烯等基础化工原料!,项正确&
’/+!%解析&帕罗西汀的分子式为*
!(
2
#$
703
)
!+项正确"帕罗西汀分子中不存在碳碳双键’醇羟基和肽键!-
项错误"帕罗西汀具有碱性!能与盐酸反应!*项错误"杂环中所有碳原子不可能处于同一平面!,项错误&
(/*!%解析&向01
#
9:3
)
溶液中通入2*;!不能证明非金属性(*;"9:!因为2*;不是氯元素最高价氧化物对应
的水化物!+项错误"向硫酸铜溶液中逐滴加入氨水!形成难溶物的原因是氨水呈碱性!可与*<#=形成难溶
的氢氧化铜!继续滴加氨水!难溶物溶解!得到深蓝色的四氨合铜配离子!-项错误"饱和01*;溶液使蛋白质
发生盐析!析出固体!*<93 溶液使蛋白质发生变性!析出固体!析出固体的原理不同!*项正确"恒温条件
%
下!扩大充有03 密闭容器的体积!平衡向生成03 的方向移动!,项错误&
# #
!$/,!%解析&从能量变化图可知反应!为吸热反应!反应"为放热反应!+项错误"每个*3分子中有!个#
键和#个$键!而每个*3
#
中有#个#键和#个$键!-项错误"选择合适的催化剂可降低反应活化能!但不
能改变焓变!*项错误"题述反应机理中涉及物质中有两种非极性分子$2 ’*3 %!三种极性分子$*232’
# # )
23’*3%!,项正确&
#
!!/-!%解析&根据题意可推知 >’?’@’A’B分别为 2’0’3’01’9&由于0原子#C轨道达到半充满稳定结
构!故第一电离能(0"3"9!+项错误"3与2可形成2
#
3和2
#
3
#
!3与0可形成03’03
#
等!3与01
可形成013和013 !3与9可形成93 和93 !-项正确"01与活泼非金属之间能形成离子晶体!0’3’
# # # # )
.6#D)
9的单质能形成分子晶体!不能形成共价晶体!*项错误"93 分子中硫原子价层电子数为)= E)!9
) #
.6#D#
原子的杂化方式为FC#!93
#
分子中硫原子价层电子数为#=
#
E)!9原子的杂化方式也为FC#!,项
错误&
!#/+!%解析&从电池总反应式可以看出放电时!G:
!
*
.
中*原子的化合价升高!G:
!
*
.
作负极!G:
!6!
*H3
#
作正
极&放电时!G:
!
*
.
作负极!+极电极反应式为G:
!
*
.
6!86###*
.
=!G:=!+项错误"由+极电极反应式知!
放电时!G:=从负极脱嵌!经电解液和隔膜嵌入正极!-项正确"放电时!-极为正极!则充电时-极为阳极!
G:*H3
#
在-极上发生氧化反应!电极反应式为G:*H3
#
6!86###G:
!6!
*H3
#
=!G:=!*项正确"由+项分析
化学参考答案!第!!!!!页!共"页"
{#{QQABAYQUggCAABIAAAgCEwW4CEGQkBAAACoOxFAAMAABSQFABAA=}#}
书书书知!放电时!-电极反应式为G:
!6!
*H3
#
=!G:==!86###G:*H3
#
!则每转移!IH;电子时!电极增加
!IH;锂离子!若转移$/#IH;电子!-电极将增重$/#IH;D&4#IH;6!E!/%4!,项正确&
!)/,!%解析&根据题意及图像分析知!曲线+*J描述27浓度的变化!曲线,*-描述76浓度变化!+项正
确"#"K’C2E%时!"平 $2=%E!D!$6%IH;#G6!!"平 $76%E!/.D!$6)IH;#G6!!"平 $27%E%/$D
!$6%IH;#G6!!由电离平衡常数的定义可知# $27%E
"平 $2=%#"平 $76%
E
!D!$6%D!/.D!$6)
E
1 "平 $27% %/$D!$6%
%D!$6%!-项正确"根据图知*点时"$76%E"$27%’"$2=%""$326%!再根据溶液的电荷守恒知"$01=%=
"$2=%E"$326%="$76%!得到"$27%""$01=%!*项正确"J点溶液呈酸性!27的电离程度大于76的水
解程度!27电离出的2=对水的电离起抑制作用!故J点水的电离程度小于纯水的电离程度!,项错误&
三!非选择题"本题共%小题#共"’分$
#&/!!%分"#答案$!!"=)价!!分"! 除去铁泥表面的油污!!分"
!#"烧杯!!分"!漏斗!!分"!玻璃棒!!分"
!)"适当增大酸的浓度%加热%搅拌%延长时间等!任写两种合理即可&#分"
!%"#78#==#2==*;36####78)==*;6=2
#
3!#分"! 2
#
3
#
%*;
#
%3
#
等合理答案均可!!分"
!"")78)==)01==)93#
%
6=)*3#
)
6=)2
#
3###01
)
78
)
!93
%
"
)
!32" .$=)*3 #%!#分"
!."取少许滤液于试管中&向其中滴加稀硝酸酸化&再滴加硝酸银溶液&若有白色沉淀产生&则说明待测液中
含有*;6!#分"
%解析&$!%根据化合物中各元素正负化合价的代数和等于$可知黄钠铁矾中78元素的化合价为=)价"油
污在碱性条件下能发生水解反应而被除去&
$#%过滤操作用到的玻璃仪器有烧杯’漏斗’玻璃棒&
$)%为提高)酸溶*浸取率!可采取的措施有适当增大酸的浓度’加热’搅拌’延长时间等&
$%%酸性条件下!01*;3具有强氧化性!可以将78#=氧化为78)=&在不引入杂质的前提下!用23 可以替
# #
代01*;3起氧化作用&
$"%硫酸钠和碳酸钠和78)=发生反应生成0178$93%$32%&
) ) % ) .
$.%滤液中的主要成分是氯化钠!检验滤液中*;6的方法是取少许滤液于试管中!向其中滴加稀硝酸酸化!
再滴加硝酸银溶液!若有白色沉淀产生则说明待测液中含有*;6&
#’/!!%分"#答案$!!"检查装置的气密性!!分"!1!!分"
!#"789=#2=###78#==2
#
9%!#分"!不能!!分"
!)"三口烧瓶或三颈烧瓶!!分"! 2
#
9=L
#
=#M32####ML=9$=#2
#
3!#分"
!%"吸收未反应的29气体&防止污染环境!!分"
#
!""7893
%
!!分"!L
#
!!分"! 可逆!!分"!#78)==#L6&’#78#==L
#
!没写可逆号扣!分&#分"
%解析&$!%在连接完装置后!必须检查装置的气密性!再依次加入药品进行实验!操作时!要先打开装置+
中的分液漏斗1!使装置+中药品先反应生成29气体!然后打开装置-中的分液漏斗N进行装置-内的
#
反应&
$#%装置+中发生反应的离子方程式为789=#2=###78#==2
#
9%!装置+中若将稀硫酸换成稀硝酸!稀
硝酸具有强氧化性!无法制取29&
#
化学参考答案!第!!!!#页!共"页"
{#{QQABAYQUggCAABIAAAgCEwW4CEGQkBAAACoOxFAAMAABSQFABAA=}#}$)%装置-中仪器O的名称是三颈烧瓶!其中发生反应的化学方程式为 2
#
9=L
#
=#M32####ML=9$=
#23&
#
$%%装置*中盛有0132溶液!可吸收未反应的29气体!防止污染环境&
#
$"%接通灵敏电流计后!指针向左偏转!说明左侧是正极!发生还原反应!右侧是负极!发生氧化反应!即总反
应为#78)==#L6&’#78#==L
#
!灵敏电流计读数变为零时!反应结束!若再向,中加入7893
%
或向J中加
入碘固体后!灵敏电流计出现指针偏向右侧!说明右侧为正极!碘作氧化剂!得电子发生还原反应!左侧为负
极!负极78#=失电子!发生氧化反应!故在浓度改变时反应逆向进行!说明78$93 %与ML反应为可逆反
# % )
应!即反应的离子方程式为#78)==#L6&’#78#==L
#
&
#(/!!"分"#答案$!!"!6"=$=%"5P’IH;6!!#分"
!#"%$/!#IH;’G6!’I:Q6!!#分"!!#/(.IH;#’G6#!#分&单位不作要求"! (!#分"
&(!#分"
’&!N""&!1"!!分"
!)"!!!分"!"!#分"!正反应为放热反应&升高温度&平衡逆向移动!!分"
%解析&$!%已知%#*3$4%=3
#
$4%####*3
#
$4%!(’
!
E6$5P#IH;6!!
#
$4%=3
#
$4%####2
#
3$4%!
(’
#
E6%5P#IH;6!!’*2
%
$4%=#3
#
$4%###*3
#
$4%=#2
#
3$4%!(’
)
E6"5P#IH;6!!因此根据盖斯
定律可知!’6%6&即得反应 *2
%
$4%=*3
#
$4%&’#*3$4%=#2
#
$4%!所以该反应的反应热
(’E6"5P#IH;6!=$5P#IH;6!=%5P#IH;6!E$6"=$=%%5P#IH;6!&
$#%%根据+容器曲线’O点数据列三段式(
容器+的O点处(!!!!!*2
%
$4%=*3
#
$4%&’#*3$4%=#2
#
$4%
!!起始浓度+$IH;#G6!%!!!!!!!!!!!!!$!!! !$
!!转化浓度+$IH;#G6!%!!!$/.!!$/.!!!!/#!!!!/#
!!平衡浓度+$IH;#G6!%!!!$/%!!$/%!!!!/#!!!!/#
$/.
$)"I:Q内($*2
%
%E
"
IH;#G6!#I:Q6!E$/!#IH;#G6!#I:Q6!!
!/##D!/##
#E IH;##G6#E!#/(.IH;##G6#&
! $/%D$/%
原+容器的平衡体系中!*3 ’*2 各$/%IH;!*3’2 各!/#IH;!恒温时向+容器的平衡体系中再充入
# % #
*3
#
’*2
%
各$/%IH;!*3’2
#
各!/#IH;!相当于平衡时增大压强!平衡逆向移动!重新达平衡前!(正((逆 &
&该反应的正反应为吸热反应!温度越低!平衡常数越小!1点温度低于O点!即1点处该反应的平衡常数
# #(#
!
&’原料气体中!*3
#
的量越多!*2
%
转化率越大!根据温度相同时1’N两点的*2
%
转化率可知)"
!!N点容器内气体物质的量最大!压强最大!即总压强(&$N%"&$1%&
$)%相同温度下反应’*2
%
$4%=#3
#
$4%###*3
#
$4%=#2
#
3$4%对应的*2
%
转化率较高!则催化效果最佳
的是催化剂!"如果R点已经达到平衡状态!R点以后体系处于平衡状态!则8点未达到平衡状态!则8点的
(正"(逆 !正反应为放热反应!S点转化率比R点低的原因是放热反应!升高温度!平衡逆向移动&
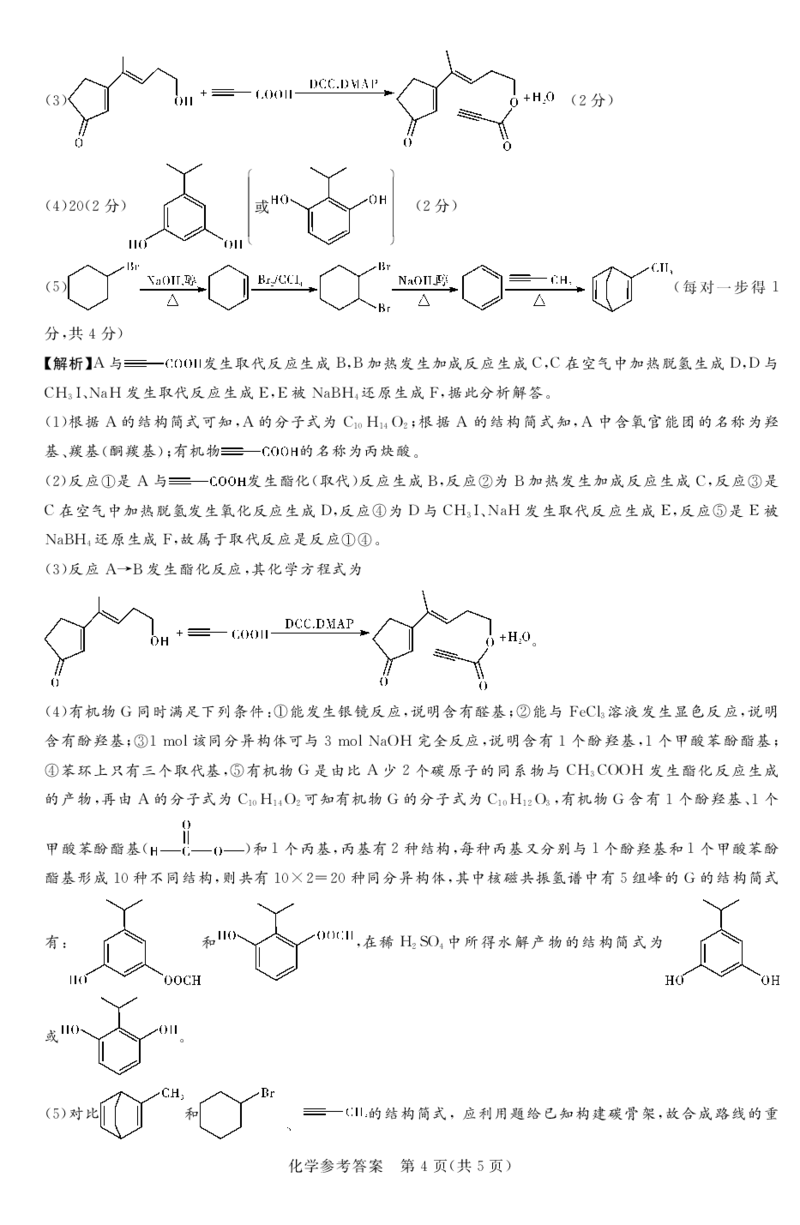
)$/!!"分"#答案$!!"羰基!或酮羰基"%羟基!满分#分&写对!个给!分"! 丙炔酸!!分"
!#"%*!#分"
化学参考答案!第!!!!)页!共"页"
{#{QQABAYQUggCAABIAAAgCEwW4CEGQkBAAACoOxFAAMAABSQFABAA=}#}!)" !!#分"
) +
!%"#$!#分" 或 !!#分"
* ,
!"" !每对一步得!
分&共%分"
%解析&+与 发生取代反应生成-!-加热发生加成反应生成*!*在空气中加热脱氢生成,!,与
*2L’012发生取代反应生成J!J被01-2 还原生成7!据此分析解答&
) %
$!%根据+的结构简式可知!+的分子式为* 2 3 "根据+的结构简式知!+中含氧官能团的名称为羟
!$ !% #
基’羰基$酮羰基%"有机物 的名称为丙炔酸&
$#%反应%是+与 发生酯化$取代%反应生成-!反应&为-加热发生加成反应生成*!反应’是
*在空气中加热脱氢发生氧化反应生成,!反应*为,与*2
)
L’012发生取代反应生成J!反应+是J被
01-2
%
还原生成7!故属于取代反应是反应%*&
$)%反应+--发生酯化反应!其化学方程式为
&
$%%有机物T同时满足下列条件(%能发生银镜反应!说明含有醛基"&能与78*;
)
溶液发生显色反应!说明
含有酚羟基"’!IH;该同分异构体可与)IH;0132完全反应!说明含有!个酚羟基!!个甲酸苯酚酯基"
*苯环上只有三个取代基!+有机物T是由比+少#个碳原子的同系物与*2
)
*332发生酯化反应生成
的产物!再由+的分子式为* 2 3 可知有机物T的分子式为* 2 3 !有机物T含有!个酚羟基’!个
!$ !% # !$ !# )
甲酸苯酚酯基$ %和!个丙基!丙基有#种结构!每种丙基又分别与!个酚羟基和!个甲酸苯酚
酯基形成!$种不同结构!则共有!$D#E#$种同分异构体!其中核磁共振氢谱中有"组峰的T的结构简式
有( 和 !在稀293 中所得水解产物的结构简式为
# %
或 &
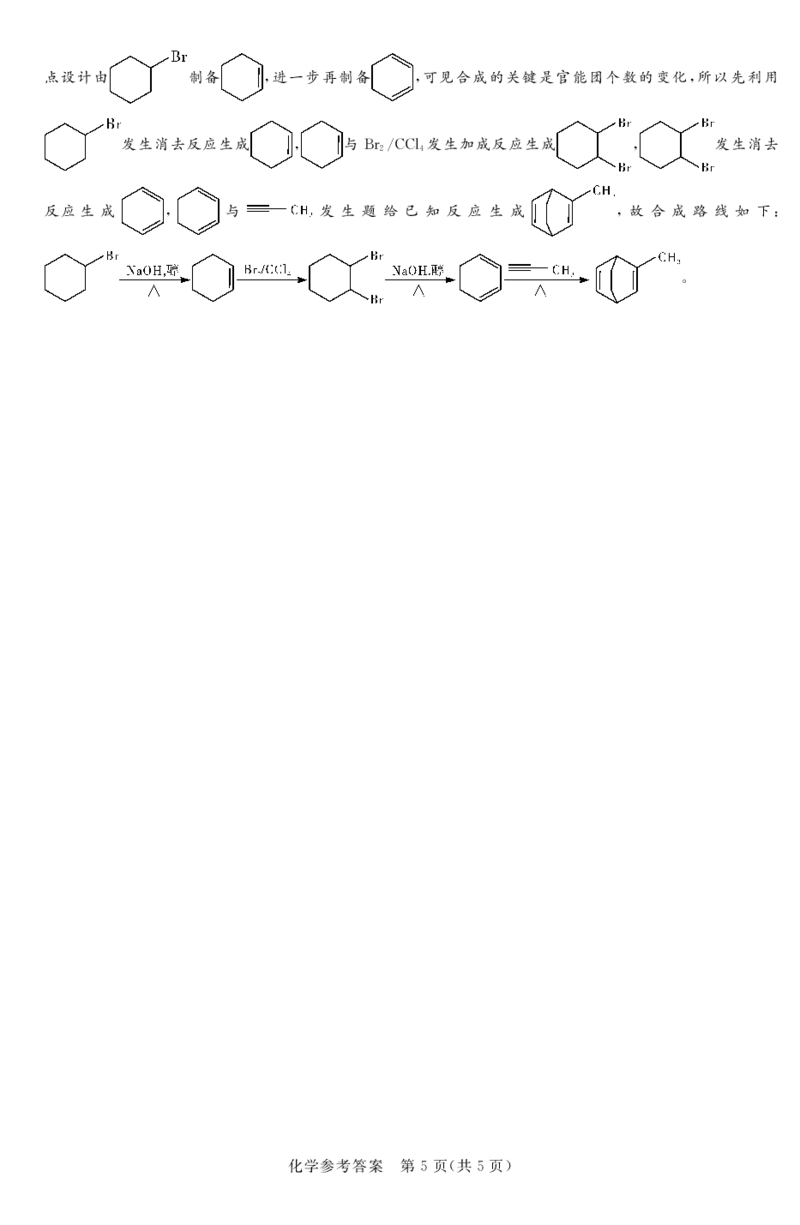
$"%对比 和 的结构简式!应利用题给已知构建碳骨架!故合成路线的重
化学参考答案!第!!!!%页!共"页"
{#{QQABAYQUggCAABIAAAgCEwW4CEGQkBAAACoOxFAAMAABSQFABAA=}#}点设计由 制备 !进一步再制备 !可见合成的关键是官能团个数的变化!所以先利用
发生消去反应生成 ! 与-U+**;发生加成反应生成 ! 发生消去
# %
反应生 成 ! 与 发 生 题 给 已 知 反 应 生 成 !故 合 成 路 线 如 下(
&
化学参考答案!第!!!!"页!共"页"
{#{QQABAYQUggCAABIAAAgCEwW4CEGQkBAAACoOxFAAMAABSQFABAA=}#}