文档内容
西南大学附属中学 重庆育才中学 万州高级中学
高 2024 届拔尖强基联盟高三下 2 月联合考试
化 学 试 题
(满分:100分;考试时间:75分钟)
命题学校:重庆育才中学
2024年2月
注意事项:
1.答题前,考生先将自己的姓名、班级、考场/座位号、准考证号填写在答题卡上.
2.答选择题时,必须使用2B铅笔填涂;答填空题时,必须使用0.5毫米的黑色签字笔书写;必须在题号对应的
答题区域内作答,超出答题区域书写无效;保持答卷清洁、完整.
3.考试结束后,将答题卡交回(试题卷学生保存,以备评讲).
可能用到的相对原子质量:Cl-35.5 Ti-48
一、选择题(本题包括 14小题,每小题 3分,共 42分。在每小题给出的四个选项中,只有
一个选项符合要求)
1.下列有关化学与生活和科技发展等的解释,不
.
正
.
确
.
的一项是
A.航天员穿的宇航服内衬面料中会添加芳纶,以增加弹性,芳纶属于有机高分子材料
B.铜梁非物质文化遗产“打铁花”,是利用了铁元素的焰色试验
C.九滨路长江边上停靠的166舰,舰底镶嵌了很多锌块,这是利用牺牲阳极法对舰底进行保护
D.2023年11月15日,习主席同美国总统拜登在旧金山进行会晤。期间,习主席乘坐的是国产红旗
轿车。红旗轿车在设计时,部分材料采用了碳纤维,碳纤维属于无机非金属材料
2.用化学用语表示NH +HCl=NH Cl中的相关微粒,其中正确的是
3 4
A.NH 的结构式为 B.由H和Cl形成HCl的过程为
3
C.中子数为8的氮原子为8N D.Cl的结构示意图为
7
3.过量浓NaOH溶液和白磷加热煮沸可发生反应:P 4 +3NaOH+3H 2 O=3NaH 2 PO 2 +PH 3 ↑。下列说法不 . 正 .
确
.
的是(用N
A
表示阿伏伽德罗常数的值)
A.1molP 含6N 个σ键 B.当反应生成0.2molPH 时,转移电子数为0.6N
4 A 3 A
C.NaH PO 为正盐 D.PH 分子的键角大于NH 分子的键角
2 2 3 3
第1页 共8页4.陈述1和陈述2均正确且二者有相关性的是
选项 陈述1 陈述2
A 液氨常作制冷剂 断裂氢氮键要吸收热量
B 食盐可用于调味和消毒 NaCl是离子晶体
C 将浓硝酸保存于棕色试剂瓶并放置阴凉处 HNO 是一元强酸
3
D 用KMnO 溶液对环境消毒 KMnO 具有强氧化性
4 4
5.下列有关离子方程式,正确的是
A.向饱和Na CO 溶液中通入过量CO :CO2-+CO +H O=2HCO-
2 3 2 3 2 2 3
B.向苯酚钠溶液中通入少量CO :2 +CO +H O=2 +CO2-
2 2 2 3
C.Na[Al(OH) ]溶液与NaHCO 溶液混合:[Al(OH) ]-+HCO- =Al(OH) ↓+H O+CO2-
4 3 4 3 3 2 3
D.向Mg(HCO ) 溶液中加入过量澄清石灰水:Mg2++2HCO- +Ca2++4OH-=Mg(OH) ↓+CaCO ↓+
3 2 3 2 3
2H O+CO2-
2 3
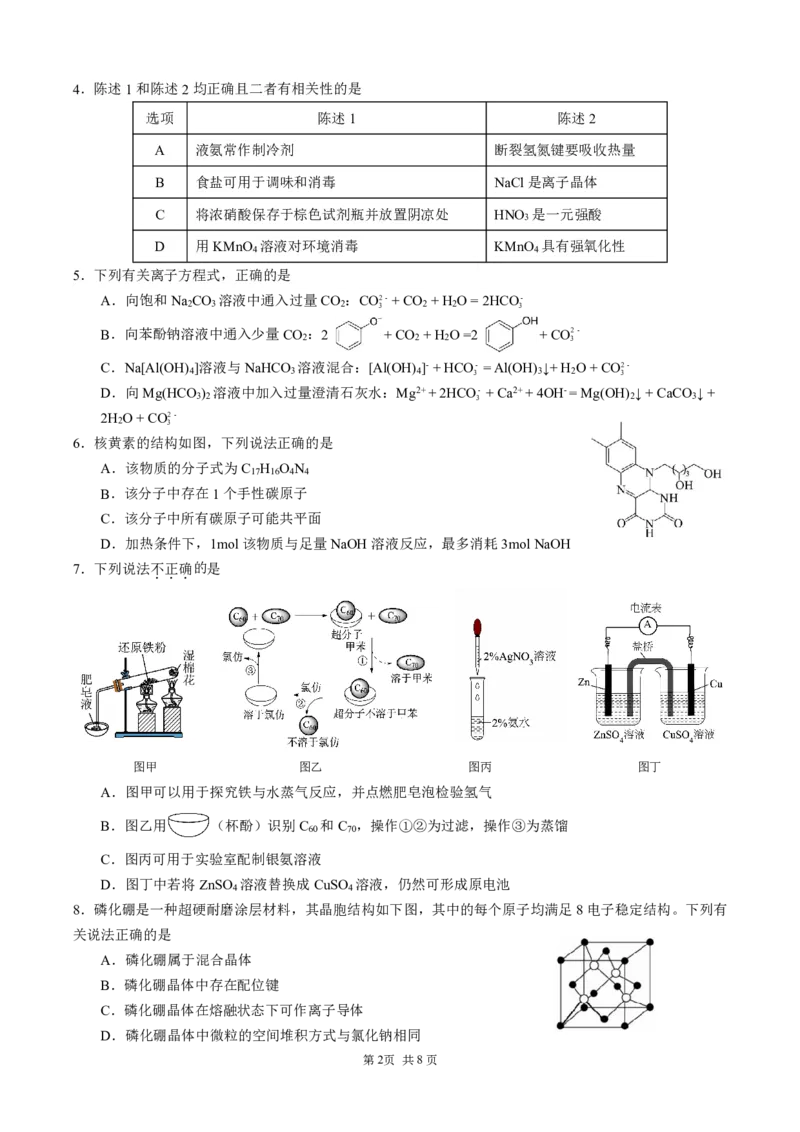
6.核黄素的结构如图,下列说法正确的是
A.该物质的分子式为C H O N
17 16 4 4
B.该分子中存在1个手性碳原子
C.该分子中所有碳原子可能共平面
D.加热条件下,1mol该物质与足量NaOH溶液反应,最多消耗3molNaOH
7.下列说法不
.
正
.
确
.
的是
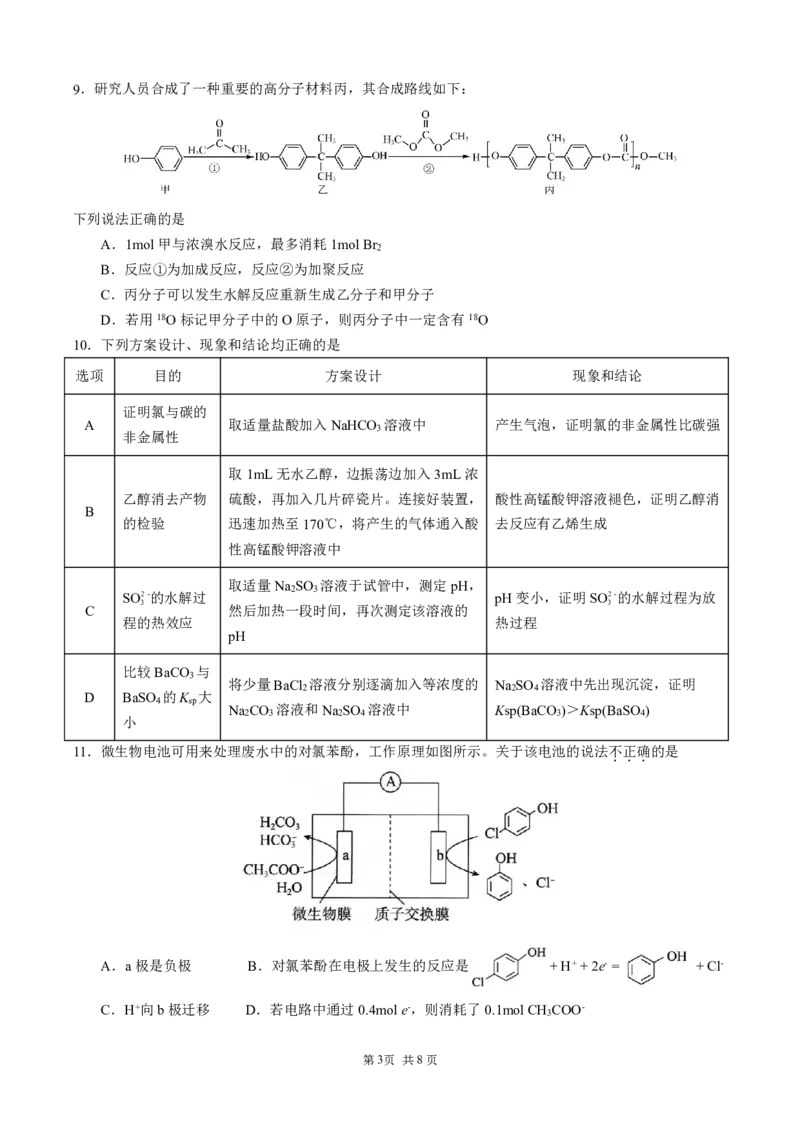
图甲 图乙 图丙 图丁
A.图甲可以用于探究铁与水蒸气反应,并点燃肥皂泡检验氢气
B.图乙用 (杯酚)识别C 和C ,操作①②为过滤,操作③为蒸馏
60 70
C.图丙可用于实验室配制银氨溶液
D.图丁中若将ZnSO 溶液替换成CuSO 溶液,仍然可形成原电池
4 4
8.磷化硼是一种超硬耐磨涂层材料,其晶胞结构如下图,其中的每个原子均满足8电子稳定结构。下列有
关说法正确的是
A.磷化硼属于混合晶体
B.磷化硼晶体中存在配位键
C.磷化硼晶体在熔融状态下可作离子导体
D.磷化硼晶体中微粒的空间堆积方式与氯化钠相同
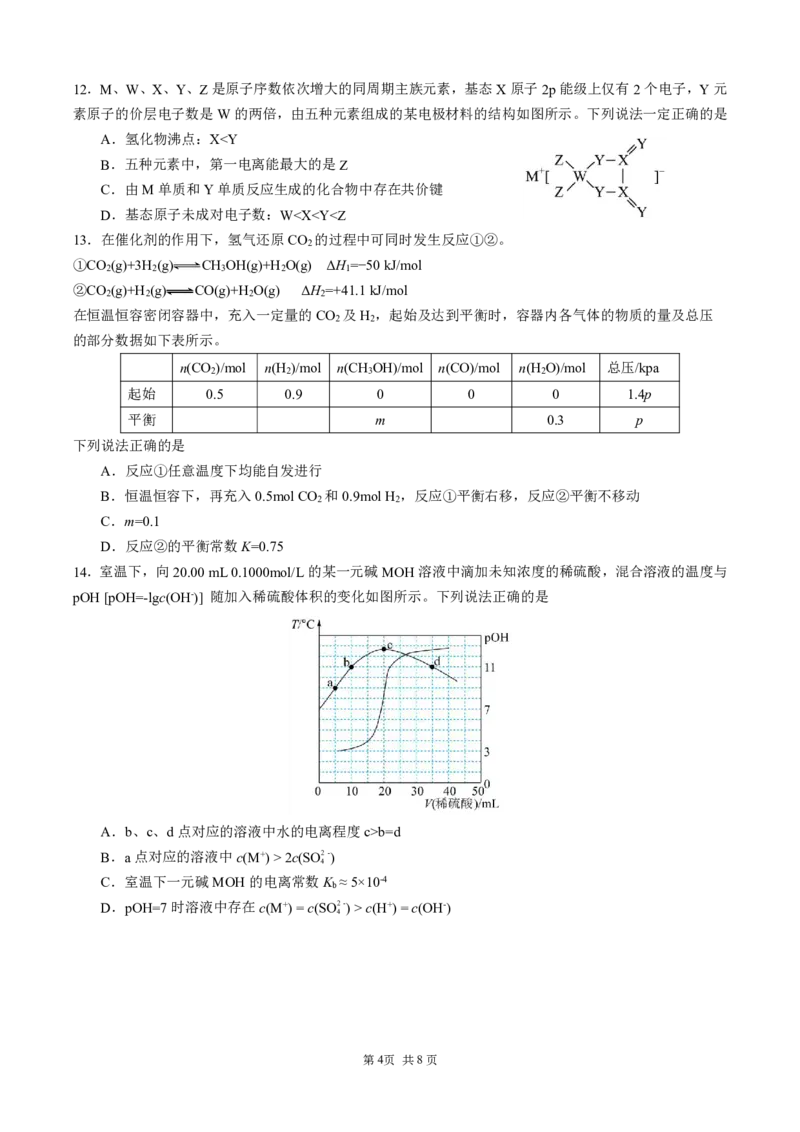
第2页 共8页9.研究人员合成了一种重要的高分子材料丙,其合成路线如下:
下列说法正确的是
A.1mol甲与浓溴水反应,最多消耗1molBr
2
B.反应①为加成反应,反应②为加聚反应
C.丙分子可以发生水解反应重新生成乙分子和甲分子
D.若用18O标记甲分子中的O原子,则丙分子中一定含有18O
10.下列方案设计、现象和结论均正确的是
选项 目的 方案设计 现象和结论
证明氯与碳的
A 取适量盐酸加入NaHCO 溶液中 产生气泡,证明氯的非金属性比碳强
3
非金属性
取1mL无水乙醇,边振荡边加入3mL浓
乙醇消去产物 硫酸,再加入几片碎瓷片。连接好装置, 酸性高锰酸钾溶液褪色,证明乙醇消
B
的检验 迅速加热至170℃,将产生的气体通入酸 去反应有乙烯生成
性高锰酸钾溶液中
取适量Na SO 溶液于试管中,测定pH,
2 3
SO2-的水解过 pH变小,证明SO2-的水解过程为放
3 3
C 然后加热一段时间,再次测定该溶液的
程的热效应 热过程
pH
比较BaCO 与
3
将少量BaCl 溶液分别逐滴加入等浓度的 Na SO 溶液中先出现沉淀,证明
2 2 4
D BaSO 的K 大
4 sp
Na CO 溶液和Na SO 溶液中 Ksp(BaCO )>Ksp(BaSO )
2 3 2 4 3 4
小
11.微生物电池可用来处理废水中的对氯苯酚,工作原理如图所示。关于该电池的说法不
.
正
.
确
.
的是
A.a极是负极 B.对氯苯酚在电极上发生的反应是 +H++2e-= +Cl-
C.H+向b极迁移 D.若电路中通过0.4mole-,则消耗了0.1molCH COO-
3
第3页 共8页12.M、W、X、Y、Z是原子序数依次增大的同周期主族元素,基态X原子2p能级上仅有2个电子,Y元
素原子的价层电子数是W的两倍,由五种元素组成的某电极材料的结构如图所示。下列说法一定正确的是
A.氢化物沸点:Xb=d
B.a点对应的溶液中c(M+)>2c(SO2-)
4
C.室温下一元碱MOH的电离常数K ≈5×10-4
b
D.pOH=7时溶液中存在c(M+)=c(SO2-)>c(H+)=c(OH-)
4
第4页 共8页二、填空题(本题包括 4小题,共 58分)
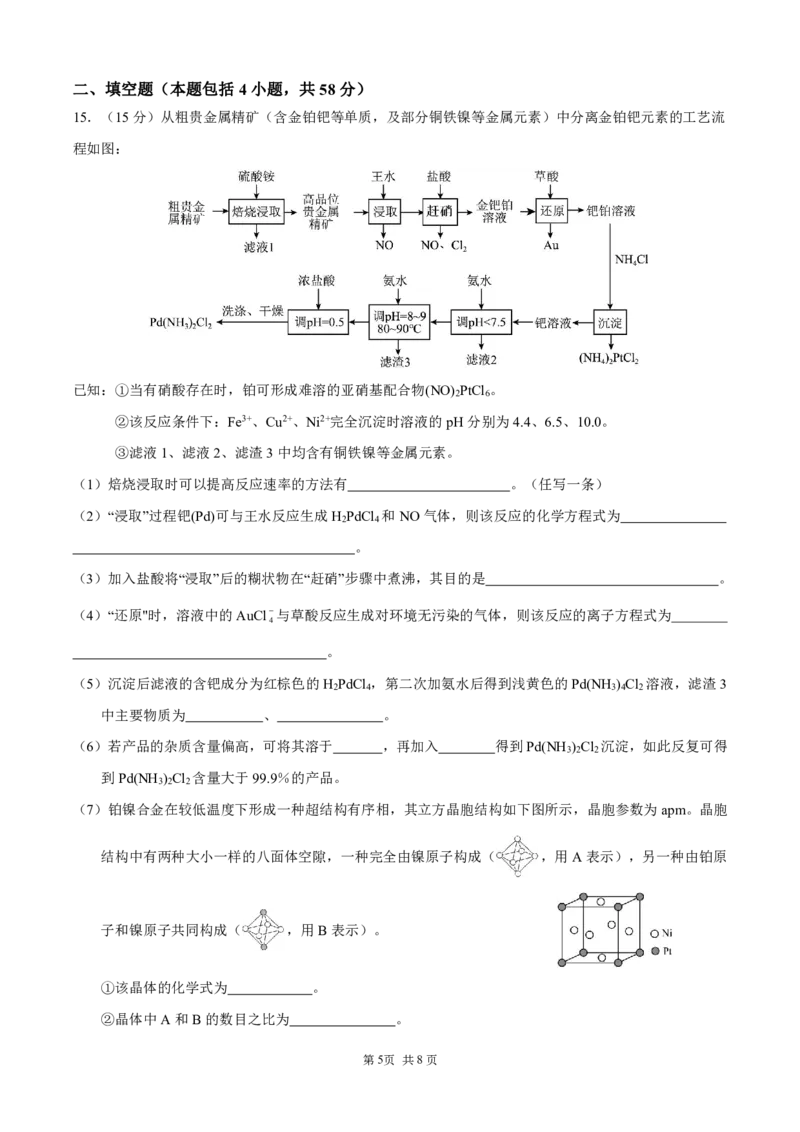
15.(15分)从粗贵金属精矿(含金铂钯等单质,及部分铜铁镍等金属元素)中分离金铂钯元素的工艺流
程如图:
已知:①当有硝酸存在时,铂可形成难溶的亚硝基配合物(NO) PtCl 。
2 6
②该反应条件下:Fe3+、Cu2+、Ni2+完全沉淀时溶液的pH分别为4.4、6.5、10.0。
③滤液1、滤液2、滤渣3中均含有铜铁镍等金属元素。
(1)焙烧浸取时可以提高反应速率的方法有 。(任写一条)
(2)“浸取”过程钯(Pd)可与王水反应生成H PdCl 和NO气体,则该反应的化学方程式为
2 4
。
(3)加入盐酸将“浸取”后的糊状物在“赶硝”步骤中煮沸,其目的是 。
(4)“还原"时,溶液中的AuCl与草酸反应生成对环境无污染的气体,则该反应的离子方程式为
4
。
(5)沉淀后滤液的含钯成分为红棕色的H PdCl ,第二次加氨水后得到浅黄色的Pd(NH ) Cl 溶液,滤渣3
2 4 3 4 2
中主要物质为 、 。
(6)若产品的杂质含量偏高,可将其溶于 ,再加入 得到Pd(NH ) Cl 沉淀,如此反复可得
3 2 2
到Pd(NH ) Cl 含量大于99.9%的产品。
3 2 2
(7)铂镍合金在较低温度下形成一种超结构有序相,其立方晶胞结构如下图所示,晶胞参数为apm。晶胞
结构中有两种大小一样的八面体空隙,一种完全由镍原子构成( ,用A表示),另一种由铂原
子和镍原子共同构成( ,用B表示)。
①该晶体的化学式为 。
②晶体中A和B的数目之比为 。
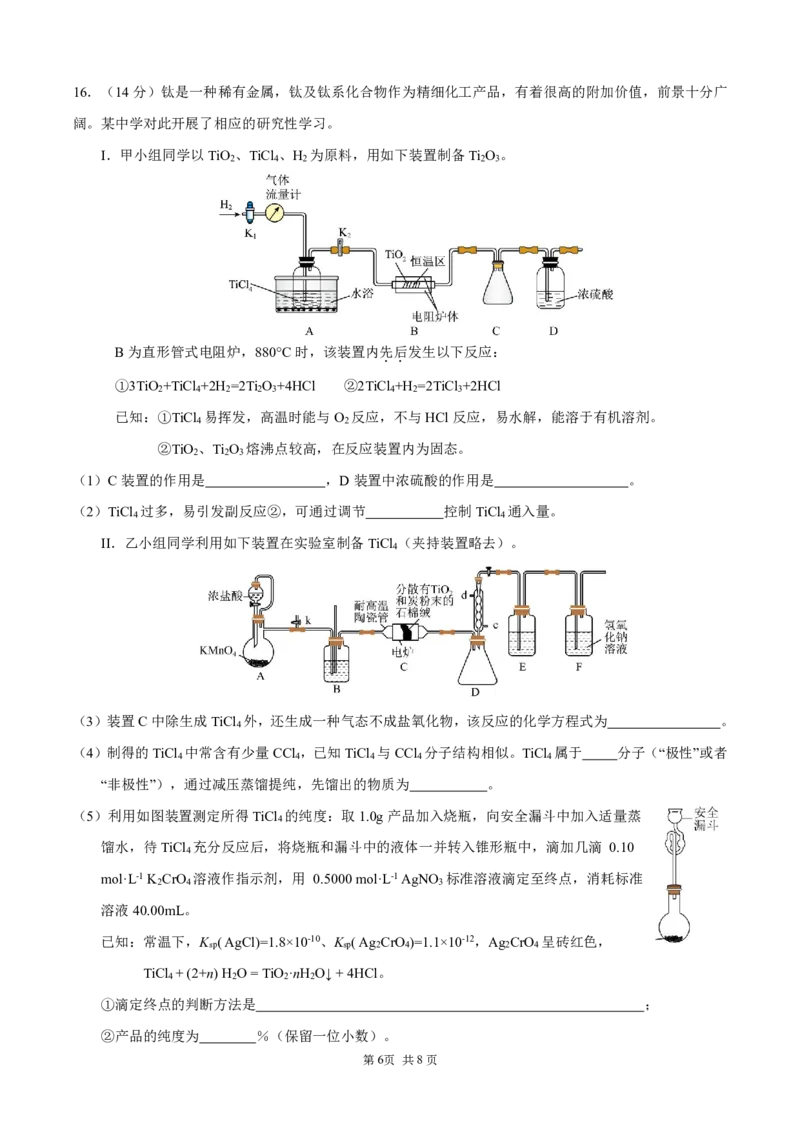
第5页 共8页16.(14分)钛是一种稀有金属,钛及钛系化合物作为精细化工产品,有着很高的附加价值,前景十分广
阔。某中学对此开展了相应的研究性学习。
I.甲小组同学以TiO 、TiCl 、H 为原料,用如下装置制备Ti O 。
2 4 2 2 3
B为直形管式电阻炉,880°C时,该装置内先
.
后
.
发生以下反应:
①3TiO +TiCl +2H =2Ti O +4HCl ②2TiCl +H =2TiCl +2HCl
2 4 2 2 3 4 2 3
已知:①TiCl 易挥发,高温时能与O 反应,不与HCl反应,易水解,能溶于有机溶剂。
4 2
②TiO 、Ti O 熔沸点较高,在反应装置内为固态。
2 2 3
(1)C装置的作用是 ,D装置中浓硫酸的作用是 。
(2)TiCl 过多,易引发副反应②,可通过调节 控制TiCl 通入量。
4 4
II.乙小组同学利用如下装置在实验室制备TiCl (夹持装置略去)。
4
(3)装置C中除生成TiCl 外,还生成一种气态不成盐氧化物,该反应的化学方程式为 。
4
(4)制得的TiCl 中常含有少量CCl ,已知TiCl 与CCl 分子结构相似。TiCl 属于 分子(“极性”或者
4 4 4 4 4
“非极性”),通过减压蒸馏提纯,先馏出的物质为 。
(5)利用如图装置测定所得TiCl 的纯度:取1.0g产品加入烧瓶,向安全漏斗中加入适量蒸
4
馏水,待TiCl 充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴 0.10
4
mol·L-1K CrO 溶液作指示剂,用 0.5000mol·L-1AgNO 标准溶液滴定至终点,消耗标准
2 4 3
溶液40.00mL。
已知:常温下,K (AgCl)=1.8×10-10、K (Ag CrO )=1.1×10-12,Ag CrO 呈砖红色,
sp sp 2 4 2 4
TiCl +(2+n)H O=TiO ·nH O↓+4HCl。
4 2 2 2
①滴定终点的判断方法是 ;
②产品的纯度为 %(保留一位小数)。
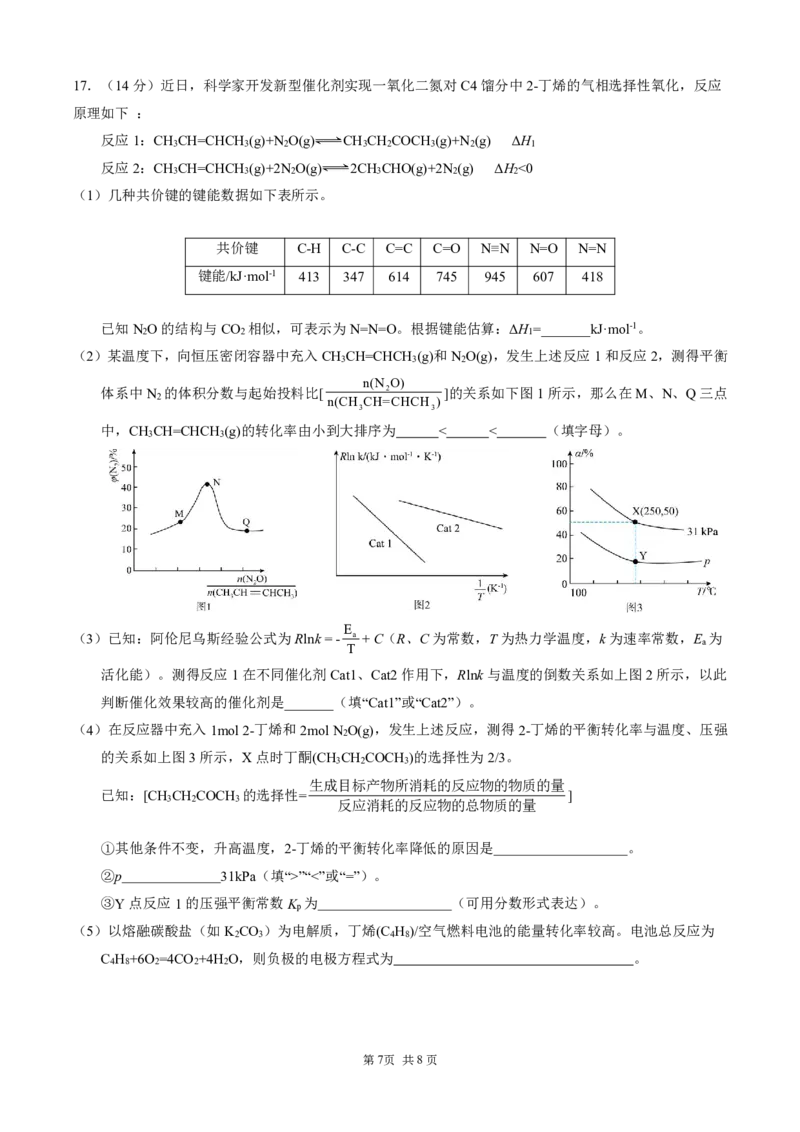
第6页 共8页17.(14分)近日,科学家开发新型催化剂实现一氧化二氮对C4馏分中2-丁烯的气相选择性氧化,反应
原理如下 :
反应1:CH CH=CHCH (g)+N O(g) CH CH COCH (g)+N (g) ΔH
3 3 2 3 2 3 2 1
反应2:CH CH=CHCH (g)+2N O(g) 2CH CHO(g)+2N (g) ΔH <0
3 3 2 3 2 2
(1)几种共价键的键能数据如下表所示。
共价键 C-H C-C C=C C=O N≡N N=O N=N
键能/kJ·mol-1 413 347 614 745 945 607 418
已知N O的结构与CO 相似,可表示为N=N=O。根据键能估算:ΔH =_______kJ·mol-1。
2 2 1
(2)某温度下,向恒压密闭容器中充入CH CH=CHCH (g)和N O(g),发生上述反应1和反应2,测得平衡
3 3 2
n(N O)
体系中N 的体积分数与起始投料比[ 2 ]的关系如下图1所示,那么在M、N、Q三点
2 n(CH CH=CHCH )
3 3
中,CH CH=CHCH (g)的转化率由小到大排序为 < < (填字母)。
3 3
E
(3)已知:阿伦尼乌斯经验公式为Rlnk=- a +C(R、C为常数,T为热力学温度,k为速率常数,E 为
a
T
活化能)。测得反应1在不同催化剂Cat1、Cat2作用下,Rlnk与温度的倒数关系如上图2所示,以此
判断催化效果较高的催化剂是_______(填“Cat1”或“Cat2”)。
(4)在反应器中充入1mol2-丁烯和2molN O(g),发生上述反应,测得2-丁烯的平衡转化率与温度、压强
2
的关系如上图3所示,X点时丁酮(CH CH COCH )的选择性为2/3。
3 2 3
生成目标产物所消耗的反应物的物质的量
已知:[CH CH COCH 的选择性= ]
3 2 3 反应消耗的反应物的总物质的量
①其他条件不变,升高温度,2-丁烯的平衡转化率降低的原因是 。
②p 31kPa(填“>”“<”或“=”)。
③Y点反应1的压强平衡常数K 为 (可用分数形式表达)。
p
(5)以熔融碳酸盐(如K CO )为电解质,丁烯(C H )/空气燃料电池的能量转化率较高。电池总反应为
2 3 4 8
C H +6O =4CO +4H O,则负极的电极方程式为 。
4 8 2 2 2
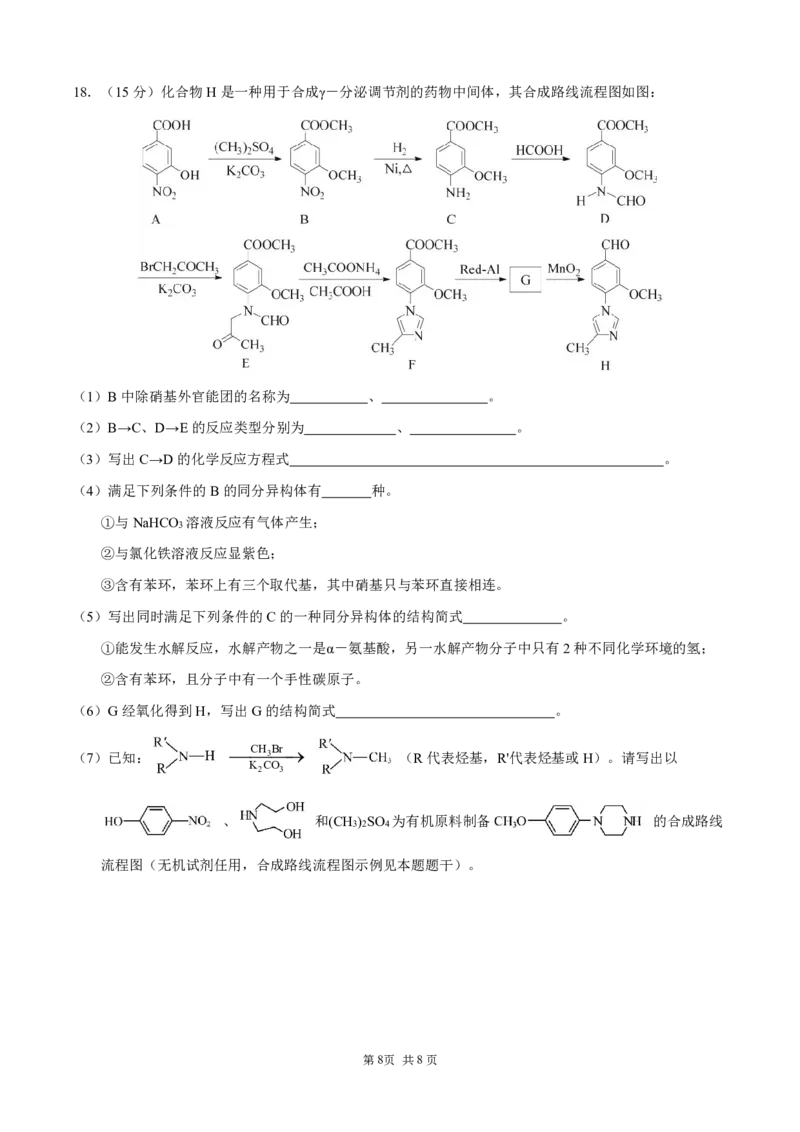
第7页 共8页18.(15分)化合物H是一种用于合成γ-分泌调节剂的药物中间体,其合成路线流程图如图:
(1)B中除硝基外官能团的名称为 、 。
(2)B→C、D→E的反应类型分别为 、 。
(3)写出C→D的化学反应方程式 。
(4)满足下列条件的B的同分异构体有 种。
①与NaHCO 溶液反应有气体产生;
3
②与氯化铁溶液反应显紫色;
③含有苯环,苯环上有三个取代基,其中硝基只与苯环直接相连。
(5)写出同时满足下列条件的C的一种同分异构体的结构简式 。
①能发生水解反应,水解产物之一是α-氨基酸,另一水解产物分子中只有2种不同化学环境的氢;
②含有苯环,且分子中有一个手性碳原子。
(6)G经氧化得到H,写出G的结构简式 。
(7)已知:
CH
3
Br
(R代表烃基,R'代表烃基或H)。请写出以
K CO
2 3
、 和(CH ) SO 为有机原料制备 的合成路线
3 2 4
流程图(无机试剂任用,合成路线流程图示例见本题题干)。
第8页 共8页