文档内容
2023~2024 学年度下学期六校高二期末联考试卷
化 学
考生注意:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间75分钟。
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用 2B铅笔把答题卡上
对应题目的答案标号涂黑;非选择题请用直径 0.5毫米黑色墨水签字笔在答题卡上各题的答
题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
4.本卷命题范围:人教版选择性必修2、3。
5.可能用到的相对原子质量:H1 C12 O16 Na23 Al27 Si28 Cl35.5 Br80 I127
一、选择题:本大题共 15小题,每小题3分,共45分。在每小题给出的四个选项中,只有
一项是符合题目要求的。
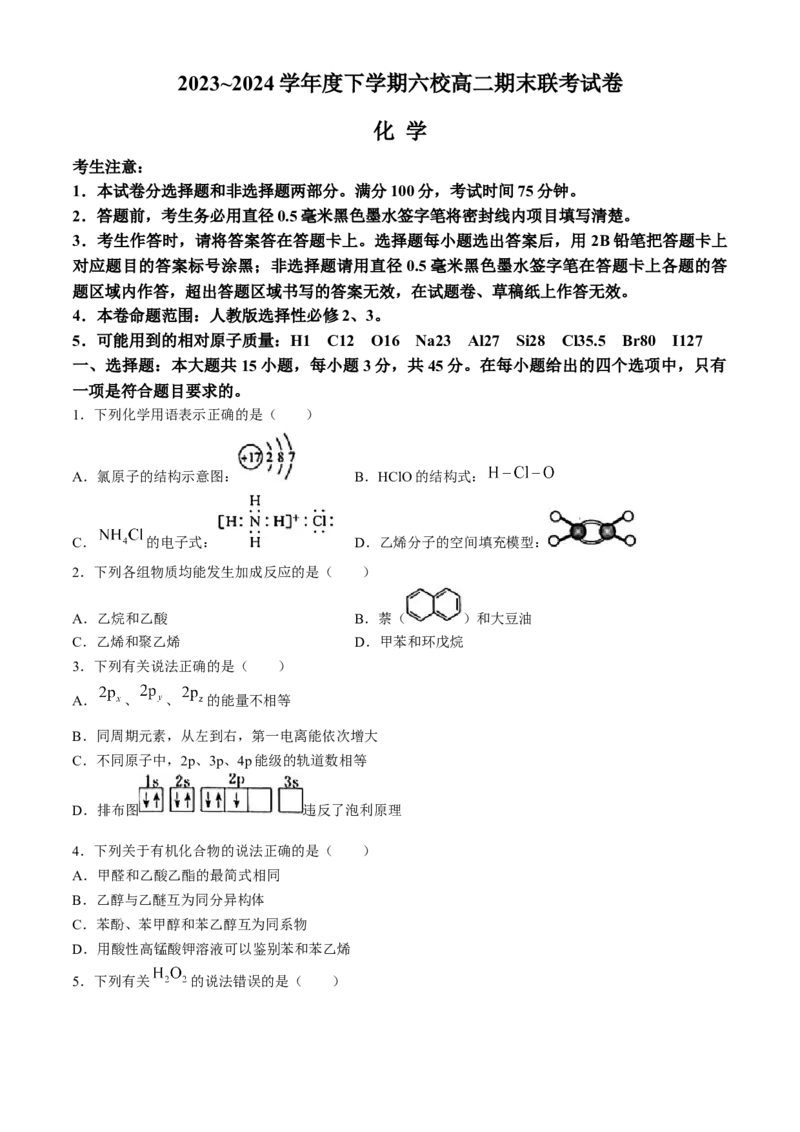
1.下列化学用语表示正确的是( )
A.氯原子的结构示意图: B.HClO的结构式:
C. 的电子式: D.乙烯分子的空间填充模型:
2.下列各组物质均能发生加成反应的是( )
A.乙烷和乙酸 B.萘( )和大豆油
C.乙烯和聚乙烯 D.甲苯和环戊烷
3.下列有关说法正确的是( )
A. 、 、 的能量不相等
B.同周期元素,从左到右,第一电离能依次增大
C.不同原子中,2p、3p、4p能级的轨道数相等
D.排布图 违反了泡利原理
4.下列关于有机化合物的说法正确的是( )
A.甲醛和乙酸乙酯的最简式相同
B.乙醇与乙醚互为同分异构体
C.苯酚、苯甲醇和苯乙醇互为同系物
D.用酸性高锰酸钾溶液可以鉴别苯和苯乙烯
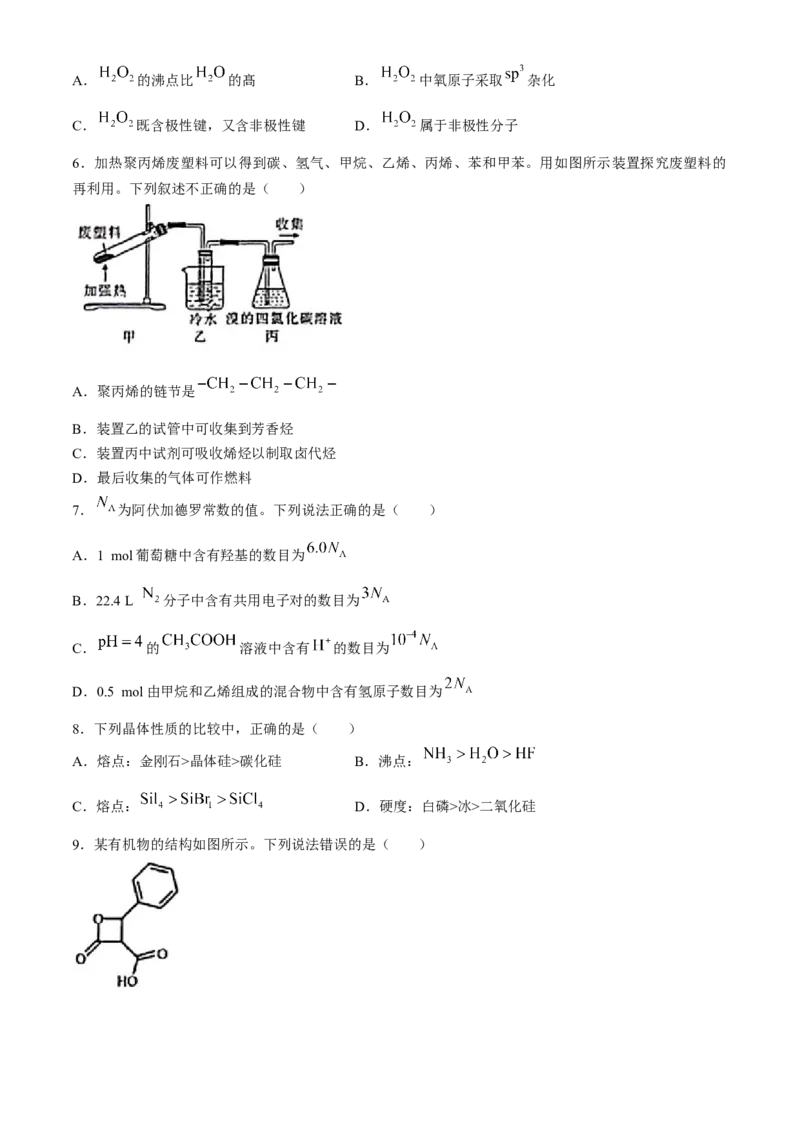
5.下列有关 的说法错误的是( )A. 的沸点比 的髙 B. 中氧原子采取 杂化
C. 既含极性键,又含非极性键 D. 属于非极性分子
6.加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯。用如图所示装置探究废塑料的
再利用。下列叙述不正确的是( )
A.聚丙烯的链节是
B.装置乙的试管中可收集到芳香烃
C.装置丙中试剂可吸收烯烃以制取卤代烃
D.最后收集的气体可作燃料
7. 为阿伏加德罗常数的值。下列说法正确的是( )
A.1 mol葡萄糖中含有羟基的数目为
B.22.4 L 分子中含有共用电子对的数目为
C. 的 溶液中含有 的数目为
D.0.5 mol由甲烷和乙烯组成的混合物中含有氢原子数目为
8.下列晶体性质的比较中,正确的是( )
A.熔点:金刚石>晶体硅>碳化硅 B.沸点:
C.熔点: D.硬度:白磷>冰>二氧化硅
9.某有机物的结构如图所示。下列说法错误的是( )A.该有机物的分子式为
B.该有机物分子中所有原子共平面
C.1 mol该有机物最多与3 mol 发生加成反应
D.该有机物能发生加成、氧化和水解反应
10.观察下列两种物质的晶胞结构示意图,下列说法错误的是( )
A.Na位于元素周期表的s区
B.NaCl晶体属于离子晶体
C.图甲可知锂的某种氧化物的化学式为
D.图乙可知与每个 等距离且最近的 所围成的空间结构为正四面体
11.二缩三乙二醇(C)可用于制备新型的手机电池离子导体材料,其合成过程如图所示。下列说法错误
的是( )
A.C的分子式为 B.A的结构简式为
C.1个B分子中含有2个羟基 D.反应Ⅰ、Ⅱ的原子利用率小于100%
12.W、X、Y、Z是周期表中前20号原子序数依次增大的的主族元素,部分性质如下表,下列说法正确
的是( )
W 某种单质被称为地球生物的保护伞
X X、W形成的化合物中阴阳离子个数比为1∶2
Y Y的最外层电子数是X、W的最外层电子数之和
Z X和Z不在同一主族
A.Z的单质能与水反应生成氢气 B.简单离子半径:Z>Y>X>W
C.X的最高价氧化物对应水化物为弱碱 D.W分别与X、Y、Z形成的化合物均有离子键
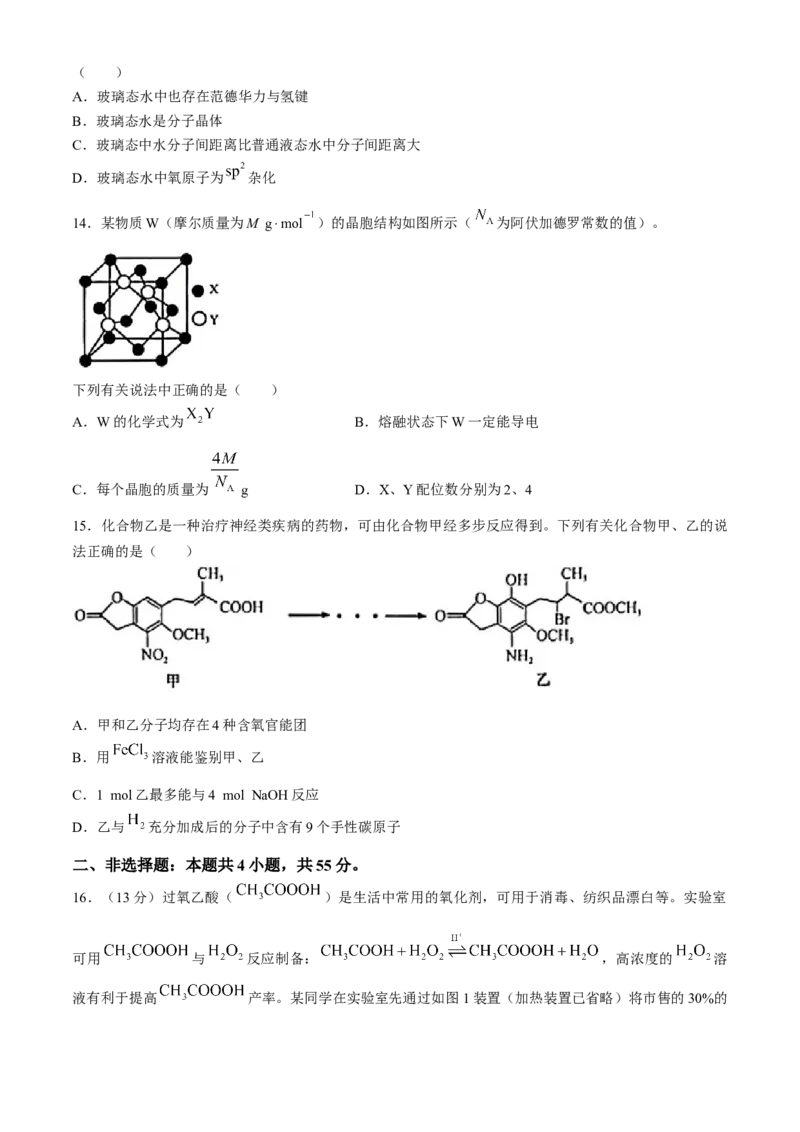
13.水是生命之源,水的状态除了气、液、固之外,还有玻璃态。玻璃态水是由液态水急速冷却到-
108℃时形成的一种无定形状态,其密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是( )
A.玻璃态水中也存在范德华力与氢键
B.玻璃态水是分子晶体
C.玻璃态中水分子间距离比普通液态水中分子间距离大
D.玻璃态水中氧原子为 杂化
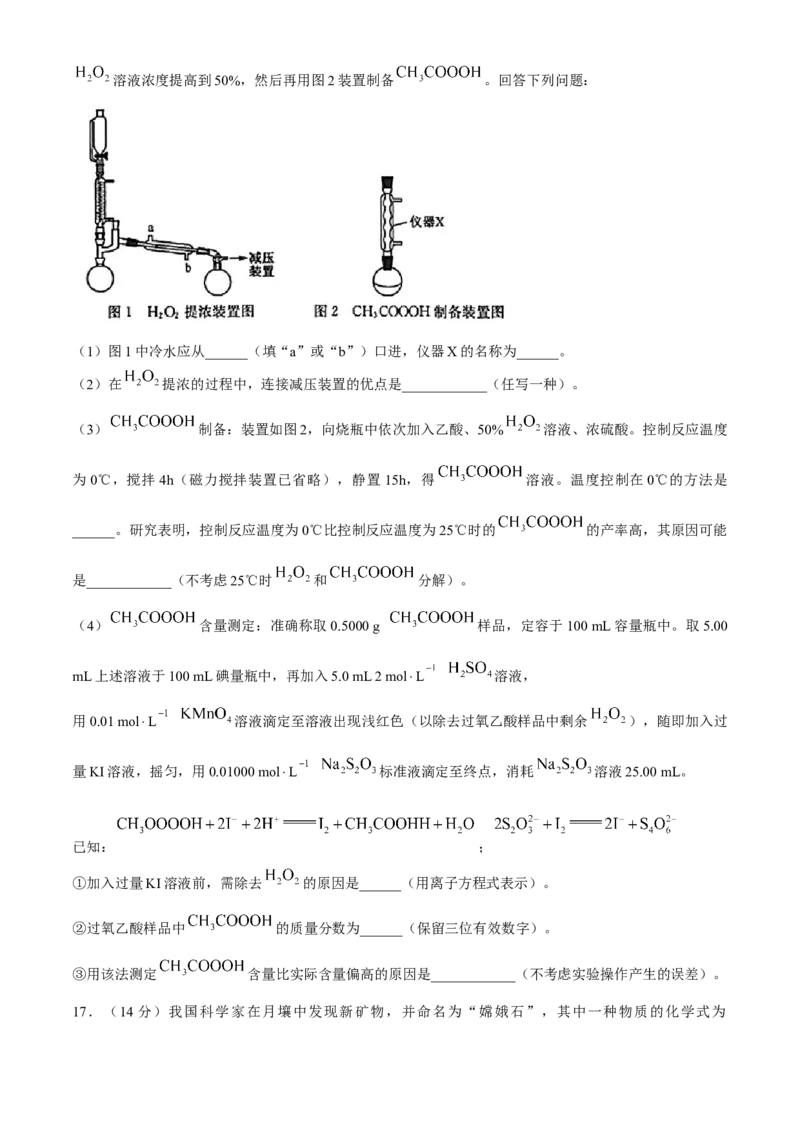
14.某物质W(摩尔质量为M g⋅mol )的晶胞结构如图所示( 为阿伏加德罗常数的值)。
下列有关说法中正确的是( )
A.W的化学式为 B.熔融状态下W一定能导电
C.每个晶胞的质量为 g D.X、Y配位数分别为2、4
15.化合物乙是一种治疗神经类疾病的药物,可由化合物甲经多步反应得到。下列有关化合物甲、乙的说
法正确的是( )
A.甲和乙分子均存在4种含氧官能团
B.用 溶液能鉴别甲、乙
C.1 mol乙最多能与4 mol NaOH反应
D.乙与 充分加成后的分子中含有9个手性碳原子
二、非选择题:本题共4小题,共55分。
16.(13分)过氧乙酸( )是生活中常用的氧化剂,可用于消毒、纺织品漂白等。实验室
可用 与 反应制备: ,高浓度的 溶
液有利于提高 产率。某同学在实验室先通过如图1装置(加热装置已省略)将市售的30%的溶液浓度提高到50%,然后再用图2装置制备 。回答下列问题:
(1)图1中冷水应从______(填“a”或“b”)口进,仪器X的名称为______。
(2)在 提浓的过程中,连接减压装置的优点是____________(任写一种)。
(3) 制备:装置如图2,向烧瓶中依次加入乙酸、50% 溶液、浓硫酸。控制反应温度
为0℃,搅拌4h(磁力搅拌装置已省略),静置15h,得 溶液。温度控制在0℃的方法是
______。研究表明,控制反应温度为0℃比控制反应温度为25℃时的 的产率高,其原因可能
是____________(不考虑25℃时 和 分解)。
(4) 含量测定:准确称取0.5000 g 样品,定容于100 mL容量瓶中。取5.00
mL上述溶液于100 mL碘量瓶中,再加入5.0 mL 2 mol⋅L 溶液,
用0.01 mol⋅L 溶液滴定至溶液出现浅红色(以除去过氧乙酸样品中剩余 ),随即加入过
量KI溶液,摇匀,用0.01000 mol⋅L 标准液滴定至终点,消耗 溶液25.00 mL。
已知: ;
①加入过量KI溶液前,需除去 的原因是______(用离子方程式表示)。
②过氧乙酸样品中 的质量分数为______(保留三位有效数字)。
③用该法测定 含量比实际含量偏高的原因是____________(不考虑实验操作产生的误差)。
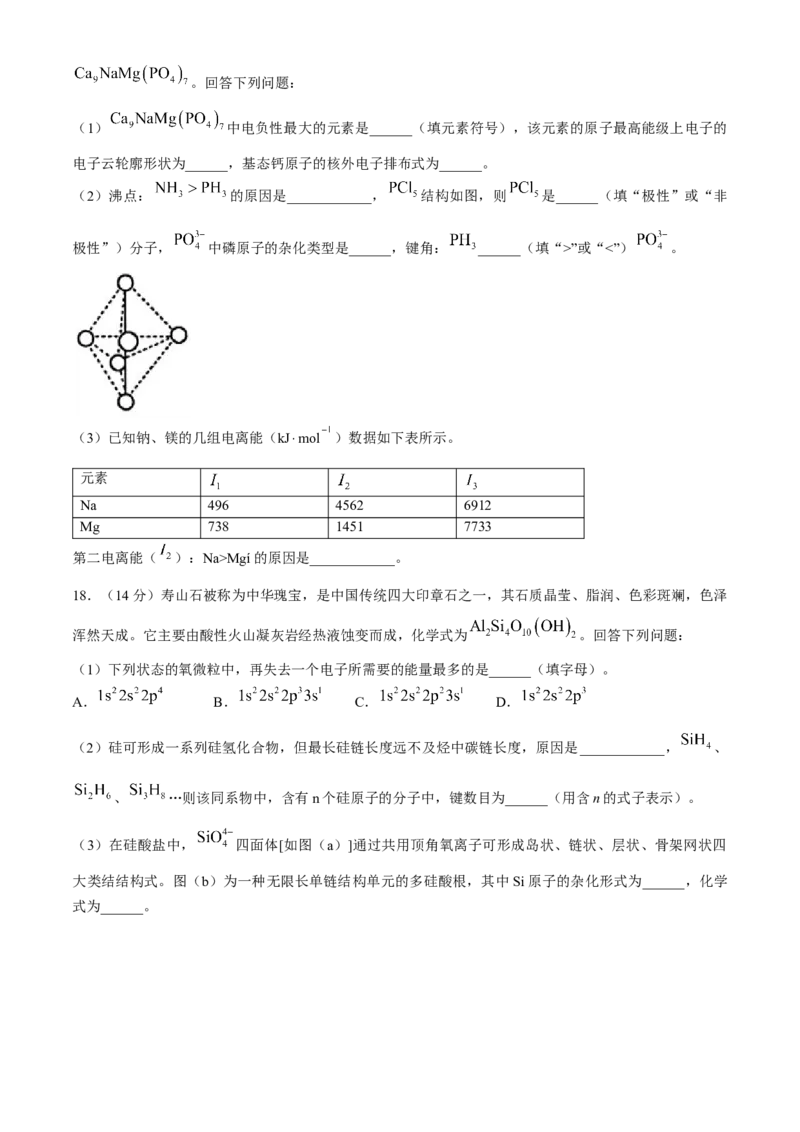
17.(14 分)我国科学家在月壤中发现新矿物,并命名为“嫦娥石”,其中一种物质的化学式为。回答下列问题:
(1) 中电负性最大的元素是______(填元素符号),该元素的原子最高能级上电子的
电子云轮廓形状为______,基态钙原子的核外电子排布式为______。
(2)沸点: 的原因是____________, 结构如图,则 是______(填“极性”或“非
极性”)分子, 中磷原子的杂化类型是______,键角: ______(填“>”或“<”) 。
(3)已知钠、镁的几组电离能(kJ⋅mol )数据如下表所示。
元素
Na 496 4562 6912
Mg 738 1451 7733
第二电离能( ):Na>Mgí的原因是____________。
18.(14分)寿山石被称为中华瑰宝,是中国传统四大印章石之一,其石质晶莹、脂润、色彩斑斓,色泽
浑然天成。它主要由酸性火山凝灰岩经热液蚀变而成,化学式为 。回答下列问题:
(1)下列状态的氧微粒中,再失去一个电子所需要的能量最多的是______(填字母)。
A. B. C. D.
(2)硅可形成一系列硅氢化合物,但最长硅链长度远不及烃中碳链长度,原因是____________, 、
、 …则该同系物中,含有n个硅原子的分子中,键数目为______(用含n的式子表示)。
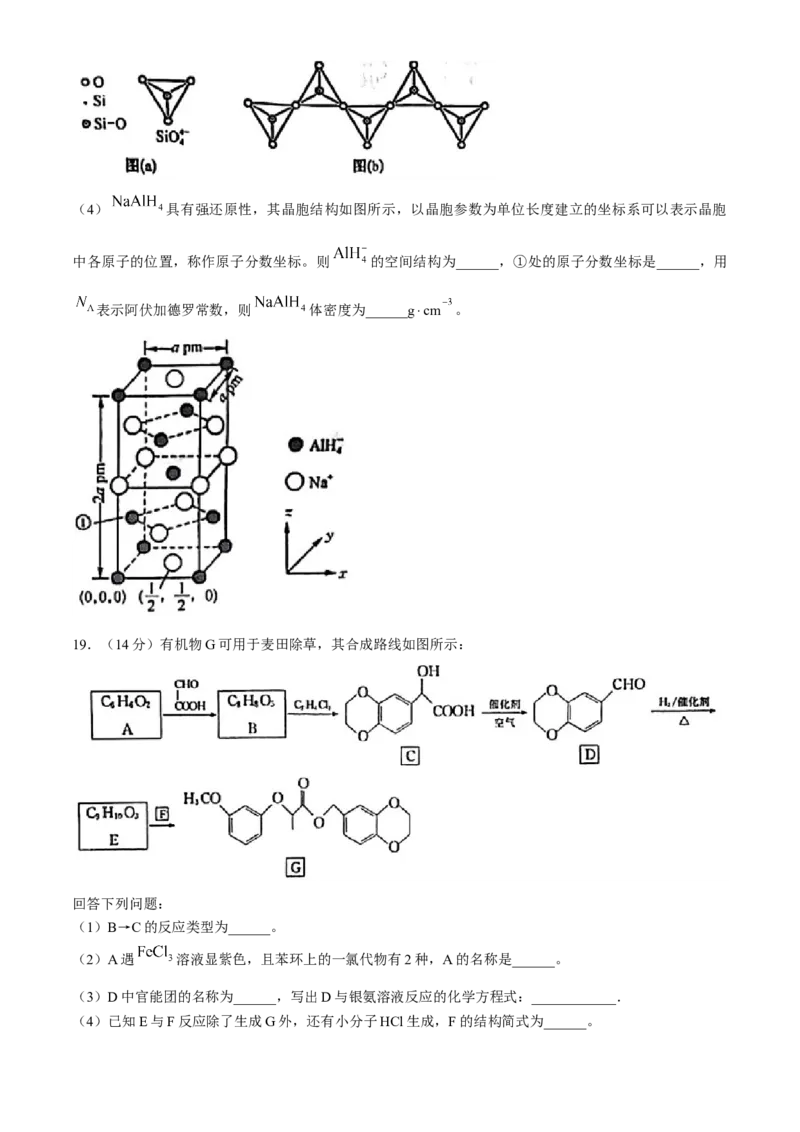
(3)在硅酸盐中, 四面体[如图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四
大类结结构式。图(b)为一种无限长单链结构单元的多硅酸根,其中Si原子的杂化形式为______,化学
式为______。(4) 具有强还原性,其晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞
中各原子的位置,称作原子分数坐标。则 的空间结构为______,①处的原子分数坐标是______,用
表示阿伏加德罗常数,则 体密度为______g⋅cm 。
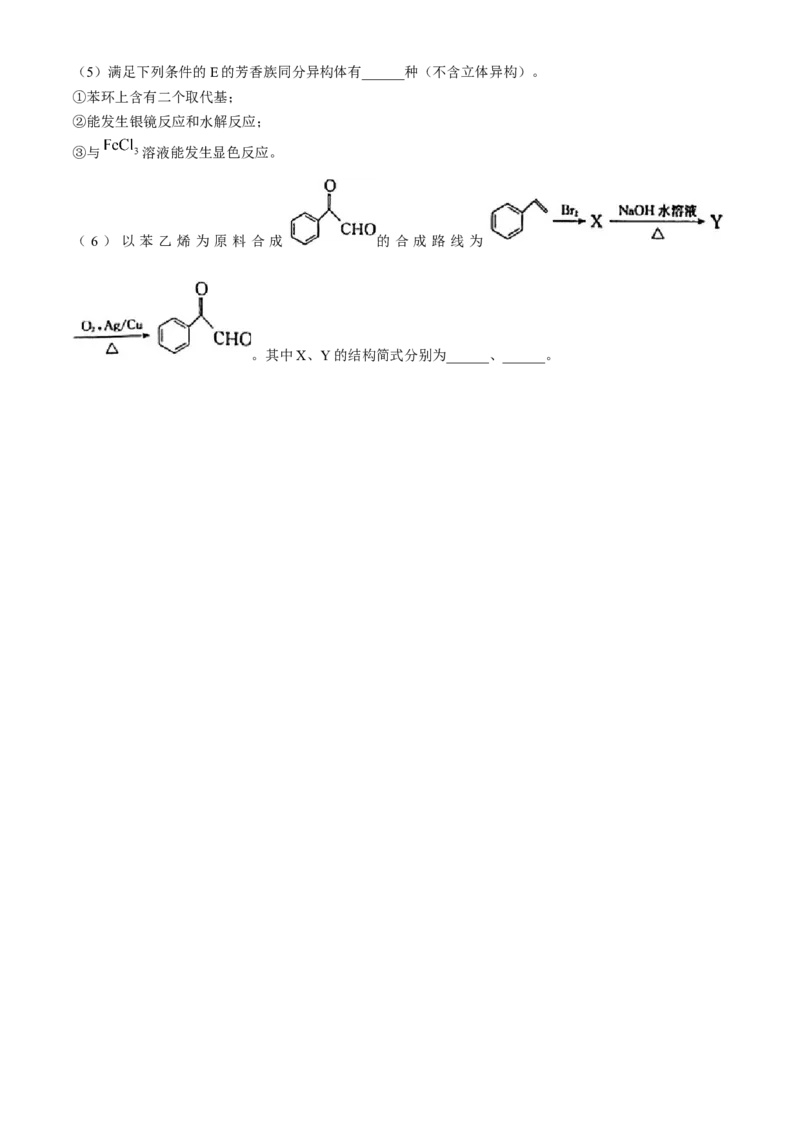
19.(14分)有机物G可用于麦田除草,其合成路线如图所示:
回答下列问题:
(1)B→C的反应类型为______。
(2)A遇 溶液显紫色,且苯环上的一氯代物有2种,A的名称是______。
(3)D中官能团的名称为______,写出D与银氨溶液反应的化学方程式:____________.
(4)已知E与F反应除了生成G外,还有小分子HCl生成,F的结构简式为______。(5)满足下列条件的E的芳香族同分异构体有______种(不含立体异构)。
①苯环上含有二个取代基;
②能发生银镜反应和水解反应;
③与 溶液能发生显色反应。
( 6 ) 以 苯 乙 烯 为 原 料 合 成 的 合 成 路 线 为
。其中X、Y的结构简式分别为______、______。2023~2024 学年度下学期六校高二期末联考试卷•化学
参考答案、提示及评分细则
1.A 氯原子的结构示意图为 ,A项正确;HClO的结构式为 ,B项错误;
的电子式为 ,C项错误; 为乙烯的球棍模型,乙烯的比例模型为
,D项错误。
2.B 乙烷和乙酸均不能发生加成反应,A项错误;萘中苯环能被H₂等加成,大豆油中含有碳碳双键,B
项正确;聚乙烯中无双键,不能发生加成反应,C项错误;环戊烷不能发生加成反应,D项错误。
3.C 、 、 能量相等,A项错误;电子排布时,处于半满或全满时稳定,所以第一电离能:
,B项错误;2p、3p、4p能级的轨道数均为3,C项正确;违反洪特规则,D项错误。
4.D 甲醛和乙酸乙酯的最简式不相同,A项错误;乙醚有4个碳原子,乙醇有2个碳原子,B项错误;
苯酚与苯
甲醇和苯乙醇不属于同类物质,C项错误;苯不能使酸性高锰酸钾溶液褪色,而苯乙烯能,D项正确。
5.D 1 mol 可形成3 mol氢键, 只能形成2 mol氢键,分子间可形成的氢键数目越多,沸点越
高,A项正确; 中两个氧原子均为 杂化,B项正确; 中既含有极性键,又含有非极性键,
C项正确; 为极性分子,D项错误。
6.A 聚丙烯的链节是 ,A项不正确;加热聚丙烯废塑料可以得到芳香烃,如苯和甲
苯,B项正确;烯烃可与溴单质发生加成反应生成溴代烃,C项正确;最后收集的气体为氢气和甲烷,可
作燃料,D项正确。
7.D 葡萄糖是五羟基醛,1 mol葡萄糖中含有羟基数目为 ,A项错误;状态未知,无法计算,B
项错误;溶液的体积未知,无法计算,C项错误;0.5 mol由甲烷和乙烯组成的混合物中含氢原子数目为
,D项正确。
8.C 由 、 、 键的键能和键长可判断熔点:金刚石>碳化硅>晶体硅,A项错误;沸点:, B 项 错 误 ; 由 、 、 的 相 对 分 子 质 量 可 判 断 熔 点 :
,C项正确;二氧化硅是共价晶体,硬度大,白磷和冰都是分子晶体,硬度小,D项
错误。
9.B该有机物的分子式为 ,A项正确;该有机物分子中含有饱和碳原子,所有原子不可能共平
面,B项错误;1 mol该有机物最多与3 mol 发生加成反应,C项正确;该有机物能发生加成、氧化和
水解反应,D项正确。
10.D NaCl晶体中,与 等距离且最近的 所围成的空间结构为正八面体,D项错误。
11.D 由C的结构简式可知,其分子式为 ,A项正确;A的结构简式为 ,B项正确;
B的结构简式为 ,1个该分子中含有2个羟基,C项正确;反应物中的原子
全部进入生成物中,反应Ⅰ、Ⅱ中原子利用率均为100%,D项错误。
12.A W、X、Y、Z分别为O、Na、Cl、Ca。在金属活动顺序表中,钙在钠前,所以钙能与水反应生成
氢气,A项正确;离子半径: ,B项错误;NaOH为强碱,C项错误;O和Cl形
成的化合物不含离子键,D项错误。
13.A 普通水变成玻璃态水属于物理过程,水的分子组成不变,A项正确;玻璃态属于无定形物质,B项
错误;由玻璃态水“密度与普通液态水的密度相同”知,两种状态的水中分子间距离相同,C项错误;水
中氧原子均为 杂化,D项错误。
14.C 由图知X位于顶点与面上,Y位于晶胞内,由均摊法可求出一个晶胞中含有4个X、4个Y,化学
式为 XY(或 YX),A项错误;不能确定 W是离子晶体,B 项错误;晶胞中 mol,故
g,C项正确;由晶胞图知,每个Y周围存在四个等距离且最近的X,即Y的配位数是4,
故X的配位数也是4,D项错误。
15.B 甲分子中存在羧基、酯基、硝基和醚键四种含氧官能团,乙分子中存在羟基、酯基和醚键三种含氧
官能团,A项错误;乙分子中含有酚羟基,能使 溶液显紫色,甲分子中无酚羟基,B项正确;1 mol乙最多能与5 mol NaOH反应(左侧1个酯基与2个NaOH反应),C项错误;乙分子中酯基不能与 发
生加成,反应后分子中含有8个手性碳原子,D项错误。
16.(1)b;(球形)冷凝管(各1分)
(2)降低提浓时的温度、提高提浓时的速率、减少提浓时 的分解等(任答1点,2分)
(3)冰水浴(1分);制备 的反应放热,温度低,有利于生成 (2分)
(4)① (2分)
②38.0%(2分)
③过量的 氧化 生成 或在酸性溶液中 会被空气中氧气氧化为 等,合理即可(2分)
17.(1)O(2分);哑铃形或纺锤形(1分); (或其他合理形式,2分)
(2) 分子间存在氢键而 分子间不存在氢键(2分);非极性分子(1分); (2分);<(2
分)
(3)钠失去第二个电子时,其能级电子排布由稳定的 转化为不稳定的 ,需要消耗较多的能量(2
分)
18.(1)D(2分)
(2)硅的原子半径比碳的原子半径大,硅硅键键能小于碳碳键键能,稳定性较差; (各2分)
(3) (1分); (或 )(2分)
(4)正四面体(2分); (1分); (2分)
19.(1)取代反应(1分)
(2)邻苯二酚或1,2-苯二酚(1分)
( 3 ) 醚 键 、 醛 基 ;
(各2分)
(4) (2分)
(5)6(2分)(6) ; (各2分)