文档内容
第五章 化工生产中的重要非金属元素
第2节 氮及其化合物
(第3课时 硝酸、酸雨及防治 )
一、选择题
1.氮元素被氧化的反应是
A.工业合成氨 B.实验室检验
C.常温下浓硝酸使铁钝化 D.闪电时空气中产生NO
【答案】D
【详解】
A.工业上是用N 与H 在高温、高压、催化剂条件下合成氨,在该反应过程中N元素化合
2 2
价降低,得到电子被还原,A不符合题意;
B.实验室检验 的方法是将铵盐与碱共热发生复分解反应产生NH ,根据NH 能够使
3 3
湿润的红色石蕊试纸变为蓝色检验,在这个过程中元素化合价不变,因此没有发生氧化还
原反应,B不符合题意;
C.常温下浓硝酸使铁钝化,是浓硝酸将铁氧化为Fe O,浓硝酸中的N得到电子被还原为
3 4
NO 气体,氮元素发生的是还原反应,C不符合题意;
2
D.闪电时空气中N 与O 在电火花作用下产生NO,N元素化合价升高,失去电子被氧化,
2 2
D符合题意;
故合理选项是D。
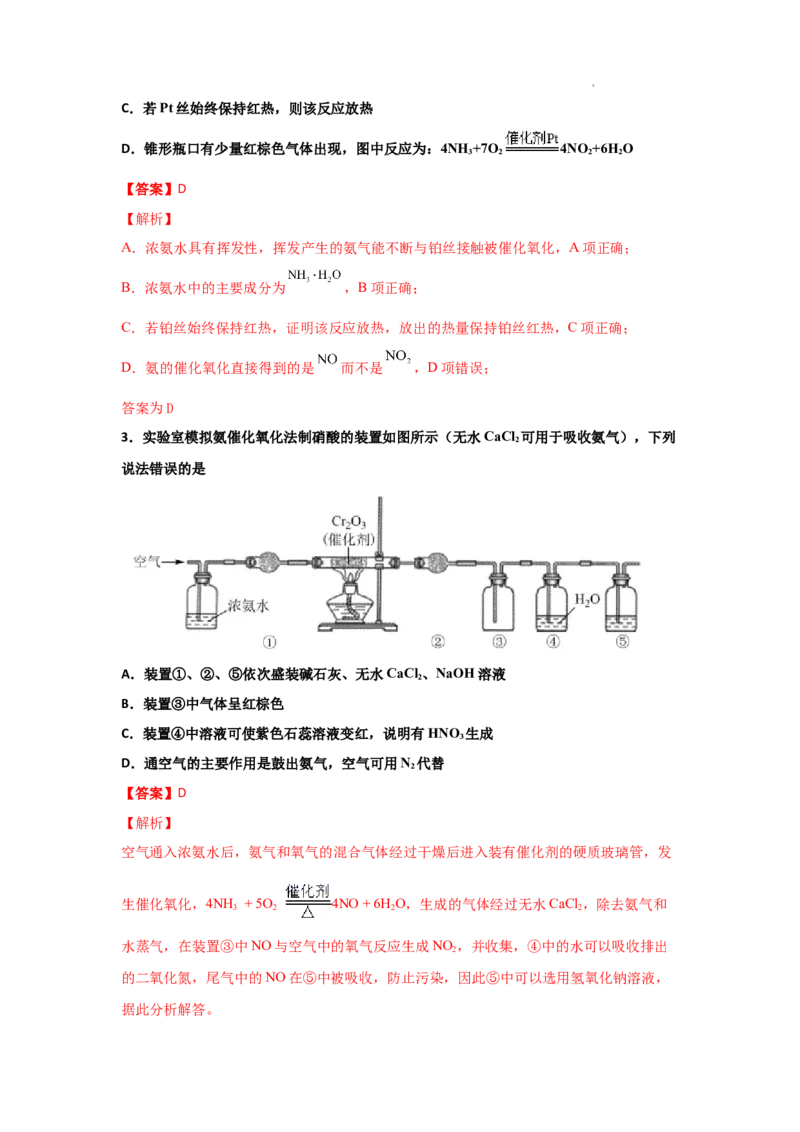
2.氨能被氧气氧化,经一系列反应得到硝酸。分析如图实验所得结论错误的是( )
A.浓氨水具有挥发性
B.浓氨水中含有NH •HO
3 2C.若Pt丝始终保持红热,则该反应放热
D.锥形瓶口有少量红棕色气体出现,图中反应为:4NH +7O 4NO +6H O
3 2 2 2
【答案】D
【解析】
A.浓氨水具有挥发性,挥发产生的氨气能不断与铂丝接触被催化氧化,A项正确;
B.浓氨水中的主要成分为 ,B项正确;
C.若铂丝始终保持红热,证明该反应放热,放出的热量保持铂丝红热,C项正确;
D.氨的催化氧化直接得到的是 而不是 ,D项错误;
答案为D
3.实验室模拟氨催化氧化法制硝酸的装置如图所示(无水CaCl 可用于吸收氨气),下列
2
说法错误的是
A.装置①、②、⑤依次盛装碱石灰、无水CaCl 、NaOH溶液
2
B.装置③中气体呈红棕色
C.装置④中溶液可使紫色石蕊溶液变红,说明有HNO 生成
3
D.通空气的主要作用是鼓出氨气,空气可用N 代替
2
【答案】D
【解析】
空气通入浓氨水后,氨气和氧气的混合气体经过干燥后进入装有催化剂的硬质玻璃管,发
生催化氧化,4NH + 5O 4NO + 6H O,生成的气体经过无水CaCl ,除去氨气和
3 2 2 2
水蒸气,在装置③中NO与空气中的氧气反应生成NO ,并收集,④中的水可以吸收排出
2
的二氧化氮,尾气中的NO在⑤中被吸收,防止污染,因此⑤中可以选用氢氧化钠溶液,
据此分析解答。A.根据上述分析,装置①、②、⑤依次盛装碱石灰、无水CaCl 、NaOH溶液,故A正确;
2
B.装置③NO被氧化生成NO ,气体呈红棕色,故B正确;
2
C.装置④中发生3NO + H O =2HNO + NO,溶液显酸性,可使紫色石蕊溶液变红,故C
2 2 3
正确;
D.通空气的主要作用是鼓出氨气并提供氧气,空气不能用N 代替,故D错误;
2
故选D。
4.硝酸被称为“国防工业之母”是因为它是制取炸药的重要原料。下列实验事实与硝酸性质
不相对应的一组是( )
A.浓硝酸使紫色石蕊试液先变红后褪色——酸性和强氧化性
B.不能用稀硝酸与锌反应制氢气——强氧化性
C.要用棕色瓶盛装浓硝酸——不稳定性
D.能使滴有酚酞的氢氧化钠溶液红色褪去——强氧化性
【答案】D
【解析】
A. 浓硝酸使紫色石蕊试液先变红,表现出酸性;后褪色,表现出强氧化性,正确。
B. 不能用稀硝酸与锌反应制氢气,因为硝酸具有强氧化性,被锌还原生成氮氧化物等,而
不生成氢气,正确。
C. 要用棕色瓶盛装浓硝酸,因为浓硝酸具有光的不稳定性,正确。
D. 能使滴有酚酞的氢氧化钠溶液红色褪去,可能是硝酸表现出强氧化性,将酚酞氧化而褪
色;也可能是硝酸表现出酸性,中和了氢氧化钠的碱性,酚酞在中性溶液中呈无色,错误。
故选D。
5.对于硫酸和硝酸的比较中,下列叙述不正确的是( )
A.冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装 B.稀硫酸和稀硝酸都具有氧化性
C.浓硫酸和浓硝酸都具有很强的腐蚀性、脱水性 D.硫酸和硝酸都是重要的化工原料
【答案】C
【解析】
A. 铝、铁与冷的浓硫酸和浓硝酸发生的钝化,因此冷的浓硫酸和浓硝酸都可以用铝、铁的
容器盛装,故A正确;
B. 稀硫酸和稀硝酸都具有氧化性,稀硫酸和金属反应生成氢气,表现氧化性,稀硝酸和金
属反应生成硝酸盐和一氧化氮表现氧化性,故B正确;
C. 浓硫酸和浓硝酸都具有很强的腐蚀性,浓硫酸具有脱水性,浓硝酸不具有,故C错误;D. 化工生产中用硝酸、硫酸生产化肥、农药、炸药、燃料,金属加工前的酸洗等,故D
正确。
综上所述,答案为C。
6.化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列
反应中不属于这种情况的是
A.过量的稀硝酸和铁反应 B.常温下过量的浓硝酸与铝块
C.加热下过量的二氧化锰与浓盐酸 D.加热条件下过量的铜与浓硫酸
【答案】A
【解析】
A.过量稀硝酸与铁反应生成硝酸铁和NO,所以不存在稀硝酸过量,铁不完全反应的情况,
故A选;
B.常温下,Al和浓硝酸发生钝化现象而导致铝、浓硝酸都不完全反应,所以存一种物质
过量,另一种物质仍不能完全反应的情况,故B不选;
C.MnO 与浓盐酸在加热条件下反应生成氯气,MnO 和稀盐酸不反应,所以存在一种物
2 2
质过量,另一种物质仍不能完全反应的情况,故C不选;
D.加热条件下,Cu和浓硫酸反应,Cu和稀硫酸不反应,所以存在一种物质过量,另一种
物质仍不能完全反应的情况,故D不选;
故选A。
7.(2021·重庆复旦中学高一期中)相同质量的四份铜片,分别置于足量的下列酸中,在
一定条件下反应,所得到的气体的物质的量最多的是( )
A.浓硫酸 B.稀硫酸 C.浓硝酸 D.稀硝酸
【答案】C
【解析】
设金属Cu均为1mol,则
A.Cu+2H SO (浓) CuSO +SO↑+2H O,1molCu完全反应,生成1mol气体;
2 4 4 2 2
B.由铜在金属活动性顺序表中的位置可知,铜不可以和非氧化性酸反应产生H,即铜和
2
稀硫酸不反应;
C.由Cu+4HNO (浓)=Cu(NO)+2NO↑+2H O,1molCu完全反应,生成2mol气体;
3 3 2 2 2
D.由3Cu+8HNO (稀)=3Cu(NO)+2NO↑+4HO,1molCu完全反应生成气体 mol;
3 3 2 2
故相同质量的四份铜片与足量的酸反应,所得到的气体的物质的量最多的是浓HNO;
3答案选C。
8.在100mL混合液中,HNO 和HSO 物质的量浓度分别是0.4mol/L和0.1mol/L,向该
3 2 4
混合液中加入1.92gCu粉,加热充分反应后,所得溶液中Cu2+的物质的量浓度是( )
A.0.15 mol/L B.0.3 mol/L C.0.1 mol/L D.0.225 mol/L
【答案】D
【解析】
溶液中的氢离子包括硝酸电离和硫酸电离的,因为硝酸和硫酸都是强酸,所以溶液中的氢
离子的物质的量为:0.4mol/L×0.1L+0.1mol/L×0.1L×2=0.06mol,硝酸根离子的物质的量为:
0.4mol/L×0.1L=0.04mol,1.92gCu的物质的量为: ,则3Cu+8H++NO-
3
=2NO↑+3Cu2++4H O,结合氢离子、铜、硝酸根离子的物质的量和铜与稀硝酸反应的离子
2
方程式可知,氢离子的物质的量不足,根据氢离子的物质的量计算,反应中有0.06mol氢
离子参加反应,则参加反应的铜的物质的量为:0.06:n(Cu) = 8:3,n(Cu) =0.0225mol,
则反应生成Cu2+的物质的量为0.0225mol,故所得溶液中Cu2+的物质的量浓度是
,D符合题意;
答案选D。
9.用如图中装置进行实验,实验一段时间后,现象与预测不一致的是
①中物质 ②中物质 实验预测
A 浓氨水 酚酞试液 ②中溶液变为红色
B 浓硝酸 淀粉KI溶液 ②中溶液变为蓝色
C 浓盐酸 浓氨水 大烧杯中有白烟
D 饱和的亚硫酸溶液 稀溴水 ②中无明显变化
A.A B.B C.C D.D【答案】D
【解析】
A.浓氨水具有挥发性,氨气溶于水形成氨水,氨水显示碱性,使得酚酞溶液变为红色,
现象与预测一致,故A不选;
B.浓硝酸具有挥发性和强氧化性,能将碘离子氧化为碘单质,淀粉遇到单质碘显示蓝色,
现象与预测一致,故B不选;
C.浓盐酸具有挥发性和酸性,能和氨气之间发生反应,产生氯化铵固体,大烧杯中有白
烟,现象与预测一致,故C不选;
D.饱和亚硫酸不稳定分解产生二氧化硫,二氧化硫能和溴水发生氧化还原反应生成硫酸
和氢溴酸,所以溴水的颜色会褪去,现象与预测不一致,故D选;
答案选D。
10.下列说法错误的是
A.空气中的SO 溶于水,最终形成酸雨
2
B.汽车排放的尾气、硝酸厂和化肥厂的废气都含有氮氧化物
C.工业废水任意排放是造成酸雨的主要原因
D.为了减少酸雨的形成,可对燃料进行脱硫处理
【答案】C
【解析】
A.SO 与水反应生成亚硫酸,亚硫酸能被氧化为硫酸,形成酸雨,故A正确;
2
B.汽车排放的尾气、硝酸厂和化肥厂的废气都含有氮元素,含有氮氧化物,故B正确;
C.工业废水任意排放引起江河湖泊污染,与酸雨无关,故C错误;
D.燃料脱硫可减少二氧化硫的排放,为了减少酸雨的形成,可对燃料进行脱硫处理,故
D正确;
答案选C。
12.下列关于浓硝酸的说法正确的是( )
A.难挥发 B.常温下不能氧化铜
C.应保存在无色细口瓶中 D.常温下能使铝片钝化
【答案】D
【解析】
A.硝酸是挥发性酸,浓硝酸易挥发,故A错误;
B.常温下浓硝酸能和铜反应生成硝酸铜、二氧化氮、水,常温下能氧化铜单质,故B错误;
C.浓硝酸见光易分解,应保存在棕色细口瓶中,故C错误;
D.浓硝酸具有强氧化性,常温下能使铁、铝钝化,故D正确;
答案选D。
二、非选择题
13.铜与稀硝酸反应 ,氧化剂是_______,氧化
产物是_______,3个Cu参加反应转移_______个电子,HNO 在该反应中体现_______性质。
3
(填“氧化性”、“还原性”、“酸性”)
【答案】HNO Cu(NO ) 6 氧化性、酸性
3 3 2
【解析】
在该反应中N元素化合价由反应前HNO 中的+5价变为反应后NO中的+2,化合价降低,
3
得到电子被还原,所以HNO 作氧化剂;Cu元素化合价由反应前Cu单质的0价变为反应
3
后Cu(NO ) 中的+2价,化合价升高,失去电子被氧化,所以Cu为还原剂,Cu(NO ) 是氧
3 2 3 2
化产物;在反应中Cu由单质0价变为Cu(NO ) 中的+2价,化合价升高2价,每1个Cu发
3 2
生反应转移2个电子,则3个Cu参加反应转移6个电子,在该反应中HNO 作氧化剂,表
3
现氧化性;同时有部分HNO 反应后仍以+5价的 形式存在,与Cu2+结合形成
3
Cu(NO ),又表现酸性,故该反应中HNO 的作用体现氧化性、酸性。
3 2 3
14.工业上可以废铜屑为原料制备硝酸铜,下列4种方法中,适宜采用的是哪一种
________?请从节约原料和环境保护的角度说明原因_________。
①
②
③
④
【答案】③ ③先将铜单质氧化得到氧化铜,再与稀硝酸反应得到硝酸铜和水,没有浪
费原料,也没有生成其它有害物质;①、②和④铜单质与浓稀硝酸或浓硫酸反应都会生成
氮氧化物或硫氧化物气体,浪费了原料,还需后续处理,不然会污染环境。【详解】
工业上可以废铜屑为原料制备硝酸铜,方法①和方法②铜单质与浓稀硝酸反应都会生成氮
氧化物气体,浪费了原料,还需后续处理,不然会污染环境;方法④用到浓硫酸,与铜单
质反应生成了二氧化硫气体,浪费原料,污染环境;最优方案是方法③,先将铜单质氧化
得到氧化铜,再与稀硝酸反应得到硝酸铜和水,没有浪费原料,也没有生成其它有害物质。
15.利用下图所示装置进行铜与硝酸反应的实验。
(1)硝酸一般盛放在棕色试剂瓶中,请用化学方程式说明其原因:___________。
(2)使用稀硝酸进行实验:反应开始后,铜丝逐渐变细,有气泡产生,溶液变蓝。
①铜与稀硝酸反应的离子方程式为___________。
②实验中观察到试管中的气体略有红棕色,其原因是___________(用化学方程式表示)。
(3)使用浓硝酸进行实验:反应剧烈进行,铜丝逐渐变细,溶液变绿,试管上方出现红棕
色气体。
①铜与浓硝酸反应的化学方程式为___________。
②某同学推测反应后溶液呈绿色的原因是 在溶液中达到饱和, 的饱和溶液呈黄色,
硝酸铜溶液呈蓝色,两者混合后呈绿色。他取少量该绿色溶液,向其中加入适量水后溶液
变为蓝色,可能的原因是___________(用化学方程式表示)。
【答案】
(1)
(2)
(3)
【分析】
(1)硝酸见光易分解,一般盛放在棕色试剂瓶中。(2)使用稀硝酸进行实验,铜丝被氧化逐渐变细,生成一氧化氮气体,有气泡产生,得到
硝酸铜溶液显蓝色。
(3)使用浓硝酸进行实验,铜丝被氧化逐渐变细,试管上方出现红棕色气体是 ,说
明溶液是 的饱和溶液,因 的饱和溶液呈黄色,硝酸铜溶液呈蓝色,两者混合后溶
液变绿色。
(1)
硝酸一般盛放在棕色试剂瓶中,因为硝酸见光易分解,化学方程式:
。
(2)
①铜与稀硝酸反应生成一氧化氮,离子方程式为: ;
②实验中观察到试管中的气体略有红棕色,因为反应生成的无色NO气体与试管内氧气中
反应生成红棕色的NO ,化学方程式: 。
2
(3)
①铜与浓硝酸反应生成二氧化氮,化学方程式为: ;
②加入适量水后饱和溶液中的 与水发生反应生成了硝酸和一氧化氮,原溶液中 饱
和溶液的黄色褪去,显现出硝酸铜溶液的蓝色,化学方程式: