文档内容
专题 03 无机非金属材料
专项训练
1.地壳中含量最多的非金属元素是( )
A.氧 B.碳 C.硅 D.铝
2.在SiO 晶体内部,每个Si与4个O分别形成4个单键,则与每个O形成单键的Si的数目是
2
A.1 B.2 C.3 D.4
3.“九秋风露越窑开,夺得千峰翠色来”是赞誉越窑秘色青瓷的诗句,描绘我国古代精美的青瓷工艺品。
玻璃、水泥和陶瓷均为硅酸盐制品,下列有关说法中正确的是( )
A.玻璃是人类最早使用的硅酸盐制品
B.制水泥的原料为纯碱、石灰石和石英
C.硅酸盐制品的性质稳定、熔点较高
D.沙子和黏土的主要成分均为硅酸盐
4.《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无沙黏土而为之”,“凡坯既成,干燥之后,
则堆积窖中燃薪举火”,“浇水转釉(主要为青色),与造砖同法”。下列说法错误的是( )
A.沙子和黏土的主要成分为硅酸盐
B.“燃薪举火”使黏土发生复杂的物理、化学变化
C.烧制后自然冷却成红瓦,浇水冷却成青瓦
D.黏土是制作砖瓦和陶瓷的主要原料
5.下列有关硅及其化合物的叙述中,正确的是( )
A.硅是光导纤维的主要成分
B.硅是构成岩石与许多矿物的基本元素
C.SiO 是酸性氧化物,不与任何酸发生反应
2
D.可以通过SiO 与水反应一步制得硅酸
2
6.2020年12月17日,我国“嫦娥五号”返回器携带月球样品安全着陆,探月工程圆满成功。“嫦娥”
五号探测器采用太阳能电池板提供能量,制造太阳能电池板的核心材料是
A.二氧化硅 B.硅 C.钛合金 D.铝合金
7.下列关于碳和硅的比较,正确的是( )
A.碳和硅在自然界中的存在形式都是既有游离态也有化合态
B.碳和硅的最高化合价都是+4价
C.硅元素在地壳中的含量占第二位,碳占第一位
D.硅与碳一样均含有两种常见价态的氧化物—— 和
8.能证明碳酸的酸性比硅酸的强的依据是( )
A. 是气体, 是固体B.高温下能发生反应:
C. 能溶于水生成碳酸,而 却不溶于水
D.将 通入 溶液中有胶状沉淀生成
9.我国具有独立知识产权的电脑芯片“龙芯一号”的问世,填补了我国计算机制造史上的一项空白。下
列对硅及其化合物的有关叙述正确的是( )
A.二氧化硅既能与烧碱溶液反应又能与氢氟酸反应,所以二氧化硅是两性氧化物
B.晶体硅的化学性质不活泼,常温下不与任何物质发生反应
C.晶体硅是一种良好的半导体材料,但是它的提炼工艺复杂,价格极高
D.晶体硅和金刚石的硬度都很大
10.下列物质中,属于酸性氧化物且跟水不能形成酸的是( )
A.CO B.SiO C.SO D.Fe O
2 2 2 2 3
11.下列说法正确的是( )
A.SiO 熔点高硬度大,因此可用于制光导纤维
2
B.向NaSiO 溶液中滴加稀盐酸:
2 3
C. ,该物质间转化能实现
D.高纯硅可用于制作光感电池
12.据《参考消息》报道,有科学家提出硅是“21世纪的能源”“未来的石油”。假如硅作为一种普遍使
用的新型能源被开发利用,下列说法你认为不妥的是( )
A.硅便于运输、贮存,从安全的角度考虑,硅是较安全的燃料
B.自然界中存在大量的单质硅
C.硅燃烧放出的热量多,且燃烧产物对环境污染程度低,容易有效控制
D.自然界中Si易开采
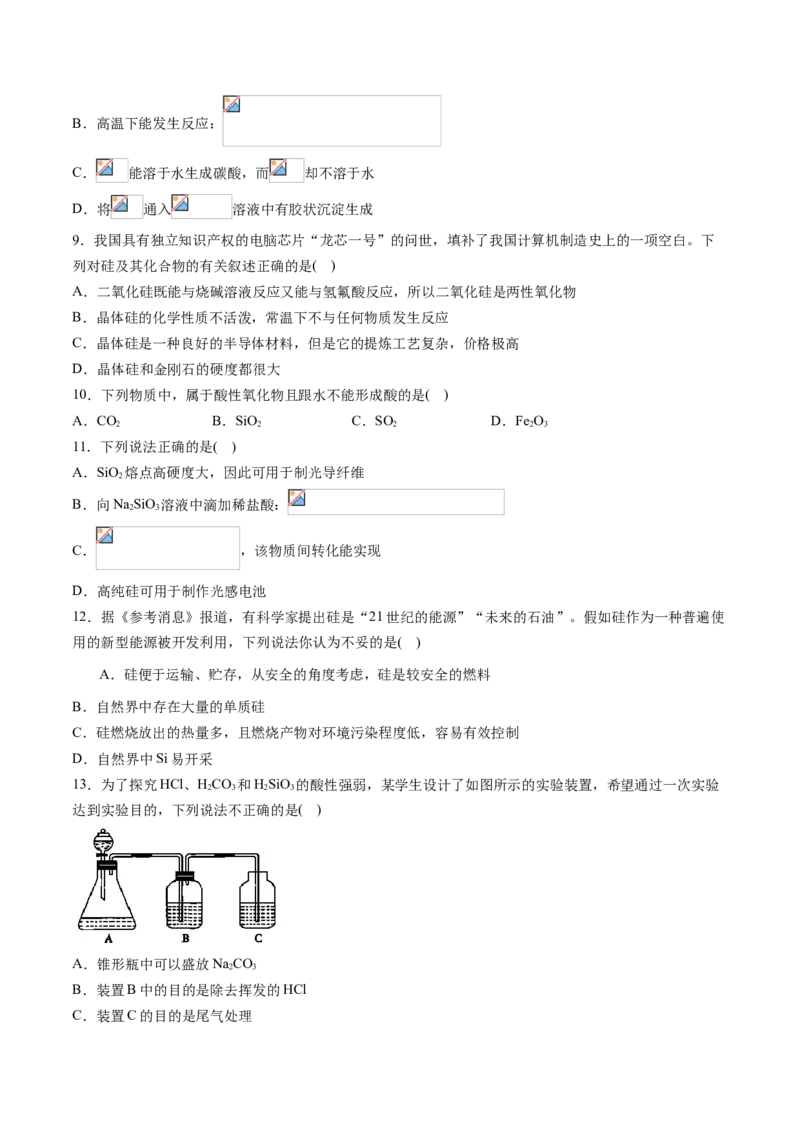
13.为了探究HCl、HCO 和HSiO 的酸性强弱,某学生设计了如图所示的实验装置,希望通过一次实验
2 3 2 3
达到实验目的,下列说法不正确的是( )
A.锥形瓶中可以盛放NaCO
2 3
B.装置B中的目的是除去挥发的HCl
C.装置C的目的是尾气处理D.该装置可以得出HCl、HCO、HSiO 的酸性强弱顺序
2 3 2 3
14.SiO 是一种化工原料,可以制备一系列物质。下列说法正确的是
2
A.图中所有反应都不属于氧化还原反应
B.硅酸盐的化学性质稳定,常用于制作光导纤维
C.普通玻璃是由纯碱、石灰石和石英制成的,其熔点很高
D.可用盐酸除去石英砂(主要成分为 SiO)中少量的碳酸钙
2
15.硅是组成无机非金属材料的一种主要元素,下列有关硅的化合物的叙述错误的是
A.氮化硅陶瓷是一种新型无机非金属材料,其化学式为
B.碳化硅( )的硬度大,熔点高,可用于制作高温结构陶瓷和轴承
C.光导纤维是一种新型无机非金属材料,其主要成分为
D.氮化硅( )、氧化铝( )、碳化硅( )和二氧化锆( )都可用作制高温结构陶瓷的材料
16.高纯度单晶硅是典型的无机非金属材料,又称半导体材料,它的发现和使用曾引起计算机的一场“革
命"。这种材料可以按所给路线制备:
SiO 粗硅 SiHCl Si(纯)
2 3
(1)写出步骤①的化学方程式:_______。
(2)步骤②经过冷凝得到的SiHCl (沸点为33.0℃)中含有少量的SiCl (沸点为57.6℃)和HCl(沸点为 ℃),
3 4
提纯SiHCl 的主要化学操作的名称是_______;SiHCl 和SiCl 一样遇水可发生剧烈水解,已知SiHCl 水解
3 3 4 3
会生成两种气态产物,请写出其水解的化学方程式:_______。
(3)请写出二氧化硅与氢氯酸反应的化学方程式:_______。
17.硅是重要的半导体材料。近日,我国宣布突破了碳基半导体材料制备的瓶颈,有望替代目前的硅材料,
支持高端芯片的国产化。(1)Si在元素周期表中的位置是___。
(2)制作芯片需要高纯度的硅,高纯硅中Si原子之间的相互作用是___(填“离子键”或“共价键”)。
(3)非金属性Si弱于P,用原子结构解释原因:___,得电子能力Si小于P。
(4)下列关于C和Si及其化合物的推断中,正确的是___(填序号)。
①C的最高正化合价与Si的最高正化合价相同
②SiO 具有还原性
2
③最高价氧化物对应水化物的酸性:HCO>H SiO
2 3 2 3
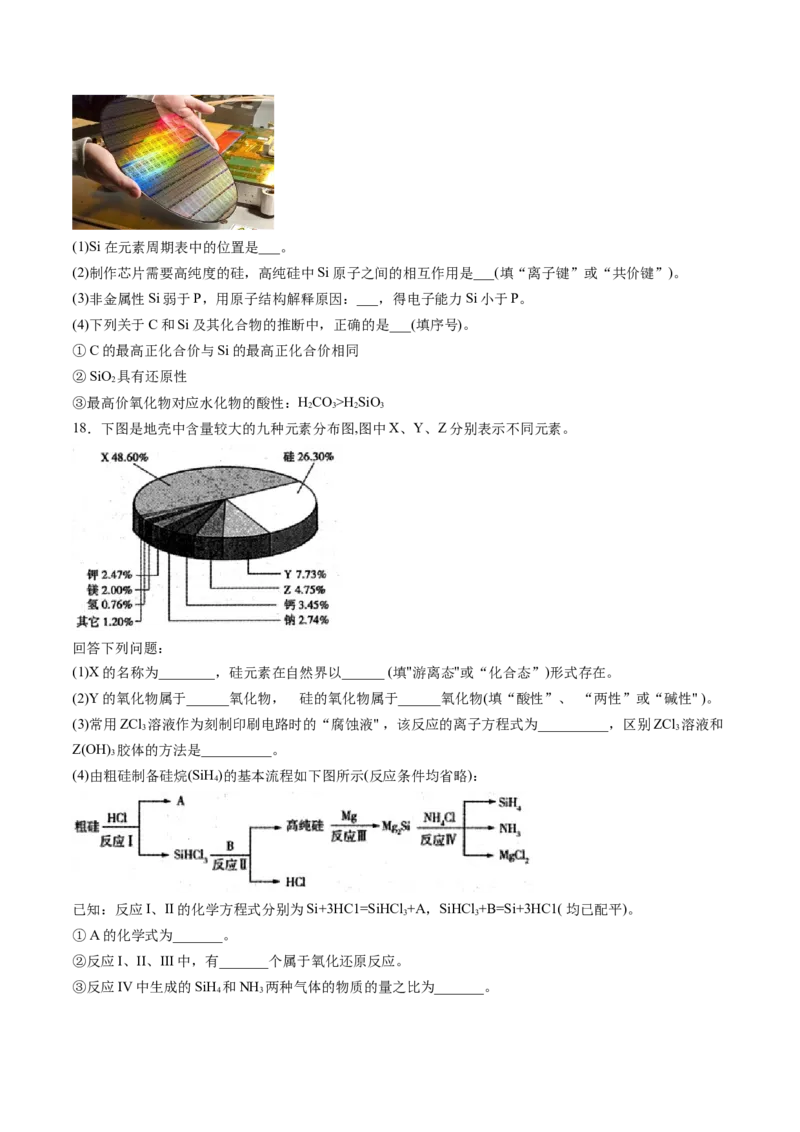
18.下图是地壳中含量较大的九种元素分布图,图中X、Y、Z分别表示不同元素。
回答下列问题:
(1)X的名称为________,硅元素在自然界以______ (填"游离态"或“化合态”)形式存在。
(2)Y的氧化物属于______氧化物, 硅的氧化物属于______氧化物(填“酸性”、 “两性”或“碱性" )。
(3)常用ZCl 溶液作为刻制印刷电路时的“腐蚀液" ,该反应的离子方程式为__________,区别ZCl 溶液和
3 3
Z(OH) 胶体的方法是__________。
3
(4)由粗硅制备硅烷(SiH)的基本流程如下图所示(反应条件均省略):
4
已知:反应I、II的化学方程式分别为Si+3HC1=SiHCl +A,SiHCl +B=Si+3HC1( 均已配平)。
3 3
①A的化学式为_______。
②反应I、II、III中,有_______个属于氧化还原反应。
③反应IV中生成的SiH 和NH 两种气体的物质的量之比为_______。
4 3