文档内容
第四章 物质结构 元素周期律
第二节 元素周期律
第1课时 元素性质的周期性变化规律
一、单选题
1.元素的性质呈周期性变化的根本原因是( )
A.相对原子质量递增,量变引起质变 B.原子半径呈周期性变化
C.原子核外电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
2.下列元素的原子半径最小的是( )
A.C B.B C.O D.F
3.下列物质性质变化的比较,正确的是( )
A.原子半径大小:Al>Mg>Na B.碱性强弱:KOH>NaOH>LiOH
C.气态氢化物稳定性:HBr>HCl>HF D.还原性强弱:F->Cl->Br->I-
4.研究表明26Al可以衰变为26Mg。能比较这两种元素失电子能力强弱的方法是( )
A.比较这两种元素的单质的硬度及熔点
B.在氯化铝和氯化镁溶液中分别滴加过量的氨水
C.将打磨过的镁条和铝条分别和热水作用,并滴入酚酞溶液
D.将镁条和铝条插入氢氧化钠溶液中
5.砷(As)为第四周期第ⅤA族元素,根据元素周期表和元素周期律的知识,下列有关推测不正确的是( )
A.砷有-3、+3、+5等多种化合价
B.原子半径:As>P
C.酸性:HAsO >HSO
3 4 2 4
D.热稳定性:HBr>AsH
3
6.X、Y分别代表两种非金属元素,下列不能说明非金属性X比Y强的是( )
A.X的氧化物对应水溶液的酸性比Y的氧化物对应水溶液的酸性强
B.Y-的还原性强于X-
C.X的单质X 能将Y的阴离子Y-氧化为Y
2 2
D.X、Y的单质分别与Fe化合,产物中前者Fe为+3价,后者Fe为+2价
7.周期表中第117号元素X,它的原子结构与卤族元素相似,电子排布有7个电子层,且最外层有7个电
子。下列叙述中正确的是( )
1
原创精品资源学科网独家享有版权,侵权必究!A.此X元素的气态氢化物的化学式为HX,在常温下很稳定
B.其单质带有金属光泽,具有强氧化性,可与KI发生置换反应生成I
2
C.其单质的分子式为X ,易溶于有机溶剂
2
D.AgX是一种有色的易溶于水的化合物
8.(2020·安徽合肥一中高一期末)以下有关原子结构、元素周期律及元素周期表的叙述正确的是( )
A.所有主族元素原子的最外层电子数都等于元素的最高正化合价
B.多电子原子中,在离核较近的区域内运动的电子能量较低
C.第IA族元素从上到下,单质的熔点逐渐降低
D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
9.某元素X的气态氢化物化学式为HX,下列叙述不正确的是( )
2
A.该元素的原子最外电子层上有6个电子
B.该元素最高价氧化物的化学式为XO
2
C.该元素是非金属元素
D.该元素最高价氧化物对应水化物的化学式为HXO
2 4
10.1934年约里奥–居里夫妇在核反应中用α粒子(即氦核 He)轰击金属原子 X,得到核素 Y,开创了
人造放射性核素的先河: X+ He→ Y+ n。其中元素X、Y的最外层电子数之和为8。下列叙述正确
的是( )
A. X的相对原子质量为26 B.X、Y均可形成三氯化物
C.X的原子半径小于Y的 D.Y仅有一种含氧酸
二、填空题
11.用“>”或“<”回答下列问题:
(1)酸性:HCO___HSiO,HSiO___HPO 。
2 3 2 3 2 3 3 4
(2)碱性:Ca(OH) ___Mg(OH) ,Mg(OH) ___Al(OH) 。
2 2 2 3
(3)气态氢化物的稳定性:HO___HS,HS___HCl。
2 2 2
(4)还原性:HO__HS,HS___HCl。
2 2 2
从以上答案中可以归纳出:
①元素的非金属性越强,其最高价氧化物对应水化物的酸性越___。
②元素的金属性越强,其最高价氧化物对应水化物的碱性越___。
2
原创精品资源学科网独家享有版权,侵权必究!③元素___性越强,其对应气态氢化物的稳定性越强。
④元素非金属性越强,其对应气态氢化物的还原性越__。
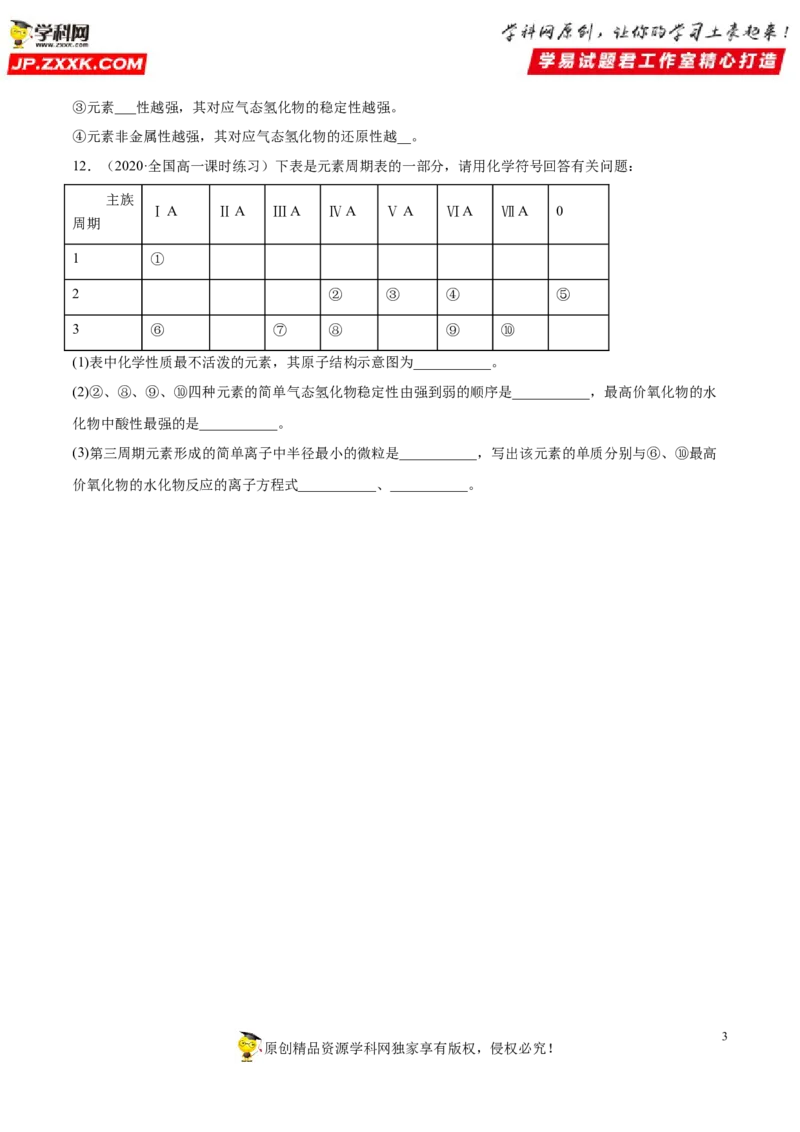
12.(2020·全国高一课时练习)下表是元素周期表的一部分,请用化学符号回答有关问题:
主族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
周期
1 ①
2 ② ③ ④ ⑤
3 ⑥ ⑦ ⑧ ⑨ ⑩
(1)表中化学性质最不活泼的元素,其原子结构示意图为___________。
(2)②、⑧、⑨、⑩四种元素的简单气态氢化物稳定性由强到弱的顺序是___________,最高价氧化物的水
化物中酸性最强的是___________。
(3)第三周期元素形成的简单离子中半径最小的微粒是___________,写出该元素的单质分别与⑥、⑩最高
价氧化物的水化物反应的离子方程式___________、___________。
3
原创精品资源学科网独家享有版权,侵权必究!