文档内容
第四章 物质结构 元素周期律
第三节 化学键
第2课时 共价键
1.下列物质中,既含有极性共价键,又含有非极性共价键的是( )
A.CH B.CO C.NH Cl D.HO
4 2 4 2 2
【答案】D
【解析】
A. CH 中只有极性共价键,A不符合题意;
4
B. CO 中只有极性共价键,B不符合题意;
2
C. NH Cl中含有离子键和极性共价键,C不符合题意;
4
D.HO 中既含有极性共价键,又含有非极性共价键,D符合题意;
2 2
答案选D。
2.下列物质中,既有离子键又有共价键的是( )
A.CaCl B.NaO C.HO D.NaCl
2 2 2 2
【答案】B
【解析】一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,铵根
离子和酸根离子之间存在离子键。
A. 氯化钙中钙离子和氯离子之间只存在离子键,故A错误;
B. NaO 中钠离子和过氧根离子之间存在离子键,氧和氧原子之间存在共价键,故B正确;
2 2
C. 水分子中氢、氧之间只存在共价键,故C错误;
D. NaCl中钠离子和氯离子之间只存在离子键,故D错误。
3.下列各组物质都是共价化合物的是( )
A.HS和NaO B.HO和NH Cl
2 2 2 2 4
C.NH 和N D.HNO 和HCl
3 2 3
【答案】D
【解析】
A. H S为共价化合物,NaO 为离子化合物,故A不符合题意;
2 2 2
B.H O为共价化合物,NH Cl为离子化合物,故B不符合题意;
2 4
C.NH 为共价化合物, N 为单质,故C不符合题意;
3 2D.HNO 和HCl都为共价化合物,故D符合题意;
3
【点睛】
根据化合键型判断化合物类别。如离子化合物中一定含有离子键,可能含有共价键;共价化合物只含有共
价键。
4.(2020·湖北江夏·金口中学月考)在下列化学反应中既有离子键、极性键、非极性键断裂,又有离子键、
极性键、非极性键形成的是( )
A.Cl+HO=HClO+HCl
2 2
B.MgN+6HO=3Mg(OH) ↓+2NH ↑
3 2 2 2 3
C.2NaO+2HO=4NaOH+O↑
2 2 2 2
D.NH Cl+NaOH NaCl+NH ↑+HO
4 3 2
【答案】C
【解析】
一般金属元素与非金属元素形成离子键,同种非金属元素之间形成非极性共价键,不同非金属元素之间形
成极性共价键,铵盐中铵根离子和酸根离子之间存在离子键,据此分析解答。
A.没有离子键的断裂与形成,也没有非极性键的形成,A不正确;
B.没有非极性键的断裂与形成,B不正确;
C.2NaO+2H O=4NaOH+O ↑中有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成,
2 2 2 2
故C正确;
D.没有非极性键的断裂与形成,D不正确;
5.下列各组物质的晶体中,化学键类型相同、晶体类型、物质发生状态变化所克服的粒子间的相互作用
也相同的是( )
A.SO 和HCl B.KCl和Mg C.NaCl和HO D.CCl 和SiO
3 2 4 2
【答案】A
【解析】
A.SO 和HCl都是分子晶体,都有极性共价键,物质发生状态变化都克服分子间作用力,A符合题意;
3
B.KCl为离子晶体,Mg为金属晶体,晶体类型不同,化学键类型不同,物质发生状态变化时,前者克服的
是离子键,后者克服的是金属键,B不符合题意;
B.NaCl为离子晶体,HO为分子晶体,晶体类型不同,化学键类型不同,物质发生状态变化时,前者克服
2
的是离子键,后者克服的是分子间作用力,C不符合题意;
D.CCl 是分子晶体,SiO 是原子晶体,都有极性共价键,物质发生状态变化前者克服分子间作用力,后者
4 2
克服的是共价键,晶体类型不同,D不符合题意;6.(2020·江苏高考真题)反应 可用于氯气管道的检漏。下列表示相关微粒
的化学用语正确的是
A.中子数为9的氮原子:
B.N 分子的电子式:
2
C.Cl 分子的结构式:Cl—Cl
2
D.Cl-的结构示意图:
【答案】C
【解析】
A.N原子的质子数为7,中子数为9的氮原子的质量数为7+9=16,该氮原子表示为 ,A错误;
B.N 分子中两个N原子间形成3对共用电子对,N 分子的电子式为 ,B错误;
2 2
C.Cl 分子中两个Cl原子间形成1对共用电子对,Cl 分子的结构式为Cl—Cl,C正确;
2 2
D.Cl-的核电荷数为17,核外有18个电子,Cl-的结构示意图为 ,D错误;
7.下列关于化学键的说法正确的是( )
A.构成单质分子的微粒一定含有共价键
B.全部由非金属元素组成的化合物中可能含有离子键
C.非极性键只存在于非金属单质或共价化合物中
D.化学键包括离子键、共价键、氢键
【答案】B
【解析】
A.构成单质分子的微粒中,稀有气体分子内不含有共价键,A不正确;
B.全部由非金属元素组成的化合物(铵盐)中含有离子键,B 正确;
C.非极性键也存在于离子化合物中,如NaO 中含氧氧键,C不正确;
2 2D.氢键不属于化学键,它属于分子间作用力,D不正确;
8.下列每组物质发生转化时所克服的作用力属于同种类型的是( )
A.碘和干冰的升华 B.氯化钠的熔化与冰的融化
C.氯化氢和酒精溶于水 D.二氧化硅和生石灰的熔化
【答案】A
【解析】
A. 碘和干冰升华时克服的作用力都是分子间作用力,A项符合;
B. NaCl熔化时克服的作用力是离子键,冰融化时克服的作用力是分子间作用力,B项不符合;
C. 氯化氢溶于水克服的作用力是共价键,酒精溶于水克服的作用力是分子间作用力,C项不符合;
D. 是由原子构成的共价化合物,熔化时克服的作用力是共价键,CaO是离子化合物,熔化时克服的
作用力是离子键,D项不符合;
9.下列变化中,不需要破坏化学键的是( )
A.电解水 B.碘升华
C.加热氯酸钾使其分解 D.氯化钠溶于水
【答案】B
【解析】
A.电解水发生化学变化,旧化学键断裂,形成新化学键A项错误;
B. 碘升华,化学键不变,只破坏分子间作用力,B项正确;
C. 加热氯酸钾使其分解,发生化学变化,化学键被破坏,C项错误;
D. 氯化钠溶于水,发生电离,离子键被破坏,D项错误;
10.(2020·贵阳市第十四中学高一期末)下列化学用语正确的是( )
A.HS的电子式: B.S2-结构示意图:
2
C.NaO 的电子式: D.CCl 的电子式:
2 2 4
【答案】B
【解析】
A.HS是共价化合物,电子式为 ,A错误;
2B.S2-的质子数是16,核外电子数是18,结构示意图为 ,B正确;
C.NaO 是离子化合物,电子式为 ,C错误;
2 2
D.CCl 是共价化合物,电子式为 ,D错误。
4
二、填空题
11.下列物质中,①HO ②O ③NaO ④NaOH ⑤NaBr ⑥AlCl ⑦Ne ⑧HO
2 2 2 2 3 2 2
(1) 只存在共价键的是___________________
(2) 含有极性键和非极性键的是__________________
(3) 含有离子键和极性键的是______________
(4) 含有离子键和非极性键的是_______________
(5) 属于共价化合物的是_______________________
【答案】①②⑥⑧ ⑧ ④ ③ ①⑥⑧
【详解】①HO为共价化合物,只存在H-O极性共价键;
2
②O 只存在O=O非极性共价键;
2
③NaO 为离子化合物,存在离子键、O-O极性共价键;
2 2
④NaOH为离子化合物,存在离子键、H-O极性共价键;
⑤NaBr为离子化合物,只存在离子键;
⑥AlCl 为共价化合物,只存在极性共价键
3
⑦Ne为单原子分子,不存在化学键
⑧HO 为共价化合物,存在O-O极性共价键和H-O极性共价键
2 2
综上所述,只存在共价键的是①②⑥⑧;含有极性键和非极性键的是⑧ ;含有离子键和极性键的是④;
含有离子键和非极性键的是③;属于共价化合物的是①⑥⑧。
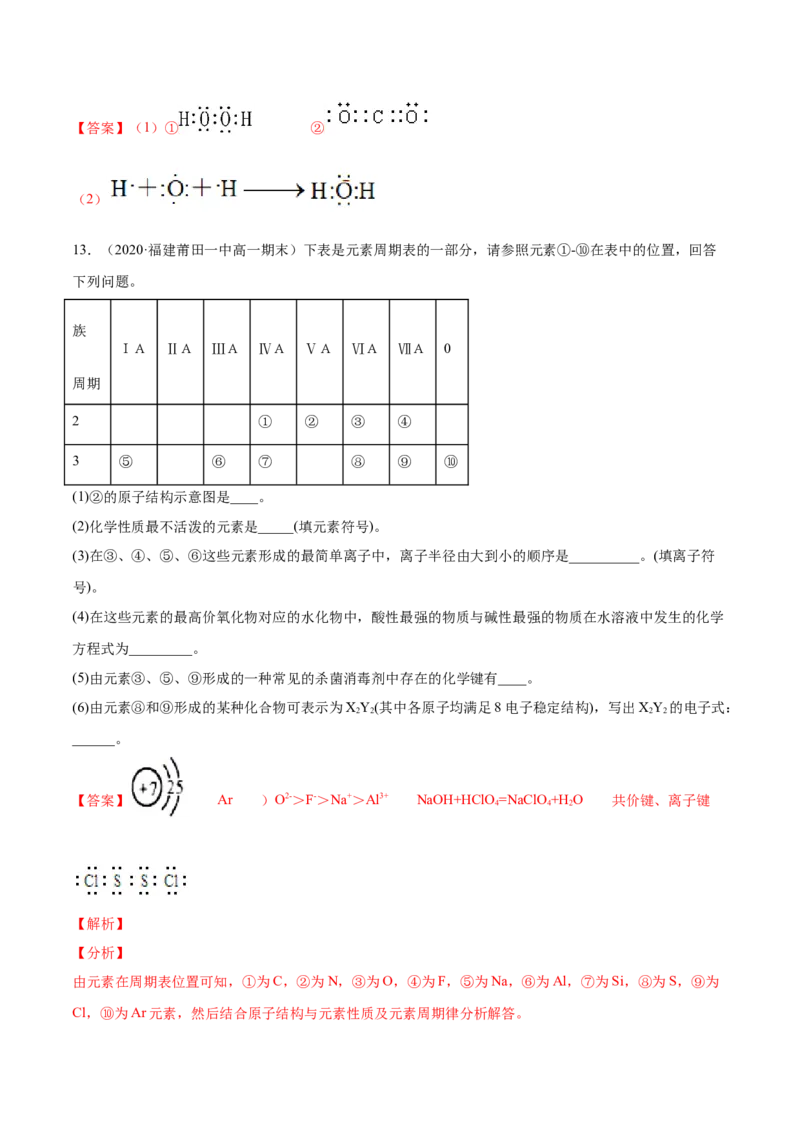
12.(1)写出下列物质的电子式。
①HO________________________ ②CO
2 2 2____________________________________
(2) 用电子式表示下列物质的形成过程。
HO________________________
2【答案】(1)① ②
(2)
13.(2020·福建莆田一中高一期末)下表是元素周期表的一部分,请参照元素①-⑩在表中的位置,回答
下列问题。
族
IA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
周期
2 ① ② ③ ④
3 ⑤ ⑥ ⑦ ⑧ ⑨ ⑩
(1)②的原子结构示意图是____。
(2)化学性质最不活泼的元素是_____(填元素符号)。
(3)在③、④、⑤、⑥这些元素形成的最简单离子中,离子半径由大到小的顺序是__________。(填离子符
号)。
(4)在这些元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质在水溶液中发生的化学
方程式为_________。
(5)由元素③、⑤、⑨形成的一种常见的杀菌消毒剂中存在的化学键有____。
(6)由元素⑧和⑨形成的某种化合物可表示为XY(其中各原子均满足8电子稳定结构),写出XY 的电子式:
2 2 2 2
______。
【答案】 Ar )O2->F->Na+>Al3+ NaOH+HClO =NaClO +H O 共价键、离子键
4 4 2
【解析】
【分析】
由元素在周期表位置可知,①为C,②为N,③为O,④为F,⑤为Na,⑥为Al,⑦为Si,⑧为S,⑨为
Cl,⑩为Ar元素,然后结合原子结构与元素性质及元素周期律分析解答。【详解】
(1)②为N元素,其原子核外电子排布为2、5,所以原子结构示意图为 ;
(2)0族元素Ar原子最外层有8个电子,既不容易失去电子,也不容易得到电子,化学性质最不活泼,最稳
定;
(3)根据元素在周期表的位置可知:③为O,④为F,⑤为Na,⑥为Al,这几种元素形成的离子核外电子排
布都是2、8,电子层结构相同。对于电子层结构相同的离子,核电荷数越大,离子半径越小,所以这几种
元素形成的离子中,离子半径由大到小的顺序是:O2->F->Na+>Al3+;
(4)同一周期元素随原子序数的增大,元素的金属性逐渐减弱,非金属性逐渐增强;同一主族元素,原子序
数越大,元素的金属性越强,非金属性越弱。在上述元素中金属性最强的是Na元素,其形成的最高价氧
化物对应的水化物是NaOH;能够形成含氧酸的非金属性最强的元素是Cl元素,其形成的最高价含氧酸是
HClO,二者在水溶液中发生反应产生NaClO 和HO,反应的化学方程式为:NaOH+HClO
4 4 2 4
=NaClO +H O;
4 2
(5)③为O,⑤为Na,⑨为Cl,由这三种元素形成的一种常见的杀菌消毒剂是NaClO,该物质是离子化合
物,Na+与ClO-通过离子键结合,在阴离子ClO-中,Cl与O原子之间通过共价键结合,故该化合物中存在
的化学键有离子键、共价键;
(6)⑧为S,⑨为Cl,由元素⑧和⑨形成的某种化合物可表示为XY 是SCl,2个S原子通过一个共价键结
2 2 2 2
合,每个S原子分别与1个Cl原子结合,从而使分子中各个原子都达到最外层8个电子的稳定结构,其电
子式为: 。