文档内容
长春二实验中学高一上学期期中考试
化学试卷
考生注意:
1.满分 100分,考试时间75分钟。
2.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对
应题目的答案标号涂黑;非选择题请用直径 0.5毫米黑色墨水签字笔在答题卡上各题的答题区
域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
...........................
3.本卷命题范围:人教版必修第一册第一章至第二章。
可能用到的相对原子质量:H1 He4 C 12 N14 O16 Na 23 S 32 Cl35.5
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目
要求的。
1.1926年,中国永利碱厂用“联合制碱法”工艺生产的“红三角”牌纯碱获得美国费城万国博览会金奖。
确定此工艺流程的科学家是( )
A.门捷列夫 B.屠呦呦 C.凯库勒 D.侯德榜
2.硝酸铜的用途很多,可用作分析试剂、氧化剂、硝化剂、催化剂等。已知硝酸铜固体的物质的量,下列物
理量仍无法确定的是( )
A.体积 B.氮原子数 C.质量 D.硝酸根离子数
3.新制氯水在光照下逸出的气体是( )
A.氯气 B.氧气 C.氯化氢 D.水蒸气
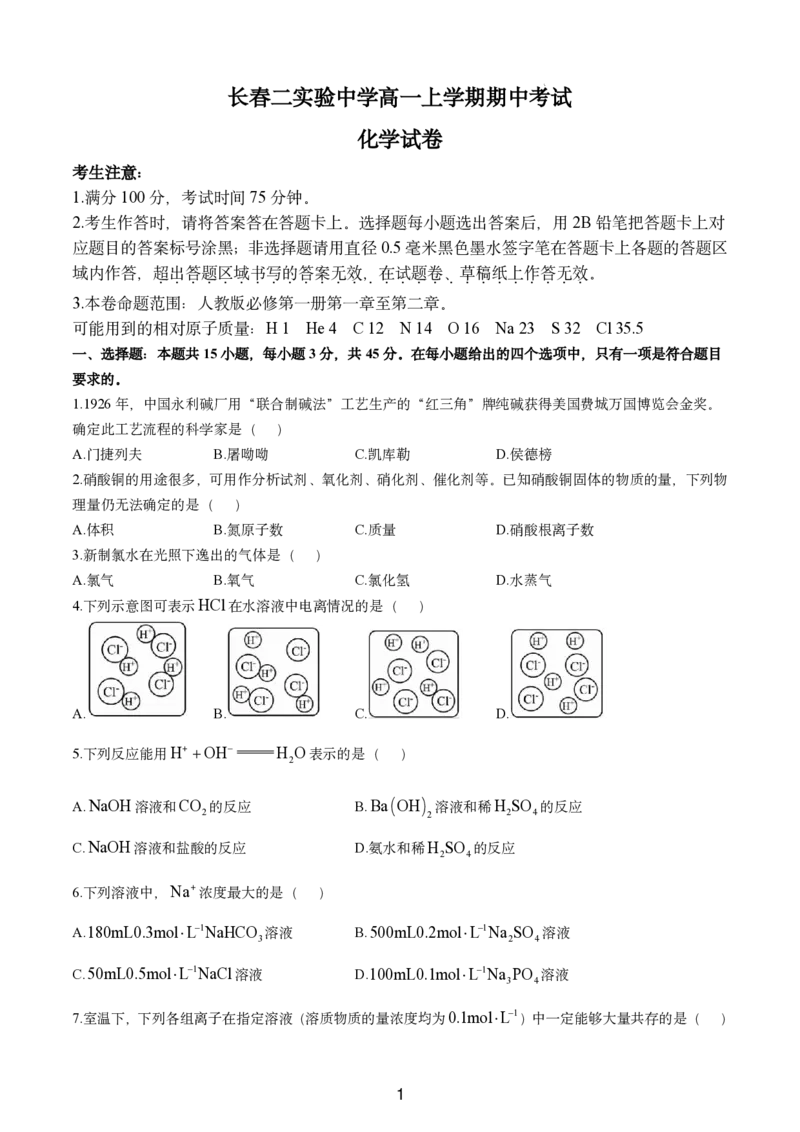
4.下列示意图可表示HCl在水溶液中电离情况的是( )
A. B. C. D.
5.下列反应能用H OH H O表示的是( )
2
A.NaOH溶液和CO 的反应 B.Ba OH 溶液和稀H SO 的反应
2 2 2 4
C.NaOH溶液和盐酸的反应 D.氨水和稀H SO 的反应
2 4
6.下列溶液中,Na
浓度最大的是( )
A.180mL0.3molL1NaHCO 溶液 B.500mL0.2molL1Na SO 溶液
3 2 4
C.50mL0.5molL1NaCl溶液 D.100mL0.1molL1Na PO 溶液
3 4
7.室温下,下列各组离子在指定溶液(溶质物质的量浓度均为0.1molL1
)中一定能够大量共存的是( )
学科网(北京)股份有限公司
1A.NaClO溶液:K 、Ca2 、Cl 、NO
3
B.NaCl溶液:H 、Ag 、Fe3 、NO
3
C.Na CO 溶液:Ba2 、K 、OH 、Cl
2 3
D.NaOH溶液:K 、Ca2 、HCO 、NO
3 3
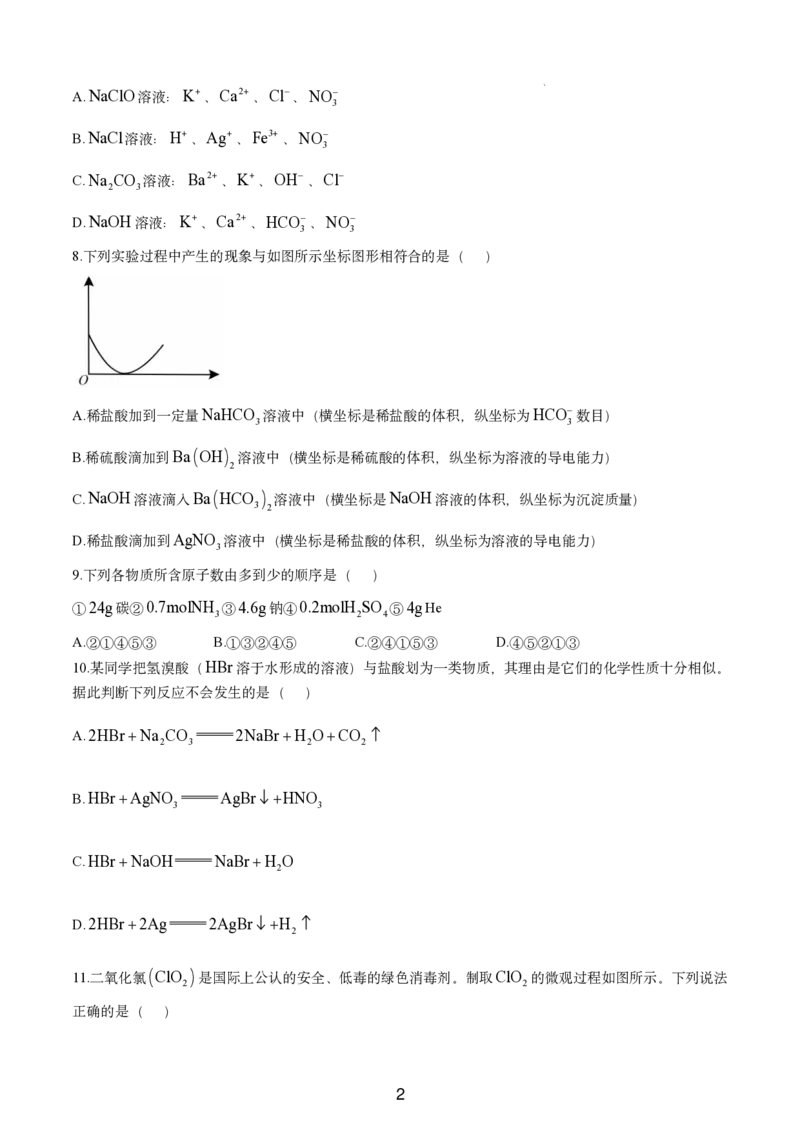
8.下列实验过程中产生的现象与如图所示坐标图形相符合的是( )
A.稀盐酸加到一定量NaHCO 溶液中(横坐标是稀盐酸的体积,纵坐标为HCO 数目)
3 3
B.稀硫酸滴加到Ba OH 溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力)
2
C.NaOH溶液滴入Ba HCO 溶液中(横坐标是NaOH溶液的体积,纵坐标为沉淀质量)
3 2
D.稀盐酸滴加到AgNO 溶液中(横坐标是稀盐酸的体积,纵坐标为溶液的导电能力)
3
9.下列各物质所含原子数由多到少的顺序是( )
①24g碳②0.7molNH ③4.6g钠④0.2molH SO ⑤4gHe
3 2 4
A.②①④⑤③ B.①③②④⑤ C.②④①⑤③ D.④⑤②①③
10.某同学把氢溴酸(HBr溶于水形成的溶液)与盐酸划为一类物质,其理由是它们的化学性质十分相似。
据此判断下列反应不会发生的是( )
A.2HBrNa CO 2NaBrH OCO
2 3 2 2
B.HBrAgNO AgBrHNO
3 3
C.HBrNaOH NaBrH O
2
D.2HBr2Ag 2AgBrH
2
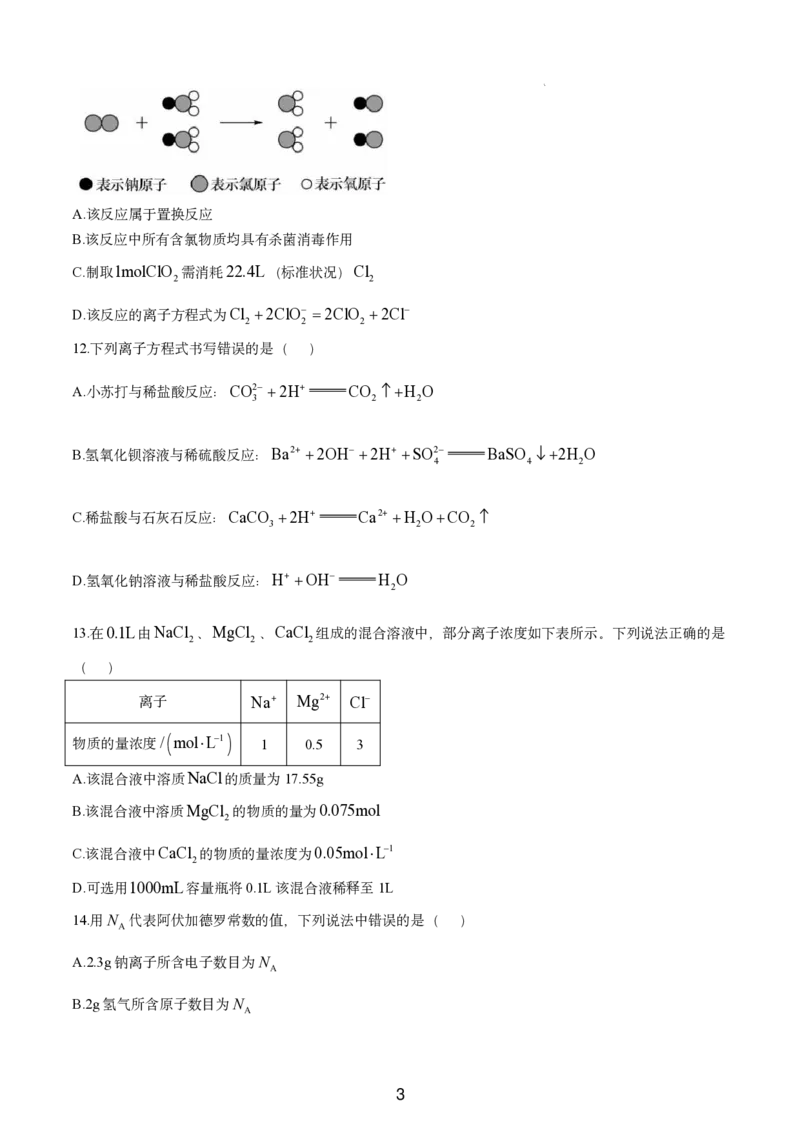
11.二氧化氯 ClO 是国际上公认的安全、低毒的绿色消毒剂。制取ClO 的微观过程如图所示。下列说法
2 2
正确的是( )
学科网(北京)股份有限公司
2A.该反应属于置换反应
B.该反应中所有含氯物质均具有杀菌消毒作用
C.制取1molClO 需消耗22.4L(标准状况)Cl
2 2
D.该反应的离子方程式为Cl 2ClO 2ClO 2Cl
2 2 2
12.下列离子方程式书写错误的是( )
A.小苏打与稀盐酸反应:CO2 2H CO H O
3 2 2
B.氢氧化钡溶液与稀硫酸反应:Ba2 2OH 2H SO2 BaSO 2H O
4 4 2
C.稀盐酸与石灰石反应:CaCO 2H Ca2 H OCO
3 2 2
D.氢氧化钠溶液与稀盐酸反应:H OH H O
2
13.在0.1L由NaCl 、MgCl 、CaCl 组成的混合溶液中,部分离子浓度如下表所示。下列说法正确的是
2 2 2
( )
离子 Na Mg2 Cl
物质的量浓度/ molL1 1 0.5 3
A.该混合液中溶质NaCl的质量为17.55g
B.该混合液中溶质MgCl 的物质的量为0.075mol
2
C.该混合液中CaCl 的物质的量浓度为0.05molL1
2
D.可选用1000mL容量瓶将0.1L该混合液稀释至1L
14.用N 代表阿伏加德罗常数的值,下列说法中错误的是( )
A
A.2.3g钠离子所含电子数目为N
A
B.2g氢气所含原子数目为N
A
学科网(北京)股份有限公司
3C.17gNH 所含的电子数为10N
3 A
D.N 个氧分子和N 个氢分子的质量比等于16:1
A A
15.某温度下,向a、b、c、d 中分别充入等质量的CH 、CO 、O 、SO 四种气体中的一种(已知:
4 2 2 2
密封隔板Ⅰ、Ⅱ、Ⅲ、IV可自由滑动,且与容器内壁不摩擦),如图所示。下列说法错误的是( )
A.c中充入的是O B.a和c中气体物质的量之比为1:2
2
C.a和d中气体的体积之比为1:5 D.c和d中气体密度之比为2:1
二、非选择题:本题共4小题,共55分。
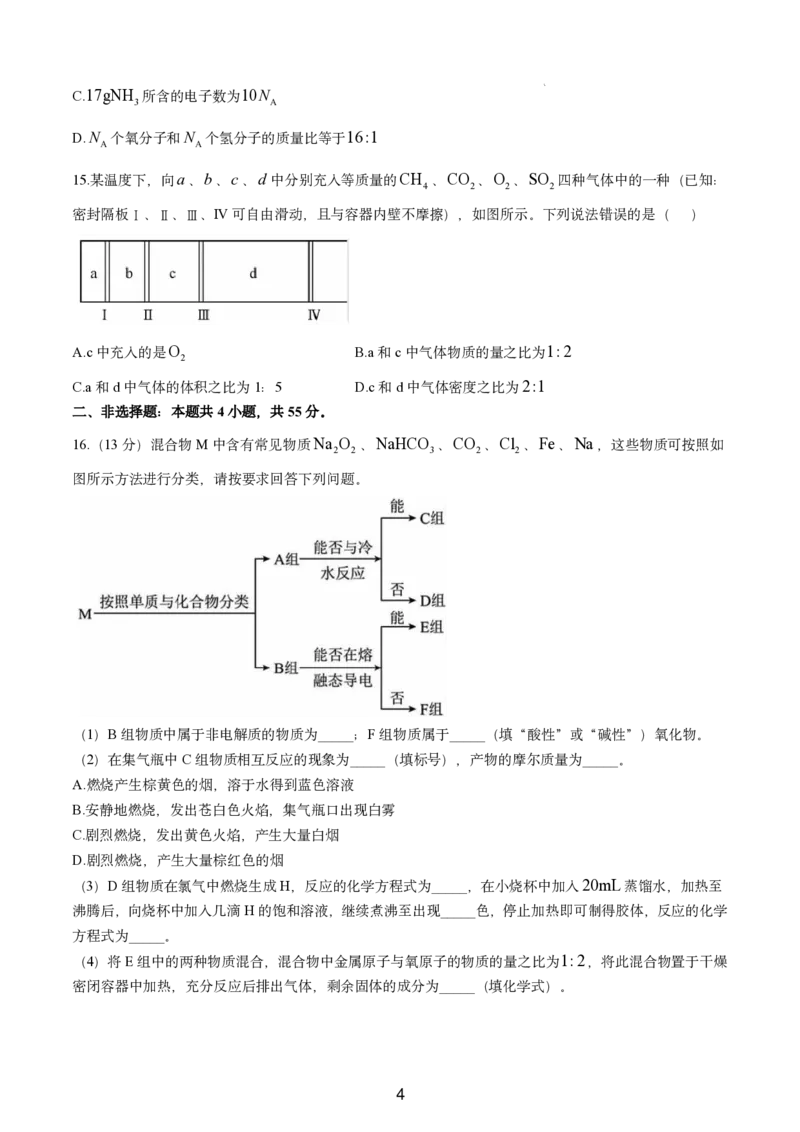
16.(13分)混合物M中含有常见物质Na O 、NaHCO 、CO 、Cl 、Fe、Na,这些物质可按照如
2 2 3 2 2
图所示方法进行分类,请按要求回答下列问题。
(1)B组物质中属于非电解质的物质为_____;F组物质属于_____(填“酸性”或“碱性”)氧化物。
(2)在集气瓶中C组物质相互反应的现象为_____(填标号),产物的摩尔质量为_____。
A.燃烧产生棕黄色的烟,溶于水得到蓝色溶液
B.安静地燃烧,发出苍白色火焰,集气瓶口出现白雾
C.剧烈燃烧,发出黄色火焰,产生大量白烟
D.剧烈燃烧,产生大量棕红色的烟
(3)D组物质在氯气中燃烧生成H,反应的化学方程式为_____,在小烧杯中加入20mL蒸馏水,加热至
沸腾后,向烧杯中加入几滴H的饱和溶液,继续煮沸至出现_____色,停止加热即可制得胶体,反应的化学
方程式为_____。
(4)将E组中的两种物质混合,混合物中金属原子与氧原子的物质的量之比为1:2,将此混合物置于干燥
密闭容器中加热,充分反应后排出气体,剩余固体的成分为_____(填化学式)。
学科网(北京)股份有限公司
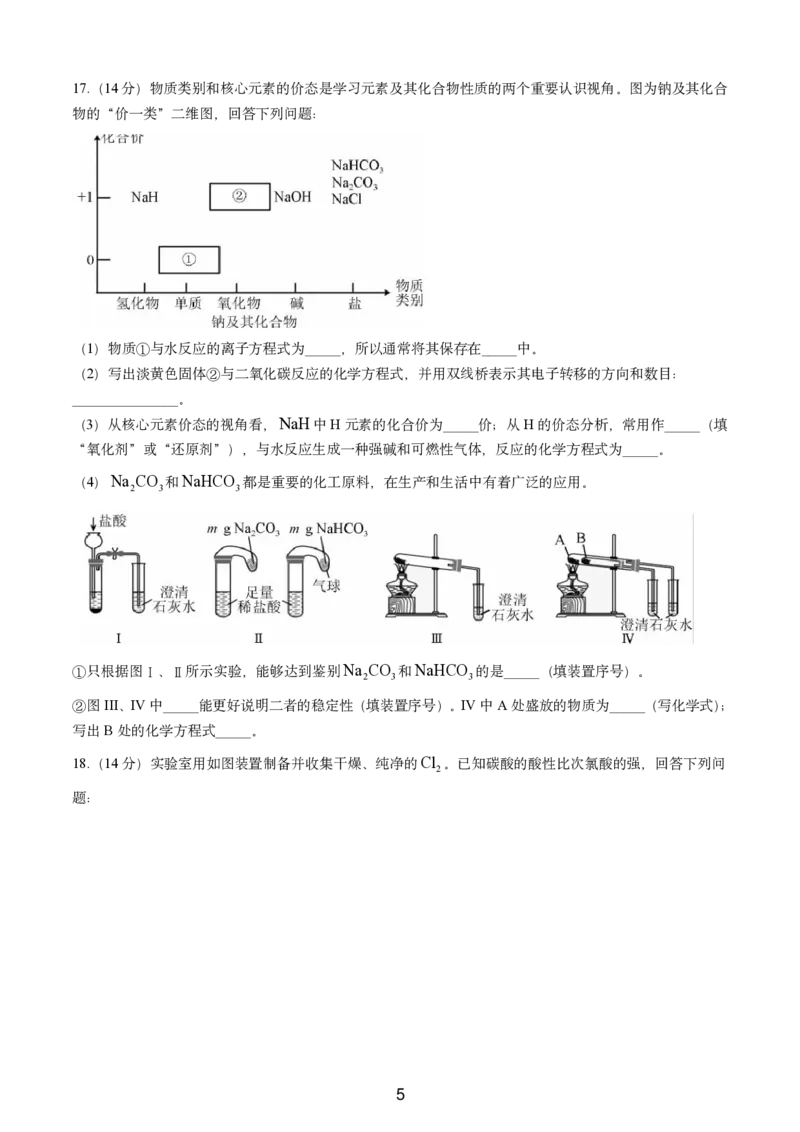
417.(14分)物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视角。图为钠及其化合
物的“价一类”二维图,回答下列问题:
(1)物质①与水反应的离子方程式为_____,所以通常将其保存在_____中。
(2)写出淡黄色固体②与二氧化碳反应的化学方程式,并用双线桥表示其电子转移的方向和数目:
_______________。
(3)从核心元素价态的视角看,NaH中H元素的化合价为_____价;从H的价态分析,常用作_____(填
“氧化剂”或“还原剂”),与水反应生成一种强碱和可燃性气体,反应的化学方程式为_____。
(4)Na CO 和NaHCO 都是重要的化工原料,在生产和生活中有着广泛的应用。
2 3 3
①只根据图Ⅰ、Ⅱ所示实验,能够达到鉴别Na CO 和NaHCO 的是_____(填装置序号)。
2 3 3
②图III、IV中_____能更好说明二者的稳定性(填装置序号)。IV中A处盛放的物质为_____(写化学式);
写出B处的化学方程式_____。
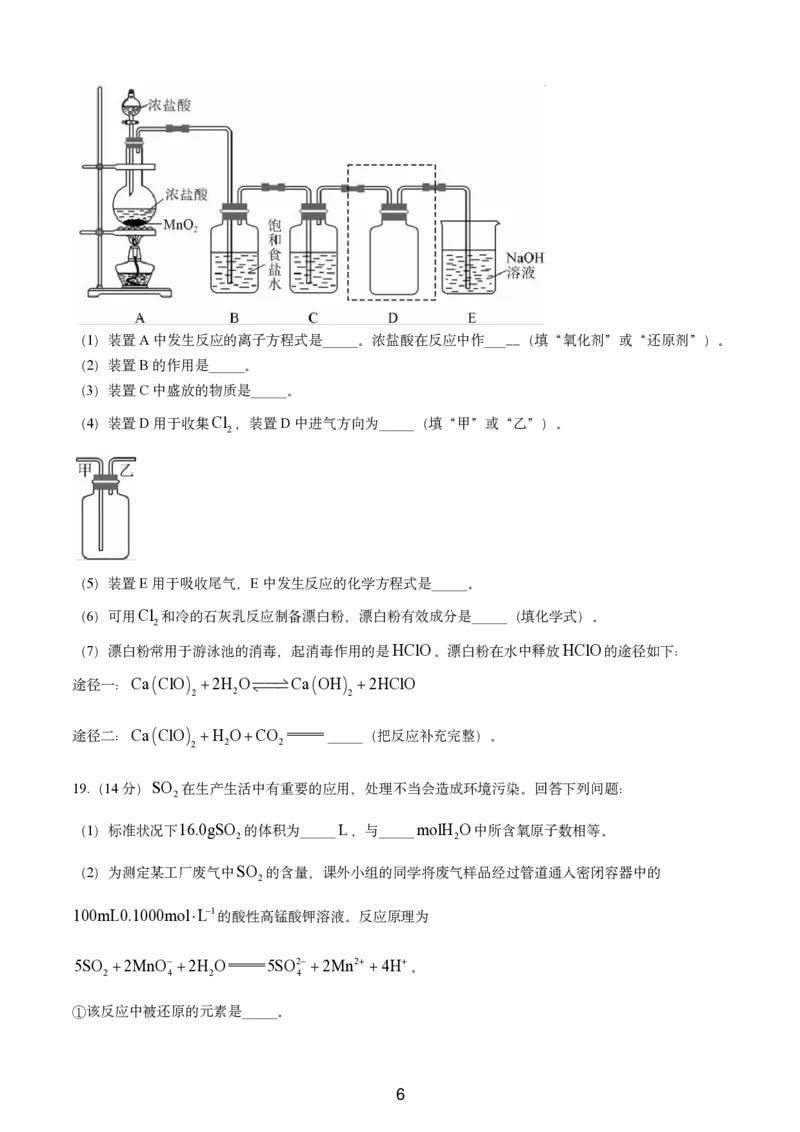
18.(14分)实验室用如图装置制备并收集干燥、纯净的Cl 。已知碳酸的酸性比次氯酸的强,回答下列问
2
题:
学科网(北京)股份有限公司
5(1)装置A中发生反应的离子方程式是_____。浓盐酸在反应中作_____(填“氧化剂”或“还原剂”)。
(2)装置B的作用是_____。
(3)装置C中盛放的物质是_____。
(4)装置D用于收集Cl ,装置D中进气方向为_____(填“甲”或“乙”)。
2
(5)装置E用于吸收尾气,E中发生反应的化学方程式是_____。
(6)可用Cl 和冷的石灰乳反应制备漂白粉,漂白粉有效成分是_____(填化学式)。
2
(7)漂白粉常用于游泳池的消毒,起消毒作用的是HClO。漂白粉在水中释放HClO的途径如下:
途径一:Ca ClO 2H O Ca OH 2HClO
2 2 2
途径二:Ca ClO H OCO _____(把反应补充完整)。
2 2 2
19.(14分)SO 在生产生活中有重要的应用,处理不当会造成环境污染。回答下列问题:
2
(1)标准状况下16.0gSO 的体积为_____L,与_____molH O中所含氧原子数相等。
2 2
(2)为测定某工厂废气中SO 的含量,课外小组的同学将废气样品经过管道通入密闭容器中的
2
100mL0.1000molL1
的酸性高锰酸钾溶液。反应原理为
5SO 2MnO 2H O 5SO2 2Mn2 4H 。
2 4 2 4
①该反应中被还原的元素是_____。
学科网(北京)股份有限公司
6②100mL该酸性高锰酸钾溶液恰好完全反应时,转移电子的数目为_____N 。
A
③若通入管道的废气样品为am3 时,酸性高锰酸钾溶液恰好褪色,则该废气样品中SO 的含量为
2
_____gm3 (用含a的表达式表示,假定样品中其他气体均不参与反应,SO 可被溶液充分吸收)。
2
④实验需240mL0.500molL1
的硫酸溶液,使用的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、_____;
需用量筒量取密度为1.84gcm3
,质量分数为98%的浓硫酸_____mL;若定容时俯视刻度线,则所配溶液
的浓度_____(填“偏高”“偏低”或“不变”)。
长春二实验中学高一上学期期中考试·
化学参考答案、提示及评分细则
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目
要求的。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 D A B D C C A B A D D A D B C
1.D“联合制碱法”由我国著名化学家侯德榜先生发明。
2.A硝酸铜固体标准状况下为固体,已知物质的量不能确定它的体积。
3.B
4.DHCl分子是强电解质,在水溶液中完全电离,电离方程式为HCl H Cl ,D正确。
5.C氢氧化钠和二氧化碳反应的离子方程式为CO 2OH CO2 H O,A错误;Ba OH 溶液
2 3 2 2
和稀H SO 反应的离子方程式为2H 2OH SO2 Ba2 BaSO 2H O,B错误;氨水是弱
2 4 4 4 2
碱,与稀H SO 反应的离子方程式为NH H OH NH H O,D错误。
2 4 3 2 4 2
6.CNa 的物质的量浓度与各溶液的体积无关,根据有关物质的化学式可知,Na
的物质的量浓度最大的是
0.5molL1NaCl溶液。
7.AAg 与Cl 不能大量共存,B错误;Ba2 与CO2 不能大量共存,C错误;OH 与HCO
不能大量共
3 3
存,D错误。
8.B稀盐酸加到一定量NaHCO 溶液中发生反应生成氯化钠、水和二氧化碳,HCO 的数目不断减少,减
3 3
学科网(北京)股份有限公司
7
少到0后不再增加,A错误;稀硫酸滴加到Ba OH 溶液中发生反应生成硫酸钡沉淀和水,溶液中的离子
2
浓度不断减小,两者恰好反应时离子浓度达到最小值,继续加入稀硫酸,离子浓度又逐渐增大,溶液的导
电能力先减小后增大,B正确;NaOH溶液滴入Ba HCO 溶液中生成碳酸钡沉淀,沉淀质量从0逐渐
3 2
增大到最大值后不变,C错误;稀盐酸滴加到AgNO 溶液中生成氯化银沉淀和硝酸,溶液中的离子浓度不
3
会减小到0再增大,溶液的导电能力也不会减小到0再增大,D错误。
9.A①24g碳中所含 C原子的物质的量为2mol,原子数为2N ;②0.7molNH 含有原子的物质的量为
A 3
2.8mol,原子数为2.8N ;③4.6g钠中含有原子的物质的量为0.2mol,原子数为0.2N ;④0.2molH SO
A A 2 4
含有原子的物质的量为1.4mol,原子数为1.4N ;5.4gHe的物质的量为1mol,原子数为N 。则所含原
A A
子数由多到少的顺序为②①④⑤③。
10.D盐酸和碳酸钠反应生成氯化钠、二氧化碳、水,所以氢溴酸和碳酸钠反应生成溴化钠、二氧化碳、水,
反应的方程式为2HBrNa CO 2NaBrH OCO ,A正确;盐酸和硝酸银反应生成氯化银
2 3 2 2
沉淀,所以氢溴酸和硝酸银反应生成溴化银沉淀,反应方程式是HBrAgNO AgBr HNO ,B
3 3
正确;盐酸和氢氧化钠反应生成氯化钠和水,所以氢溴酸和氢氧化钠反应生成溴化钠和水,反应的方程式
是HBrNaOH NaBrH O,C正确;银和盐酸不反应,所以银和氢溴酸也不反应,D错误。
2
11.D根据微观过程示意图可知,反应的化学方程式:Cl 2NaClO 2ClO 2NaCl,根据置换反
2 2 2
应定义可知,该反应不属于置换反应,A错误;反应中并不是所有含氯物质都具有杀菌消毒作用,如氯化
钠无氧化性,不能杀菌消毒,B错误;根据化学方程式可知,生成1molClO ,消耗0.5molCl ,标准状况
2 2
下 对 应 体 积 为 11.2L , C 错 误 ; 由 该 反 应 的 化 学 方 程 式 可 知 , 反 应 的 离 子 方 程 式 :
Cl 2ClO 2ClO 2Cl ,D正确。
2 2 2
12.A小苏打与稀盐酸反应的离子方程式为HCO H CO H O,A错误。
3 2 2
13.D由表可知,c Na 1molL1 ,该混合液中,NaCl的质量为5.85g,A错误;c Mg2 0.5molL1 ,
含溶质MgCl 的物质的量为0.05mol,B错误;氯化钠提供的氯离子的物质的量为0.1mol,氯化镁提供的
2
学科网(北京)股份有限公司
8氯 离 子 的 物 质 的 量 为 0.1mol , 根 据 氯 离 子 守 恒 , 由 CaCl 提 供 的
2
n Cl 0.3mol0.1mol0.1mol0.1mol,则n CaCl 0.05mol,c CaCl 0.5molL1 ,C错
2 2
误;先将0.1L该混合液倒入烧杯中,加水稀释并恢复至室温后,转移到1000mL容量瓶中,定容后备用,
D正确。
14.B2.3g钠离子含电子数目为N ,A正确;2gH 中含2N H原子,B错误;17gNH 含电子数目为10N ,
A 2 A 3 A
C正确;N 个O 分子的质量为32g,N 个H 分子的质量为2g,质量之比为16:1,D正确。
A 2 A 2
1 1 1
15.C设CH 、CO 、O 、SO 四种气体的质量均为1g,则它们的物质的量分别为 mol、 mol、 mol、
4 2 2 2 16 44 32
1
mol,相同情况下的物质的量之比等于气体的体积之比,则a,b,c,d分别盛装的是SO 、CO 、O 、
64 2 2 2
CH ,A正确;A和C中气体分别为SO 和O ,物质的量之比为1:2,B正确;A和D中气体分别为SO
4 2 2 2
和CH ,物质的量之比等于气体的体积之比,气体的体积之比为1:4,C错误;C和D中气体分别是O 和
4 2
CH ,密度之比等于相对分子质量之比为2:1,D正确。
4
二、非选择题:本题共4小题,共55分。
16.(1)CO (1分)酸性(1分)
2
(2)C(2分)58.5gmol1
(1分)
△ △
(3)2Fe3Cl 2FeCl 红褐 FeCl 3H O Fe OH (胶体)3HCl(各2分)
2 3 3 2 3
(4)Na CO (2分)
2 3
17.(1)2Na2H O 2Na2OHH (2分)煤油或石蜡油(1分)
2 2
(2) (2分)
(3)-1(1分)还原剂(1分)NaHH O NaOHH (2分)
2 2
△
(4)①II(1分)②IV(1分)Na CO (1分)2NaHCO Na CO H OCO (2分)
2 3 3 2 3 2 2
学科网(北京)股份有限公司
9△
18.(1)2Cl 4H MnO Mn2 Cl 2H O(2分)还原剂(1分)
2 2 2
(2)除去Cl 中混有的HCl(2分)
2
(3)浓硫酸(2分)
(4)甲(1分)
(5)Cl 2NaOH NaClNaClOH O(2分)
2 2
(6)Ca ClO (2分)
2
(7)CaCO 2HClO(2分)
3
1.6
19.(1)5.60.5(2)①Mn(或锰)(1分)②0.05③ ④250mL容量瓶 6.8 偏高(1分,除标注外,每
a
空2分)
学科网(北京)股份有限公司
10