文档内容
5.1.1 硫和二氧化硫 练习(解析版)
1.下列有关说法正确的是( )
A.因为硫单质具有氧化性,故铁粉与硫粉共热可以生成Fe S
2 3
B.硫在空气中燃烧的产物是SO ,在纯氧中燃烧的产物是SO
2 3
C.SO 的水溶液能导电,所以SO 是电解质
2 2
D.二氧化硫可用于抑制酒类中细菌的生长,可在葡萄酒中微量添加
【答案】D
【解析】A. 因为硫单质具有氧化性,但氧化性不强,铁粉与硫粉共热生成FeS,A错误;
B. 硫在空气中燃烧的产物是SO ,在纯氧中燃烧的产物也是SO ,B错误;
2 2
C. SO 的水溶液能导电,因为二氧化硫与水反应生成亚硫酸,亚硫酸是电解质,二氧化硫不是电解
2
质,C错误;
D. 二氧化硫可用于抑制酒类中细菌的生长,可在葡萄酒中微量添加,D正确;
2.下列关于硫的叙述中不正确的是( )
A.试管内壁附着的硫可用二硫化碳溶解除去
B.硫在自然界中只能以硫化物和硫酸盐的形态存在
C.化石燃料的大量燃烧是空气中二氧化硫含量升高的原因
D.分离黑火药中的硝酸钾、木炭、硫要用到二硫化碳、水及过滤操作
【答案】B
【解析】A、硫是一种不溶于水的黄色晶体,易溶于二硫化碳,试管内壁附着的硫可用二硫化碳溶
解除去,故A不符合题意;
B、在自然界中硫的存在形式有游离态和化合态,单质硫主要存在于火山周围的地域中,以化合态
存在的硫多为矿物,可分为硫化物矿和硫酸盐矿,故B符合题意;
C、化石燃料中含有大量硫元素,在空气中燃烧过程中会释放大量二氧化硫气体,因此化石燃料的
大量燃烧是空气中二氧化硫含量升高的原因,故C不符合题意;
D、硝酸钾易溶于水,木炭和硫单质不溶于水,因此可以先将固体溶于水,然后过滤,再将滤渣溶
于二硫化碳,然后过滤分离硫单质和木炭,故D不符合题意;
3.下列说法中不正确的是( )
A.硫是一种黄色的能溶于水的固体
B.硫在自然界中既有化合态又有游离态存在
C.硫跟铁反应生成硫化亚铁
D.硫在空气中的燃烧产物是二氧化硫
【答案】A
【解析】A.硫难溶于水,微溶于酒精,易溶于二硫化碳,A错误;
B.硫在自然界中既有化合态又有游离态存在,火山口存在硫磺,B正确;
C.变价金属和硫反应生成低价态化合物,铁和硫加热生成硫化亚铁,C正确;
D.硫和氧气点燃生成二氧化硫,D正确;
4.关于SO 的叙述中正确的是 ( )。
2A.在有的反应中显示氧化性,在有的反应中显示还原性
B.是酸性氧化物,溶于水得稳定的亚硫酸
C.SO 气体通入NaOH溶液一定得到NaSO
2 2 3
D.SO 气体通入BaCl 溶液中,能生成白色沉淀
2 2
【答案】 A
【解析】亚硫酸不稳定,易分解,B项错;SO 与NaOH反应还可能生成NaHSO ,C项错;SO 与
2 3 2
BaCl 溶液不反应, D项错。
2
5.将SO 气体通入显红色的酚酞试液中,发现红色消失,主要是因为SO ( )。
2 2
A.有漂白性 B.有还原性
C.有氧化性 D.溶于水后溶液显酸性
【答案】 D
【解析】SO 与水反应生成HSO ,使溶液碱性减弱,红色消失。
2 2 3
6.银耳本身为淡黄色,某地生产的一种“雪耳”,颜色洁白如雪。制作如下:将银耳堆放在密闭
状态良好的塑料棚内,棚的一端支口小锅,锅内放有硫磺,加热使硫磺熔化并燃烧,两天左右,
“雪耳”就制成了。“雪耳”炖而不烂,对人体有害,制作“雪耳”利用的是
A.硫的还原性 B.硫的漂白性
C.二氧化硫的还原性 D.二氧化硫的漂白性
【答案】D
【解析】试题分析:硫磺熔化并燃烧,产生二氧化硫,利用二氧化硫的漂白性,淡黄色的银耳被漂
白之后洁白如雪,故选D。
7.检验 SO 气体中是否混有 CO 气体,可采用的方法是( )
2 2
A.通过品红溶液
B.通过澄清石灰水
C.先通过足量酸性 KMnO 溶液,再通过澄清石灰水
4
D.先通过 NaOH 溶液,再通过澄清石灰水
【答案】C
【解析】A、因品红溶液检验的是二氧化硫,故A错误;
B、因不管有没有CO 都会产生白色沉淀:CO+ Ca(OH) =CaCO ↓+H O,SO +
2 2 2 3 2 2
Ca(OH) =CaSO ↓+H O,不能验证有无CO,故B错误;
2 3 2 2
C、KMnO 酸性溶液将SO 完全吸收,若有白色沉淀一定有CO,若无沉淀则无CO,所以C选项
4 2 2 2
是正确的;
D、SO 和CO 都与NaOH溶液:CO+ 2NaOH=Na CO+H O,SO + 2NaOH=Na SO +H O,所以不
2 2 2 2 3 2 2 2 3 2
管是否混有CO 都不会产生白色沉淀,故D错误。
2
所以C选项是正确的。
8.下列离子方程式正确的是 ( )。
A.向NaOH溶液中通入少量的SO
2
SO +OH-===HSO
2
B.向氯水中通入少量的SO
2Cl+SO +2HO===4H++2Cl-+SO
2 2 2
C.将SO 通入到饱和的NaHCO 溶液中
2 3
2H++CO===HO+CO↑
2 2
D.将SO 通入到BaCl 溶液中
2 2
SO +HO+Ba2+===BaSO ↓+2H+
2 2 3
【答案】B
【解析】A应为SO +2OH-===SO+HO;C应为2HCO+SO ===SO+2CO↑+HO;D不反应。
2 2 2 2 2
催化剂
△
9.对于反应2SO +O 2SO 的叙述不正确的是 ( )。
2 2 3
A.该反应是可逆反应
B.反应方程式中“ ”表示在相同条件下,反应可以同时向两个方向进行
C.1 mol O 与2 mol SO 混合反应,可生成2 mol SO
2 2 3
D.在该反应中SO 作还原剂
2
【答案】C
【解析】根据可逆反应的特点,1 mol O 和2 mol SO 反应,不可能生成2 mol SO 。
2 2 3
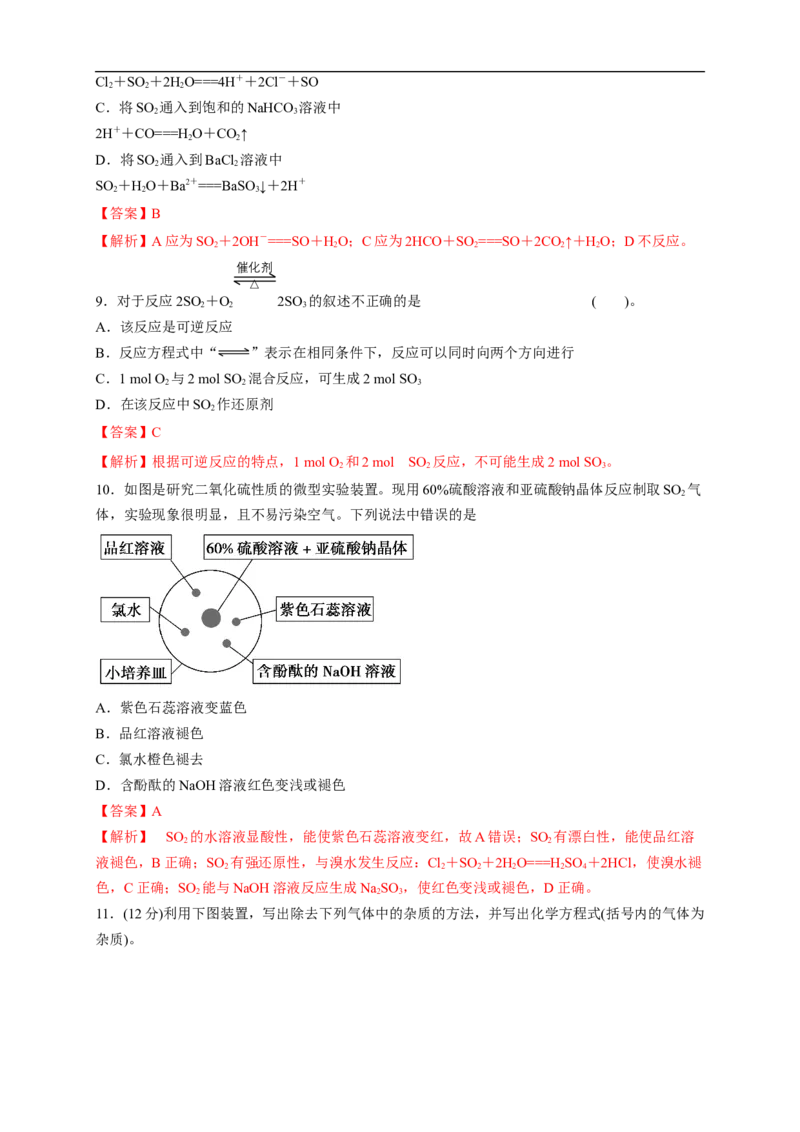
10.如图是研究二氧化硫性质的微型实验装置。现用60%硫酸溶液和亚硫酸钠晶体反应制取SO 气
2
体,实验现象很明显,且不易污染空气。下列说法中错误的是
A.紫色石蕊溶液变蓝色
B.品红溶液褪色
C.氯水橙色褪去
D.含酚酞的NaOH溶液红色变浅或褪色
【答案】A
【解析】 SO 的水溶液显酸性,能使紫色石蕊溶液变红,故A错误;SO 有漂白性,能使品红溶
2 2
液褪色,B正确;SO 有强还原性,与溴水发生反应:Cl+SO +2HO===H SO +2HCl,使溴水褪
2 2 2 2 2 4
色,C正确;SO 能与NaOH溶液反应生成NaSO ,使红色变浅或褪色,D正确。
2 2 3
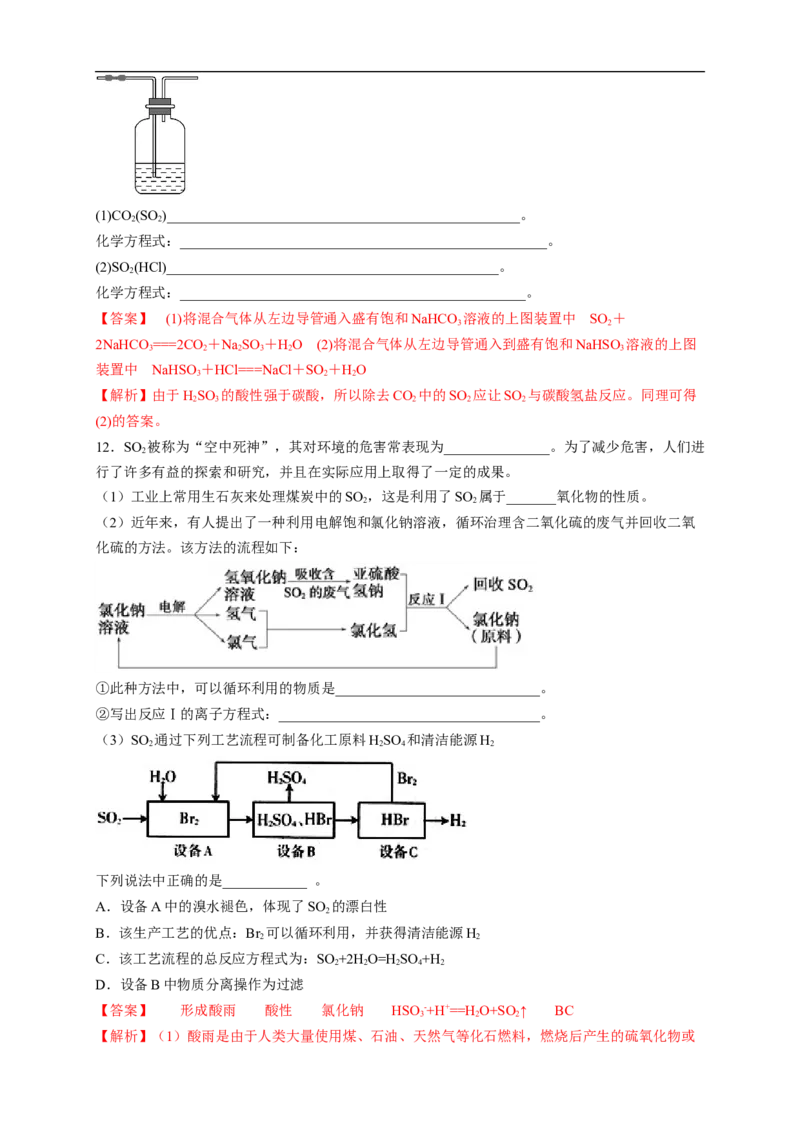
11.(12分)利用下图装置,写出除去下列气体中的杂质的方法,并写出化学方程式(括号内的气体为
杂质)。(1)CO (SO )__________________________________________________。
2 2
化学方程式:____________________________________________________。
(2)SO (HCl)_______________________________________________。
2
化学方程式:_________________________________________________。
【答案】 (1)将混合气体从左边导管通入盛有饱和NaHCO 溶液的上图装置中 SO +
3 2
2NaHCO ===2CO +NaSO +HO (2)将混合气体从左边导管通入到盛有饱和NaHSO 溶液的上图
3 2 2 3 2 3
装置中 NaHSO+HCl===NaCl+SO +HO
3 2 2
【解析】由于HSO 的酸性强于碳酸,所以除去CO 中的SO 应让SO 与碳酸氢盐反应。同理可得
2 3 2 2 2
(2)的答案。
12.SO 被称为“空中死神”,其对环境的危害常表现为_______________。为了减少危害,人们进
2
行了许多有益的探索和研究,并且在实际应用上取得了一定的成果。
(1)工业上常用生石灰来处理煤炭中的SO ,这是利用了SO 属于_______氧化物的性质。
2 2
(2)近年来,有人提出了一种利用电解饱和氯化钠溶液,循环治理含二氧化硫的废气并回收二氧
化硫的方法。该方法的流程如下:
①此种方法中,可以循环利用的物质是_____________________________。
②写出反应Ⅰ的离子方程式:_____________________________________。
(3)SO 通过下列工艺流程可制备化工原料HSO 和清洁能源H
2 2 4 2
下列说法中正确的是____________ 。
A.设备A中的溴水褪色,体现了SO 的漂白性
2
B.该生产工艺的优点:Br 可以循环利用,并获得清洁能源H
2 2
C.该工艺流程的总反应方程式为:SO +2H O=HSO +H
2 2 2 4 2
D.设备B中物质分离操作为过滤
【答案】 形成酸雨 酸性 氯化钠 HSO -+H+==H O+SO ↑ BC
3 2 2
【解析】(1)酸雨是由于人类大量使用煤、石油、天然气等化石燃料,燃烧后产生的硫氧化物或氮氧化物,在大气中经过复杂的化学反应后形成,酸雨对生物有极大的危害,因此被称为“空中死
神”;二氧化硫是酸性氧化物,二氧化硫和CaO反应生成亚硫酸钙;亚硫酸钙不稳定,极易被空
气中氧气氧化生成硫酸钙;(2)①根据图知,用氯化钠溶液电解得到NaOH、氯气、氢气,亚硫
酸氢钠和稀盐酸反应生成氯化钠、二氧化硫和水,因此能循环利用的物质是氯化钠;②亚硫酸氢钠
和稀盐酸发生复分解反应生成氯化钠、二氧化硫和水,离子反应方程式为HSO -+H+=HO+SO ↑;
3 2 2
(3)A. 设备A中的溴水褪色,体现了SO 的还原性,A错误;B. 反应前消耗溴,反应后生成溴,
2
因此该生产工艺的优点:Br 可以循环利用,并获得清洁能源H,B正确;C. 根据起始原料和最终
2 2
产品可知该工艺流程的总反应方程式为:SO +2H O=HSO +H ,C正确;D. 硫酸和氢溴酸互溶,
2 2 2 4 2
设备B中物质分离操作应该是蒸馏,不能为过滤,D错误,答案选BC。