文档内容
第五章 化工生产中的重要非金属元素
单元测试卷
时间:90分钟 满分:100分
一、 选择题(本题共12小题,每小题4分,共48分。每小题只有一个选项符合题意)
1.氮的固定是指( )
A.植物从土壤中吸收氮肥
B.大豆的根瘤菌将含氮的化合物转变为植物蛋白质
C.将空气中的氮气转变为氮的化合物
D.硝酸和氨气反应生成氮肥
【答案】C
【解析】A.植物从土壤中吸收氮肥,氮肥是指含氮的盐类.盐是化合物,不是氮气单质。植物从土壤中
吸收盐中的氮元素,显然不是将游离态的氮转化为化合态的氮,A错误;
B.大豆的根瘤菌将含氮的化合物转变为植物蛋白质,不属于氮的固定。因为大豆的根瘤菌转变成植物蛋
白的氮是化合物中的氮进行转变的,B错误;
C.将空气中的氮气转变为氮的化合物,氮气是单质,是游离态的氮,转变为化合态符合氮的固定定义,C
正确;
D.硝酸和氨气反应生成氮肥,硝酸、氨气、氮肥均为化合物,均为化合态的氮,显然不是将游离态的氮
转化为化合态的氮,D错误;
答案选C。
2.下列有关实验原理或实验操作正确的是
A.喷泉实验 B.收集NO
2
C.制备SO D.除去Cl 中的HCl
2 2【答案】D
【解析】A.氮气不溶于水,不能形成喷泉实验,故A错误;
B.二氧化氮与水反应,不能排水法收集,故B错误;
C.Cu与稀硫酸不反应,不能制备二氧化硫,故C错误;
D.HCl极易溶于水,食盐水可抑制氯气的溶解,导管长进短出、洗气可分离,故D正确;
3.你认为减少酸雨产生的途径可采取的措施是( )
①减少煤作燃料 ②造高工厂烟囱 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
【答案】C
【解析】①用煤作燃料会产生二氧化硫、氮氧化物,造成酸雨,所以减少煤作燃料可减少酸雨的形成,①
合理;
②把工厂烟囱造高不能减少二氧化硫、氮氧化物的产生,即不能减缓酸雨污染,②不合理;
③燃料脱硫处理可减少含硫物质的排放,可减少二氧化硫的形成,③合理;
④在已经酸化的土壤中加石灰,可以改良土壤,但不能减缓酸雨污染,④不合理;
⑤开发新能源可以减少煤、石油的使用,因而可减少酸雨的形成,故⑤合理;
故正确说法是①③⑤,选项C合理。
4.下列方法适合实验室制取氨气的是
A.N 和H 催化加热制取氨气
2 2
B.加热NH HCO 制取氨气
4 3
C.将浓氨水向生石灰固体上滴加
D.将NH Cl稀溶液和NaOH稀溶液混合
4
【答案】C
【解析】A.氮气与氢气化合生成氨气为可逆反应,不能进行到底,得到产物不纯净,且条件要求高,适
合工业制备氨气,不适合实验室制备,故A错误。
B.氯化铵受热分解生成氨气和二氧化碳,二氧化碳影响氨气的收集,所以不适合实验室制备,故B错误。
C.浓氨水向生石灰固体上滴加使氨水平衡朝着正方向移动,有利于NH 生成,可以用来制备氨气,故C正
3
确。
D.将NH Cl溶液和NaOH溶液混合,生成一水合氨和氯化钠,得不到氨气,故D错误。
4
5.用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是 ( )
①幕布的着火点升高 ②幕布的质量增加
③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气A.①② B.③④ C.①③ D.②④
【答案】B
【解析】氯化铵分解吸收热量,能降低火焰温度,达不到幕布的着火点;并且分解产物氯化氢和氨气能隔
绝空气,均破坏了可燃物的燃烧条件,故能使幕布不易着火,答案选B。
6.下列关于化学与生产、生活的认识错误的是
A.CO、SO 、N 等均是造成温室效应的气体
2 2 2
B.节能减排符合低碳经济的要求
C.使用清洁能源是防止酸雨发生的重要措施之一
D.大量焚烧田间秸秆会污染空气
【答案】A
【解析】A.CO、CH 和氮氧化合物都是形成温室效应的气体,SO 、N 不是形成温室效应的气体,故A
2 4 2 2
错误;
B.节能减排可以减少CO 的排放,符合低碳经济的要求,故B正确;
2
C.酸雨主要由化石燃料燃烧产生的二氧化硫、氮氧化物等酸性气体形成的,使用清洁能源减少了二氧化
硫、氮氧化物的排放,所以使用清洁能源是防止酸雨发生的重要措施之一,故C正确;
D.焚烧秸秆会造成大气污染,产生一氧化碳等,故D正确;
7.下列离子的检验方法中,正确的是
A.先用盐酸酸化,再加AgNO 溶液产生白色沉淀,则原溶液中存在Cl-离子
3
B.先加过氧化氢溶液,再加硫氰化钾溶液,产生血红色,则原溶液中存在Fe2+离子
C.加入足量的盐酸溶液,产生无色无味的气体,且能使澄清石灰水变浑浊,则原溶液中存在CO2-离子
3
D.加入过量盐酸酸化,无沉淀产生,再加入BaCl 溶液,产生白色沉淀,则说明原溶液中存在SO 2-离子
2 4
【答案】D
【解析】A.加入盐酸,引入氯离子,应加入硝酸酸化,故A错误;
B.先加过氧化氢溶液,不能说明原溶液中是否存在Fe2+离子,应先加硫氰化钾,溶液不变红,再加过氧
化氢溶液变红,才能检验原溶液中含有Fe2+,故B错误;
C.加入足量的盐酸溶液,产生无色无味的气体,且能使澄清石灰水变浑浊,该气体为二氧化碳,原溶液
中可能含有CO2-离子或者碳酸氢根离子,所以原溶液中不一定存在CO2-,故C错误;
3 3
D.先加入过量HCl酸化,排除干扰离子,然后再向澄清液中加入BaCl 溶液,产生白色沉淀,该白色沉淀
2
一定为硫酸钡,则说明原溶液中一定存在SO 2-离子,故D正确;
4
8.氨水显弱碱性的主要原因是( )
A.通常状况下,氨的溶解度不大B.氨水中的一水合氨少量电离
C.溶于水的氨分子只有少量发生电离
D.氨本身的碱性弱
【答案】B
【解析】A. 气体的溶解度与溶液酸碱性无关,A错误;
B. 氨水溶液中存在一水合氨的电离平衡,溶液呈碱性是因为电离出了氢氧根离子,c(H+)<c(OH-),B
正确;
C. 溶液碱性与溶液中氢氧根离子浓度和氢离子浓度的大小有关,且氨气分子不电离,C错误;
D. 氨气本身无碱性,是溶液中生成的一水合氨电离出氢氧根离子,D错误;
9.下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
选项 陈述Ⅰ 陈述Ⅱ
A S有可燃性 S在纯氧中燃烧生成SO
3
B SiO 有导电性 SiO 可用于制备光导纤维
2 2
C 浓硫酸有强氧化性 浓硫酸可用于干燥H 和CO
2
D Fe3+有氧化性 FeCl 溶液可用于回收废旧电路板中的铜
3
A.A B.B C.C D.D
【答案】D
【解析】A. S无论在空气中还是在纯氧中燃烧都生成SO ,故A错误;
2
B. 制备光导纤维的材料是SiO,SiO 属于共价化合物,不导电,光导纤维是对光全反射原理,传导光信号,
2 2
故B错误;
C. 浓硫酸作干燥剂,利用浓硫酸的吸水性,不是强氧化性,故C错误;
D. Fe3+与Cu发生2Fe3++Cu=Cu2++2Fe2+,利用Fe3+的强氧化性,故D正确;
10.下列物质都具有漂白性,漂白原理与其它几种不同的是( )
A.氯水 B.SO C.HO D.HClO
2 2 2
【答案】B
【解析】二氧化硫漂白原理是它与有色物质化合生成不稳定的无色物质;氯水、双氧水、次氯酸具有强氧
化性能使有色物质褪色,故选B。
11.下图是进行气体性质实验的常用装置,液体一定不能充满试管的是A.若a为水,b是HCl B.若a为水,b是NO
2
C.若a为水(滴有酚酞),b是NH D.若a为NaOH溶液,b是Cl
3 2
【答案】B
【解析】A. HCl极易溶于水,所以若a为水,b是HCl,液体会充满试管,A不符合题意;
B. NO 与HO会发生反应:3NO +H O=2HNO +NO,反应产生NO不能溶于水,因此液体一定不能充满试
2 2 2 2 3
管,B符合题意;
C. 若a为水(滴有酚酞),b是NH ,由于氨气极易溶于水,所以液体会充满试管,C不符合题意;
3
D. 若a为NaOH溶液,b是Cl,Cl 与NaOH会发生反应:Cl+2NaOH=NaCl+NaClO+H O,反应产生的物
2 2 2 2
质都易溶于水,因此液体会充满试管,D不符合题意;
12.如图是某硫酸试剂瓶标签上的部分文字。据此,下列说法正确的是( )
A.该硫酸的物质的量浓度为9.2 mol/L
B.1 mol Zn与足量的该硫酸反应生成2 g氢气
C.该硫酸与等体积水混合所得溶液的物质的量浓度等于9.2 mol/L
D.向50 mL该硫酸溶液中加入足量的铜片,加热充分反应后,被还原的硫酸的物质的量小于0.46 mol
【答案】D
【解析】A.该硫酸的物质的量浓度为c= = =18.4mol/L,错误;
B.浓硫酸和Zn反应不生气氢气,生成SO 和水,错误;
2
C.该浓硫酸和等体积的水混合后溶液体积不是原来的2倍,所以物质的量浓度不是9.2mol/L,错误;
D.50mL浓硫酸的物质的量为0.05L×18.4mol/L=0.92mol,浓硫酸和铜反应:Cu+2H SO (浓)
2 4
CuSO +SO↑+2H O,被还原的硫酸的物质的量是反应的硫酸的物质的量的一半,但随着反应的进行,硫酸
4 2 2浓度降低,稀硫酸和铜不反应,所以被还原的硫酸的物质的量小于0.46mol,正确;
二、非选择题
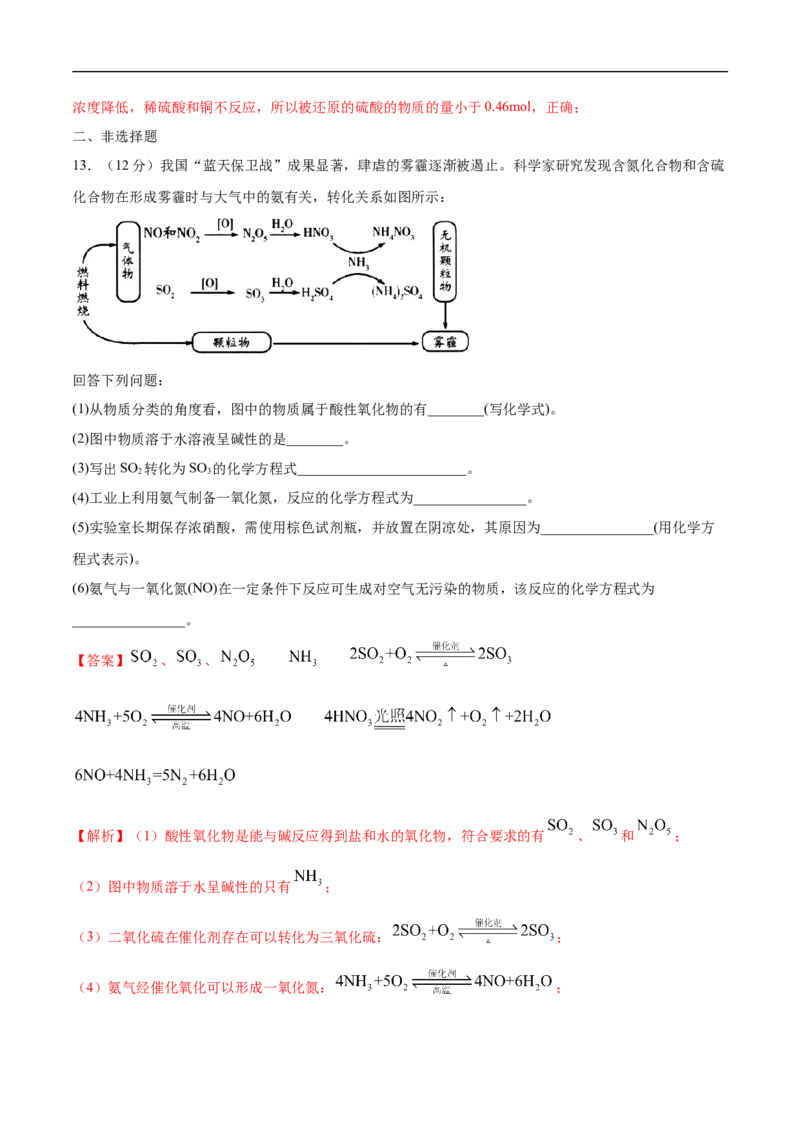
13.(12分)我国“蓝天保卫战”成果显著,肆虐的雾霾逐渐被遏止。科学家研究发现含氮化合物和含硫
化合物在形成雾霾时与大气中的氨有关,转化关系如图所示:
回答下列问题:
(1)从物质分类的角度看,图中的物质属于酸性氧化物的有________(写化学式)。
(2)图中物质溶于水溶液呈碱性的是________。
(3)写出SO 转化为SO 的化学方程式________________________。
2 3
(4)工业上利用氨气制备一氧化氮,反应的化学方程式为________________。
(5)实验室长期保存浓硝酸,需使用棕色试剂瓶,并放置在阴凉处,其原因为________________(用化学方
程式表示)。
(6)氨气与一氧化氮(NO)在一定条件下反应可生成对空气无污染的物质,该反应的化学方程式为
________________。
【答案】 、 、
【解析】(1)酸性氧化物是能与碱反应得到盐和水的氧化物,符合要求的有 、 和 ;
(2)图中物质溶于水呈碱性的只有 ;
(3)二氧化硫在催化剂存在可以转化为三氧化硫: ;
(4)氨气经催化氧化可以形成一氧化氮: ;(5)浓硝酸见光或受热时易分解,因此要保存在棕色试剂瓶中: ;
(6)氨气中的氮为-3价,一氧化氮中的氮为+2价,因此二者可以在一定条件下发生归中反应得到氮气:
。
14.(13分)某课外活动小组在实验室用如下图所示的装置进行实验,验证氨的某些性质并收集少量纯净
的N。
2
请回答:
(1)实验前先将仪器按图示连接好,然后检查装置的气密性。怎样检查该装置的气密性?
________________。
(2)烧瓶内装有生石灰,随浓氨水的滴入,产生氨气。氨气产生的原因是________________。
(3)实验进行一段时间后,观察到加热的硬质玻璃管内的黑色氧化铜粉末变为红色,盛无水CuSO 的干
4
燥管内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的N。根据这些现象,写出硬质玻璃管内发
2
生反应的化学方程式:______________________。这个反应说明氨气具有________。
A.碱性 B.还原性 C.氧化性 D.不稳定性
(4)洗气瓶中浓硫酸的主要作用是________________________。
(5)在最后出气管的导管口收集干燥、纯净的氮气,收集方法是___________________。
【答案】先关闭分液漏斗的活塞,向广口瓶中加水,浸没进气导管口,用酒精灯在烧瓶下稍加热,若导气
管口有少量气泡冒出,停止加热后,导管内水面上升,形成一段水柱,说明装置的气密性良好
NH ·H O中的HO与CaO反应并放热,使NH 逸出 3CuO+2NH 3Cu+N+3HO B 干燥
3 2 2 3 3 2 2
N,吸收未反应的NH 用塑料袋或球胆收集
2 3
【解析】(1)检查本装置气密性,先关闭分液漏斗的活塞,向广口瓶中加水,浸没进气导管口,用酒精
灯在烧瓶下稍加热,若导气管口有少量气泡冒出,停止加热后,导管内水面上升,形成一段水柱,说明装
置的气密性良好,故答案为:先关闭分液漏斗的活塞,向广口瓶中加水,浸没进气导管口,用酒精灯在烧
瓶下稍加热,若导气管口有少量气泡冒出,停止加热后,导管内水面上升,形成一段水柱,说明装置的气
密性良好;(2)浓氨水滴入生石灰中,生石灰CaO溶于水放热,使氨水分解同时生石灰与水反应生成氢氧化钙,氢
氧根离子浓度增大,使NH +H O NH ·H O NH ++OH-电离平衡向左移动,氨气逸出,所
3 2 3 2 4
以用浓氨水和生石灰可以快速制氨气,故答案为:NH ·H O中的HO与CaO反应并放热,使NH 逸出;
3 2 2 3
(3)碱石灰的作用是干燥氨气,E中发生氨气还原氧化铜的反应,黑色粉末变红说明生成了铜,无水硫酸
铜变蓝说明生成了水,同时还有氮气生成,由此可写出反应方程式3CuO+2NH 3Cu+N+3HO,
3 2 2
反应中-3价的氮全部升为0价,氨气表现还原性,故答案为:3CuO+2NH 3Cu+N+3HO;B;
3 2 2
(4)洗气瓶中浓硫酸的作用是干燥N、吸收多余的氨气,防止氨气逸出污染环境,故答案为:干燥N;
2 2
吸收未反应的NH ;
3
(5)收集纯净、干燥的氨气用气囊收集,故可用塑料袋或球胆收集,故答案为:用塑料袋或球胆收集。
15.(14分)某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm
的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO 、NO 等进行研究具有重要意
2 x
义。请回答下列问题
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均
浓度如下表:
离子 K+ Na+ NH + SO 2- NO - Cl-
4 4 3
浓度/mol·L-1 4×10-6 6×10-6 2×10-5 4×10-5 3×10-5 2×10-5
根据表中数据判断待测试样为__(填“酸”或“碱”)性,表示该试样酸碱性的c(H+)或
c(OH-)=___mol·L-1。
(2)煤燃烧排放的烟气中含有SO 和NO ,易形成酸雨,污染大气,采用NaClO 溶液在碱性条件下可对
2 x 2
烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式。
(____)ClO -+(____)NO+(____)OH-=(____)Cl-+(____)NO -+______
2 3
(3)为减少SO 对环境的污染,常将煤炭转化为清洁的气体燃料,并将烟气进行处理,吸收其中的SO 。
2 2
①写出焦炭与水蒸气反应的化学方程式:__。
②以下物质可以用来吸收烟气中SO 的是__(填字母代号)。
2
a.Ca(OH) b.Na CO c.CaCl d.NaHSO
2 2 3 2 3
(4)汽车尾气中NO 和CO的生成及转化。
x
①汽车启动时汽缸温度高,汽缸中会生成NO,化学方程式为___。
②汽车燃油不完全燃烧时产生CO。在汽车尾气系统中装上催化转化器可使CO和NO反应转化为无污染、无毒性的两种气体,其化学反应方程式为___。
【答案】酸 10-4 3 4 4 3 4 2H O C+H O CO+H ab N +O 2NO
2 2 2 2 2
2CO+2NO 2CO+N
2 2
【解析】(1)根据表格数据,试样所含水溶性无机离子所带电荷总数是c(K+)+c(Na+)+c(NH +)-2c(SO 2-)-
4 4
c(NO -)-c(Cl-)= 4×10-6+6×10-6+2×10-5-2×4×10-5-3×10-5-2×10-5 =-1×10-4,根据溶液的电中性原则,溶液中应该
3
含有带正电荷的氢离子,c(H+)=1.0×10-4mol/L,所以溶液呈酸性;
(2)ClO -中氯元素化合价由+3降低为-1,NO中N元素化合价由+2升高为+5,根据得失电子守恒、电荷
2
守恒、元素守恒,烟气脱硝过程的离子方程式3ClO -+4NO+3OH-=3Cl-+4NO-+2 H O;
2 3 2
(3)①焦炭与水蒸气反应生成CO和H,反应方程式是C+H O CO+H;
2 2 2
②SO 是酸性氧化物,能被碱性溶液吸收,Ca(OH) 呈碱性,能吸收SO 生成亚硫酸钙和水;NaCO 呈碱
2 2 2 2 3
性,能吸收SO ;CaCl 与SO 不反应 ;NaHSO 与SO 不反应;故选ab;
2 2 2 3 2
(4)①汽车启动时汽缸温度高,氮气和氢气在汽缸中生成NO,化学方程式为是N+O 2NO;
2 2
②在汽车尾气系统中装上催化转化器可使CO和NO反应转化为氮气、二氧化碳,其化学反应方程式为
2CO+2NO 2CO+N 。
2 2
16.(15分)硫酸型酸雨的形成原理可简化表示如下:
回答下列问题:
(1)A物质的化学式_________,B物质的化学式_________。
(2)根据SO 的性质,可让工厂的烟道气通过________除去SO ,达到减少污染的目的。
2 2
(3)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
注 溶液的pH越大,H+的物质的量浓度就越小。
①雨水样品的pH变化的原因是____________(用化学方程式表示)。
②如果将刚取样的上述雨水和用氯气消毒的自来水相混合,pH将_________(填“增大”“减小”或“不变”),原因是(用化学方程式表示):_____________。
(4)你认为减少酸雨产生可采用的措施是_________(填序号)。
①少用煤做燃料;②把工厂烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新能源
【答案】SO SO 碱液(或氨水)、氧化剂 2HSO +O=2H SO 减小 HSO +Cl+
2 3 2 3 2 2 4 2 3 2
HO=HSO +2HCl ①③⑤
2 2 4
【解析】(1)酸雨形成是含硫物质的燃烧生成的二氧化硫形成的,依据流程分析可知含硫燃气主要是二氧化
硫,催化氧化为三氧化硫,三氧化硫溶于水生成硫酸,反应的过程为:SO SO HSO ,则A物
2 3 2 4
质的化学式为SO ,B物质的化学式为SO ;
2 3
(2)SO 是酸性氧化物,且SO 中硫元素显+4价,它可能升高到+6价,具有还原性,做还原剂,依据氧化还
2 2
原反应,需要加入还原剂实现转化,则可让工厂的烟道气通过碱溶液(如氨水)或氧化剂(如酸性KMnO 溶
4
液)而除去SO ,达到减少污染的目的;
2
(3)①雨水的pH值变小的原因是由于排放出来的SO 等气体溶于水后生成HSO ,HSO 随雨水的下降,逐
2 2 3 2 3
渐被空气中的氧气所氧化生成易电离的HSO ,方程式为2HSO +O =2H SO ,从而使雨水的酸性增强;
2 4 2 3 2 2 4
②因氯气能氧化HSO 生成硫酸和盐酸,两者都是强酸,酸性增强,pH减小,反应的化学方程式为:
2 3
HSO +Cl+HO=HSO +2HCl;
2 3 2 2 2 4
(4)少用煤作燃料、燃料脱硫、开发新的能源等措施可以减少二氧化硫气体的排放,从而减少酸雨的形成,
即①③⑤正确,故答案为①③⑤。