文档内容
2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)
专题 01 第一章 物质及其变化(B 卷)
(能力提高篇)
说明:本试卷分选择题和非选择题,满分100分,考试时间90分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16
一、选择题:本题共20个小题,每小题2分。共40分,在每小题给出的四个选项中,只有一项是符合题
目要求的。
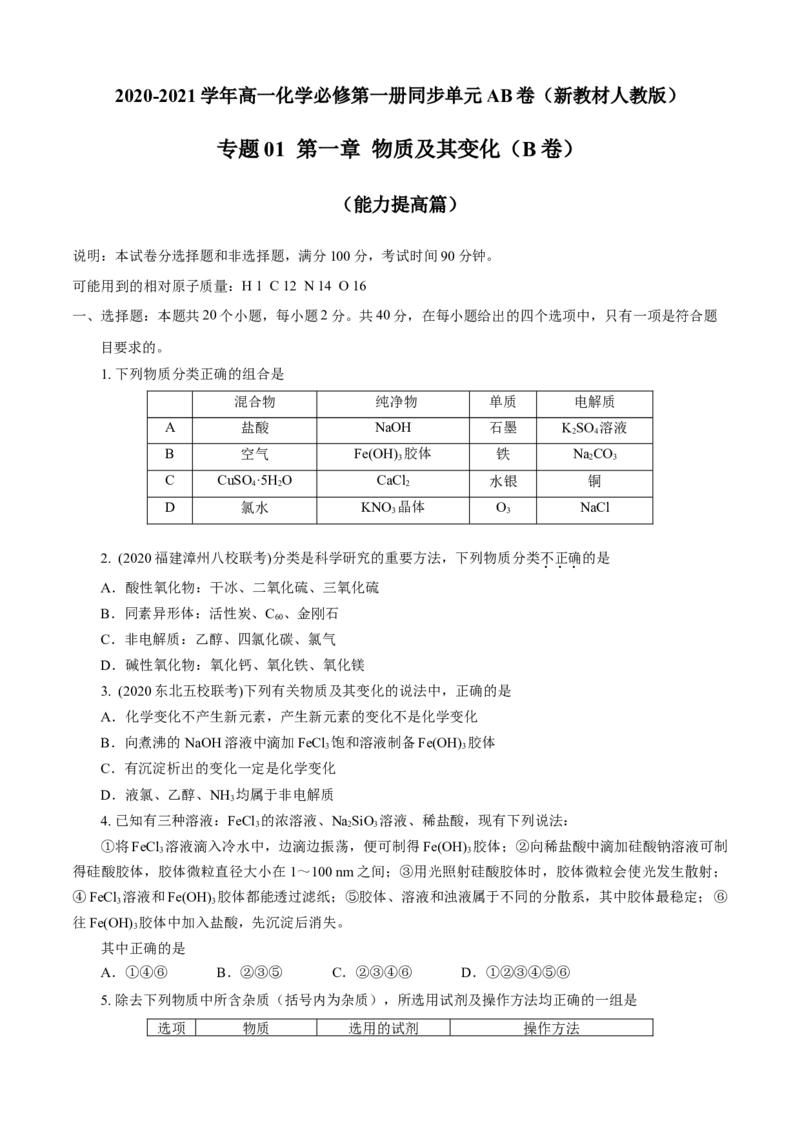
1. 下列物质分类正确的组合是
混合物 纯净物 单质 电解质
A 盐酸 NaOH 石墨 KSO 溶液
2 4
B 空气 Fe(OH) 胶体 铁 NaCO
3 2 3
C CuSO ·5H O CaCl 水银 铜
4 2 2
D 氯水 KNO 晶体 O NaCl
3 3
2. (2020福建漳州八校联考)分类是科学研究的重要方法,下列物质分类不正确的是
A.酸性氧化物:干冰、二氧化硫、三氧化硫
B.同素异形体:活性炭、C 、金刚石
60
C.非电解质:乙醇、四氯化碳、氯气
D.碱性氧化物:氧化钙、氧化铁、氧化镁
3. (2020东北五校联考)下列有关物质及其变化的说法中,正确的是
A.化学变化不产生新元素,产生新元素的变化不是化学变化
B.向煮沸的 NaOH溶液中滴加FeCl 饱和溶液制备Fe(OH) 胶体
3 3
C.有沉淀析出的变化一定是化学变化
D.液氯、乙醇、NH 均属于非电解质
3
4. 已知有三种溶液:FeCl 的浓溶液、NaSiO 溶液、稀盐酸,现有下列说法:
3 2 3
①将FeCl 溶液滴入冷水中,边滴边振荡,便可制得Fe(OH) 胶体;②向稀盐酸中滴加硅酸钠溶液可制
3 3
得硅酸胶体,胶体微粒直径大小在1~100 nm之间;③用光照射硅酸胶体时,胶体微粒会使光发生散射;
④FeCl 溶液和Fe(OH) 胶体都能透过滤纸;⑤胶体、溶液和浊液属于不同的分散系,其中胶体最稳定;⑥
3 3
往Fe(OH) 胶体中加入盐酸,先沉淀后消失。
3
其中正确的是
A.①④⑥ B.②③⑤ C.②③④⑥ D.①②③④⑤⑥
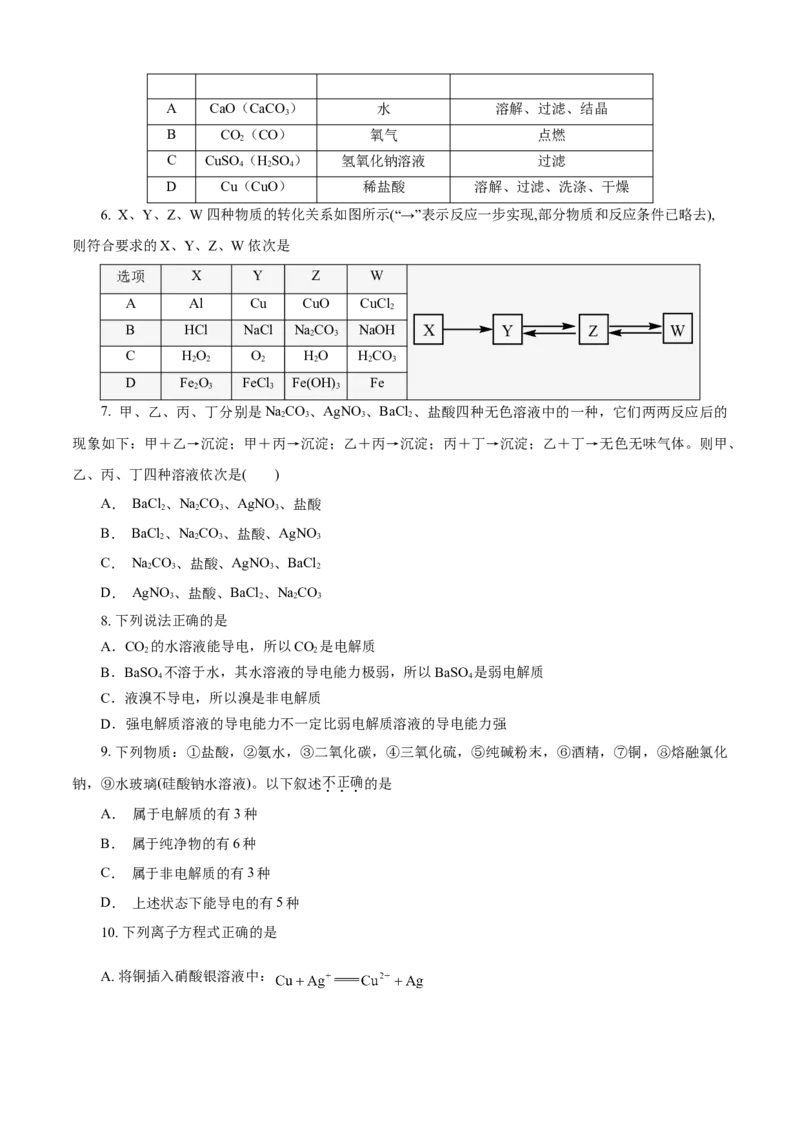
5. 除去下列物质中所含杂质(括号内为杂质),所选用试剂及操作方法均正确的一组是
选项 物质 选用的试剂 操作方法A CaO(CaCO ) 水 溶解、过滤、结晶
3
B CO(CO) 氧气 点燃
2
C CuSO (HSO ) 氢氧化钠溶液 过滤
4 2 4
D Cu(CuO) 稀盐酸 溶解、过滤、洗涤、干燥
6. X、Y、Z、W 四种物质的转化关系如图所示(“→”表示反应一步实现,部分物质和反应条件已略去),
则符合要求的X、Y、Z、W 依次是
选项 X Y Z W
A Al Cu CuO CuCl
2
B HCl NaCl NaCO NaOH X Y Z W
2 3
C HO O HO HCO
2 2 2 2 2 3
D Fe O FeCl Fe(OH) Fe
2 3 3 3
7. 甲、乙、丙、丁分别是NaCO 、AgNO 、BaCl 、盐酸四种无色溶液中的一种,它们两两反应后的
2 3 3 2
现象如下:甲+乙→沉淀;甲+丙→沉淀;乙+丙→沉淀;丙+丁→沉淀;乙+丁→无色无味气体。则甲、
乙、丙、丁四种溶液依次是( )
A. BaCl 、NaCO、AgNO、盐酸
2 2 3 3
B. BaCl 、NaCO、盐酸、AgNO
2 2 3 3
C. NaCO、盐酸、AgNO、BaCl
2 3 3 2
D. AgNO、盐酸、BaCl 、NaCO
3 2 2 3
8. 下列说法正确的是
A.CO 的水溶液能导电,所以CO 是电解质
2 2
B.BaSO 不溶于水,其水溶液的导电能力极弱,所以BaSO 是弱电解质
4 4
C.液溴不导电,所以溴是非电解质
D.强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强
9. 下列物质:①盐酸,②氨水,③二氧化碳,④三氧化硫,⑤纯碱粉末,⑥酒精,⑦铜,⑧熔融氯化
钠,⑨水玻璃(硅酸钠水溶液)。以下叙述不正确的是
A. 属于电解质的有3种
B. 属于纯净物的有6种
C. 属于非电解质的有3种
D. 上述状态下能导电的有5种
10. 下列离子方程式正确的是
A. 将铜插入硝酸银溶液中:B. 溶液与过量 溶液反应:
C. 用食醋除水垢:
D. 稀硫酸和 溶液反应:
11. 往含Fe3+、H+、NO的混合液中加入少量SO,充分反应后,下列表示该反应的离子方程式正确的
是
A.2Fe3++SO+HO===2Fe2++SO+2H+
2
B.2H++SO===H O+SO ↑
2 2
C.2H++2NO+3SO===3SO+2NO↑+HO
2
D.2Fe3++3SO+3HO===2Fe(OH) ↓+3SO ↑
2 3 2
12. 已知MOx- + 3 S2- + 14 H+=== 2 M 3+ + 3S ↓ + 7H O,则MOx-中的M的化合价为
2 7 2 2 7
A +2 B +3 C +4 D +6
13. 在甲、乙两烧杯溶液中,分别含有下列离子中的三种:Cu2+、Na+、H+、SO 2-、CO2-、OH-。已
4 3
知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是
A.CO2-、OH-、SO 2-
3 4
B. Na+、H+、SO 2-
4
C. Cu2+、H+、SO 2-
4
D. Na+、OH-、CO2-
3
14. (2020新课标全国Ⅱ卷)北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水
熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”。下列有关叙述错误的是
A.胆矾的化学式为CuSO
4
B.胆矾可作为湿法冶铜的原料
C.“熬之则成胆矾”是浓缩结晶过程
D.“熬胆矾铁釜,久之亦化为铜”是发生了置换反应
15. (2020江西南昌联考)古诗词是古人为我们留下的宝贵精神财富,下列诗句不涉及氧化还原反应的是
A.野火烧不尽,春风吹又生
B.春蚕到死丝方尽,蜡炬成灰泪始干
C.粉身碎骨浑不怕,要留清白在人间
D.爆竹声中一岁除,春风送暖入屠苏
16. 某种飞船以NH 和NO 为动力源,发生反应:2NH +NO===3N +4HO,反应温度可高达2
2 4 2 4 2 4 2 4 2 2
700 ℃,对于该反应,下列说法中正确的是A.该反应属于置换反应
B.NH 是氧化剂
2 4
C.NO 是还原剂
2 4
D.N 既是氧化产物,又是还原产物
2
17. (2020河南调研)已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未
配平):
①G→ Q+NaCl
②Q+HO――→X+H
2 2
③Y+NaOH→ G+Q+HO
2
④Z+NaOH→ Q+X+HO
2
这五种化合物中Cl元素化合价由低到高的顺序是( )
A.G、Y、Q、Z、X B.X、Z、Q、G、Y
C.X、Z、Q、Y、G D.G、Q、Y、Z、X
18. 在两份相同的Ba(OH) 溶液中,分别滴入物质的量浓度相等的 HSO 、NaHSO 溶液,其导电能力
2 2 4 4
随滴入溶液体积变化的曲线如图所示。
下列分析不正确的是
A.①代表滴加HSO 溶液的变化曲线
2 4
B.b点,溶液中大量存在的离子是Na+、OH-
C.c点,两溶液中含有相同量的OH-
D.a、d两点对应的溶液均显中性
19. (2020杭州二模)现有下列三个氧化还原反应:
①2B-+Z===B +2Z- ②2A2++B ===2A3++2B-
2 2 2
③2XO+10Z-+16H+===2X2++5Z+8HO
2 2
根据上述反应,判断下列结论中错误的是
A.要除去含有A2+、Z-和B-混合溶液中的A2+,而不氧化Z-和平B-,应加入Z
2
B.还原性强弱顺序为A2+>B->Z->X2+
C.X2+是XO的还原产物,B 是B-的氧化产物
2
D.在溶液中可能发生反应:XO+5A2++8H+===X2++5A3++4HO
2
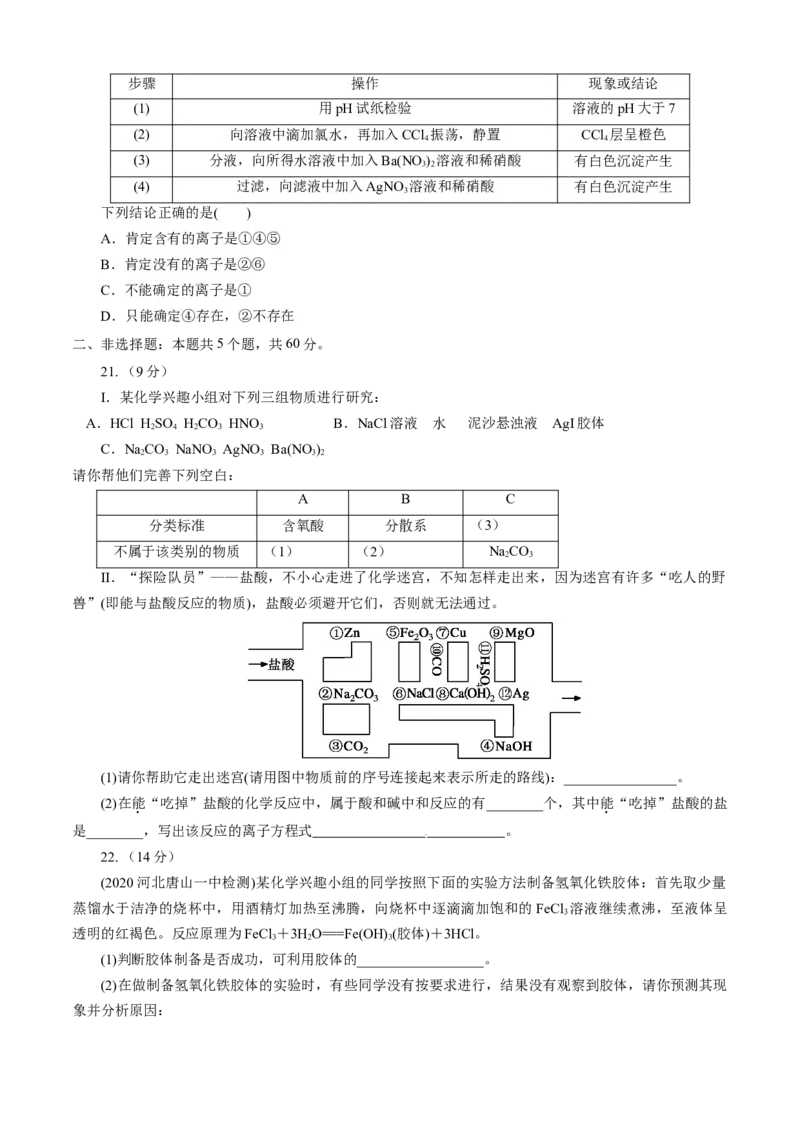
20. 某无色混合盐溶液中,除水电离产生的离子外还可能含有:①Na+、②Ba2+、③Cl-、④Br-、
⑤SO、⑥SO中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象或得到的结论如表
所示。步骤 操作 现象或结论
(1) 用pH试纸检验 溶液的pH大于7
(2) 向溶液中滴加氯水,再加入CCl 振荡,静置 CCl 层呈橙色
4 4
(3) 分液,向所得水溶液中加入Ba(NO ) 溶液和稀硝酸 有白色沉淀产生
3 2
(4) 过滤,向滤液中加入AgNO 溶液和稀硝酸 有白色沉淀产生
3
下列结论正确的是( )
A.肯定含有的离子是①④⑤
B.肯定没有的离子是②⑥
C.不能确定的离子是①
D.只能确定④存在,②不存在
二、非选择题:本题共5个题,共60分。
21. (9分)
I.某化学兴趣小组对下列三组物质进行研究:
A.HCl HSO HCO HNO B.NaCl溶液 水 泥沙悬浊液 AgI胶体
2 4 2 3 3
C.NaCO NaNO AgNO Ba(NO )
2 3 3 3 3 2
请你帮他们完善下列空白:
A B C
分类标准 含氧酸 分散系 (3)
不属于该类别的物质 (1) (2) NaCO
2 3
II.“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野
兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线):________________。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有________个,其中能“吃掉”盐酸的盐
是________,写出该反应的离子方程式 。
22. (14分)
(2020河北唐山一中检测)某化学兴趣小组的同学按照下面的实验方法制备氢氧化铁胶体:首先取少量
蒸馏水于洁净的烧杯中,用酒精灯加热至沸腾,向烧杯中逐滴滴加饱和的FeCl 溶液继续煮沸,至液体呈
3
透明的红褐色。反应原理为FeCl +3HO===Fe(OH) (胶体)+3HCl。
3 2 3
(1)判断胶体制备是否成功,可利用胶体的__________________。
(2)在做制备氢氧化铁胶体的实验时,有些同学没有按要求进行,结果没有观察到胶体,请你预测其现
象并分析原因:①甲同学没有选用饱和氯化铁溶液,而是将稀氯化铁溶液滴入沸水中,结果没有观察到
________________________,其原因是_____________________________________________。
②乙同学在实验中没有使用蒸馏水,而是用自来水,结果会________________________,原因是
____________________________________________。
③丙同学向沸水中滴加饱和氯化铁溶液后,长时间加热,结果会________________________,原因是
____________________________________。
(3)丁同学按要求制备了Fe(OH) 胶体,但是他又向Fe(OH) 胶体中逐滴加入了稀HSO 溶液,结果出
3 3 2 4
现了一系列变化。
①先出现红褐色沉淀,原因是________________________________________________。
②随后沉淀溶解,此反应的离子方程式是______________________________。
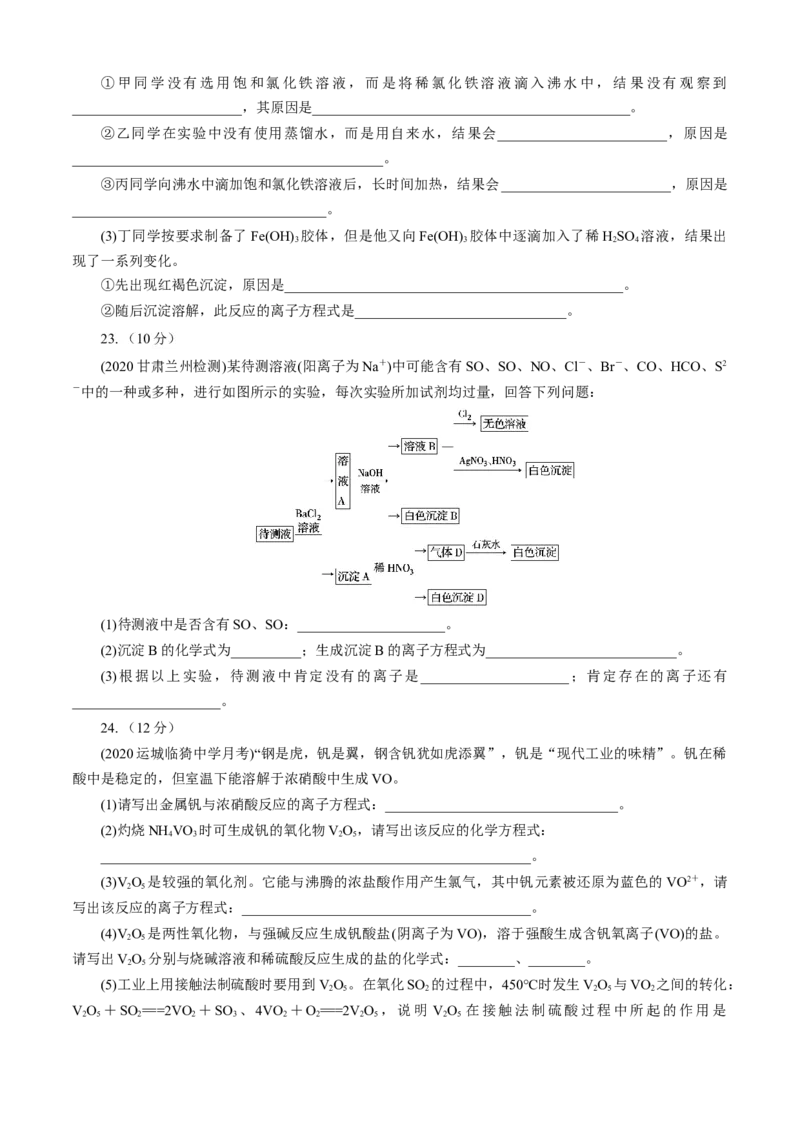
23. (10分)
(2020甘肃兰州检测)某待测溶液(阳离子为Na+)中可能含有SO、SO、NO、Cl-、Br-、CO、HCO、S2
-中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,回答下列问题:
(1)待测液中是否含有SO、SO:_____________________。
(2)沉淀B的化学式为__________;生成沉淀B的离子方程式为___________________________。
(3)根据以上实验,待测液中肯定没有的离子是_____________________;肯定存在的离子还有
_____________________。
24. (12分)
(2020运城临猗中学月考)“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒在稀
酸中是稳定的,但室温下能溶解于浓硝酸中生成VO。
(1)请写出金属钒与浓硝酸反应的离子方程式:_________________________________。
(2)灼烧NH VO 时可生成钒的氧化物VO,请写出该反应的化学方程式:
4 3 2 5
_____________________________________________________________。
(3)V O 是较强的氧化剂。它能与沸腾的浓盐酸作用产生氯气,其中钒元素被还原为蓝色的VO2+,请
2 5
写出该反应的离子方程式:_________________________________________。
(4)V O 是两性氧化物,与强碱反应生成钒酸盐(阴离子为VO),溶于强酸生成含钒氧离子(VO)的盐。
2 5
请写出VO 分别与烧碱溶液和稀硫酸反应生成的盐的化学式:________、________。
2 5
(5)工业上用接触法制硫酸时要用到VO 。在氧化SO 的过程中,450℃时发生VO 与VO 之间的转化:
2 5 2 2 5 2
VO +SO ===2VO +SO 、4VO +O===2V O ,说明 VO 在接触法制硫酸过程中所起的作用是
2 5 2 2 3 2 2 2 5 2 5_____________________________________________________。
25. (15分)
(2020试题调研)高铁酸钾(K FeO)是一种易溶于水、高效的多功能水处理剂。工业上通常先制得高铁
2 4
酸钠,然后在一定温度下,向高铁酸钠溶液中加入KOH至饱和,从而使高铁酸钾析出。
(1)高铁酸钾中铁元素的化合价为________,推测其具有的化学性质是____________。
(2)高铁酸钾与水反应生成O、Fe(OH) (胶体)和KOH。
2 3
①该反应的离子方程式为_________________________________________________。
②高铁酸钾作为水处理剂起到的作用是________________________。
(3)①在无水条件下制备高铁酸钠的主要反应为2FeSO +a NaO===2Na FeO +b X+2NaSO +cO↑,
4 2 2 2 4 2 4 2
该反应中物质X的化学式为____________,b与c的关系是____________。
②一定温度下,向高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾,原因是
________________________________________________________________________。
(4)在碱性条件下,由氯化铁、氯气可制备高铁酸钾,写出该反应的离子方程式:
_________________________________________________________。