文档内容
2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)
专题 01 第一章 物质及其变化(A 卷)
(基础强化篇)
说明:本试卷分选择题和非选择题,满分100分,考试时间90分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16
一、选择题:本题共20个小题,每小题2分。共40分,在每小题给出的四个选项中,只有一项是符合题
目要求的。
1. 下列各物质或其主要成分的名称(或俗名)、化学式、类别一致的是
A.胆矾 CuSO ·5H O 混合物
4 2
B.氖气 Ne 单质
C.烧碱 NaOH 氧化物
D.纯碱 NaOH 碱
2. 下列各组物质不属于同素异形体的是
A. H O和HO B. O 和O C. 金刚石和石墨 D. 红磷和白磷
2 2 2 2 3
3. (2020辽宁师大附中期中)分类是化学学习与研究的常用方法,下列分类正确的是
A.NaO、MgO、Al O 均属于碱性氧化物
2 2 2 3
B.纯碱、烧碱、熟石灰均属于碱
C.酸、碱、盐之间发生的反应均属于复分解反应
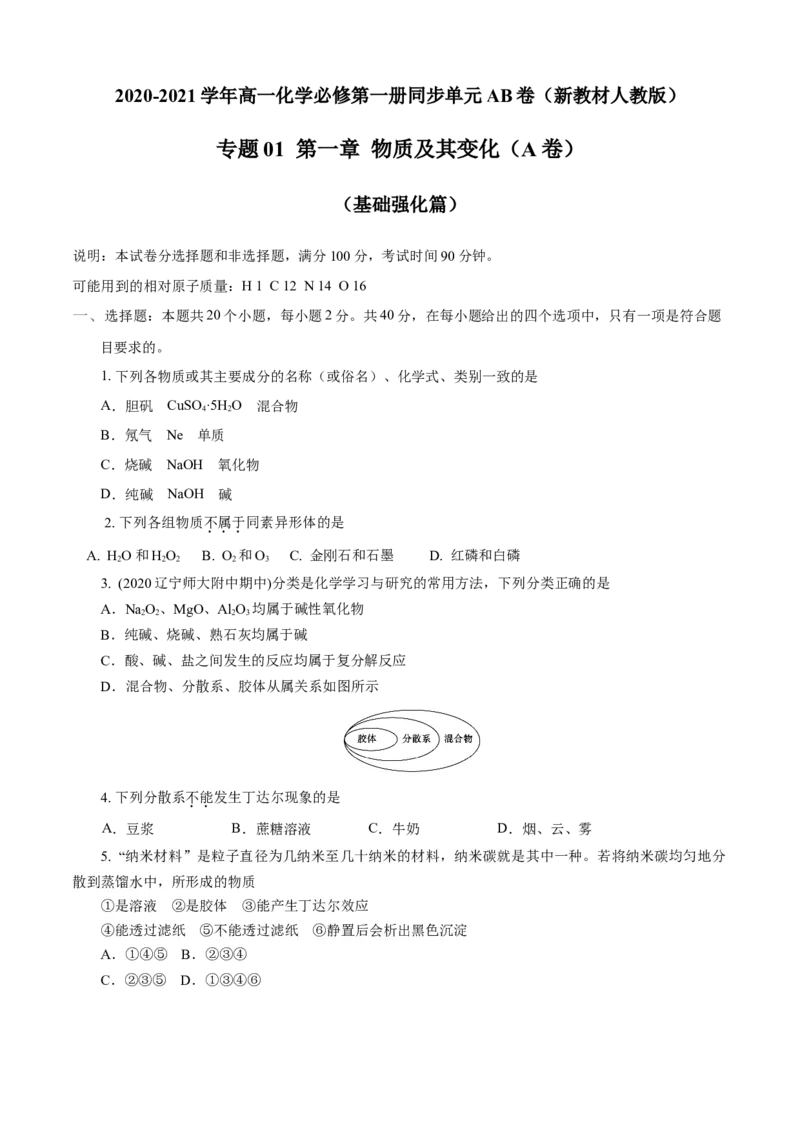
D.混合物、分散系、胶体从属关系如图所示
4. 下列分散系不能发生丁达尔现象的是
A.豆浆 B.蔗糖溶液 C.牛奶 D.烟、云、雾
5. “纳米材料”是粒子直径为几纳米至几十纳米的材料,纳米碳就是其中一种。若将纳米碳均匀地分
散到蒸馏水中,所形成的物质
①是溶液 ②是胶体 ③能产生丁达尔效应
④能透过滤纸 ⑤不能透过滤纸 ⑥静置后会析出黑色沉淀
A.①④⑤ B.②③④
C.②③⑤ D.①③④⑥6. X、Y、Z有如图所示的转化关系(“→”表示反应一步实现,部分物质和反应条件已略去),则符合要求的
X、Y、Z依次为
A. Cu、CuO、Cu(OH)
2
B. C、CO、HCO
2 3
C. CaO、Ca(OH) 、CaCO
2 3
D. H O、H、HO
2 2 2 2
7. 下列物质都能导电,其中属于电解质的是
A.熔融的NaOH B.铁丝 C.稀硫酸 D.NaCl溶液
8. 下列说法中正确的是
A.三氧化硫的水溶液能导电,所以三氧化硫是电解质
B.自由移动离子数目多的电解质溶液导电能力一定强
C.NaHSO 在水溶液及熔融状态下均可电离出Na+、H+、SO
4
D.NH 是非电解质,但其水溶液能导电
3
9. 下列反应中,能用H++OH-=HO表示的是
2
A.NaOH溶液和CO 的反应 B.Ba(OH) 溶液和稀HSO 的反应
2 2 2 4
C.NaOH溶液和盐酸的反应 D.氨水和稀HSO 的反应
2 4
10. 铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如图所示。
图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是
A.OH-+HCl===H O+Cl-
2
B.Ca(OH) +Cu2+===Ca2++Cu(OH)
2 2
C.Fe+Cu2+===Cu+Fe2+
D.Fe+2H+===Fe3++H↑
2
11. 下列反应的离子方程式中,正确的是
A.稀硫酸滴在银片上:2Ag+2H+=2Ag++H↑
2B.稀硫酸与氢氧化钡溶液混合:SO +Ba2+=BaSO↓
4
C.稀硝酸滴在大理石上:CaCO +2H+=Ca2++HCO
3 2 3
D.氧化铁与稀盐酸混合:Fe O+6H+=2Fe3++3HO
2 3 2
12. 对四种无色溶液进行离子检验,实验结果如下,其中明显错误的是
A.K+、Na+、Cl-、NO B.Cu2+、NO 、OH-、HCO
C.Na+、OH-、Cl-、NO D.OH-、K+、S2-、Na+
13. 下列各组离子因发生氧化还原反应而不能大量共存的是
A.Fe3+、OH-、SO、CO
B.Cu2+、Fe2+、H+、NO
C.Ag+、Na+、SO、Cl-
D.K+、H+、CO、MnO
14. 重金属离子具有毒性。实验室中有甲、乙两种重金属离子的废液,甲废液经化验呈碱性,主要的
有毒离子为Ba2+,如将甲、乙两废液按一定比例混合,毒性明显降低。则乙废液中可能含有的离子是
A.Cu2+和SO B.Cu2+和Cl C.K+和SO D.Ag+和NO
15. 下列有关实验室制取气体的反应中,其原理不属于氧化还原反应的是
A.实验室中用稀硫酸与锌粒反应制取H
2
B.实验室中用高锰酸钾加热分解制取O
2
C.实验室中用HO 与MnO 作用产生O
2 2 2 2
D.实验室中用稀盐酸与石灰石反应制取CO
2
16. 在下列变化中,需要加入合适的氧化剂才能实现的是( )
A.HCl→H B.CO→CO C.FeCl →FeCl D.SO →SO
2 2 3 2 2 3
17. 苹果汁是人们喜爱的饮料,由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色(Fe2+)变
为棕黄色(Fe3+)。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有
A.氧化性 B.还原性 C.碱性 D.酸性
18. (2020全国3卷)宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿
色来自孔雀石颜料(主要成分为 Cu(OH) ·CuCO ),青色来自蓝铜矿颜料(主要成分为
2 3
Cu(OH) ·2CuCO)。下列说法错误的是
2 3
A.保存《千里江山图》需控制温度和湿度
B.孔雀石、蓝铜矿颜料不易被空气氧化
C.孔雀石、蓝铜矿颜料耐酸耐碱D.Cu(OH) ·CuCO 中铜的质量分数高于Cu(OH) ·2CuCO
2 3 2 3
19. (2020河北衡水检测)已知:①2Fe3++2I-===I +2Fe2+;②2Fe3++Fe===3Fe2+;③2Fe(OH) +I+
2 2 2
2OH-===2Fe(OH) +2I-。根据以上反应判断,下列说法正确的是
3
A.I-的还原性强于Fe
B.I 的氧化性强于Fe3+
2
C.③易发生的主要原因是Fe(OH) 比Fe(OH) 更难溶
3 2
D.溶液酸碱性对Fe3+和Fe2+的氧化性或还原性没有影响
20. 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
物质
甲 乙 丙 丁 物质转化关系
编号
① Cu CuO CuSO Cu(NO )
4 3 2
② NaCO NaOH NaHCO CO
2 3 3 2
③ (NH )SO CaSO SO NH HSO
4 2 3 3 2 4 3
④ Fe Fe O FeO FeCl
3 4 2
A.①②③④ B.②③④
C.①③④ D.①②③
二、非选择题:本题共5个题,共60分。
21.(16分)
(一)有以下几种物质:
①碳酸氢钠晶体 ②液态氯化氢 ③铁 ④蔗糖 ⑤酒精 ⑥熔融的KSO ⑦干冰 ⑧石墨
2 4
试回答(填序号):
(1)以上物质能导电的是 。
(2)以上物质中属于非电解质的是 。
(3)以上物质中溶于水后水溶液能导电的是 。
(4) ①、②在水溶液中反应的离子方程式为 。
(二)某溶液的溶质可能由下列离子组成:Cl-、SO、CO、H+、Ba2+、Na+,某同学进行了如下实验:
Ⅰ. 向溶液中加入过量的BaCl 溶液,有白色沉淀产生,过滤;
2
Ⅱ. 向Ⅰ中滤液中加入AgNO 溶液,有白色沉淀产生;
3
Ⅲ. 将Ⅰ中的沉淀加入稀盐酸中,沉淀部分消失,有气体产生。
(5)依据以上实验可以推断,原溶液中一定含有 (用离子符号表示,下同);
一定没有 ;可能含有 ,检验是否存在该离子的方法为
。
22. (11分)
铜器久置于空气中会和空气中的水蒸气、CO 、O 作用产生“绿锈”,该“绿锈”俗称“铜绿”[化学
2 2
式为Cu (OH) CO],“铜绿”能跟酸反应生成铜盐、CO 和HO。某同学利用下述系列反应实现了“铜→
2 2 3 2 2
铜绿→……→铜”的转化。(1)从三种不同分类标准回答,“铜绿”属于哪类物质:____________________________。
(2)写出“铜绿”与盐酸反应的化学方程式:_____________________________________。
(3)写出④⑤的化学方程式:
④__________________________________________________;
⑤__________________________________________________。
(4)上述转化过程中属于化合反应的是________,属于复分解反应的是________,属于分解反应的是
________。
23. (12分)
(1) 实验室用碳酸钙与盐酸反应制取CO 气体,反应的离子方程式:____________________________;
2
常用澄清石灰水检验CO 气体的离子方程式是__________________________________________________。
2
(2)将表面附有铁锈(成分是Fe O)的铁钉放入稀硫酸中,开始反应的离子方程式是__________________
2 3
____________________________________;反应片刻后,可观察到有气体产生,其离子方程式是
________________________________________。
(3)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,
它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。
①用小苏打片(NaHCO )治疗胃酸过多的离子方程式为________________________________________。
3
②如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH) ],反应的离子方程式为
3
________________________________________________________________________。
24. (9分)
某同学用某种粗盐进行提纯实验,步骤见下图。
(1)步骤①和②的操作名称是________________。
(2)步骤③判断加入盐酸“适量”的方法是________________________。步骤④加热蒸发时要用玻璃
棒不断搅拌,这是为了防止______________,当蒸发皿中有较多量固体出现时,应
________________,用余热使水分蒸干。
(3)猜想和验证:
猜想 验证的方法 现象 结论
猜想Ⅰ:固体A中含 取少量固体A于试管中,滴加稀
__________ 猜想Ⅰ成立
碳酸盐 盐酸,并用涂有澄清石灰水的小烧杯罩于试管口
猜想Ⅱ:固体A中含 取少量固体A于试管中,先滴入 有气泡放出,无
__________
BaCO ______,再滴入NaSO 溶液 白色沉淀生成
3 2 4
猜想Ⅲ:最后制得的
取少量 NaCl 晶体溶于试管中的
NaCl 晶体中还含有 _________ 猜想Ⅲ成立
蒸馏水,________
NaSO
2 4
25. (12分)
(2019年海南华侨中学高三月考)氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1) 下列生产、生活中的事例中没有发生氧化还原反应的是 (填字母)。
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反
应的关系”可用下图表达。
试写出有水参加的符合反应类型Ⅳ的一个化学方程式: ,其中水为 剂。
(3)过氧化氢俗称双氧水,医疗上利用它的杀菌消毒作用来清洗伤口。HO 有时可作为矿业废液消毒剂,
2 2
有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),可经以下反应实现:KCN+H O+H O
2 2 2
===A+NH ↑,试写出生成物 A 的化学式: ,并阐明 HO 被称为绿色氧化剂的理由:
3 2 2
。
(4)氯化铵常用于焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为 CuO+
NH Cl===== Cu+ CuCl + N↑+ HO。
4 2 2 2
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是 (填元素名称),氧化剂是 (填化学式)。