文档内容
高一化学试题
可能用到的相对原子质量:H 1 Li 3 C 12 O 16 Na 23 Al 27 Fe 56 Cu 64
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
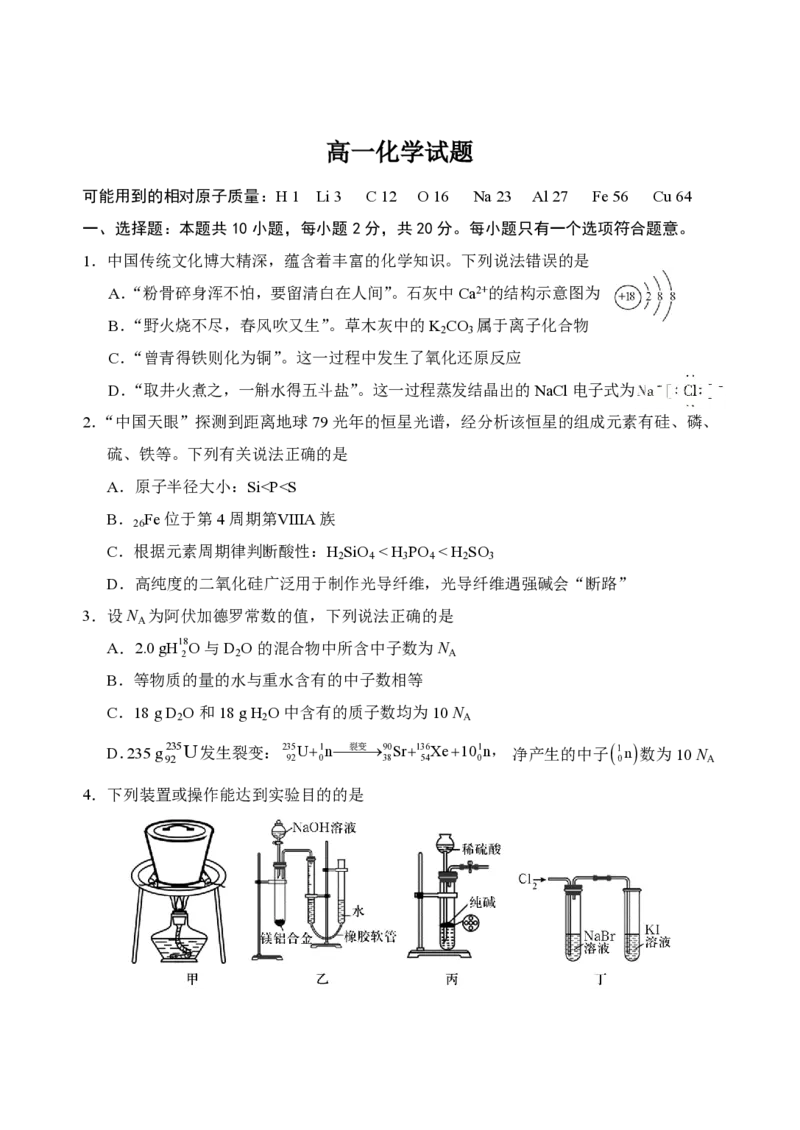
1.中国传统文化博大精深,蕴含着丰富的化学知识。下列说法错误的是
A.“粉骨碎身浑不怕,要留清白在人间”。石灰中Ca2+的结构示意图为
B.“野火烧不尽,春风吹又生”。草木灰中的K CO 属于离子化合物
2 3
C.“曾青得铁则化为铜”。这一过程中发生了氧化还原反应
D.“取井火煮之,一斛水得五斗盐”。这一过程蒸发结晶出的NaCl电子式为
2.“中国天眼”探测到距离地球79光年的恒星光谱,经分析该恒星的组成元素有硅、磷、
硫、铁等。下列有关说法正确的是
A.原子半径大小:Si X > Z >W
B.Z的氧化物为酸性氧化物,能与水反应生成对应的酸
C.X、Z分别与W形成的最简单化合物的热稳定性:X S
液中
色后的溶液又恢复红色
14.在标准状态下,由最稳定的单质合成1 mol某物质的焓变(等压条件下,反应产物的总
能量与反应物的总能量之差,用 ΔH 表示)叫做该物质的标准摩尔生成焓,用
Δ HqkJ×mol-1表示,最稳定单质的标准摩尔生成焓为0,相同状况下有关物质的D Hq
f m f m
如图所示。下列说法正确的是
A.标准状态下,C H 比C H 稳定
2 4 2 6
B.H O (g)的D Hq<-285.8kJ×mol-1
2 f m
C.标准状况下,1 mol C H (g)完全燃烧放出的热量为1411.1 kJ
2 4
D.1mol C H (g)的能量小于2 mol C(s)与3 mol H (g)的能量之和
2 6 2
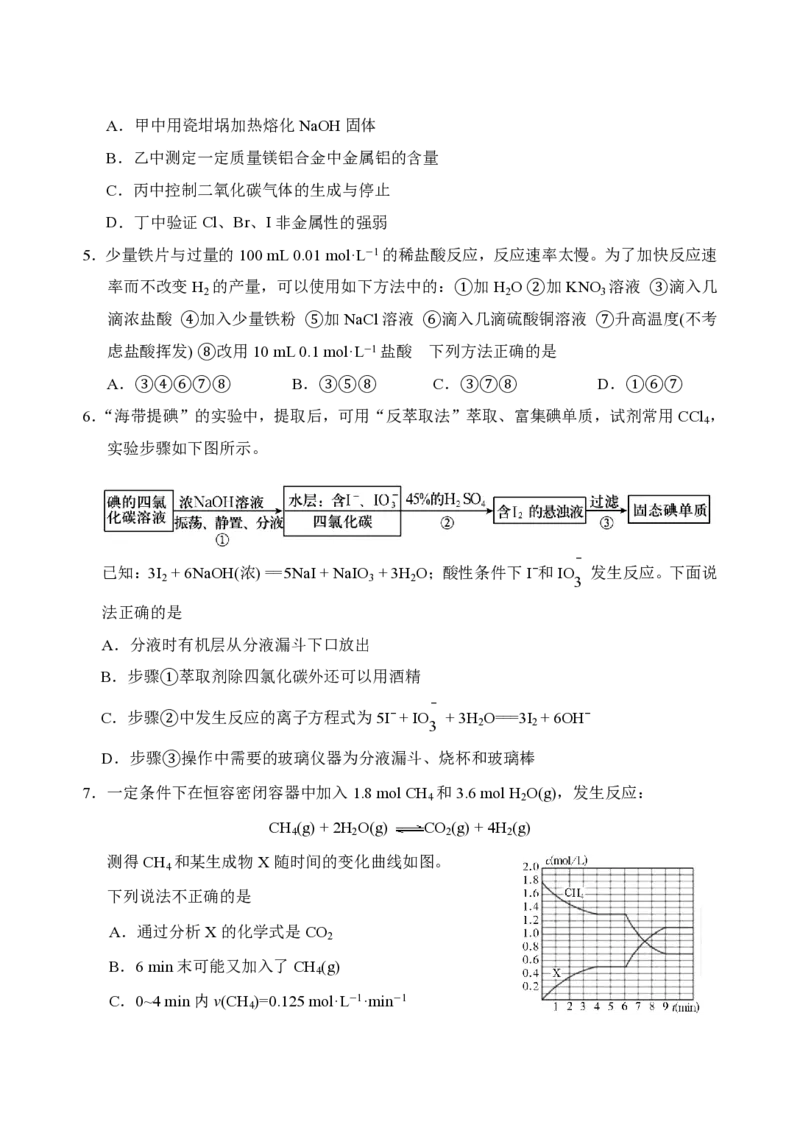
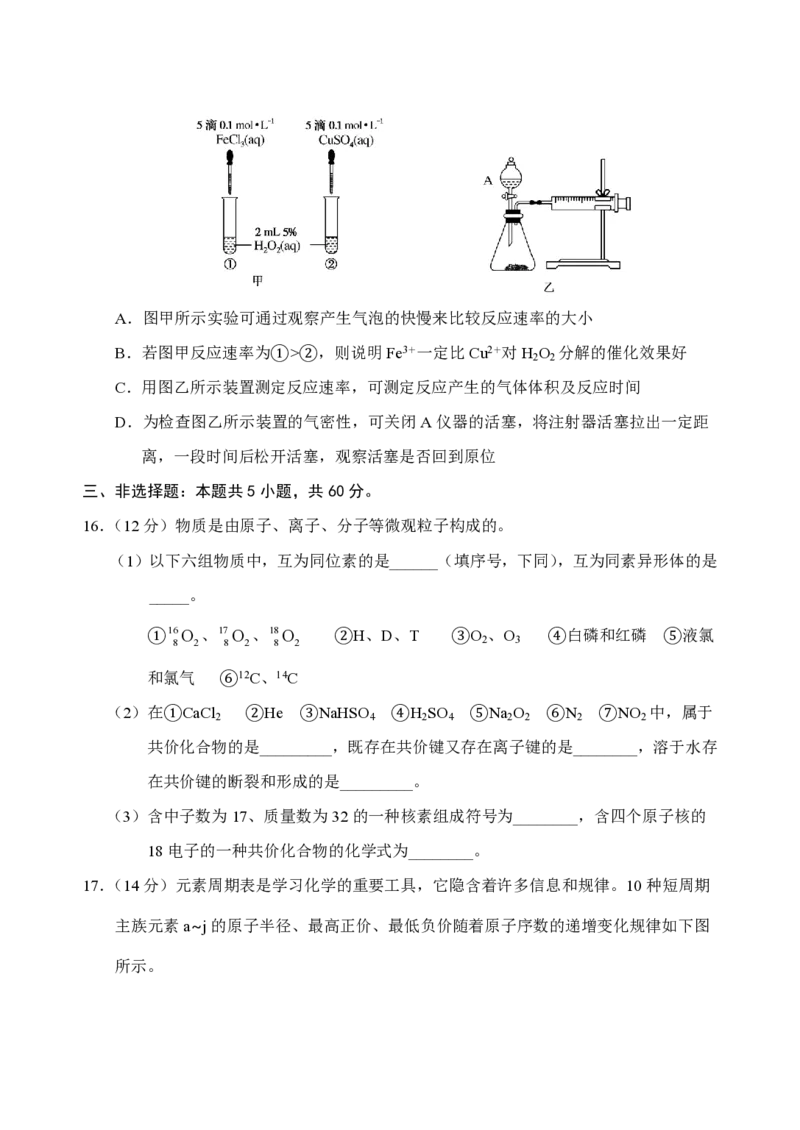
15.为比较Fe3+和Cu2+对H O 分解反应的催化效果,两位同学分别设计了如图甲、乙所示
2 2
的实验。下列叙述错误的是A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图甲反应速率为①>②,则说明Fe3+一定比Cu2+对H O 分解的催化效果好
2 2
C.用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间
D.为检查图乙所示装置的气密性,可关闭A仪器的活塞,将注射器活塞拉出一定距
离,一段时间后松开活塞,观察活塞是否回到原位
三、非选择题:本题共5小题,共60分。
16.(12分)物质是由原子、离子、分子等微观粒子构成的。
(1)以下六组物质中,互为同位素的是______(填序号,下同),互为同素异形体的是
_____。
①16O 、17O 、18O ②H、D、T ③O 、O ④白磷和红磷 ⑤液氯
8 2 8 2 8 2 2 3
和氯气 ⑥12C、14C
(2)在①CaCl ②He ③NaHSO ④H SO ⑤Na O ⑥N ⑦NO 中,属于
2 4 2 4 2 2 2 2
共价化合物的是_________,既存在共价键又存在离子键的是________,溶于水存
在共价键的断裂和形成的是_________。
(3)含中子数为17、质量数为32的一种核素组成符号为________,含四个原子核的
18电子的一种共价化合物的化学式为________。
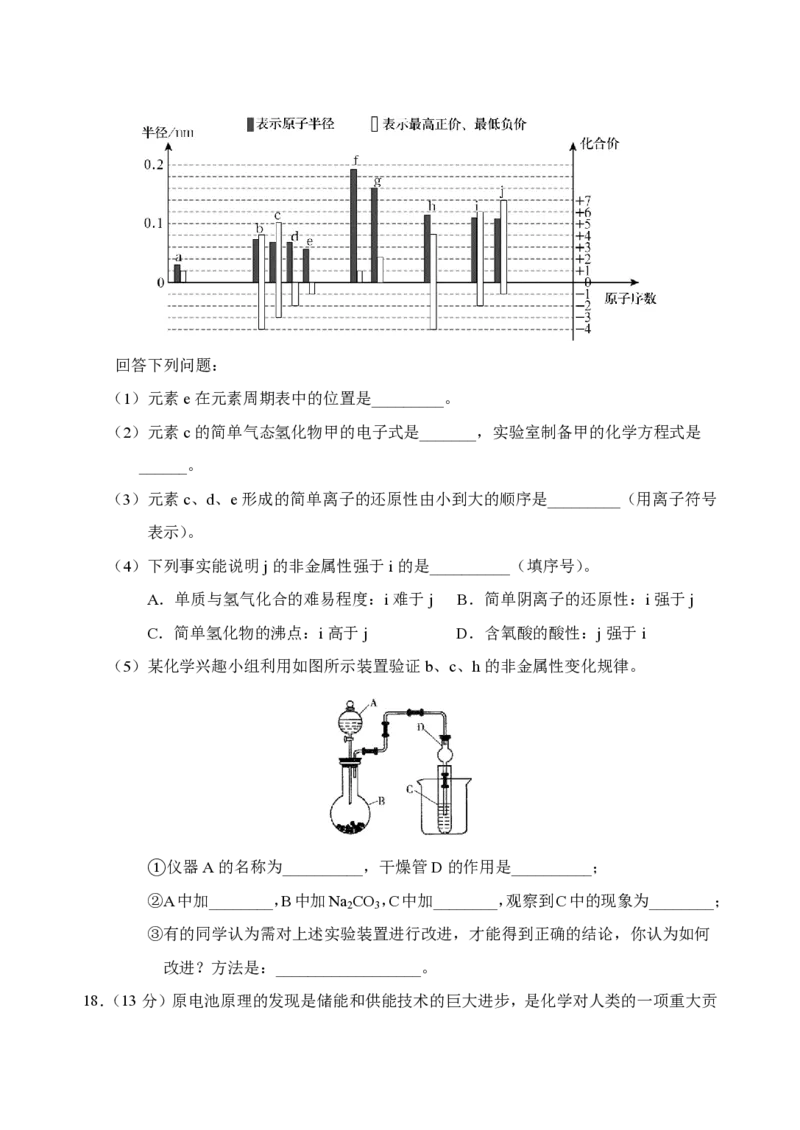
17.(14分)元素周期表是学习化学的重要工具,它隐含着许多信息和规律。10种短周期
主族元素a~j的原子半径、最高正价、最低负价随着原子序数的递增变化规律如下图
所示。回答下列问题:
(1)元素e在元素周期表中的位置是_________。
(2)元素c的简单气态氢化物甲的电子式是_______,实验室制备甲的化学方程式是
______。
(3)元素c、d、e形成的简单离子的还原性由小到大的顺序是_________(用离子符号
表示)。
(4)下列事实能说明j的非金属性强于i的是__________(填序号)。
A.单质与氢气化合的难易程度:i难于j B.简单阴离子的还原性:i强于j
C.简单氢化物的沸点:i高于j D.含氧酸的酸性:j强于i
(5)某化学兴趣小组利用如图所示装置验证b、c、h的非金属性变化规律。
①仪器A的名称为__________,干燥管D的作用是__________;
②A中加________,B中加Na CO ,C中加________,观察到C中的现象为________;
2 3
③有的同学认为需对上述实验装置进行改进,才能得到正确的结论,你认为如何
改进?方法是:__________________。
18.(13分)原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。人们应用原电池原理制作了多种电池,广泛使用于日常生活、生产和科学技术等
方面,以满足不同的需要。请按要求回答下列问题:
(1)新一代锂二次电池体系和全固态锂二次电池体系是化学、物理等学科的基础理论
研究与应用技术的前沿。Li-CuO二次电池的比能量高、工作温度宽。Li-CuO二次
电池中,放电时金属锂作____极。比能量是指消耗单位质量的电极所释放的电量,
可用来衡量电池的优劣,则Li、Na、Al分别作为电极时比能量由大到小的顺序为
__________。
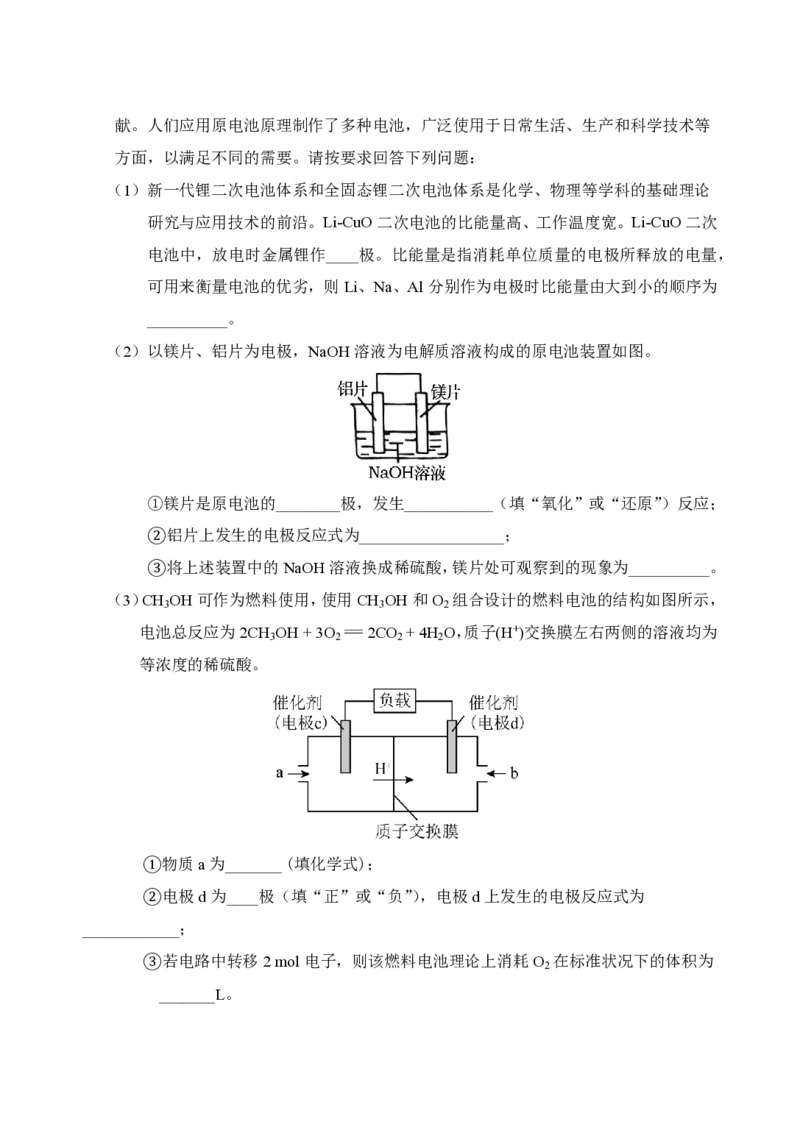
(2)以镁片、铝片为电极,NaOH溶液为电解质溶液构成的原电池装置如图。
①镁片是原电池的________极,发生___________(填“氧化”或“还原”)反应;
②铝片上发生的电极反应式为__________________;
③将上述装置中的NaOH溶液换成稀硫酸,镁片处可观察到的现象为__________。
(3)CH OH可作为燃料使用,使用CH OH和O 组合设计的燃料电池的结构如图所示,
3 3 2
电池总反应为2CH OH + 3O == 2CO + 4H O,质子(H+)交换膜左右两侧的溶液均为
3 2 2 2
等浓度的稀硫酸。
①物质a为_______ (填化学式);
②电极d为____极(填“正”或“负”),电极d上发生的电极反应式为
____________;
③若电路中转移2 mol电子,则该燃料电池理论上消耗O 在标准状况下的体积为
2
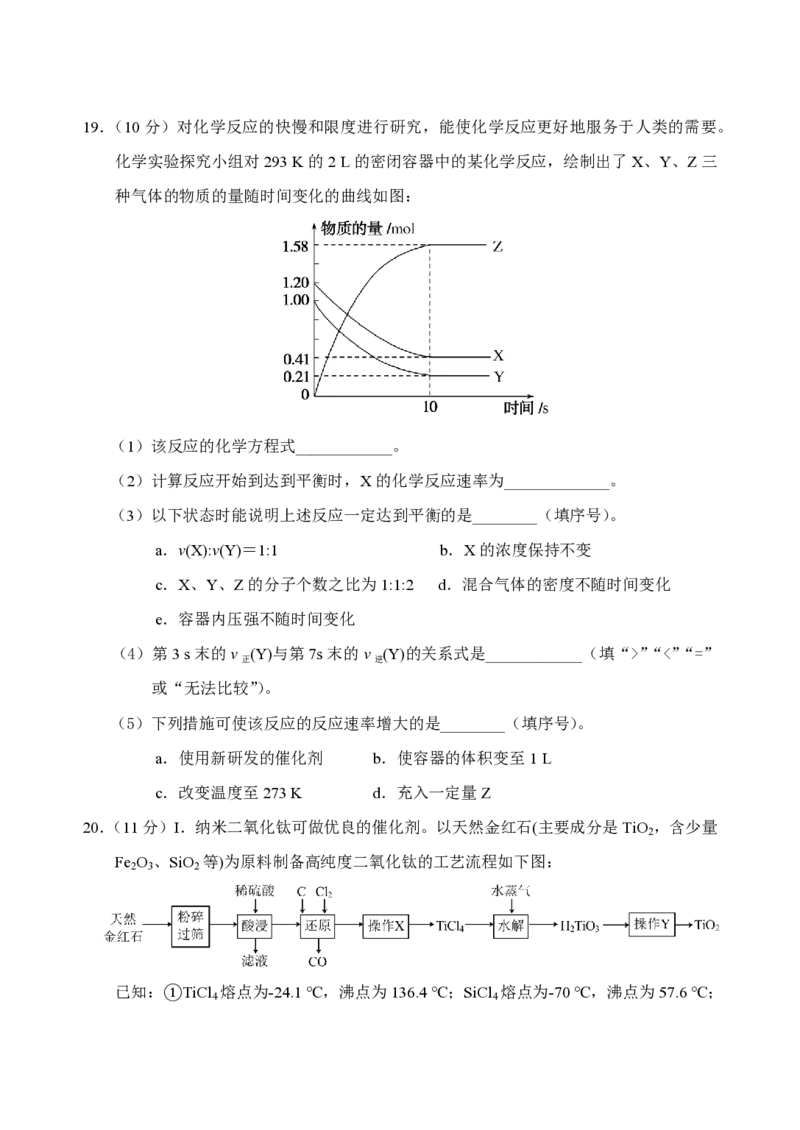
_______L。19.(10分)对化学反应的快慢和限度进行研究,能使化学反应更好地服务于人类的需要。
化学实验探究小组对293 K的2 L的密闭容器中的某化学反应,绘制出了X、Y、Z三
种气体的物质的量随时间变化的曲线如图:
(1)该反应的化学方程式____________。
(2)计算反应开始到达到平衡时,X的化学反应速率为_____________。
(3)以下状态时能说明上述反应一定达到平衡的是________(填序号)。
a.v(X):v(Y)=1:1 b.X的浓度保持不变
c.X、Y、Z的分子个数之比为1:1:2 d.混合气体的密度不随时间变化
e.容器内压强不随时间变化
(4)第3 s末的v (Y)与第7s末的v (Y)的关系式是____________(填“>”“<”“=”
正 逆
或“无法比较”)。
(5)下列措施可使该反应的反应速率增大的是________(填序号)。
a.使用新研发的催化剂 b.使容器的体积变至1 L
c.改变温度至273 K d.充入一定量Z
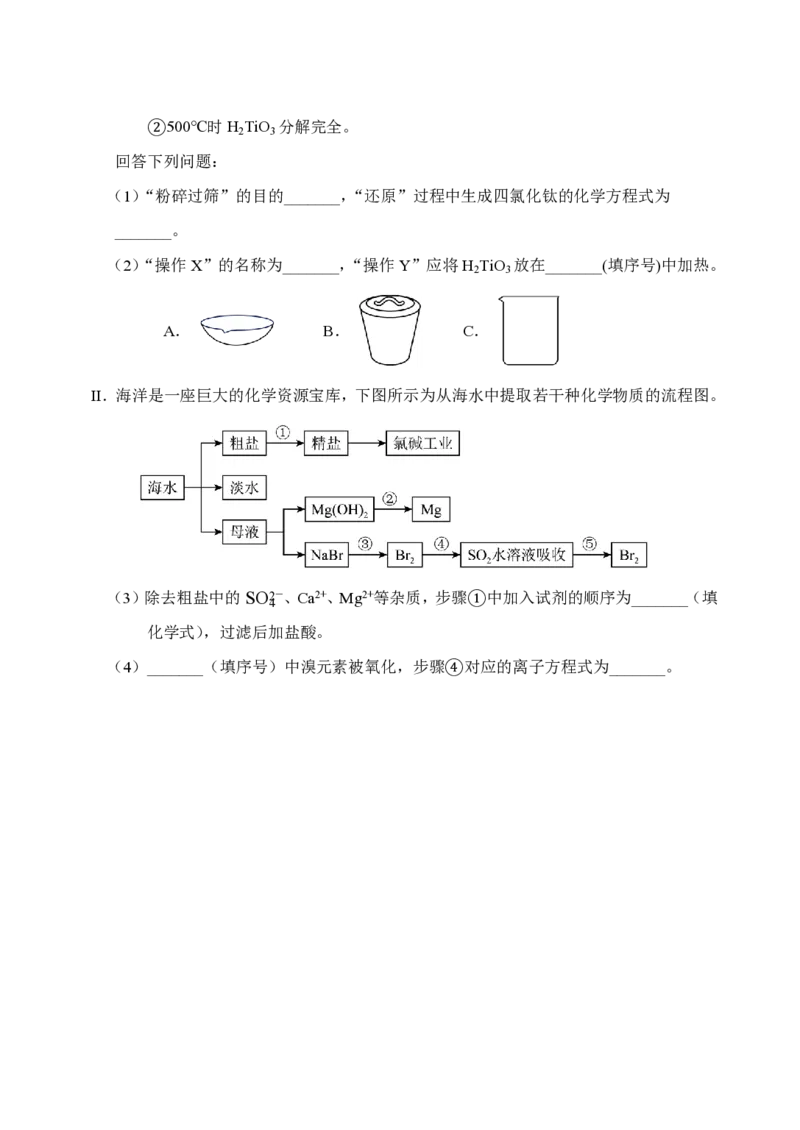
20.(11分)I.纳米二氧化钛可做优良的催化剂。以天然金红石(主要成分是TiO ,含少量
2
Fe O 、SiO 等)为原料制备高纯度二氧化钛的工艺流程如下图:
2 3 2
已知:①TiCl 熔点为-24.1 ℃,沸点为136.4 ℃;SiCl 熔点为-70 ℃,沸点为57.6 ℃;
4 4②500℃时H TiO 分解完全。
2 3
回答下列问题:
(1)“粉碎过筛”的目的_______,“还原”过程中生成四氯化钛的化学方程式为
_______。
(2)“操作X”的名称为_______,“操作Y”应将H TiO 放在_______(填序号)中加热。
2 3
A. B. C.
II.海洋是一座巨大的化学资源宝库,下图所示为从海水中提取若干种化学物质的流程图。
(3)除去粗盐中的SO2-、Ca2+、Mg2+等杂质,步骤①中加入试剂的顺序为_______(填
4
化学式),过滤后加盐酸。
(4)_______(填序号)中溴元素被氧化,步骤④对应的离子方程式为_______。高一化学试题参考答案
一 、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.A 2.D 3.A 4.B 5.C 6.A 7.B 8.B 9.D 10.D
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,
全部选对得4分,选对但不全的得2分,有选错的得0分。
11.D 12.BC 13.A 14.CD 15.B
三、非选择题:本题共5小题,共60分。
16.(12分)
(1)②⑥(2分) ③④ (2分)
(2)④⑦ (2分) ③⑤ (2分) ⑤⑦(2分)
(3)① (1分) ② PH 或H O (1分)
3 2 2
17.(14分)
(1)第2周期ⅦA族(1分)
△
(2) (1分) 2NH Cl + Ca(OH) == =CaCl + 2NH ↑+ 2H O(2分)
4 2 2 3 2
(3)F-<O2-<N3- (2分)
(4)AB (2分)
(5)①分液漏斗(1分) 防倒吸(1分)
②硝酸(或HNO )(1分) 硅酸钠溶液(1分) 生成白色胶状沉淀(1分)
3
③在B与C之间连接一个盛有饱和碳酸氢钠溶液的洗气瓶(1分)
18.(13分)
(1)负(1分) Li>Al>Na (1分)
(2)①正(1分)还原(1分) ②Al + 4OH- - 3e- ==[ Al(OH) ]- (2分)
4
③镁片逐渐溶解(1分)
(3)①CH OH(1分) ②正(1分) O +4H++4e-==2H O(2分) ③11.2 (2分)
3 2 2
19.(10分)(1)X(g)+Y(g) 2Z(g) (2分)
(2)0.0395 mol·L-1·s-1(2分)
(3)b (2分)
(4)> (2分) (5)abd(2分)
20.(11分)
I.(1)增大接触面积,提高酸浸效率(1分) C + 2Cl + TiO ==TiCl + 2CO (2分)
2 2 4
(2)蒸馏 B
II.(3)BaCl 、NaOH、Na CO (2分。合理即可)
2 2 3
(4)③⑤(2分) Br + SO + 2H O==4H+ + 2Br- + SO2-(2分)
2 2 2 4