文档内容
2024—2025 学年度第一学期期中学科素养测评
高中一年级化学试卷
说明:
1.本试卷分为第I卷和第II卷(8页),答题卡(4页),共12页。
2.考试时间为75分钟,全卷满分100分。
3.考试开始前先在答题卡上填上学校、姓名、准考证号等相应的内容。
4.从第I卷各小题答案选项中选择正确的答案编号涂写在答题卡相应位置上,答在试卷上无效;
第II卷必须用黑色钢笔或签字笔答在答题卡上。考试结束,试卷不收回、答题卡收回。
5.可能用到的相对原子质量:H-1 O-16 C-12 N-14 Na-23 Mg-24 S-32
Cl-35.5 K-39 Ca-40 Mn-55 Fe-56 Cu-63.5 Ag-108
第I卷
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题
4分。在每小题只有一项是符合题目要求的。
1.“中国要强大,人民生活要好,必须有强大科技。”我国下列重大科技中获诺贝尔奖的是( )
A.蛟龙号载人潜水器实验成功 B.屠呦呦研制抗疟新药-青蒿素
C.侯德榜发明联合制碱法 D.首次人工合成结晶牛胰岛素
2.物质世界充满了变化。下列过程中,没有涉及化学变化的是( )
A.药物的合成 B.节日燃放烟花 C.维C泡腾片入水产生 D.冰块融化
大量气泡
A.A B.B C.C D.D
3.下列物质中,属于电解质且现有状态能导电的是( )
A.铁丝 B.熔融的 C.NaCl溶液 D.酒精
4.下列电离方程式书写正确的是( )
A. B.
C. D.
5.下列各组离子在溶液中一定能大量共存的是( )
A. 、 、 、 B. 、 、 、
C. 、 、 、 D. 、 、 、
6.按照物质的树状分类和交叉分类,HClO应属于
①酸②氢化物③氧化物④含氧酸⑤化合物⑥混合物⑦酸性氧化物A.②③⑥⑦ B.①④⑤ C.①②⑤ D.①③⑤
7.下列转化关系中必须加入还原剂才能实现的是( )
A. B. C. D.
8.2023年诺贝尔化学奖奖励量子点的发现和合成。量子点是一类非常小的纳米尺度颗粒,美国巴文迪将能
形成CdSe(硒化镉)纳米晶体的前驱物注入热溶剂中,通过调控温度,可以高效合成直径 1~100nm间的
CdSe量子点。下列说法中正确的是( )
A.通过该方法合成的CdSe量子点属于胶体
B.该CdSe量子点可以透过滤纸和半透膜
C.分散系中分散质粒子由小到大的正确顺序是:溶液<胶体<浊液
D.在制备 胶体实验中,不断用玻璃棒搅拌可使反应更充分
9.下列有关钠及其化合物说法正确的是( )
A.钠与硫酸铁溶液反应,可置换出铁
B.新切开的钠表面很快变暗,是因为钠与氧气反应生成过氧化钠
C.灼烧白色粉末,火焰呈黄色,证明原粉末中有 ,一定没有
D.往碳酸氢钠溶液中通入二氧化碳可以除去混有的碳酸钠杂质
10.下列微粒只具有还原性的是( )
A. B. C.Na D.
11.若 、 、 和X四种离子可以按照个数之比 大量共存于同一溶液中,则X可能为
( )
A. B. C. D.
12.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影部分的是( )
A. B.
C. D.
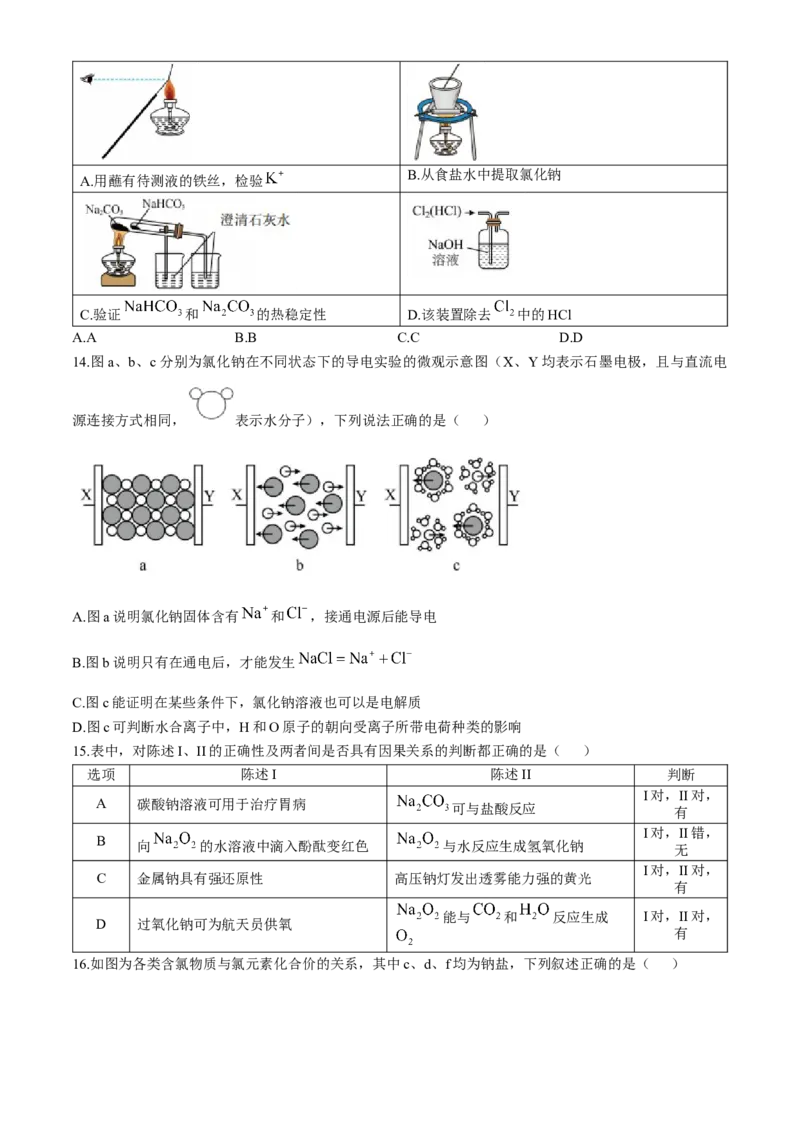
13.下列实验或操作方法正确的是( )B.从食盐水中提取氯化钠
A.用蘸有待测液的铁丝,检验
C.验证 和 的热稳定性 D.该装置除去 中的HCl
A.A B.B C.C D.D
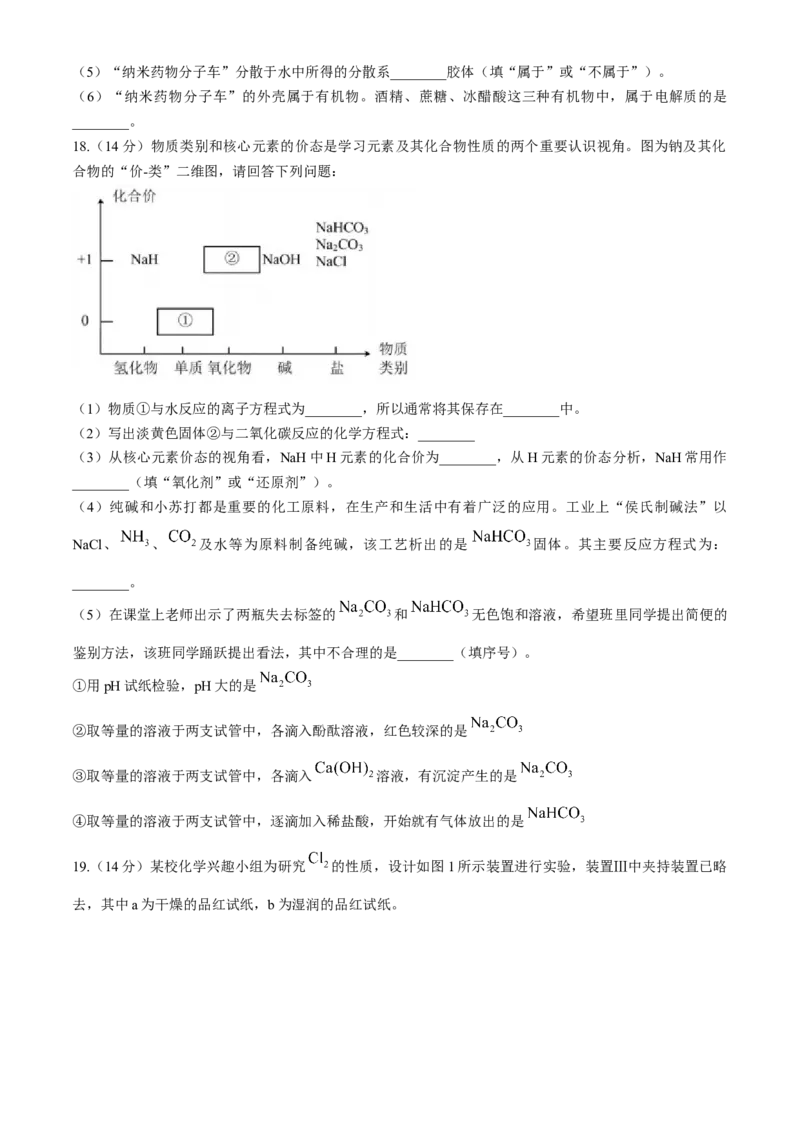
14.图a、b、c分别为氯化钠在不同状态下的导电实验的微观示意图(X、Y均表示石墨电极,且与直流电
源连接方式相同, 表示水分子),下列说法正确的是( )
A.图a说明氯化钠固体含有 和 ,接通电源后能导电
B.图b说明只有在通电后,才能发生
C.图c能证明在某些条件下,氯化钠溶液也可以是电解质
D.图c可判断水合离子中,H和O原子的朝向受离子所带电荷种类的影响
15.表中,对陈述I、II的正确性及两者间是否具有因果关系的判断都正确的是( )
选项 陈述I 陈述II 判断
I对,II对,
A 碳酸钠溶液可用于治疗胃病
可与盐酸反应 有
I对,II错,
B
向 的水溶液中滴入酚酞变红色 与水反应生成氢氧化钠 无
I对,II对,
C 金属钠具有强还原性 高压钠灯发出透雾能力强的黄光
有
能与 和 反应生成 I对,II对,
D 过氧化钠可为航天员供氧
有
16.如图为各类含氯物质与氯元素化合价的关系,其中c、d、f均为钠盐,下列叙述正确的是( )A.a→d→e的转化均可以通过一步反应实现
B.b的稀溶液可制取a
C.新制a溶液只能使石蕊变红而不褪色
D.e在空气中久置酸性减弱
第II卷
二、非选择题:本题共4小题,共56分。
17.(14分)物质的分类是学习化学的一种重要方法,科学合理的分类对于系统掌握知识、提高学习效率、
解决问题都有着重要的意义。
I.厨房中有下列用品:
①食盐 ②小苏打 ③纯碱 ④食醋(主要成分为醋酸)
(1)水溶液呈碱性的是________(填序号)。
(2)写出②在水中的电离方程式________。
(3)某同学将食盐、小苏打、纯碱划分为一类。该同学的分类依据为________(填字母)。
A.酸类 B.盐类 C.碱类 D.含钠化合物
(4)纯碱中含有少量NaCl,设计实验检验此混合物中的 、 。实验操作步骤:将少量混合物加水
溶解后,分别置于两支试管中。向第一支试管中加入稀盐酸,可观察到产生无色气泡,该反应的离子方程
式为________,说明溶液中存在 ;向第二支试管中先加入足量稀硝酸,再加入________溶液,可观
察到白色沉淀,说明溶液中存在 。
II.如图是一种“纳米药物分子运输车”,该技术可提高肿瘤的治疗效果。(5)“纳米药物分子车”分散于水中所得的分散系________胶体(填“属于”或“不属于”)。
(6)“纳米药物分子车”的外壳属于有机物。酒精、蔗糖、冰醋酸这三种有机物中,属于电解质的是
________。
18.(14分)物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视角。图为钠及其化
合物的“价-类”二维图,请回答下列问题:
(1)物质①与水反应的离子方程式为________,所以通常将其保存在________中。
(2)写出淡黄色固体②与二氧化碳反应的化学方程式:________
(3)从核心元素价态的视角看,NaH中H元素的化合价为________,从H元素的价态分析,NaH常用作
________(填“氧化剂”或“还原剂”)。
(4)纯碱和小苏打都是重要的化工原料,在生产和生活中有着广泛的应用。工业上“侯氏制碱法”以
NaCl、 、 及水等为原料制备纯碱,该工艺析出的是 固体。其主要反应方程式为:
________。
(5)在课堂上老师出示了两瓶失去标签的 和 无色饱和溶液,希望班里同学提出简便的
鉴别方法,该班同学踊跃提出看法,其中不合理的是________(填序号)。
①用pH试纸检验,pH大的是
②取等量的溶液于两支试管中,各滴入酚酞溶液,红色较深的是
③取等量的溶液于两支试管中,各滴入 溶液,有沉淀产生的是
④取等量的溶液于两支试管中,逐滴加入稀盐酸,开始就有气体放出的是
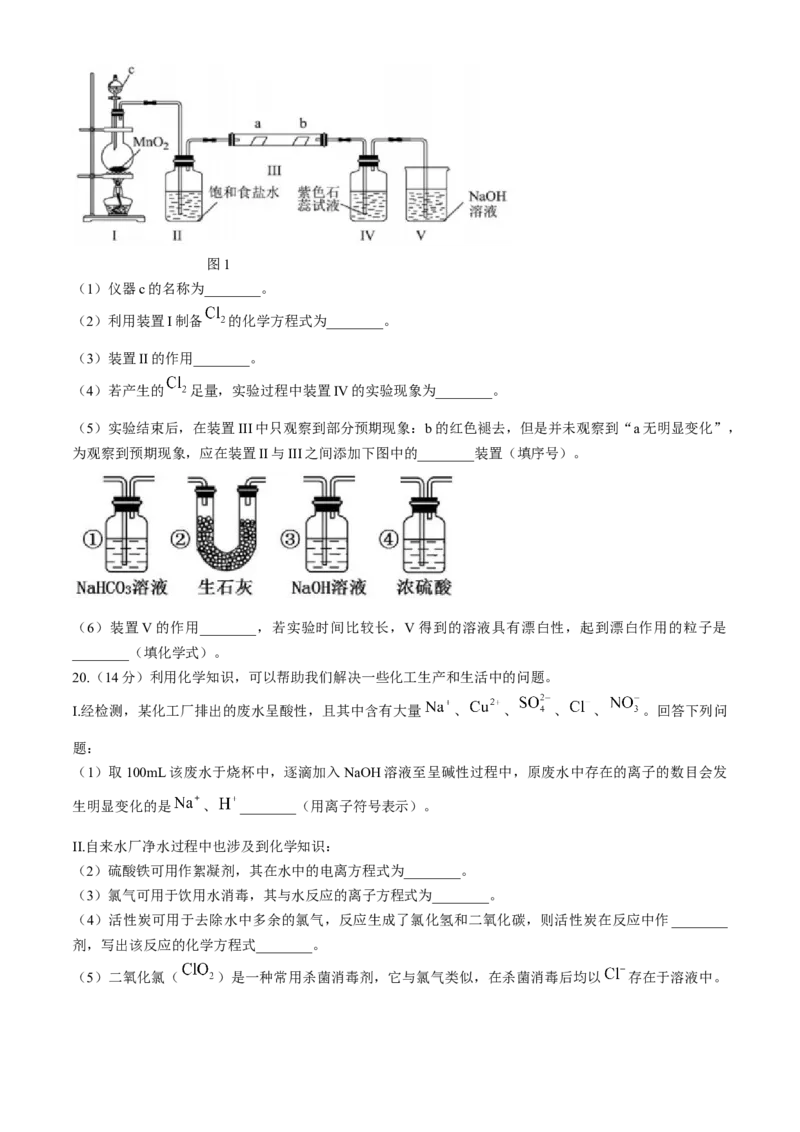
19.(14分)某校化学兴趣小组为研究 的性质,设计如图1所示装置进行实验,装置Ⅲ中夹持装置已略
去,其中a为干燥的品红试纸,b为湿润的品红试纸。图1
(1)仪器c的名称为________。
(2)利用装置I制备 的化学方程式为________。
(3)装置II的作用________。
(4)若产生的 足量,实验过程中装置IV的实验现象为________。
(5)实验结束后,在装置III中只观察到部分预期现象:b的红色褪去,但是并未观察到“a无明显变化”,
为观察到预期现象,应在装置II与III之间添加下图中的________装置(填序号)。
(6)装置V的作用________,若实验时间比较长,V得到的溶液具有漂白性,起到漂白作用的粒子是
________(填化学式)。
20.(14分)利用化学知识,可以帮助我们解决一些化工生产和生活中的问题。
I.经检测,某化工厂排出的废水呈酸性,且其中含有大量 、 、 、 、 。回答下列问
题:
(1)取100mL该废水于烧杯中,逐滴加入NaOH溶液至呈碱性过程中,原废水中存在的离子的数目会发
生明显变化的是 、 ________(用离子符号表示)。
II.自来水厂净水过程中也涉及到化学知识:
(2)硫酸铁可用作絮凝剂,其在水中的电离方程式为________。
(3)氯气可用于饮用水消毒,其与水反应的离子方程式为________。
(4)活性炭可用于去除水中多余的氯气,反应生成了氯化氢和二氧化碳,则活性炭在反应中作________
剂,写出该反应的化学方程式________。
(5)二氧化氯( )是一种常用杀菌消毒剂,它与氯气类似,在杀菌消毒后均以 存在于溶液中。在该消毒过程中表现________(填“氧化性”或“还原性”)。
III.为防治碘缺乏病,通常在食盐中添加少量的碘酸钾( ),碘酸钾和碘化钾在酸性溶液中能发生下
列反应: 。
(6)请用单线桥表示该反应的电子转移情况:2024—2025 学年度第一学期期中学科素养测评
高中一年级化学参考答案
1-5:BDBAA 6-10:BBCDC 11-16:ACCDDA
1.【详解】为表彰中国科学家屠呦呦因研制抗疟新药青蒿素作出的杰出贡献,获得2015年诺贝尔生理学或
医学奖,其余几项均未获得诺贝尔奖,故选B。
2.【详解】A.合成药物生成了新的物质,属于化学变化,故A不选;
B.节日燃放烟花中火药爆炸属于化学变化,故B不选;
C.维C泡腾片入水产生大量气泡为二氧化碳气体,有新物质生成,为化学变化,故C不选;
D.冰块融化属于物理变化,故D选;
3.【分析】注意概念:电解质是指那些在水溶液或熔融状态下能够导电的化合物。
【解析】A.铁丝能导电是因为它们有自由移动的电子,但是铁丝是金属单质,不属于电解质,故A错误;
B. 是离子化合物,在熔融状态下,离子可以自由移动,因此能够导电,离子化合物属于电解质,故
B正确;
C.NaCl在水中电离成 和 ,可以自由移动,因此能够导电,但NaCl溶液中属于混合物,不属于电
解质,故C错误;
D.酒精是有机化合物,属于非电解质,且纯酒精不导电,故D错误;
4.【详解】A. ,A正确;
B. ,B错误;
C. ,C错误;
D. ,D错误;
5.【详解】A.四种离子相互之间不反应,可以大量共存,A符合题意;
B. 、 都与 生成沉淀而不能大量共存,B不符合题意;
C. 、 生成 沉淀而不能大量共存,C不符合题意;
D. 、 均能和 生成沉淀而不能大量共存,D不符合题意;
6.【详解】HClO为酸,属于化合物,含有O元素,为含氧酸,;
符合的有①④⑤;答案选B。
7.【分析】还原剂具有还原性,必须加入还原剂才能实现,说明反应过程中某元素化合价降低被还原。
【详解】A.可由氯气和NaOH反应生成NaCl和NaClO,氯气既做氧化剂也做还原剂,不需要加入还原性
也可实现,选项A不符合;
B.过程中Mn元素的化合价降低,则应加入还原剂实现,选项B符合;C.氢元素化合价升高被氧化,需要加入氧化剂实现,选项C不符合;
D.过程中无元素的化合价发生变化,不需要加入还原性,选项D不符合;
8.【详解】A.CdSe量子点未形成分散系,不属于胶体,A错误;
B.胶体微粒可以透过滤纸但不能透过半透膜,B错误;
C.根据分散质微粒直径的大小,可以将分散系分为三类:溶液、胶体、浊液,分散系中分散质粒子直径由
小到大的正确顺序是:溶液<胶体<浊液,C正确;
D.制备 胶体时,将饱和的 溶液滴入沸水中,继续加热直到得到红褐色液体为止,不能搅拌,
搅拌会使胶体聚沉,D错误;
9.【详解】A.钠与硫酸铁溶液反应,钠先和水反应生成氢氧化钠和氢气,氢氧化钠再和硫酸铁反应生成氢
氧化铁沉淀和硫酸钠,不能置换出铁,故A错误;
B.钠是活泼金属,易被氧气氧化,新切开的钠的光亮的表面很快变暗,是因为钠与空气中氧气反应生成了
氧化钠,故B错误;
C.焰色反应为元素的性质,观察K的焰色反应需要透过蓝色的钴玻璃,则灼烧白色粉末,火焰呈黄色,证
明原粉末中有 ,不能确定是否含 ,故C错误;
D.往碳酸氢钠溶液中通入二氧化碳可以除去混有的碳酸钠杂质, ,故
D正确;
10.【详解】A. 中O为 价,处于中间价态,O元素的化合价可以升高为0价,也可以降低为 价,
既具有氧化性又具有还原性,选项A错误;
B. 处于元素的最高价,只具有氧化性,选项B错误;
C.Na化合价只能升高,不能降低,只有还原性,选项C正确;
D. 中S为+4价,处于中间价态,S元素的化合价可以升高为+6价,也可以降低为0价等,既具有氧化
性又具有还原性,选项D错误;
11.【详解】根据电荷守恒,X是 价的阴离子, 与 、 不能大量共存,故只能选 。
12.【分析】阴影部分表示除置换反应、化合反应、分解反应外的氧化还原反应。
【详解】A. 没有元素化合价改变,属于非氧化还原反应,故不选A;
B. 属于化合反应,故不选B;
C. 反应中H元素化合价改变,属于氧化还原反应,不属于基本反应类型,故
选C;
D. 属于化合反应,故不选D;
13.【详解】A.黄色光会掩盖紫色光+,所以用焰色试验检验溶液中的钾离子时,应透过蓝色的钴玻璃观察火焰,故A错误;
B.从食盐水中提取氯化钠应用蒸发的方法得到,蒸发应在蒸发皿中进行,不能在坩埚中进行,故B错误;
C.大试管中的碳酸钠直接加热不能生成能使澄清石灰水变混浊的气体,而间接加热的碳酸氢钠受热能生成
能使澄清石灰水变混浊的气体,说明碳酸钠的热稳定性强于碳酸氢钠,故C正确;
D.氯气和氯化氢都能与氢氧化钠溶液反应,所以不能用氢氧化钠溶液除去氯气中混有的氯化氢气体,故 D
错误;
14.【详解】A.氯化钠固体含有 和 ,但 和 不能自由移动,接通电源后不能导电,故A错误;
B.熔融NaCl电离不需要通电,故B错误;
C.氯化钠溶液是混合物,既不是电解质也不是非电解质,故C错误;
D.根据异性相吸的原则由图c可判断水合离子中H和O原子的朝向受到离子所带电荷种类的影响,故D正
确;
15.【解析】A.碳酸钠能够与盐酸反应,但是碳酸钠碱性较强,具有腐蚀性,不能用于治疗胃酸过多,陈述
I错误,A错误;
B.过氧化钠与水反应生成氢氧化钠,氢氧化钠为强碱,水溶液显碱性,能够使酚酞变红,过氧化钠具有强
氧化性漂白性能使得溶液褪色,所以I错,B错误;
C.钠的焰色为黄色,透雾性强,高压钠灯发出透雾能力强的黄光,I对,II对,二者无因果关系,C错误;
D.过氧化钠与水、二氧化碳反应生成碳酸钠和氧气,所以可为航天员供氧,陈述I、II的正确,且有因果关
系,D正确;
16.【分析】c、d、f均为钠盐,则c、d、f分别为NaCl、NaClO、 ,a为 ,b为HCl,e为
HClO。
【详解】A. :氯气与冷的 NaOH 溶液反应一步实现, :
NaClO溶液与二氧化碳反应可一步实现,A正确;
B.制备氯气需要用浓盐酸,B错误;
C.氯气的水溶液具有漂白性,可以漂白酸碱指示剂,则石蕊会先变红,后褪色,C错误;
D.e为次氯酸,在空气中久置分解为强酸盐酸,酸性增强,D错误;
17.(1)②③(2分)(2) (2分,写不写第二步电离不影响得分)
(3)BD(2分)(4) (2分) (2分)
(5)不属于(2分)(6)冰醋酸(2分)
【详解】(1)食盐水呈中性,碳酸氢钠、碳酸钠溶液都呈碱性,醋酸溶液呈酸性,水溶液呈碱性的是
②③;
(2)碳酸氢钠在水中电离产生钠离子和碳酸氢根,电离方程式为: ;
(3)食盐、小苏打、纯碱都能电离出金属阳离子和酸根阴离子,且阳离子均为钠离子,则食盐、小苏打、
纯碱都属于盐类,也属于含钠化合物,选BD;
(4)纯碱中含有少量NaCl,将少量混合物加水溶解后,分别置于两支试管中。向第一支试管中加入稀盐酸,碳酸钠和盐酸反应生成二氧化碳、氯化钠、水,可观察到产生无色气泡,该反应的离子方程式为
,说明溶液中存在 ;氯离子与硝酸银反应生成难溶于硝酸的氯化银沉
淀,向第二支试管中先加入足量稀硝酸,再加入 溶液,可观察到白色沉淀,说明溶液中存在 ;
(5)“纳米药物分子车”粒子直径大于100nm,分散于水中所得的分散系不属于胶体;
(6)电解质是在水溶液中或者熔融状态下能导电的化合物,故属于电解质的为:冰醋酸。
18.(1) (2分)煤油/石蜡油(2分)
(2) (2分)
(3) (2分)还原剂(2分)
(4) (2分)(5)③(2分)
【分析】根据钠的化合价以及物质类别可知,①为Na、②为淡黄色固体为 。
【详解】(1)钠与水反应生成氢氧化钠和氢气,离子方程式为 。所
以通常将钠保存在煤油中。
(2)过氧化钠与 反应生成碳酸钠和氧气,化学方程式为 。
(3)NaH中H元素化合价为 价, 价的H容易失电子,还原性较强,常用作还原剂。
(4)其主要反应原理为: 。
(5)①两种溶液的饱和溶液中,碳酸钠的浓度更大,碳酸钠溶液的碱性更强,可用量 pH的方式鉴别,①
正确;
②根据前述分析可知,碳酸钠溶液的碱性更强,加入酚酞溶液,红色更深的为碳酸钠,②正确;
③碳酸钠和碳酸氢钠都能与氢氧化钙反应生成碳酸钙沉淀,不能用氢氧化钙鉴别两者,③错误;
④碳酸钠溶液中逐滴加入稀盐酸,开始时稀盐酸与碳酸钠反应生成碳酸氢钠,无气泡产生,随着盐酸不断
加入,后续开始产生气泡,而碳酸氢钠中滴加盐酸,一开始就会产生气泡,④正确;
故答案选③。
19.(1)分液漏斗(2分)(2) (2分)
(3)除去挥发出来的HCl气体(2分)
(4)溶液先变红,后褪色(2分)
(5)④(2分)(6)吸收氯气防止污染(2分)HClO(2分,答 也给分)
【分析】由实验装置图可知,装置I中二氧化锰与浓盐酸共热反应制备氯气,浓盐酸具有挥发性,制得的
氯气中混有氯化氢和水蒸气,装置II中盛有的饱和食盐水用于除去氯化氢气体,装置III中放置的干燥的
品红试纸、湿润的品红试纸用于检验干燥的氯气没有漂白作用,装置Ⅳ中盛有的石蕊试液用于检验氯气溶于水有酸性和漂白性,装置V中盛有的氢氧化钠溶液用于吸收未反应的氯气,防止污染空气。
【详解】(1)由实验装置图可知,仪器c为分液漏斗,故答案为:分液漏斗;
(2)由分析可知,装置 I中二氧化锰与浓盐酸共热反应制备氯气,反应的化学方程式为故答案为:
,
故答案为: 。
(3)浓盐酸易挥发,有HCl挥发出来,HCl易溶于食盐水,又可以减少 的溶解;
(4)由分析可知,装置IV中盛有的石蕊试液用于检验氯气溶于水有酸性和漂白性,若产生氯气足量,实
验过程中装置IV中的实验现象为溶液先变红,后褪色,故答案为:溶液先变红,后褪色;
(5)由分析可知,装置III中放置的干燥的品红试纸、湿润的品红试纸用于检验干燥的氯气没有漂白作用,
实验中并未观察到“a无明显变化”这一预期现象是因为制得的氯气中混有水蒸气,盛有要通过干燥装置
除去水蒸气得到干燥的氯气,题给装置中只有②和④是干燥装置,因②中的碱石灰会和氯气反应,所以选
择的装置为④,故答案为:④;
(6)由分析可知,装置V中盛有的氢氧化钠溶液用于吸收未反应的氯气,会生成次氯酸钠溶液,防止污
染空气,故答案为:吸收氯气防止污染, ;
20.(1) (2分)(2) (2分)(3)
(2分)
(4)还原剂(2分) (2分)(5)氧化性(2分)
(6) (2分)
【详解】(1)该酸性废水中含有大量 、 、 、 、 、 ,取100mL该废水于烧杯
逐滴加入 NaOH 溶液至呈碱性过程中,首先发生反应: ,接着发生反应:
,这两个反应发生导致溶液中 、 的数目减少,NaOH加入,使溶液
中 的数目增加;其它离子不发生反应,无明显变化,故原废水中存在的离子的数目会发生变化的是
、 、 ;(2)硫酸电离出铁离子和硫酸根离子,电离方程式为: ;
(3)氯气和水反应生成盐酸和次氯酸,离子方程式为: ;
(4)活性炭和氯气发生反应,根据氧化还原配平,碳失4个电子,由碳指向氯气,体现还原性,方程式为:
;故答案为:还原剂; ;
(5) 由+4到 价 ,表现出氧化性。
(6)