文档内容
期中模拟测试(基础卷)
(时间:75分钟 满分:100分)
可能用到的相对原子质量:H 1 C 12 Si 28 P 31 Cl 35.5
一、选择题(本题包括15个小题,每小题只有一个选项符合题意。每小题2分,共30分)
1.(2023秋·新疆乌鲁木齐·高二乌市八中校考期末)下列关于同一原子中的基态和激发态说法中,正确的
是
A.基态时的能量比激发态时低
B.激发态时比较稳定
C.由基态转化为激发态过程中放出能量
D.电子仅在激发态跃迁到基态时才会产生原子光谱
【答案】A
【解析】激发态时能量较高,较不稳定,A正确、B不正确。电子从较低能量的基态跃迁到较高能量的激
发态时,也会产生原子光谱,D不正确
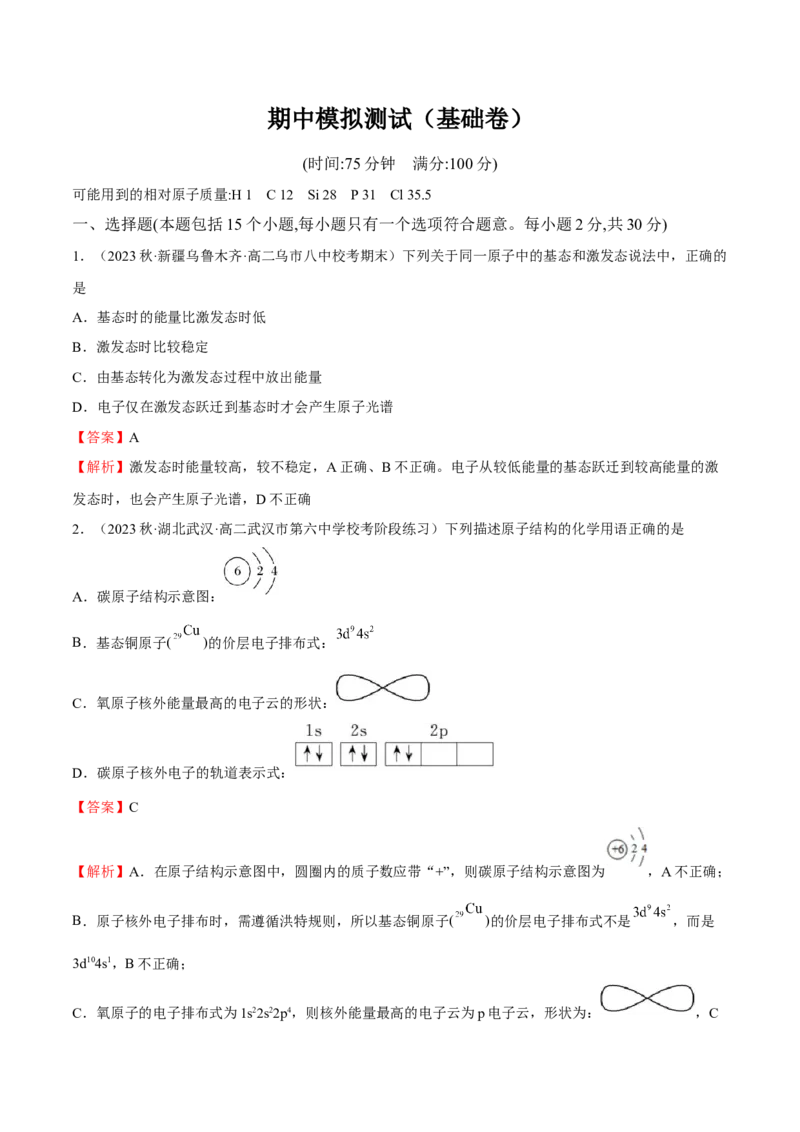
2.(2023秋·湖北武汉·高二武汉市第六中学校考阶段练习)下列描述原子结构的化学用语正确的是
A.碳原子结构示意图:
B.基态铜原子( )的价层电子排布式:
C.氧原子核外能量最高的电子云的形状:
D.碳原子核外电子的轨道表示式:
【答案】C
【解析】A.在原子结构示意图中,圆圈内的质子数应带“+”,则碳原子结构示意图为 ,A不正确;
B.原子核外电子排布时,需遵循洪特规则,所以基态铜原子( )的价层电子排布式不是 ,而是
3d104s1,B不正确;
C.氧原子的电子排布式为1s22s22p4,则核外能量最高的电子云为p电子云,形状为: ,C正确;
D.碳原子核外电子排布为1s22s22p2,轨道表示式为 ,D不正确;
故选C。
3.(2023秋·辽宁·高二沈阳市第一二〇中学校联考期末)下列化学用语表述正确的是
A.镁原子由1s22s22p63s13p1→1s22s22p63s2时,原子释放能量,由激发态转化成基态
B.基态Se的价电子排布式:
C.基态铍原子最外层电子的电子云图为:
D.电子仅在激发态跃进到基态时才会产生原子光谱
【答案】A
【解析】A.镁原子由1s22s22p63s13p1→1s22s22p63s2时,原子释放能量,由激发态转化成基态,A正确;
B.基态Se的价电子排布式: ,B错误;
C.基态Be的价电子排布式: ,则基态铍原子最外层电子的电子云图轮廓为球形,C错误;
D.原子光谱有两种:吸收光谱和发射光谱,电子由基态跃迁到激发态,或由激发态跃迁到基态,都会产
生原子光谱,D错误。
故选A。
4.(2023秋·湖北武汉·高二武汉市第六中学校考阶段练习)下列状态的镁中,电离最外层一个电子所需能
量最大的是( )
A. B. C. D.
【答案】D
【解析】AD微粒都是Mg原子失去一个电子后得到的,但是A微粒能量高于D,稳定性D>A,所以失电
子能量D>A;BC都是原子,但是B是基态、C是激发态,能量:C>B,稳定性B>C,所以失去一个电
子能量:B>C;D为Mg+、B为Mg原子,D再失去电子所需能量就是Mg原子的第二电离能,B失去一个
电子的能量是Mg原子的第一电离能,其第二电离能大于第一电离能,所以电离最外层一个电子所需能量
D>B,通过以上分析知,电离最外层一个电子所需能量最大的是D,故答案为D。【点睛】能量越高越不稳定,越易失电子;原子的第一电离能、第二电离能、第三电离能···依次增大。
5.(2022春·高二单元测试)下列电子排布式表示基态原子的核外电子排布的是
A.1s22s22p63s13p2 B.1s22s22p63s23p63d104s14p1
C.1s22s22p63s23p63d24s1 D.1s22s22p63s23p63d104s24p1
【答案】D
【解析】A.表示激发态原子,对应基态原子的电子排布式为1s22s22p63s23p1;
B.表示激发态原子,对应基态原子的核外电子排布式为1s22s22p63s23p63d104s2;
C.该原子处于激发态,对应基态原子电子排布式为1s22s22p63s23p63d14s2;
D.该电子排布式满足构造原理,能量最低,表示基态原子,正确
6.(2023秋·辽宁沈阳·高二沈阳市第十中学校考期末)下列有关分子结构与性质的说法中,正确的是
A.分子的稳定性既与键能、键长和键角有关,也与分子间作用力大小有关
B.分子中的中心原子若通过sp3杂化轨道成键,则该分子一定为正四面体结构
C.判断AB或AB 型分子是否是极性分子的依据是看分子中是否含有极性键
2 2
D.由于 能形成分子内氢键,故 比 难电离
【答案】D
【解析】A.分子的稳定性与分子内的化学键强弱有关,分子间作用力是确定物质聚集状态,所以分子的
稳定性与分子间作用力的大小无关,A项错误;
B.分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构,可能是三角锥形或V形,如
NH 是三角锥形,B项错误;
3
C.对于AB或AB 型分子是由极性键构成的分子,由该分子的分子空间结构决定分子极性,如果分子的
2 2
立体构型为直线形、键角等于180°,致使正电中心与负电中心重合,这样的分子就是非极性分子如CO,
2
若分子的立体构型为V形、键角小于180°,正电中心与负电中心不重合,则为极性分子如HO,C项错误;
2
D. 相对于 ,苯环上多了一个-COO-,羟基上与氧结合的氢原子能与羧基
上氧原子形成氢键,使-OH其更难电离出H+,D项正确;
答案选D。
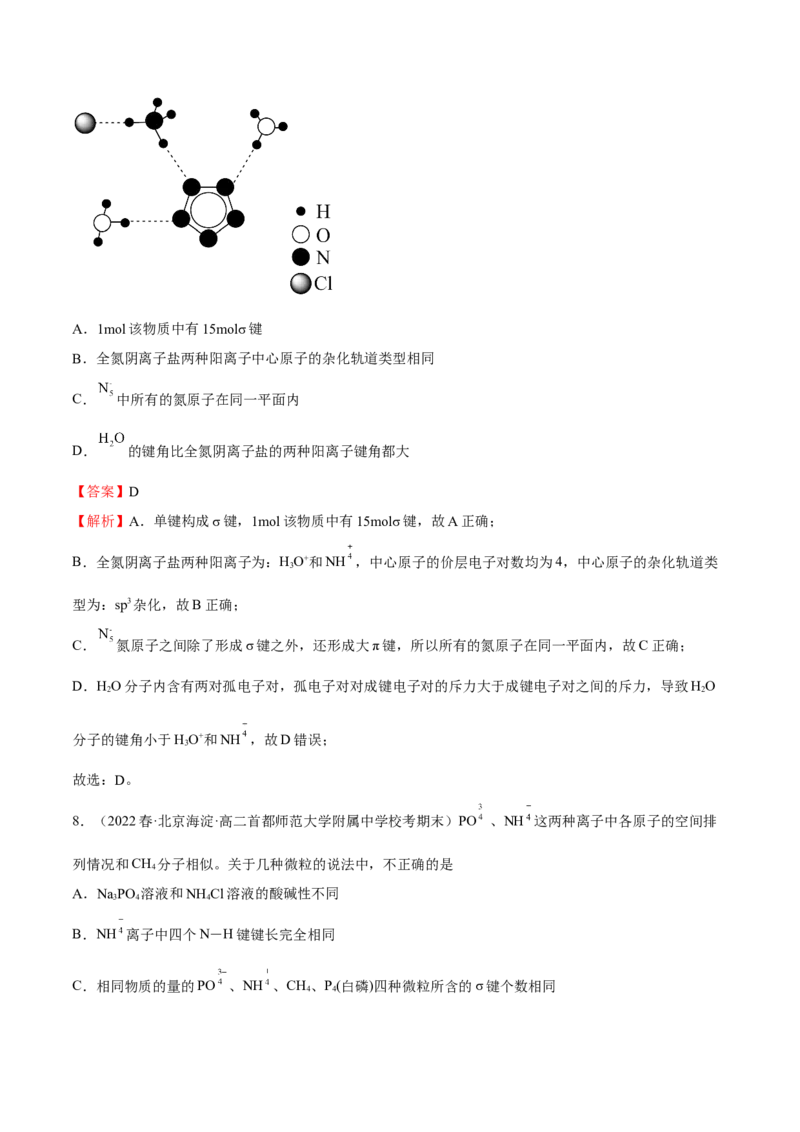
7.(2022秋·四川遂宁·高二射洪中学校考阶段练习)南京理工大学化工学院胡炳成教授团队成功合成世界
首个全氮阴离子盐,其局部结构如图所示。下列说法错误的是A.1mol该物质中有15molσ键
B.全氮阴离子盐两种阳离子中心原子的杂化轨道类型相同
C. 中所有的氮原子在同一平面内
D. 的键角比全氮阴离子盐的两种阳离子键角都大
【答案】D
【解析】A.单键构成σ键,1mol该物质中有15molσ键,故A正确;
B.全氮阴离子盐两种阳离子为:HO+和NH ,中心原子的价层电子对数均为4,中心原子的杂化轨道类
3
型为:sp3杂化,故B正确;
C. 氮原子之间除了形成σ键之外,还形成大π键,所以所有的氮原子在同一平面内,故C正确;
D.HO分子内含有两对孤电子对,孤电子对对成键电子对的斥力大于成键电子对之间的斥力,导致HO
2 2
分子的键角小于HO+和NH ,故D错误;
3
故选:D。
8.(2022春·北京海淀·高二首都师范大学附属中学校考期末)PO 、NH 这两种离子中各原子的空间排
列情况和CH 分子相似。关于几种微粒的说法中,不正确的是
4
A.NaPO 溶液和NH Cl溶液的酸碱性不同
3 4 4
B.NH 离子中四个N-H键键长完全相同
C.相同物质的量的PO 、NH 、CH、P(白磷)四种微粒所含的σ键个数相同
4 4D.PO 、NH 这离子的空间结构为四面体形
【答案】C
【解析】A.NaPO 为弱酸强碱盐呈碱性而NH Cl为弱碱强酸盐呈酸性,A项正确;
3 4 4
B. 中价层电子对为4对,无孤电子对,为正四面体,sp3杂化,N-H键均相同,B项正确;
C.前三者中均有4个σ键而后者有6个σ键,C项错误;
D. 中价层电子对为 ,无孤电子对,为四面体构型,与 相同,D项正确;
故选C。
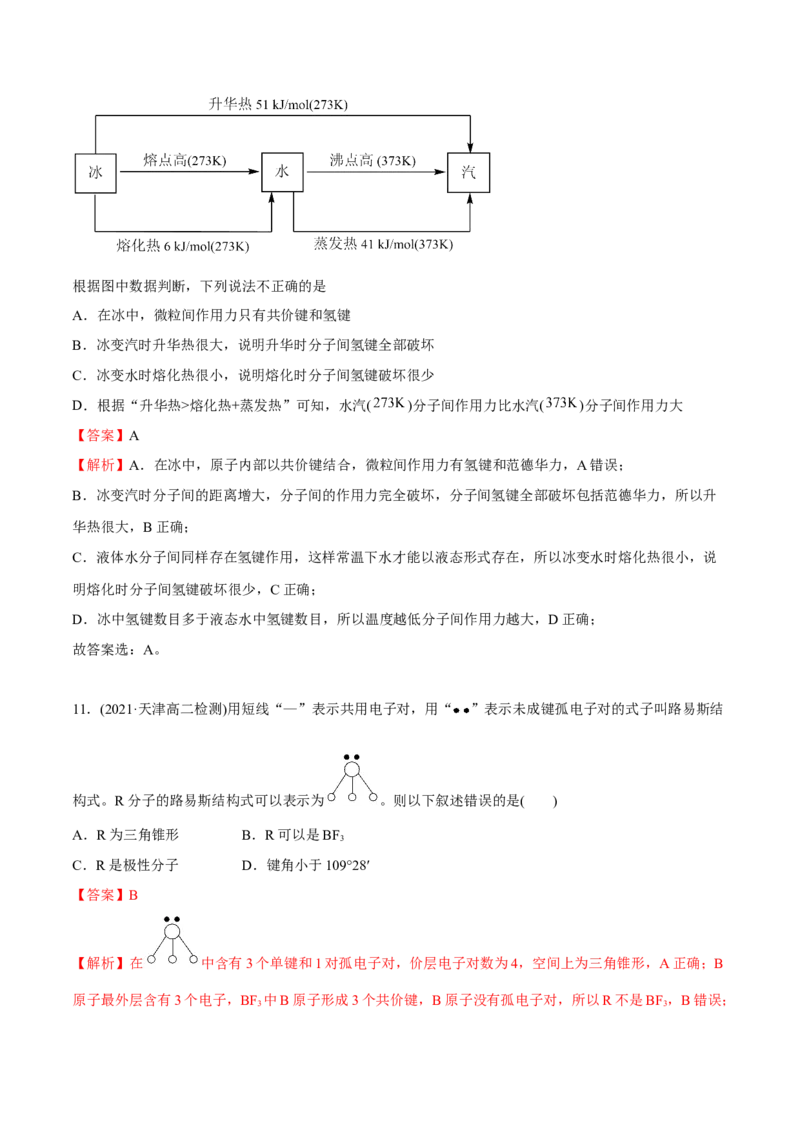
9.(2022春·四川乐山·高二统考期末)硼酸(H BO)的电离方程式为:HBO+H O [B(OH) ]-+H+,电
3 3 3 3 2 4
离时HBO 结合溶液中的OH-,使B原子最外层电子达到饱和结构,下列有关硼酸的说法正确的是
3 3
A.是一种三元弱酸
B.硼酸能抑制水的电离
C.与NaOH溶液反应的离子方程式:HBO+OH-=[B(OH) ]-
3 3 4
D.HBO 与[B(OH) ]-中B原子的杂化方式相同
3 3 4
【答案】C
【解析】A.硼酸电离出的氢离子的数目是1,可知硼酸是一元酸,A错误;
B.硼酸在水中的电离过程为: ,可以看出硼酸的电
离结合了水溶液中的氢氧根离子,对水的电离起促进作用,B错误;
C.根据硼酸电离方程式可知能和OH-发生化合反应,而使中心原子最外层电子达到饱和结构,即硼酸与
NaOH溶液反应的离子方程式:HBO+OH-=[B(OH) ]-,C正确;
3 3 4
D.硼酸的结构式为 ,[B(OH) ]-的结构式为 ,根据二者的成键电子对分别
4
为3和4,可知HBO 与[B(OH) ]-中B原子的杂化方式不同,D错误;
3 3 4
故答案选:C。
10.(2022春·浙江绍兴·高二统考期末)冰、水和汽三者之间相关联的一些热力学数据如下:根据图中数据判断,下列说法不正确的是
A.在冰中,微粒间作用力只有共价键和氢键
B.冰变汽时升华热很大,说明升华时分子间氢键全部破坏
C.冰变水时熔化热很小,说明熔化时分子间氢键破坏很少
D.根据“升华热>熔化热+蒸发热”可知,水汽( )分子间作用力比水汽( )分子间作用力大
【答案】A
【解析】A.在冰中,原子内部以共价键结合,微粒间作用力有氢键和范德华力,A错误;
B.冰变汽时分子间的距离增大,分子间的作用力完全破坏,分子间氢键全部破坏包括范德华力,所以升
华热很大,B正确;
C.液体水分子间同样存在氢键作用,这样常温下水才能以液态形式存在,所以冰变水时熔化热很小,说
明熔化时分子间氢键破坏很少,C正确;
D.冰中氢键数目多于液态水中氢键数目,所以温度越低分子间作用力越大,D正确;
故答案选:A。
11.(2021·天津高二检测)用短线“—”表示共用电子对,用“ ”表示未成键孤电子对的式子叫路易斯结
构式。R分子的路易斯结构式可以表示为 。则以下叙述错误的是( )
A.R为三角锥形 B.R可以是BF
3
C.R是极性分子 D.键角小于109°28′
【答案】B
【解析】在 中含有3个单键和1对孤电子对,价层电子对数为4,空间上为三角锥形,A正确;B
原子最外层含有3个电子,BF 中B原子形成3个共价键,B原子没有孤电子对,所以R不是BF,B错误;
3 3R分子的结构不对称,R是极性分子,C正确;三角锥形分子的键角为107°,键角小于109°28′,D正确。
12.(2021·全国·)下列“类比”结果不正确的是
A.浓硫酸与NaCl微热制备HCl,则浓硫酸与 微热可制备
B. 的分子构型为V形,则 的分子构型为V形
C.纯水的电离 ,则液氨的电离
D. 通入 溶液中无沉淀生成,则 通入 溶液中也没有沉淀生成
【答案】D
【详解】
A.浓硫酸与NaCl微热制备HCl,则浓硫酸与 微热可制备 ,均为不挥发性强酸制挥发性酸的
反应,A不符合;
B. 、 的中心原子价层电子对数为2+2=4,孤电子对数均为2,因此分子构型都为V形, B不符
合;
C. 水与氨分子内部均存在强极性键、所含氢原子都是活泼氢原子、水分子与氨分子均能结合氢离子,纯
水的电离 ,则液氨的电离 ,C不符合;
D. 通入 溶液中不发生复分解反应、无沉淀生成,二氧化硫水溶液具有明显酸性、此时硝
酸根离子具有强氧化性,则 通入 溶液中发生氧化还原反应生成硫酸钡沉淀, D符合;
答案选D。
13.(2021·陕西·武功县普集高级中学)氯化亚硫( )是一种很重要的化学试剂,可以作为氯化剂和脱
水剂。下列关于氯化亚硫分子的空间结构和中心原子( )采取何种杂化方式的说法正确的是
A.三角锥形、 B.平面三角形、
C.平面三角形、 D.三角锥形、
【答案】A【详解】
根据VSEPR, 的中心原子S原子的价层电子对数为 ,中心原子采用采用 杂化,
其中S原子含有一对孤对电子,空间构型为三角锥形,故选A。
14.下列说法中正确的是( )
A.PCl 分子是三角锥形,这是因为磷原子是sp2杂化的结果
3
B.sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的4个sp3杂化轨道
C.凡中心原子采取sp3杂化的分子,其VSEPR模型都是四面体形
D.AB 型的分子空间结构必为平面三角形
3
【答案】C
【解析】PCl 分子的价层电子对数为4,因此PCl 分子中磷原子为sp3杂化,A项错误;sp3杂化轨道是由原子最
3 3
外电子层上的s轨道和3个p轨道重新形成的能量相等、成分相同的4个轨道,B项错误;sp3杂化所得到的
VSEPR模型为四面体形,C项正确;PCl 分子中1对孤电子对占据了一个杂化轨道,因此PCl 分子是三角锥
3 3
形,D项错误。
15.根据杂化轨道理论和价层电子对互斥模型判断,下列分子或者离子的空间结构的相关描述正确的是 (
)
中心原子 价层电子 分子或离子
选项 分子式
杂化方式 对互斥模型 的空间结构
A SO sp 直线形 直线形
2
B HCHO sp2 平面三角形 三角锥形
C NF sp2 四面体形 平面三角形
3
D N sp3 正四面体形 正四面体形
【答案】D
【解析】SO 分子中的中心原子杂化方式为sp2杂化,价层电子对互斥模型呈平面三角形,分子的空间结构为
2
V形,A项错误;HCHO分子中的中心原子杂化方式为sp2杂化,价层电子对互斥模型呈平面三角形,分子的空间
结构为平面三角形,B项错误;NF 分子中的中心原子杂化方式为sp3杂化,价层电子对互斥模型呈四面体形,分
3
子的空间结构为三角锥形,C项错误。
二、选择题(本题包括5个小题,每小题有1~2个选项符合题意。每小题3分,共15分)
16.(2022春·高二单元测试)下列说法中正确的是
A.1s电子云呈球形,表示电子绕原子核做圆周运动
B.电子云图中的小黑点密度大,说明该原子核外空间电子出现的概率越大C.3d3表示3d能级有3个轨道
D.ns能级的原子轨道图可表示为
【答案】BD
【解析】电子云表示电子在核外空间某处出现的机会,不代表电子的运动轨迹,故A错误;小黑点的疏密
表示电子出现机会的多少,密则机会大,疏则机会小,故B正确;3d3表示3d能级有3个电子,故C错误;
ns能级的电子云呈球形,所以可以用该图表示该能级的原子轨道,故D正确
12.(2022春·高二单元测试)工业上电解熔融 和冰晶石 的混合物可制得铝。下列说法正
确的是
A.半径大小: B.电负性大小:
C.电离能大小: D.碱性强弱:
【答案】A
【解析】A.核外电子数相同时,核电荷数越大半径越小,故半径大小为 ,故A正确;
B.同周期元素核电荷数越大电负性越大,故 ,故B错误;
C.同周期从左往右第一电离能呈增大趋势,同主族从上往下第一电离能呈减小趋势,故电离能大小为
,故C错误;
D.元素金属性越强,其最高价氧化物对应水化物的碱性越强,故碱性强弱为 ,故D错误;
故选A。
17.(2022·全国·高二专题练习)短周期主族元素X、Y、Z、W的原子序数依次增大,X与Y位于不同周
期,Y与W位于同一主族,Y、Z原子的最外层电子数之和等于它们的内层电子总数之和,W在同周期主
族元素的基态原子中第一电离能最大。下列说法错误的是
A.与X同主族的元素的基态原子最外层电子所占轨道呈球形
B.Y、Z、W均位于元素周期表的p区
C.Z与W可形成多种化合物D.Z的最高价氧化物对应的水化物为强酸
【答案】D
【分析】短周期主族元素X、Y、Z、W的原子序数依次增大,Y与W位于同一主族,W在同周期主族元
素的基态原子中第一电离能最大,则Y为F元素,W为Cl元素,X与Y位于不同周期,X为H元素,Y、
Z原子的最外层电子数之和等于它们的内层电子总数之和,则Z为P元素,据此分析解答。
【解析】由以上分析知,X为H元素,Y为F元素,Z为P元素,W为Cl元素,
A.与H同主族的元素的基态原子最外层电子所占的轨道为s轨道,呈球形,故A正确;
B.F、P、Cl均位于元素周期表的p区,故B正确;
C.仅由P、Cl两种元素组成的化合物可以是PCl 、PCl 等,不止一种,故C正确;
3 5
D.P的最高价氧化物对应的水化物为磷酸,属于中强酸,不是强酸,故D错误;
故选D。
18.(2022春·高二单元测试)聚合物前驱体转化法在陶瓷材料制备领域有重要应用价值,一种聚合物前
驱体结构如图所示(R 、R 表示烃基)。W、X、Y、Z为原子序数依次增大的短周期元素,X、Z同主族,W
1 2
的核外电子总数等于Y的最外层电子数。下列说法不正确的是
A.原子半径:
B.简单氢化物沸点:
C.最高价含氧酸的酸性:
D.Z的氧化物 为共价晶体
【答案】C
【分析】W、X、Y、Z为原子序数依次增大的短周期元素,X、Z同主族,均成四根键,X为C,Z为Si,
W的核外电子总数等于Y的最外层电子数,W为B,Y为N。
【解析】A.同周期从左往右原子半径减小,同主族从上往下原子半径逐渐增大,故原子半径:Si>C>N,
A正确;
B.NH 中含分子间氢键,沸点高于CH,B正确;
3 4
C.同主族从上往下非金属减弱,故最高价含氧酸的酸性: ,C错误;
D.SiO 为共价晶体,D正确;
2故选C。
19.(2022春·广东江门·高二鹤山市鹤华中学校考期中)N 表示阿伏加德罗常数的值。下列说法正确的是
A
A.1.5gCH 含有的电子数为N
A
B.标准状况下,11.2L四氯化碳中含有的C-Cl键的个数为2N
A
C.60gSiO 和12g金刚石中各含有4N 个Si-O键和4N 个C-C键
2 A A
D.在1L0.1mol/L氯化铝溶液中阳离子总数大于0.1N
A
【答案】D
【解析】A.CH 含有8个电子,1.5gCH 的物质的量为0.1mol,则含有的电子数为0.8N ,A项错误;
A
B.标准状况下,四氯化碳为液体,无法通过气体摩尔体积计算,B项错误;
C.60g SiO 的物质的量是l mol,每个Si与4个O原子形成共价键,因此l mol SiO 的晶体中含有4 mol Si-
2 2
O键,Si-O键数目是4N ,12g金刚石的物质的量是l mol,由于每个C原子与相邻4个C原子形成共价键,
A
每个共价键为相邻的2个C原子所共有,则1 mol C原子形成的共价键数目是2N ,C项错误;
A
D.1L0.1mol/L氯化铝溶液中,铝离子的物质的量为0.1mol,铝离子易水解,
,水解后阳离子数增加,则阳离子总数大于0.1N ,D项正确;
A
答案选D。
20.(2022春·福建泉州·高二福建省德化第一中学校联考阶段练习)由原子序数依次增大的五种短周期元
素X、Y、Z、W、M组成的化合物是从生物体中得到的一种物质,其结构如图所示,X是短周期中原子半
径最小的元素,Z、M同主族,Z、W的原子序数之和等于M的原子序数。下列有关说法错误的是
A.Y、Z、M的杂化方式均为sp3杂化
B.最简单氢化物的沸点:M>W>Z>Y
C.原子半径:Y>Z>W>M
D.X、Y、Z、W四种元素可组成含有极性键和非极性键的离子化合物
【答案】BC【分析】根据X是短周期中原子半径最小的元素,推X为H元素,Y形成四个键,Y为C元素,Z、M同
族,Z形成三个键,M形成五对共用电子对,Z、M分别为N、P元素,由Z、W的原子序数之和等于M
的原子序数,此可推出W为O元素;
【解析】A.单键碳原子采用sp3杂化,N形成三个单键和一对孤电子对,采用sp3杂化,P原子形成三个单
键和一个双键,采用sp3杂化,A项正确;
B.最简单氢化物沸点,根据分子晶体沸点比较,水分子间含有的氢键最多沸点最高,氨气分子间存在氢
键,沸点较高,PH 和CH 分子间不存在氢键沸点较低,而PH 的相对分子质量大,范德华力强,沸点比
3 4 3
甲烷高,故沸点大小为:HO>NH >PH>CH ,B项错误;
2 3 3 4
C.同主族元素从上到下原子半径依次增大,故P原子半径比N原子半径大,C项错误;
D.H、C、N,O形成(NH )C O 等物质中含有离子键、极性键和非极性键,D项正确;
4 2 2 4
故选答案BC。
三、非选择题(本题包括5个小题,共55分)
21.(11分)(2021·山东章丘四中高二月考)A、B、C、D、E代表5种元素。请填空:
(1)A元素的原子最外层电子排布式为nsnnpn+1,则n=__________,原子中能量最高的是__________电子。
(2)B元素的-1价离子和C元素的+1价离子的电子层结构都与氩相同,B的元素符号为__________,C的
元素符号为__________。
(3)D元素的+3价离子的3d轨道为半充满状态,D的元素符号为__________,其基态原子的核外电子排布
式为__________________。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为__________,
其基态原子的核外电子排布式为__________________________________________________________。
【答案】 (1)2 2p (2)Cl K (3)Fe 1s22s22p63s23p63d64s2(或[Ar]3d64s2)
(4)Cu 1s22s22p63s23p63d104s1(或[Ar]3d104s1)
【解析】(1)s能级只有1个原子轨道,故最多只能容纳2个电子,即n=2,所以A元素的原子最外层电子
排布式为2s22p3,由此可知A是N;根据构造原理可知氮原子核外电子中2p电子能量最高。
(2)B-、C+的电子层结构都与Ar相同,即核外都有18个电子,则B为17号元素Cl,C为19号元素K。
(3)D 元素原子失去 2 个 4s 电子和 1 个 3d 电子后变成+3 价离子,其基态原子的核外电子排布式为
1s22s22p63s23p63d64s2,D为26号元素Fe。
(4)由题可知基态E原子核外电子排布式为1s22s22p63s23p63d104s1,该元素为29号元素Cu。
22.(10分)下表是元素周期表的一部分,表中所列字母分别代表一种元素。试回答下列问题:
(1)请写出n元素基态原子的电子排布式: 。(2)h 的 单 质 在 空 气 中 燃 烧 发 出 耀 眼 的 白 光 , 请 用 原 子 结 构 的 知 识 解 释 发 光 的 原 因 :
。
(3)o、p两元素的部分电离能数据列于下表:
元素 o p
I 717 759
1
I 1 509 1 561
2
I 3 248 2 957
3
比较两元素的 I 、I 可知,气态 o2+再失去一个电子比气态 p2+再失去一个电子难,其原因是
2 3
。
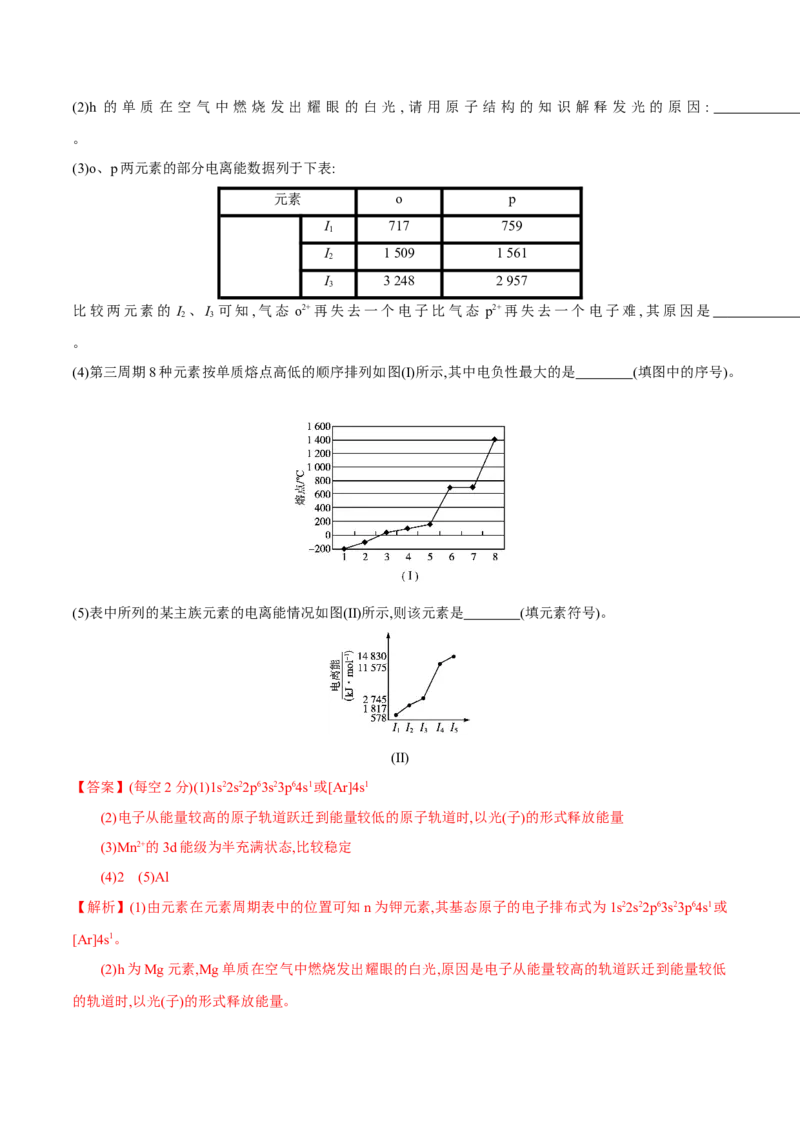
(4)第三周期8种元素按单质熔点高低的顺序排列如图(Ⅰ)所示,其中电负性最大的是 (填图中的序号)。
(5)表中所列的某主族元素的电离能情况如图(Ⅱ)所示,则该元素是 (填元素符号)。
(Ⅱ)
【答案】(每空2分)(1)1s22s22p63s23p64s1或[Ar]4s1
(2)电子从能量较高的原子轨道跃迁到能量较低的原子轨道时,以光(子)的形式释放能量
(3)Mn2+的3d能级为半充满状态,比较稳定
(4)2 (5)Al
【解析】(1)由元素在元素周期表中的位置可知n为钾元素,其基态原子的电子排布式为1s22s22p63s23p64s1或
[Ar]4s1。
(2)h为Mg元素,Mg单质在空气中燃烧发出耀眼的白光,原因是电子从能量较高的轨道跃迁到能量较低
的轨道时,以光(子)的形式释放能量。(4)第三周期元素中电负性最大的元素是Cl,第三周期元素形成的单质只有Cl 和Ar在常温下是气态,Cl
2 2
的相对分子质量大于Ar,故Cl 的熔点高于Ar。
2
23.(12分)X、Y、Z、M、Q是中学化学常见的五种元素,原子序数依次增大,其相关结构或性质信息如下表
所示。
元素 结构或性质信息
X 其原子最外层电子数是内层电子数的2倍
Y 基态原子最外层电子排布为nsnnpn+1
Z 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰
M 单质在常温、常压下是气体,基态原子的M层上有1个未成对的p电子
Q 其与X形成的合金为目前用量最多的金属材料
(1)Q元素基态原子的电子排布式是 。
(2)比较Y元素与氧元素的第一电离能: > (填元素符号);X和Z形成的化合物XZ 为一种液
2
体溶剂,其分子中的σ键和π键数目之比为 ,该化合物 溶于水(填“易”或“难”)。
(3)Y的最简单氢化物分子中含有 共价键(填“极性”或“非极性”,下同),是 分子,该氢化
物易液化,其原因是 。
(4)M的气态氢化物和氟化氢相比(填写化学式,并从微粒间作用力的角度分析原因),稳定性强的是 ,
其原因是 ;沸点高的是 ,其原因是
。
【答案】(除有标注的外,每空1分)(1)[Ar]3d64s2(或1s22s22p63s23p63d64s2)
(2)N O(两空共1分) 1∶1(2分) 难
(3)极性 极性 氨分子间可以形成氢键
(4)HF H—F的键能大于H—Cl HF HF分子间可以形成氢键
【解析】根据题意推知X、Y、Z、M、Q分别是C、N、S、Cl、Fe元素。
(1)铁原子核外有26个电子,基态原子的电子排布式是[Ar]3d64s2或1s22s22p63s23p63d64s2。
(2)N原子的2p能级是半充满状态,较稳定,因此第一电离能:N>O。X和Z形成的化合物XZ 为CS,根据
2 2
结构式S C S可知,分子中σ键和π键数目之比为1∶1,且为非极性分子;根据“相似相溶”规律可判断CS
2
难溶于水。
(3)Y的最简单氢化物为NH ,N—H是极性共价键,分子结构呈三角锥形,结构不对称,为极性分子;氨气易
3
液化的原因是氨分子间可以形成氢键。
(4)由于H—F的键能大于H—Cl,故氢化物的稳定性:HF>HCl;由于HF分子间可以形成氢键,故其沸点比HCl的高。
24.(11分)卤族元素形成的单质和化合物有很多,我们可以利用所学物质结构与性质的相关知识去认识和理
解它们。
(1)卤族元素位于元素周期表的 区;溴的价层电子排布式为 。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF) 形式存在的,使氢氟酸分子缔合的作用力是 。
2
(3)请根据下表提供的第一电离能数据判断,还原性最强的卤素原子是 (写出名称)。
元 素 氟 氯 溴 碘
第一电离能/(kJ·mol-1) 1 681 1 251 1 140 1 008
(4)已知下列5种羧酸:
①CF COOH ②CHCOOH ③CHFCOOH
3 3 2
④CH ClCOOH ⑤CHCHCOOH
2 3 2
其酸性由强到弱的顺序为 (填序号)。
(5)硼酸(H BO)是一种片层状结构的白色晶体,层内的HBO 分子通过氢键相连(如图)。则1 mol H BO 形成
3 3 3 3 3 3
的晶体中有 mol氢键。
硼酸溶于水生成弱电解质一水合硼酸
B(OH) ·H O,它电离生成少量[B(OH) ]-和H+,则[B(OH) ]-的空间结构为 ,其中B原子
3 2 4 4
的杂化方式是 。
【答案】[(1)(2)(3)每空1分,(4)(5)每空2分]
(1)p 4s24p5 (2)氢键 (3)碘 (4)①>③>④>②>⑤ (5)3 正四面体形 sp3
【解析】(3)由表中数据可知,碘的第一电离能最小,即碘失去电子能力最强,其还原性最强。
(4)F原子吸电子能力大于Cl,烃基是推电子基团,烃基中碳原子数越多,其推电子能力越弱,故5种羧酸酸
性由强到弱的顺序为①>③>④>②>⑤。
(5)由硼酸片层结构图可以看出,每个硼酸分子可以形成6个氢键,由于氢键存在于分子之间,故1 mol硼
酸形成的晶体中有3 mol氢键。在[B(OH) ]-中,B原子价层电子对数为4,无孤电子对,故[B(OH) ]-是正四面体
4 4
结构,B原子采取sp3杂化。25.(11分)(1)肼(N H)分子可视为NH 分子中的一个氢原子被—NH (氨基)取代形成的另一种氮的氢化物。
2 4 3 2
①NH 分子的空间结构是 ;N H 分子中氮原子轨道的杂化类型是 。
3 2 4
②肼可用作火箭燃料,燃烧时发生的反应是
NO(l)+2N H(l) 3N(g)+4HO(g)
2 4 2 4 2 2
ΔH=-1 038.7 kJ·mol-1
若该反应中有4 mol N—H断裂,则形成的π键有 mol。
③肼能与硫酸反应生成NHSO 。NHSO 与硫酸铵化合物类型相同,则NHSO 晶体内不存在 (填标
2 6 4 2 6 4 2 6 4
号)。
a.离子键 b.共价键 c.范德华力
(2)第ⅥA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。请回答下列问题:
①HSe的酸性比HS (填“强”或“弱”)。气态SeO 分子的空间结构为 ,SO2-的空间结构为
2 2 3 3
。
②H SeO 的分别为2.7×10-3和2.5×10-7,H SeO 第一步几乎完全电离,为1.2×10-2,请根据结构与性质的关系解
2 3 2 4
释:H SeO 比HSeO 酸性强的原因 。
2 4 2 3
【答案】(除有标注的外,每空1分)(1)①三角锥形 sp3 ②3 ③c(2分)
(2)①强 平面三角形 三角锥形 ②HSeO 和HSeO 可表示为(HO) SeO和(HO) SeO,H SeO 中的Se
2 3 2 4 2 2 2 2 3
为+4价,而HSeO 中的Se为+6价,正电性更高,导致Se—O—H中O的电子更向Se偏移,越易电离出H+(3分)
2 4
【解析】 (1)①NH 分子中氮原子的杂化方式为sp3杂化,其分子的空间构型为三角锥形;氨基(—NH )中
3 2
氮原子的杂化方式也为sp3杂化,其分子的空间构型为Ⅴ形。NH 的结构为HN—NH,相当于2个氨基,
2 4 2 2
所以氮原子的杂化方式也为sp3杂化。
②1个NH 分子含有4个N—H键,即4 mol N—H键断裂同时生成1.5 mol N,N 的结构式为N≡N,含1
2 4 2 2
个σ键和2个π键,所以会形成3 mol π键。
③NHSO 和(NH )SO 都是离子晶体,NH2+和SO 2-之间存在离子键,NH2+中N和H之间形成6个共价
2 6 4 4 2 4 2 6 4 2 6
键(其中2个配位键),N和N之间形成共价键,SO 2-中S和O之间形成共价键,不含范德华力。
4
(2)①Se的原子半径大于S的原子半径,HSe与HS相比,HSe中Se原子对H原子的作用力较弱,HSe在
2 2 2 2
水中更容易电离出H+,所以其酸性较强;SeO 中Se原子采取sp2杂化且有3个配位原子,故其立体构型为
3
平面三角形;SO 2-中S原子采取sp3杂化且有3个配位原子,故其立体构型为三角锥形。②HSeO 中Se为
3 2 3
+4价,而HSeO 中Se为+6价,Se的正电性更高,导致Se—O—H中O原子的电子向Se原子偏移,因
2 4
而在水分子的作用下,也就越容易电离出H+,即酸性越强。