文档内容
【冲刺期末】高二化学期末模拟测试卷(二)
(时间:90分钟 满分:100分)
一、选择题(本题共15小题,每小题3分,共45分,每小题只有一个选项符合题意)
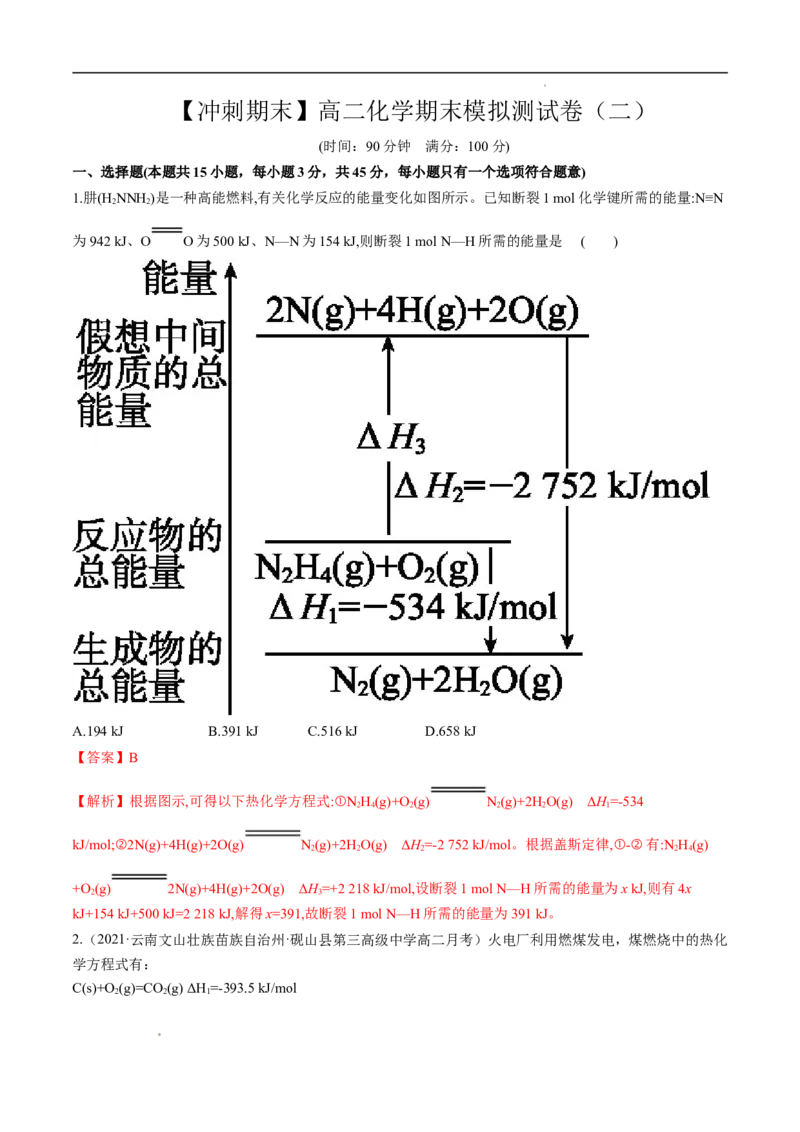
1.肼(H NNH)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol化学键所需的能量:N≡N
2 2
为942 kJ、O O为500 kJ、N—N为154 kJ,则断裂1 mol N—H所需的能量是 ( )
A.194 kJ B.391 kJ C.516 kJ D.658 kJ
【答案】B
【解析】根据图示,可得以下热化学方程式:①N H(g)+O(g) N(g)+2HO(g) ΔH=-534
2 4 2 2 2 1
kJ/mol;②2N(g)+4H(g)+2O(g) N(g)+2HO(g) ΔH=-2 752 kJ/mol。根据盖斯定律,①-②有:N H(g)
2 2 2 2 4
+O (g) 2N(g)+4H(g)+2O(g) ΔH=+2 218 kJ/mol,设断裂1 mol N—H所需的能量为x kJ,则有4x
2 3
kJ+154 kJ+500 kJ=2 218 kJ,解得x=391,故断裂1 mol N—H所需的能量为391 kJ。
2.(2021·云南文山壮族苗族自治州·砚山县第三高级中学高二月考)火电厂利用燃煤发电,煤燃烧中的热化
学方程式有:
C(s)+O(g)=CO (g) ΔH =-393.5 kJ/mol
2 2 1
学科网(北京)股份有限公司CO(g)+ O(g)=CO (g) ΔH =-283 kJ/mol
2 2 2
C(s)+ O(g)=CO(g) ΔH =?
2 3
下列有关说法中不正确的是
A.CO的燃烧热为283 kJ/mol
B.二氧化碳分解为一氧化碳和氧气的反应是吸热反应
C.ΔH=ΔH -ΔH =110.5 kJ/mol
3 2 1
D.ΔH=ΔH -ΔH =-110.5 kJ/mol
3 1 2
【答案】C
【解析】A.CO(g)+ O(g)═CO(g)△H=-283kJ/mol,CO的燃烧热为283 kJ/mol,故A正确;
2 2 2
B.CO(g)+ O(g)═CO(g)△H=-283kJ/mol,为放热反应,逆反应为吸热反应,故B正确;
2 2 2
C.碳不完全燃烧C(s)+ O(g)=CO(g),该反应也是放热反应,△H<0,故C错误;
2
D.①C(s)+O(g)═CO(g)△H=-393.5kJ/mol;②CO(g)+ O(g)═CO(g)△H=-283kJ/mol;根据盖斯定律①-
2 2 1 2 2 2
②得C(s)+ O(g)═CO(g)△H,所以△H=△H-△H=-110.5 kJ/mol,故D正确;
2 3 3 1 2
故选C。
3.下列关于如图所示转化关系(X代表卤素)的说法错误的是 ( )
A.ΔH<0
3
B.ΔH=ΔH+ΔH
1 2 3
C.按Cl、Br、I的顺序,ΔH 依次增大
2
D.ΔH 越小,HX越稳定
1
【答案】C
学科网(北京)股份有限公司【解析】A项,原子形成化学键时放热,则反应2H(g)+2X(g) 2HX(g) ΔH<0,正确;B项,根据盖斯定律,
3
途径 Ⅰ 生成HX的反应热与途径无关,所以ΔH=ΔH+ΔH,正确;C项,Cl、Br、I的原子半径依次增大,Cl、
1 2 3 2
Br 、I 断裂化学键需要的能量依次减小,所以途径Ⅱ按Cl、Br、I的顺序,吸收的热量依次减小,即ΔH 依次减
2 2 2
小,错误;D项,途径 Ⅰ ,ΔH 越小,说明放出的热量越多,则生成HX具有的能量越低,HX越稳定,正确。
1
4.在一个绝热的、容积固定的密闭容器中发生可逆反应:N (g)+3H(g) 2NH (g) ΔH<0。下列各项中
2 2 3
不能说明该反应已经达到化学平衡状态的是 ( )
A.体系的压强不再改变
B.体系的温度不再改变
C.断裂1 mol N≡N的同时,也断裂6 mol N—H
D.反应消耗的N、H 与产生NH 的速率v(N )∶v(H )∶v(NH )=1∶3∶2
2 2 3 2 2 3
【答案】D
【解析】无论反应是否达到平衡状态,反应消耗的N、H 与生成NH 的速率之比均为1∶3∶2,因此D项不能表
2 2 3
示该反应达到平衡状态。
5.(2022·全国高三专题练习)下列有关化学平衡常数的描述中正确的是( )
A.化学平衡常数的大小取决于化学反应本身,与其他外界条件无关
B.相同温度下,反应 与反应 的化学平衡常数相同
C.反应 的化学平衡常数随温度升高而增大
D.反应 的平衡常数达式为
【答案】D
【解析】化学反应平衡常数K表达式为生成物的浓度幂之积比反应物的浓度幂之积,且平衡常数只与反应
温度有关,温度升高,平衡如果正向移动,K变大,平衡如果逆向移动,K值变小。A.化学平衡常
数的大小取决于化学反应本身,并且只与温度有关,A项错误;B.相同温度下,反应
与反应 的化学平衡常数互为倒数,B项错误;C.反应
的化学平衡常数随温度升高而减小,C项错误;D.反应
学科网(北京)股份有限公司的平衡常数达式为 ,D项正确。答案选D。
6.恒温下,反应aX(g) bY(g)+cZ(g)达到平衡状态,把容器容积缩小到原来的 ,且达到新的平衡状态
时,X的物质的量浓度从0.1 mol/L增大到0.19 mol/L。下列判断中正确的是 ( )
A.a>b+c B.a1×10-7mol/L,说明促进水的电离,
A.NaOH是强碱,电离出的OH-抑制了水的电离,故A错误;
B.NaHSO 溶液中溶质完全电离,溶液显酸性,抑制水的电离,故B错误;
4
C.HNO 是强酸,完全电离,电离出的H+抑制了水的电离,故C错误;
3
D.CHCOONa属于强碱弱酸盐,电离出的CHCOO-发生水解,促进水的电离,故D正确。
3 3
故选D。
8.下列事实不能说明一元酸HA为弱酸的是 ( )
A.常温下0.1 mol/L的HA溶液pH=5
B.常温下NaA溶液的pH>7
C.HA溶液中存在H+、OH-、A-、HA
D.HA溶液能与大理石反应
【答案】D
【解析】A项,c(H+)=1×10-5 mol/L<0.1 mol/L,说明HA未完全电离,即HA为弱酸;B项,NaA溶液的pH>7,说明
A-发生水解,即HA为弱酸;C项,HA溶液中有HA分子,说明HA为弱酸;D项,只能说明HA比HCO 的酸性强,
2 3
不能说明HA为弱酸。
9.下列关于实验现象的描述中不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
学科网(北京)股份有限公司B.用铜板作电极电解硫酸铜溶液,阴极铜板质量增加
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率增大
【答案】C
【解析】A项中构成Fe-Cu原电池,负极Fe失电子溶解,H+在正极Cu上得电子生成H,现象描述正确;B项中
2
阳极Cu失电子溶解,Cu2+在阴极铜板上得电子使铜板质量增加,现象描述正确;C项中发生Cu+2Fe3+
Cu2++2Fe2+,没有铁生成,现象描述错误;D项中发生Zn+Cu2+ Zn2++Cu,生成的铜与锌构成原电池,加快
锌的腐蚀,现象描述正确。
10.下列说法中正确的是 ( )
A.因为NH Cl为强酸弱碱盐,故可用加热法除去NaCl中的NH Cl
4 4
B.用硫酸清洗锅炉中的水垢
C.用NaS作沉淀剂,除去废水中的Cu2+和Hg2+
2
D.氯化铝是一种电解质,可用电解法制铝
【答案】C
【解析】用加热法除去NaCl中的NH Cl的原因是氯化铵受热易分解为NH 和HCl,A项错误;硫酸与锅炉水
4 3
垢中的主要成分CaCO 反应生成微溶的CaSO 会覆盖在CaCO 表面阻碍反应继续进行,故应选盐酸而不是硫
3 4 3
酸,B项错误;Cu2+、Hg2+与S2-会生成难溶性CuS、HgS沉淀,C项正确;氯化铝是共价化合物,熔融状态下不导
电,工业上用电解熔融Al O 的方法制铝,D项错误。
2 3
11.将0.1 mol/L CH COOH溶液加水稀释或加入少量CHCOONa晶体时,都会引起 ( )
3 3
A.溶液的pH增大
B.CH COOH电离程度增大
3
C.溶液的导电能力减弱
D.溶液中c(OH-)减小
【答案】A
【解析】CHCOOH溶液中存在着CHCOOH的电离平衡,加水稀释使平衡向正反应方向移动,电离程度增大,
3 3
溶液中的c(H+)减小,c(OH-)增大,pH增大;加入少量CHCOONa晶体时,平衡向逆反应方向移动,电离程度减小,
3
c(H+)减小,c(OH-)增大,pH增大。
12.已知p(Ba2+)=-lgc(Ba2+)、p(X2-)=-lgc(X2-),常温下BaSO、BaCO 的沉淀溶解平衡曲线如图所示,下列叙
4 3
述中正确的是
A.p(Ba2+)=a时,两种盐的饱和溶液中离子浓度c(SO )>c(CO )
学科网(北京)股份有限公司B.M点对应的溶液中Ba2+、CO 能形成BaCO 沉淀
3
C.相同条件下,SO 比CO 更易与Ba2+结合形成沉淀
D.BaSO 不可能转化为BaCO
4 3
【答案】C
【分析】
横纵坐标代表离子浓度负对数,即横纵坐标数值越大,其离子浓度越小,根据溶度积的公式以及图像,
BaSO 的溶度积小于BaCO 的溶度积,据此分析解答;
4 3
【解析】
A.根据上述分析,K (BaSO)<K (BaCO),相同c(Ba2+)时,c(SO )<c(CO ),故A错误;
sp 4 sp 3
B.根据上述分析,M点中c(Ba2+)×c(CO )<K (BaCO),此时碳酸钡溶液为不饱和溶液,故B错误;
sp 3
C.因为K (BaSO)<K (BaCO),因此相同条件下,先产生硫酸钡沉淀,即相同条件下,SO 比CO 更
sp 4 sp 3
易与Ba2+结合形成沉淀,故C正确;
D.硫酸钡饱和溶液中加入NaCO 溶液,当溶液中c(Ba2+)×c(CO )>K (BaCO),有BaCO 沉淀析出,实
2 3 sp 3 3
现BaSO 转化成BaCO ,故D错误;
4 3
答案为C。
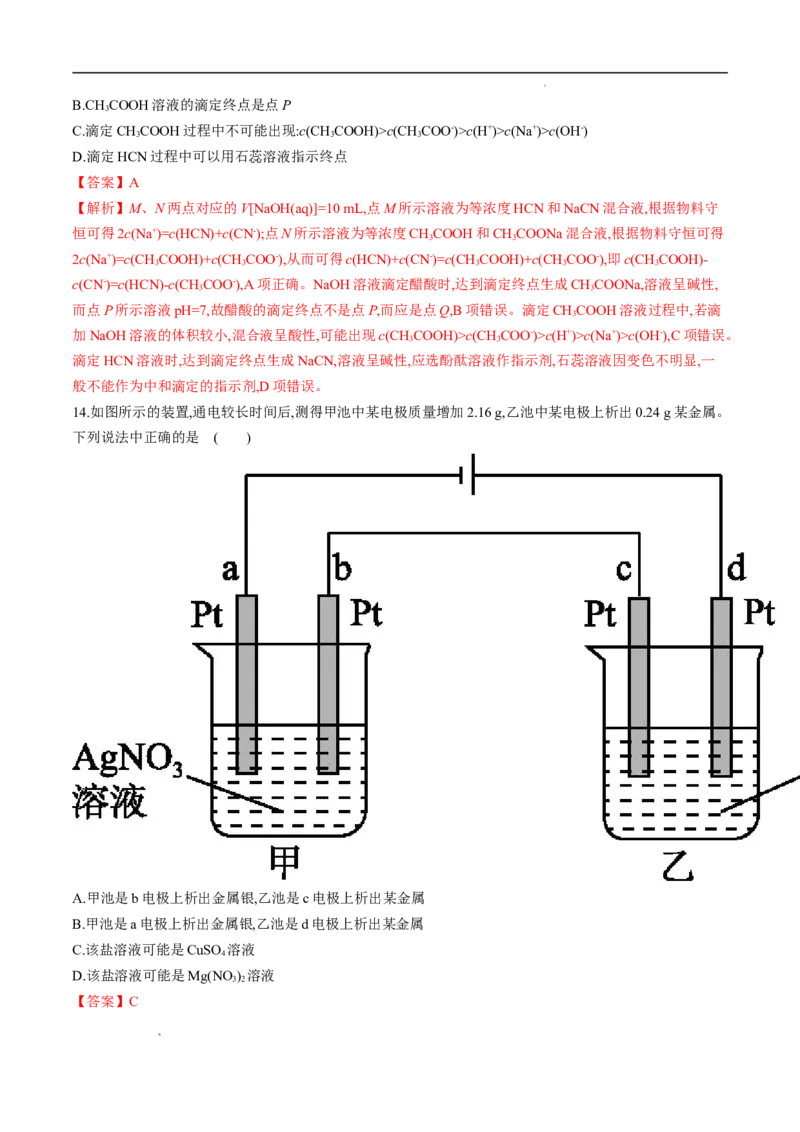
13.常温下,用0.10 mol/L NaOH溶液分别滴定20.00 mL浓度均为0.10 mol/L的CHCOOH溶液和HCN溶液,
3
所得滴定曲线如图所示。下列说法中正确的是 ( )
A.点M和点N所示溶液中:c(CHCOOH)-c(CN-)=c(HCN)-c(CHCOO-)
3 3
学科网(北京)股份有限公司B.CH COOH溶液的滴定终点是点P
3
C.滴定CHCOOH过程中不可能出现:c(CHCOOH)>c(CHCOO-)>c(H+)>c(Na+)>c(OH-)
3 3 3
D.滴定HCN过程中可以用石蕊溶液指示终点
【答案】A
【解析】M、N两点对应的V[NaOH(aq)]=10 mL,点M所示溶液为等浓度HCN和NaCN混合液,根据物料守
恒可得2c(Na+)=c(HCN)+c(CN-);点N所示溶液为等浓度CHCOOH和CHCOONa混合液,根据物料守恒可得
3 3
2c(Na+)=c(CHCOOH)+c(CHCOO-),从而可得c(HCN)+c(CN-)=c(CHCOOH)+c(CHCOO-),即c(CHCOOH)-
3 3 3 3 3
c(CN-)=c(HCN)-c(CHCOO-),A项正确。NaOH溶液滴定醋酸时,达到滴定终点生成CHCOONa,溶液呈碱性,
3 3
而点P所示溶液pH=7,故醋酸的滴定终点不是点P,而应是点Q,B项错误。滴定CHCOOH溶液过程中,若滴
3
加NaOH溶液的体积较小,混合液呈酸性,可能出现c(CHCOOH)>c(CHCOO-)>c(H+)>c(Na+)>c(OH-),C项错误。
3 3
滴定HCN溶液时,达到滴定终点生成NaCN,溶液呈碱性,应选酚酞溶液作指示剂,石蕊溶液因变色不明显,一
般不能作为中和滴定的指示剂,D项错误。
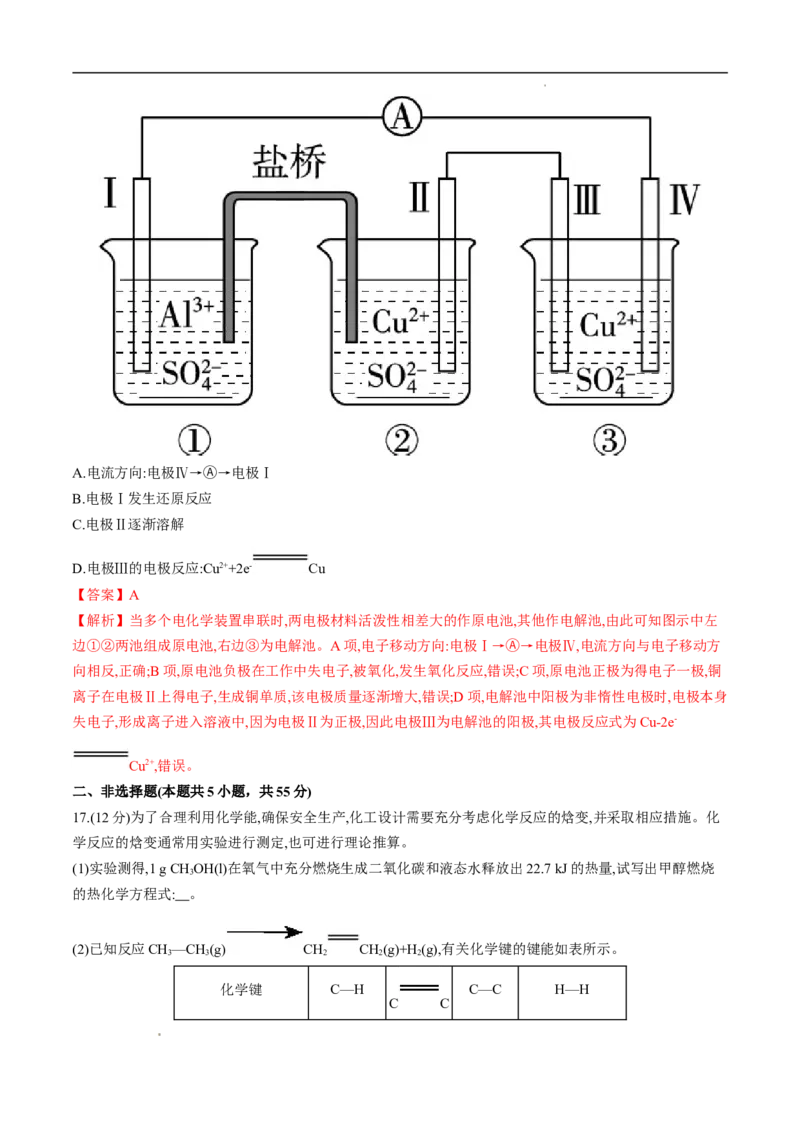
14.如图所示的装置,通电较长时间后,测得甲池中某电极质量增加2.16 g,乙池中某电极上析出0.24 g某金属。
下列说法中正确的是 ( )
A.甲池是b电极上析出金属银,乙池是c电极上析出某金属
B.甲池是a电极上析出金属银,乙池是d电极上析出某金属
C.该盐溶液可能是CuSO 溶液
4
D.该盐溶液可能是Mg(NO) 溶液
3 2
【答案】C
学科网(北京)股份有限公司【解析】甲池a电极是阴极,析出金属银,乙池c电极是阴极,析出某金属。该盐溶液如果是Mg(NO) 溶液,不
3 2
可能析出金属。
15.一定温度下,反应I
2
(g)+H
2
(g)⇌2Hl(g)在密闭容器中达到平衡时,测得c(I
2
)=0.11mmol•L-1,
c(HI)=0.78mmol•L-1。相同度温下,按下列4组初始浓度进行实验,反应逆向进行的是(注:
1mmol•L-1=10-3mol•L-1)
A B C D
c(I )/mmol•L-1 1.00 0.22 0.44 0.11
2
c(H)/mmol•L-1 1.00 0.22 0.44 0.44
2
c(HI)/mmol•L-1 1.00 1.56 4.00 1.56
【答案】C
【解析】题目中缺少c(H),则无法计算K,则不能通过Q 与K的关系判断平衡的移动方向,但可比较4个
2 c
选项中Q 的大小关系,Q 越大,则可能逆向移动。Q(A)= =1,Q(B)=
c c c c
=50.28,Q(C)= =82.64,Q(D)=
c c
=50.28,Q(C)的值最大,答案为C。
c
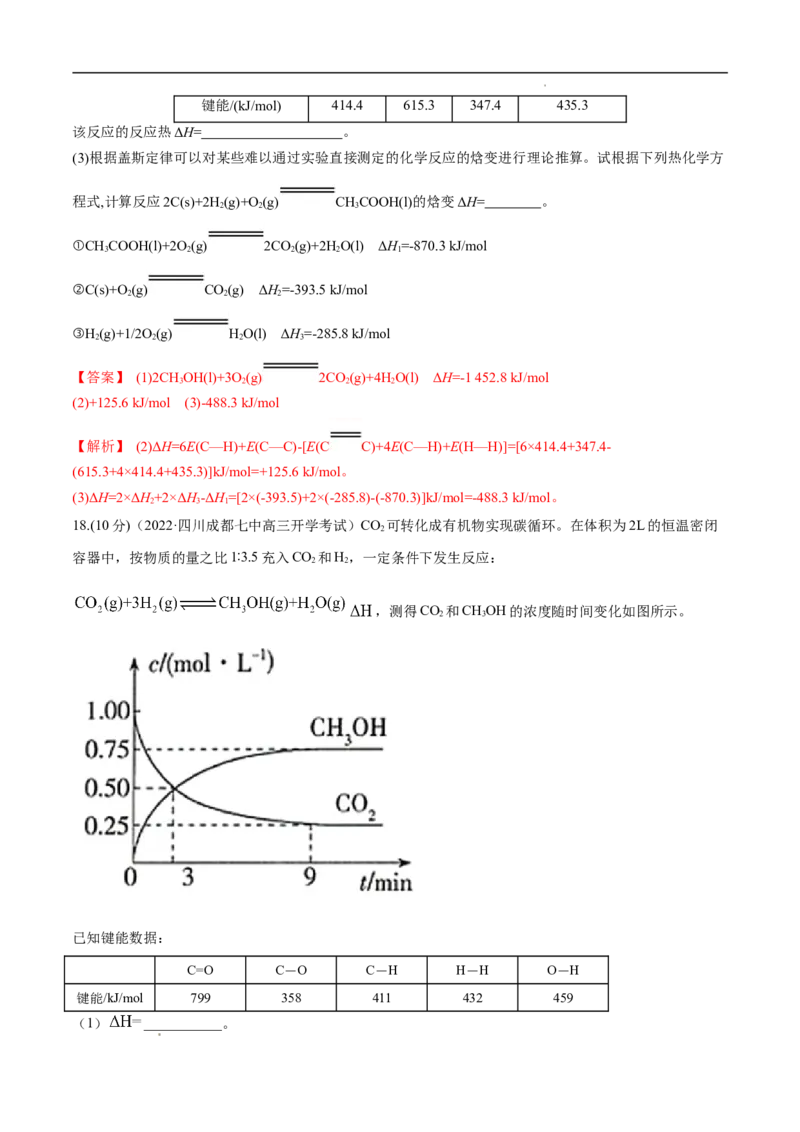
16.某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他电极均为Cu,则 ( )
学科网(北京)股份有限公司A.电流方向:电极Ⅳ→Ⓐ→电极Ⅰ
B.电极Ⅰ发生还原反应
C.电极Ⅱ逐渐溶解
D.电极Ⅲ的电极反应:Cu2++2e- Cu
【答案】A
【解析】当多个电化学装置串联时,两电极材料活泼性相差大的作原电池,其他作电解池,由此可知图示中左
边①②两池组成原电池,右边③为电解池。A项,电子移动方向:电极Ⅰ→Ⓐ→电极Ⅳ,电流方向与电子移动方
向相反,正确;B项,原电池负极在工作中失电子,被氧化,发生氧化反应,错误;C项,原电池正极为得电子一极,铜
离子在电极Ⅱ上得电子,生成铜单质,该电极质量逐渐增大,错误;D项,电解池中阳极为非惰性电极时,电极本身
失电子,形成离子进入溶液中,因为电极Ⅱ为正极,因此电极Ⅲ为电解池的阳极,其电极反应式为Cu-2e-
Cu2+,错误。
二、非选择题(本题共5小题,共55分)
17.(12分)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化
学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,1 g CH OH(l)在氧气中充分燃烧生成二氧化碳和液态水释放出22.7 kJ的热量,试写出甲醇燃烧
3
的热化学方程式: 。
(2)已知反应CH—CH(g) CH CH(g)+H(g),有关化学键的键能如表所示。
3 3 2 2 2
化学键 C—H C—C H—H
C C
学科网(北京)股份有限公司键能/(kJ/mol) 414.4 615.3 347.4 435.3
该反应的反应热ΔH= 。
(3)根据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行理论推算。试根据下列热化学方
程式,计算反应2C(s)+2H(g)+O(g) CHCOOH(l)的焓变ΔH= 。
2 2 3
①CHCOOH(l)+2O (g) 2CO(g)+2HO(l) ΔH=-870.3 kJ/mol
3 2 2 2 1
②C(s)+O (g) CO(g) ΔH=-393.5 kJ/mol
2 2 2
③H(g)+1/2O (g) HO(l) ΔH=-285.8 kJ/mol
2 2 2 3
【答案】 (1)2CH OH(l)+3O (g) 2CO(g)+4HO(l) ΔH=-1 452.8 kJ/mol
3 2 2 2
(2)+125.6 kJ/mol (3)-488.3 kJ/mol
【解析】 (2)ΔH=6E(C—H)+E(C—C)-[E(C C)+4E(C—H)+E(H—H)]=[6×414.4+347.4-
(615.3+4×414.4+435.3)]kJ/mol=+125.6 kJ/mol。
(3)ΔH=2×ΔH+2×ΔH-ΔH=[2×(-393.5)+2×(-285.8)-(-870.3)]kJ/mol=-488.3 kJ/mol。
2 3 1
18.(10分)(2022·四川成都七中高三开学考试)CO 可转化成有机物实现碳循环。在体积为2L的恒温密闭
2
容器中,按物质的量之比1∶3.5充入CO 和H,一定条件下发生反应:
2 2
,测得CO 和CHOH的浓度随时间变化如图所示。
2 3
已知键能数据:
C=O C-O C-H H-H O-H
键能/kJ/mol 799 358 411 432 459
(1) ___________。
学科网(北京)股份有限公司(2)能说明上述反应达到平衡状态的是___________(填字母)。
A.反应中CO 和CHOH的物质的量浓度之比为1∶1(即图中交叉点)
2 3
B.混合气体的压强不随时间的变化而变化
C.单位时间内生成 ,同时生成
D.混合气体的平均相对分子质量不随时间的变化而变化
E.混合气体的密度不随时间的变化而变化
(3)平衡时H 的转化率为___________(保留一位小数)。
2
(4)保持温度和容积不变,除充入H 外,还能使平衡后 增大的措施是___________(任写两
2
条)。
(5)若其他条件不变,平衡后再同时充入四种物质各0.5mol,则平衡如何移动?请简要说明理由:
___________。
【答案】
(1)
(2)BD
(3)64.3%
(4)将 从体系中分离或再按照1∶3.5充入 和 等
(5)再充入0.5mol后, 则平衡右移
【解析】
(1)根据反应的焓变 反应物的总键能和-生成物的总键能和=(2×799kJ/mol+3×432kJ/mol)-(3×411kJ/
mol+358kJ/mol+459kJ/mol+2×459kJ/mol)=-74kJ/mol。
(2)A.反应中CO 和CHOH的物质的量浓度之比为1∶1(即图中交叉点),说明此时浓度相等,但是还在
2 3
变化,故不是平衡状态,错误;
B.气体的物质的量变化即压强变化,故压强不变则达到了平衡状态,正确;
C.速率之比不等于系数之比,故不是平衡状态,错误;
D.该反应前后气体分子数不相等,即混合气体的物质的星在变化,密闭容器中气体的质量不变,则混合
学科网(北京)股份有限公司气体的平均相对分子质量不随时间的变化而变化时,说明平衡,正确;
E.密度是混合气体的质量和容器容积的比值,在反应过程中气体质量和容器容积始终保持不变,所以混
合气体的密度不随时间的变化而变化,不能说明反应达到平衡状态,错误;
故选BD。
(3)反应中二氧化碳消耗了0.75mol/L,根据反应的物质的量之比等于系数之比,故反应的氢气的物质的
量为2.25mol/L,则氢气的转化率为 64.3%。
(4)将HO(g)从体系中分离或再按照1∶3.5充入CO 和H 等,可以使平衡后 增大。
2 2 2
(5)平衡后再同时充入四种物质各0.5mol, 则平衡右移。
19.(16分)(2021·全国高二课时练习)现用盐酸标准溶液来测定NaOH溶液的浓度。实验操作如下:
①向溶液中加入2~3滴指示剂,②取20.00 mL标准溶液放入锥形瓶中,③用氢氧化钠溶液滴定至终点,④
重复以上操作,⑤配制250 mL盐酸标准溶液,⑥根据实验数据计算氢氧化钠溶液的物质的量浓度。
(1)实验过程中正确的操作顺序是___________(填序号),用___________作指示剂。
(2)滴定并记录V(NaOH)的初、终读数。数据记录如表所示:
滴定次数 1 2 3 4
V(HCl)/mL 20.00 20.00 20.00 20.00
V(NaOH) /mL(初读数) 0.10 0.30 0.00 0.20
V(NaOH) /mL (终读数) 20.08 20.30 20.80 20.22
V(NaOH) /mL (消耗) 19.98 20.00 20.80 20.02
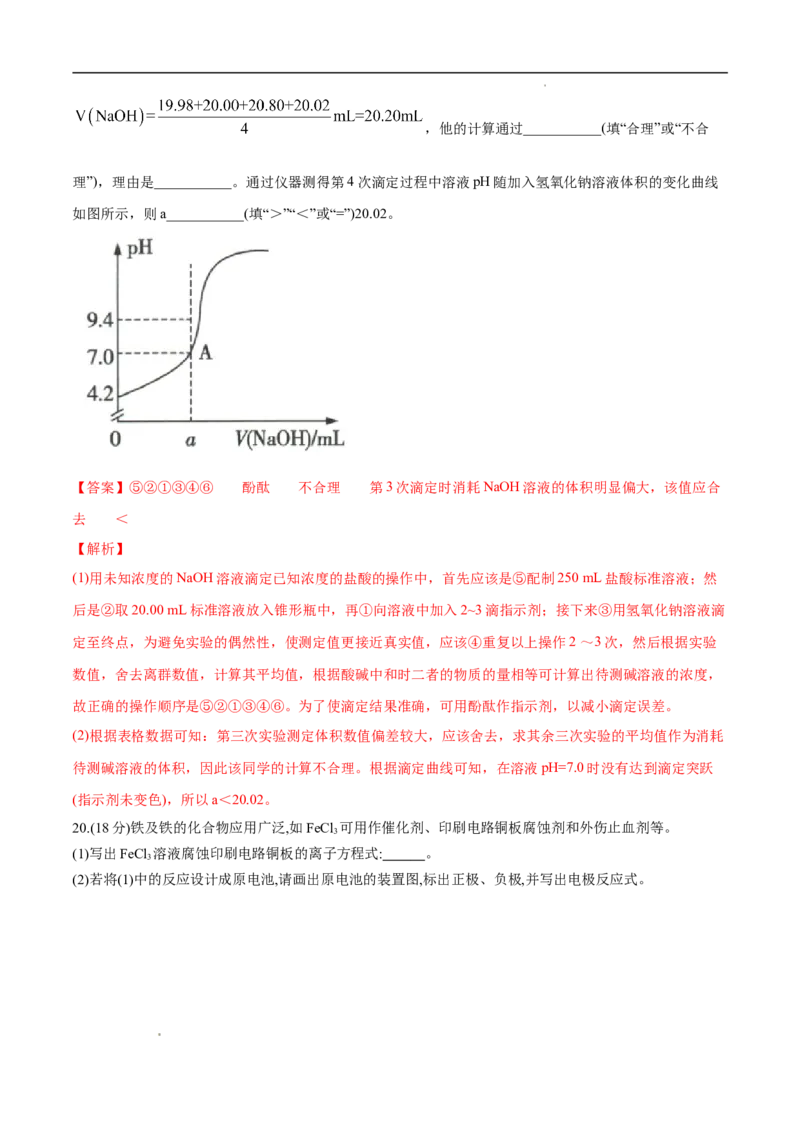
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为
学科网(北京)股份有限公司,他的计算通过___________(填“合理”或“不合
理”),理由是___________。通过仪器测得第4次滴定过程中溶液pH随加入氢氧化钠溶液体积的变化曲线
如图所示,则a___________(填“>”“<”或“=”)20.02。
【答案】⑤②①③④⑥ 酚酞 不合理 第3次滴定时消耗NaOH溶液的体积明显偏大,该值应合
去 <
【解析】
(1)用未知浓度的NaOH溶液滴定已知浓度的盐酸的操作中,首先应该是⑤配制250 mL盐酸标准溶液;然
后是②取20.00 mL标准溶液放入锥形瓶中,再①向溶液中加入2~3滴指示剂;接下来③用氢氧化钠溶液滴
定至终点,为避免实验的偶然性,使测定值更接近真实值,应该④重复以上操作2 ~3次,然后根据实验
数值,舍去离群数值,计算其平均值,根据酸碱中和时二者的物质的量相等可计算出待测碱溶液的浓度,
故正确的操作顺序是⑤②①③④⑥。为了使滴定结果准确,可用酚酞作指示剂,以减小滴定误差。
(2)根据表格数据可知:第三次实验测定体积数值偏差较大,应该舍去,求其余三次实验的平均值作为消耗
待测碱溶液的体积,因此该同学的计算不合理。根据滴定曲线可知,在溶液pH=7.0时没有达到滴定突跃
(指示剂未变色),所以a<20.02。
20.(18分)铁及铁的化合物应用广泛,如FeCl 可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
3
(1)写出FeCl 溶液腐蚀印刷电路铜板的离子方程式: 。
3
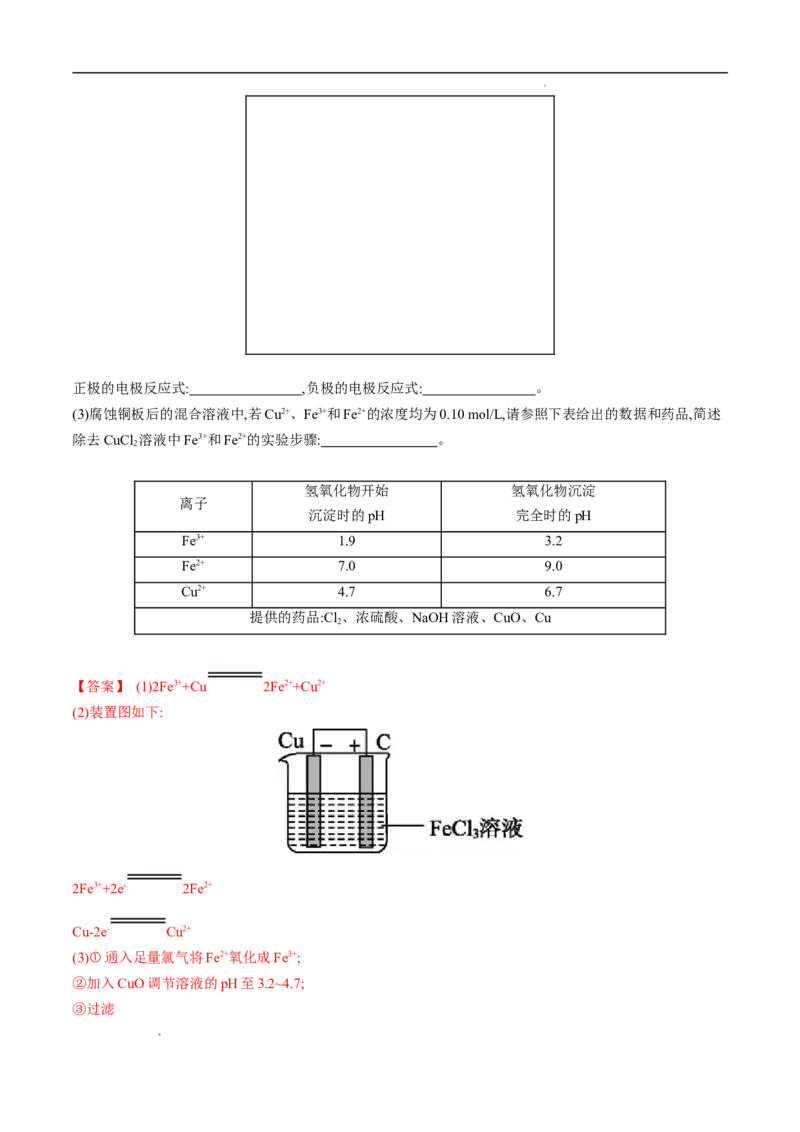
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正极、负极,并写出电极反应式。
学科网(北京)股份有限公司正极的电极反应式: ,负极的电极反应式: 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol/L,请参照下表给出的数据和药品,简述
除去CuCl 溶液中Fe3+和Fe2+的实验步骤: 。
2
氢氧化物开始 氢氧化物沉淀
离子
沉淀时的pH 完全时的pH
Fe3+ 1.9 3.2
Fe2+ 7.0 9.0
Cu2+ 4.7 6.7
提供的药品:Cl 、浓硫酸、NaOH溶液、CuO、Cu
2
【答案】 (1)2Fe3++Cu 2Fe2++Cu2+
(2)装置图如下:
2Fe3++2e- 2Fe2+
Cu-2e- Cu2+
(3)①通入足量氯气将Fe2+氧化成Fe3+;
②加入CuO调节溶液的pH至3.2~4.7;
③过滤
学科网(北京)股份有限公司【解析】 (2)根据氧化还原反应2Fe3++Cu 2Fe2++Cu2+设计原电池,负极发生氧化反应,Cu失电子作负
极,正极选择比Cu活动性弱的金属或石墨棒,电解质溶液为FeCl 溶液。
3
(3)根据表中的数据,如用直接沉淀法,Cu2+也被消耗。根据提供的试剂,可先将Fe2+氧化为Fe3+,再调节溶液的
pH。为了不引入新的杂质离子,选择CuO而不选择NaOH溶液。
学科网(北京)股份有限公司学科网(北京)股份有限公司